INTRODUCCIÓN
Estudios clínicos previos han demostrado que los anticoagulantes orales inhibidores de la vitamina K son superiores a los fármacos antiplaquetarios para reducir los eventos vasculares en los enfermos con fibrilación auricular (FA)1. Otros estudios recientes con fármacos antitrombínicos fueron planificados como estudios de «no inferioridad» respecto a los inhibidores de la vitamina K, y finalmente no demostraron ser superiores2. Por el contrario, el Estudio Nacional para la Prevención del Embolismo en la Fibrilación Auricular (NASPEAF) fue planificado como estudio «de superioridad» y demostró que el tratamiento antitrombótico combinado (anticoagulación a dosis terapéuticas más triflusal 600 mg/día) fue más eficaz que la monoterapia anticoagulante (INR 2,0-3,0), con una menor incidencia de complicaciones hemorrágicas3-5. La mediana del INR en el brazo de tratamiento combinado del grupo de pacientes en alto riesgo fue 2,17, y el intervalo intercuartílico P25-P75, 1,97-2,36. Con base en estos resultados, decidimos continuar el seguimiento de los pacientes en tratamiento combinado con INR entre 1,9 y 2,5. Los que recibían anticoagulación estándar se mantuvieron como brazo control. Con el fin de investigar una posible estrategia alternativa antiplaquetaria en el tratamiento combinado, controlamos dos grupos de pacientes con similar nivel de anticoagulación más triflusal 300 mg/día o ácido acetilsalicílico (AAS) 100 mg/día.
MÉTODOS
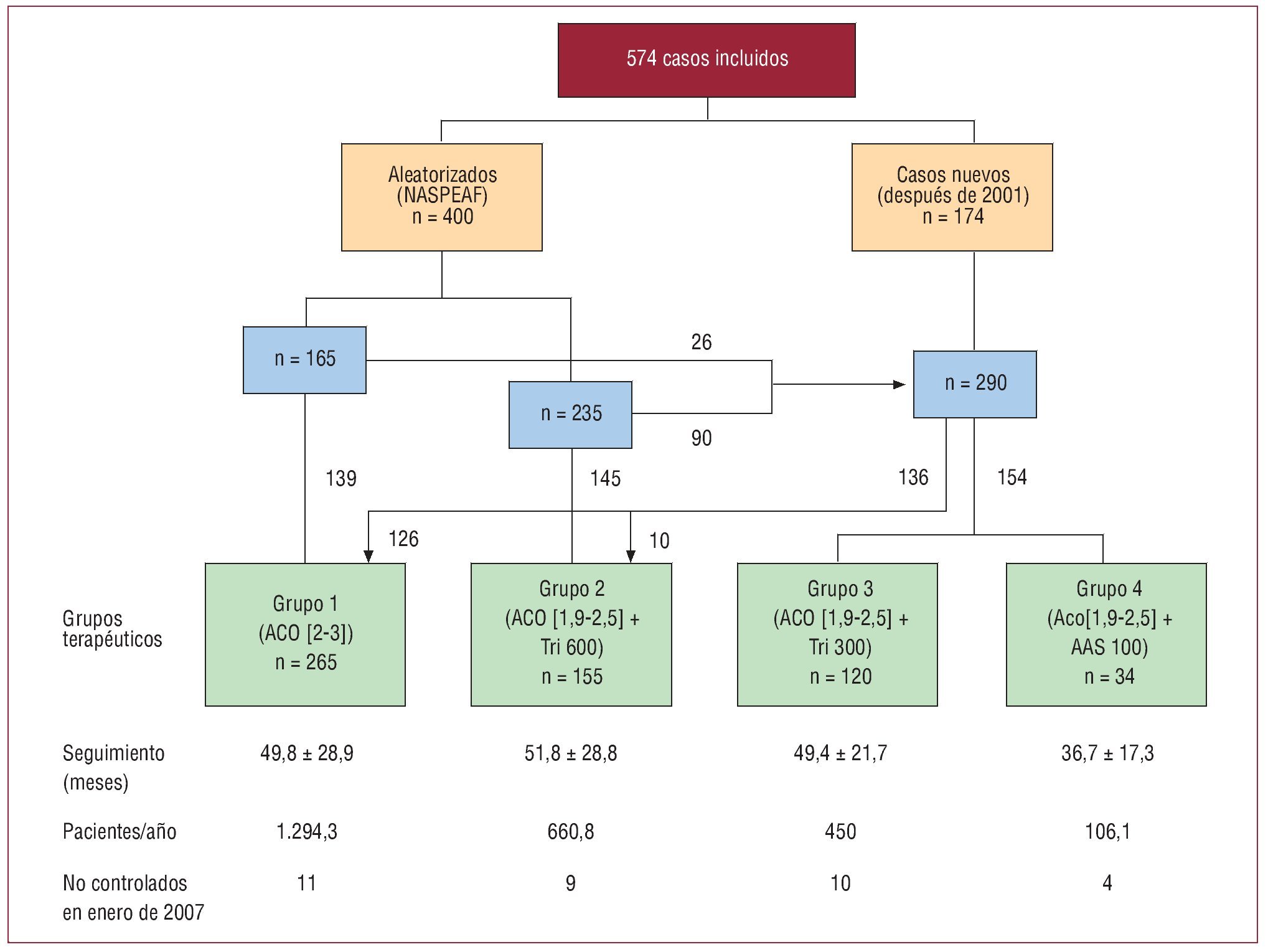
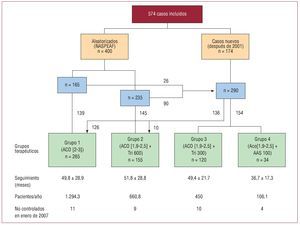
Este análisis incluye un total de 574 casos de FA atendidos en consultas externas de cardiología en el Hospital Clínico San Carlos de Madrid y centros médicos dependientes, que fueron incluidos de forma consecutiva para seguimiento prospectivo durante los últimos 11 años (fig. 1); 400 pacientes aleatorizados en el estudio NASPEAF habían sido asignados a tratamiento con anticoagulación estándar o terapia combinada con anticoagulación más triflusal 600 mg/día. De éstos, 264 continuaron el tratamiento aleatorizado, 20 lo abandonaron y los 116 restantes, junto con otros 174 nuevos casos, siguieron tratamiento anticoagulante solo o combinado con diferentes agentes antiplaquetarios. La modificación del tratamiento anticoagulante y/o antiagregante plaquetario se realizó a discreción del médico responsable y de acuerdo con las preferencias de los pacientes. La mayoría de los pacientes que recibieron tratamiento combinado con AAS tenían enfermedad coronaria. Los enfermos que recibieron tratamiento combinado con 300 mg/día de triflusal recibían anticoagulación en dosis terapéutica (INR > 2,0), a la que se añadió un cierto efecto antiplaquetario con 300 mg/día de triflusal.
Fig. 1. Diagrama de flujo de los casos aleatorizados y nuevos. AAS: ácido acetilsalicílico; ACO: anticoagulante; INR: international normalized ratio; Tri: triflusal.
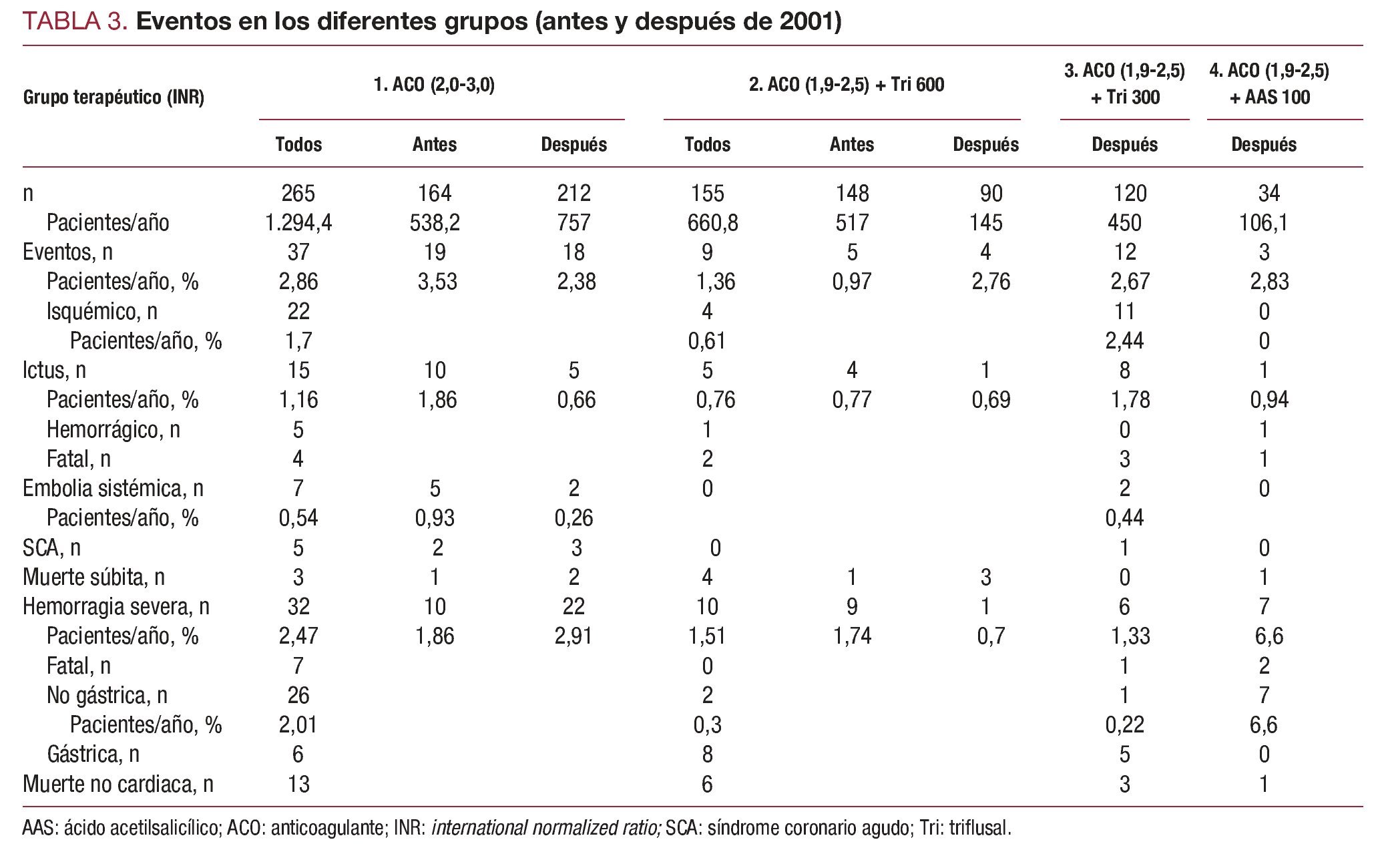
El número de casos finalmente incluidos en cada grupo fue el siguiente: el grupo 1 (n = 265) recibió monoterapia anticoagulante para un INR de 2,0-3,0; los grupos 2-4 recibieron terapia combinada con anticoagulación para un INR de 1,9-2,5 más triflusal 600 mg/día (grupo 2 = 155 casos), triflusal 300 mg/ día (grupo 3 = 120 casos) o AAS 100 mg/día (grupo 4 = 34 casos). Las medias del tiempo de seguimiento en cada grupo fueron respectivamente 49,8, 51,8, 49,4 y 36,7 meses, con un valor correspondiente de 1.294,3, 660,8, 450 y 106,1 pacientes/año.
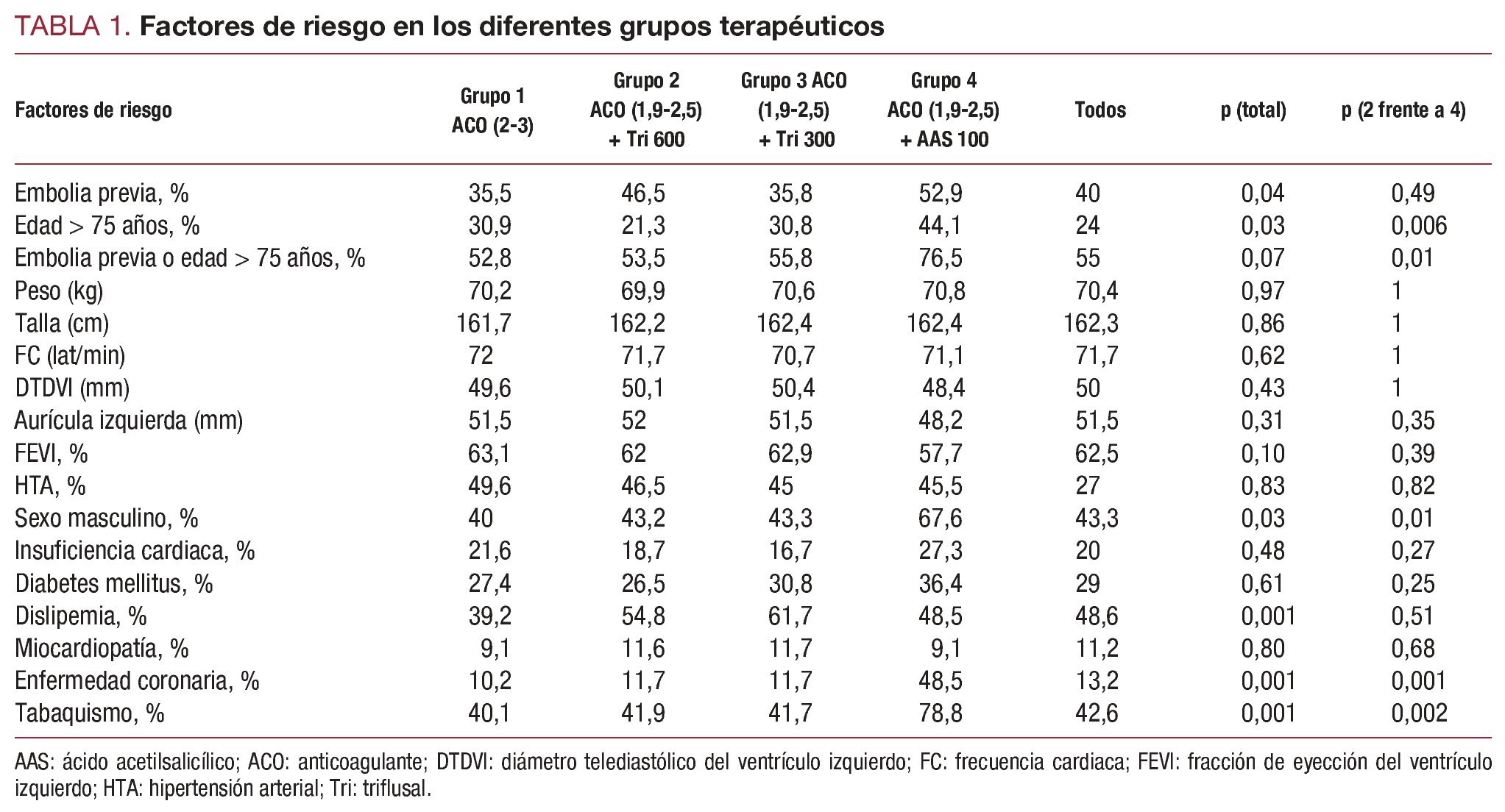
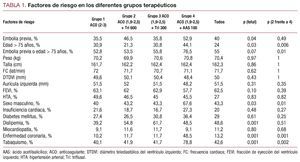
Se registraron a la entrada en el estudio (tabla 1) la prevalencia de los principales factores de riesgo (embolia previa y edad superior a 75 años) y los siguientes factores cuantitativos: peso, talla, frecuencia cardiaca y diámetros del ventrículo y la aurícula izquierdos medidos con ecocardiograma en modo M. También se registró la prevalencia de los siguientes factores de riesgo cualitativos: hipertensión arterial, sexo, historia de insuficiencia cardiaca, diabetes mellitus, dislipemia, miocardiopatía, enfermedad coronaria y antecedentes de tabaquismo. Se analizó y se comparó la prevalencia de los factores de riesgo en los diferentes grupos de enfermos, y su valor predictivo para eventos vasculares o hemorragias severas.
Solo se incluyó en el análisis a los pacientes que tenían un seguimiento mínimo de 12 meses. Se revisaron las historias hospitalarias de los que no habían sido controlados en el año 2006, y en ausencia de datos se intentó el contacto telefónico. Con todos los pacientes, excepto un 5,9%, se contactó en enero de 2007.
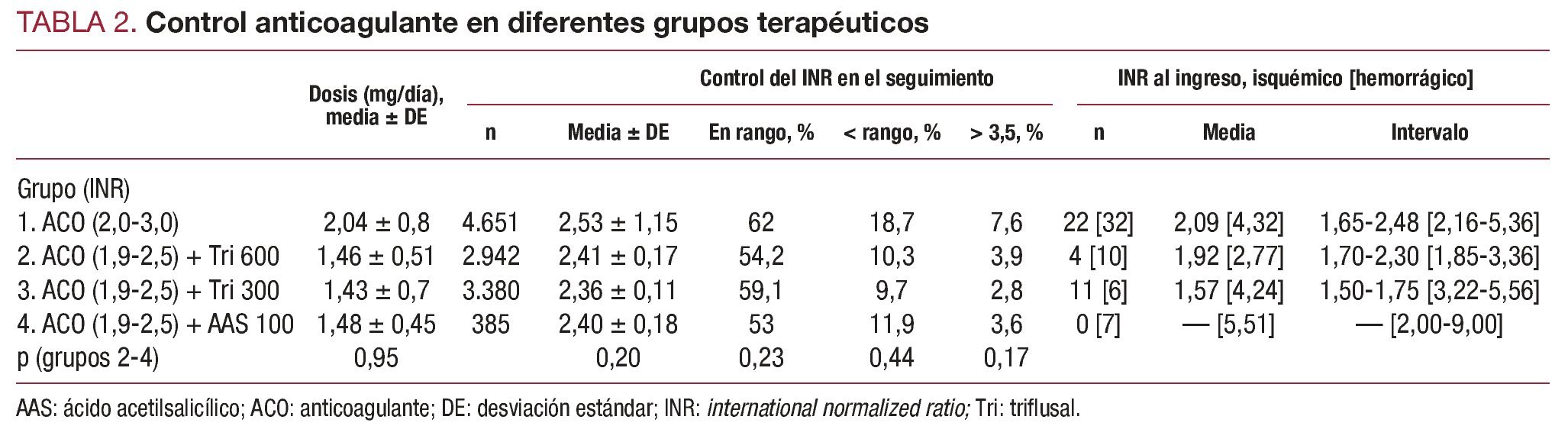
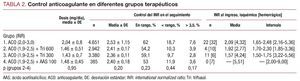
El control del INR se realizó regularmente en dos unidades de anticoagulación, con un total de 11.358 controles. El valor del INR también se registró al ingreso en el hospital por un evento vascular o hemorrágico. Se analizó el valor medio del INR de todo el tiempo de seguimiento, el porcentaje de muestras de INR dentro del intervalo terapéutico, por debajo del límite inferior del intervalo y por encima del valor 3,5. Se realizó gastroscopia en todos los casos ingresados por sospecha de hemorragia gástrica.
Se consideró como eventos primarios los siguientes: ictus isquémico o hemorrágico, embolia sistémica, síndrome coronario agudo, muerte súbita y muerte dentro de los 30 días después de un evento o hemorragia severa. Las definiciones correspondientes a estos eventos se detallan en publicaciones previas3-5. Se estableció el diagnóstico de síndrome coronario ante un dolor típico retroesternal asociado a cambios electrocardiográficos o elevación de las enzimas cardiacas.
Se analizaron y se compararon entre los diferentes grupos de enfermos los eventos primarios y las hemorragias severas. Estos eventos se compararon también, en los pacientes aleatorizados de los grupos 1 y 2, entre el periodo correspondiente al estudio NASPEAF (1995-2001) y el posterior a junio de 2001. Los pacientes de estos grupos tenían 3,3 años más al comienzo del segundo periodo.
Desde el año 2003 se administró de forma progresiva omeprazol 20 mg/día a los pacientes asignados a tratamiento combinado. Los pacientes que recibieron este tratamiento fueron el 14,6, el 40 y el 40% de los grupos 2, 3 y 4, respectivamente.
Análisis estadístico
Las comparaciones basales se realizaron mediante el test exacto de Fisher o el de la χ2 para datos categóricos, expresados en porcentajes, y el análisis de la varianza para los datos continuos, considerando los valores medios y su desviación estándar. Se ajustaron las comparaciones basales mediante un análisis multivariable. La incidencia de eventos se expresó en tasas (eventos cada 100 pacientes/año). Se utilizó el modelo proporcional de riesgos de Cox para identificar los factores de riesgo de eventos vasculares y hemorragias severas, y las variables (embolia previa, edad superior a 75 años y enfermedad coronaria) se ajustaron para los diferentes brazos terapéuticos. Se utilizó el método de Kaplan-Meier para calcular las curvas de supervivencia libre de eventos hasta el primer evento. La estimación del riesgo se ajustó y satisfizo comparando el ln (-ln) estimado de las curvas de supervivencia transformadas en curvas paralelas. Finalmente, se calculó la hazard ratio (HR) y el intervalo de confianza (IC) del 95% del modelo de regresión de Cox. Todos los tests se realizaron con un nivel de significación en p < 0,05. Para el análisis estadístico se utilizó el paquete SPSS 15.0 para Windows.
RESULTADOS
La incidencia de los factores de riesgo fue similar en los primeros tres grupos, excepto por una mayor prevalencia de embolia previa en el grupo 2 y de dislipemia en el grupo 3 (tabla 1). El grupo de pacientes que recibió AAS (grupo 4) tenía una mayor prevalencia de embolia previa, tabaquismo, sexo masculino y cardiopatía isquémica y mayor edad, aunque la prevalencia de embolia previa fue similar a la registrada en el grupo 2.
El modelo de riesgo proporcional de Cox identificó los siguientes factores de riesgo como variables independientes predictoras de eventos vasculares: historia de embolia previa (HR = 3,52; p < 0,001) y enfermedad coronaria (HR = 3,01; p = 0,001). La edad superior a 75 años mostró una leve tendencia (HR = 1,51; p = 0,186), sin alcanzar la significación estadística. La embolia previa y la enfermedad coronaria también fueron predictores de hemorragia severa, con valores significativos: HR = 2,40 (p = 0,004) y HR = 2,75 (p = 0,002), respectivamente. Otras variables (dislipemia, sexo masculino y tabaquismo) se distribuyeron también de forma heterogénea entre los grupos de comparación, pero no fueron incluidas en el modelo final por estar altamente correlacionadas con la variable enfermedad coronaria.
Los valores medios de INR y los diferentes parámetros de anticoagulación en el grupo 1 fueron significativamente superiores a los registrados en los grupos de terapia combinada (2-4), pero muy similares en estos tres grupos (tabla 2). Los valores medios de INR al ingreso por eventos isquémicos en los grupos 1, 2 y 3 fueron respectivamente 2,09, 1,92 y 1,57 (tabla 2). Los valores del INR estuvieron por debajo de 1,9 en todos los pacientes del grupo 3 ingresados por eventos isquémicos, y no hubo ningún evento de este tipo en el grupo con AAS. Los valores medios del INR al ingreso por hemorragia severa en los grupos 1-4 fueron respectivamente 4,32, 2,77, 4,24 y 5,51.
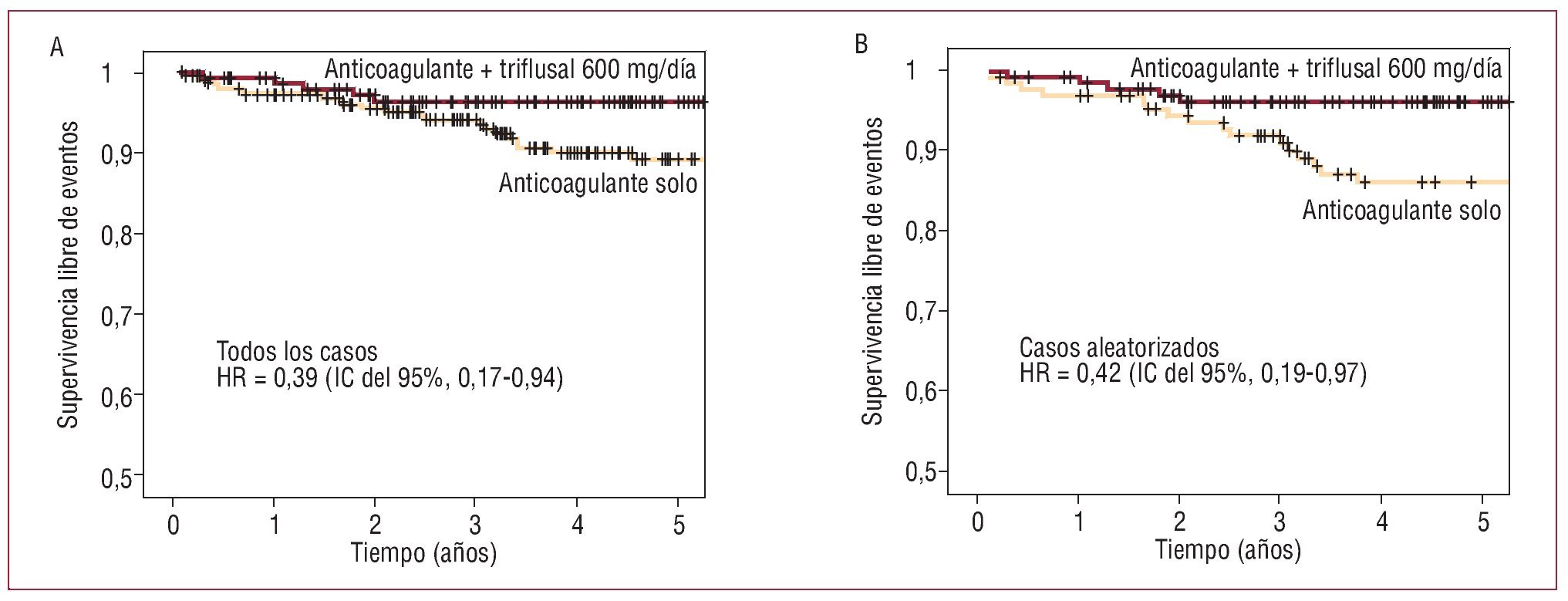
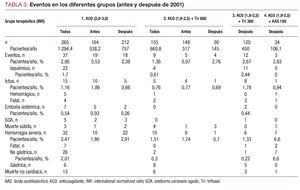
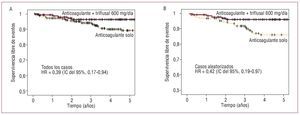
La tasas de eventos (y de mortalidad) en los grupos 1-4 fueron respectivamente 2,86 (1,24), 1,36 (0,91), 2,67 (0,89) y 2,83 (2,83) (tabla 3). Las correspondientes tasas de eventos isquémicos fueron 1,70, 0,61, 2,44 y 0. Los pacientes del grupo de terapia combinada con triflusal 600 mg/día sufrieron significativamente menos eventos primarios que los que recibieron terapia anticoagulante sola (1,36 frente a 2,86; p = 0,039). Considerando sólo a los pacientes aleatorizados de estos dos grupos, estas tasas fueron 1,48 frente a 3,37, con una diferencia similar (p = 0,04) (fig. 2). Las tasas de eventos durante el periodo del estudio NASPEAF (1995-2001) y después de junio de 2001 fueron 3,53 y 2,38 en el grupo que recibió sólo terapia anticoagulante, y 0,97 y 2,76 en el brazo que recibió tratamiento combinado (tabla 3). Ambas comparaciones resultaron no significativas. En el grupo de terapia combinada, la tasa de eventos isquémicos fue similar en los dos periodos; la diferencia en el número de eventos totales se debió a una incidencia de muerte súbita 3 veces superior en el segundo periodo. Las tasas de eventos, sin ajustar las variables predictoras, fueron similares en los grupos 1, 3 y 4. Los grupos que recibieron tratamiento combinado con triflusal 300 mg/día o AAS 100 mg/día sufrieron una tendencia no significativa a un mayor número de eventos que el grupo que recibió tratamiento combinado con triflusal 600 mg/día.
Fig. 2. Curvas de supervivencia del tratamiento combinado (anticoagulante + triflusal 600 mg/día) frente a anticoagulación sola. A: todos los casos. B: casos aleatorizados.
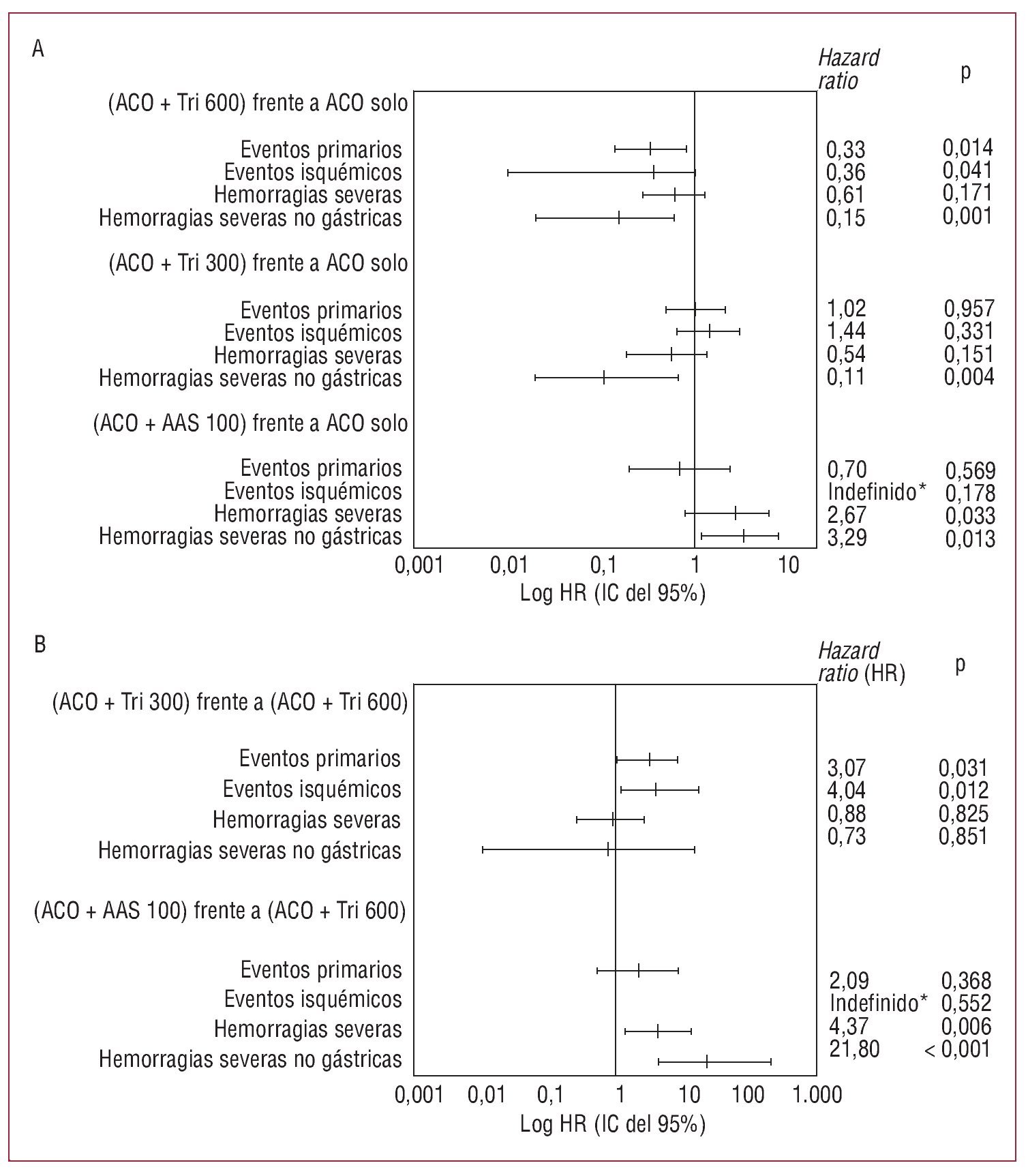
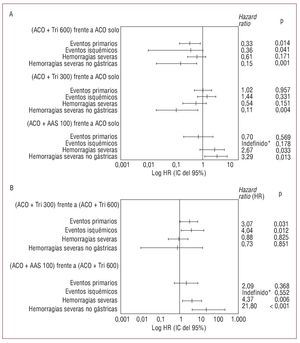
Cuando se ajustaron las variables predictoras de eventos aplicando el modelo de regresión de Cox, se confirmó el beneficio significativo del tratamiento combinado del grupo 2 comparado con el tratamiento anticoagulante solo (HR = 0,33 [0,14-0,80]; p = 0,014) y también comparado con el grupo que recibió triflusal 300 mg/día (HR = 3,07 [1,11-8,50]; p = 0,031) (fig. 3). Los pacientes que recibieron terapia combinada con triflusal 300 mg/día y los que recibieron tratamiento anticoagulante solo presentaron los mismos eventos (HR = 1,02; p = 0,957), pero el segundo tuvo una tasa de hemorragias graves más alta que el primero.
Fig. 3. Razones de riesgo (HR) tras ajustar por los factores de riesgo en los distintos grupos terapéuticos. A: grupos de tratamiento combinado 2 (anticoagulante + triflusal 600 mg/día), 3 (anticoagulante + triflusal 300 mg/día) y 4 (anticoagulante + AAS 100 mg/día) frente al grupo 1 (anticoagulante solo). B: grupos de tratamiento combinado 3 y 4 frente al grupo 2. AAS: ácido acetilsalicílico; ACO: anticoagulante; Tri: triflusal. *No hubo eventos isquémicos en el grupo de tratamiento combinado con AAS.
La tasa total de hemorragias severas en los grupos 1, 2 y 3 fueron respectivamente 2,47, 1,51 y 1,33, sin diferencia significativa en las comparaciones, pero con mayor mortalidad en el grupo 1 (tabla 3); de las 32 hemorragias severas registradas en este grupo, 5 fueron intracraneales y 4 finalmente fallecieron. Otras 6 fueron gástricas (2 pacientes murieron y los demás necesitaron transfusión). La tasa de hemorragias no gástricas en el grupo anticoagulante (2,01) fue significativamente mayor que la registrada en los grupos con terapia combinada con triflusal 600 o 300 mg/día (tasas, 0,30 y 0,22; p = 0,012 y p = 0,004, respectivamente). La tasa de 6,60 registrada en el grupo con AAS fue significativamente más elevada que en los otros grupos (p = 0,008); todas estas hemorragias fueron no gástricas.
La mayor parte de los eventos hemorrágicos registrados en los grupos que recibieron terapia combinada con triflusal fueron gástricos, y los estudios endoscópicos mostraron gastropatía superficial de la mucosa. La incidencia de hemorragia gástrica en estos grupos se redujo progresivamente desde 2002, a medida que los pacientes recibieron fármacos inhibidores de la bomba de protones.
DISCUSIÓN
Eventos primarios en los estudios de prevención del ictus en la fibrilación auricular
Las publicaciones clásicas sobre la prevención del ictus en la fibrilación auricular basaron sus conclusiones en la incidencia de eventos isquémicos6-9. Consideramos que, de acuerdo con las recomendaciones del Consort Statement10, las complicaciones graves de los eventos hemorrágicos, especialmente la muerte por hemorragia, deben ser consideradas eventos primarios. De hecho, el estudio SPAF II alcanzó conclusiones diferentes al considerar eventos primarios las hemorragias intracraneales y la muerte vascular. Por otro lado, un análisis crítico de los estudios clásicos publicados que incluyeron la muerte vascular como evento primario permitió a Oden et al11 proponer una reducción del nivel de anticoagulación a un intervalo de INR entre 2,0 y 2,5.
Intensidad de la anticoagulación en la terapia antitrombótica combinada
El valor medio del INR durante el tratamiento combinado en el estudio NASPEAF fue 1,97 en el grupo con riesgo intermedio y 2,17 en el grupo en alto riesgo, con un intervalo intercuartílico P25-P75 de 1,97-2,36. La diferencia fue pequeña y hubo mucha superposición de valores en los dos grupos. Por ello, consideramos que no había justificación para establecer dos regímenes terapéuticos diferentes para futuros estudios, y propusimos cambiar el intervalo previo de 1,4-2,4 a 1,9-2,5. El límite inferior del intervalo de INR ha sido fijado en 1,9-2,0 en los pacientes que reciben monoterapia anticoagulante12,13. Nuestro grupo podría proponer un nivel de anticoagulación por debajo de 2,0 en el tratamiento combinado, pero no está claro cuánto más bajo puede ser14: valores muy bajos (media, 1,3) fracasaron en prevenir los eventos vasculares isquémicos en algunos estudios previos15,16, y no podríamos evitar en ningún caso el control de coagulación. Nuestros resultados actuales (tabla 3, fig. 3) confirman que el tratamiento combinado con INR entre 1,9 y 2,5 es significativamente más efectivo que la monoterapia con anticoagulantes, con una tasa muy baja de hemorragias no gástricas.
Actividad plaquetaria y la nueva cascada de la coagulación. Papel del AAS
La nueva cascada de la coagulación, propuesta por Monroe et al17 en Carolina del Norte y Shafer18 en Houston, es el resultado de una profunda investigación realizada desde que MacFarlane19 publicó la cascada clásica en 1964. La nueva cascada, asumida por el Grupo de Trabajo de la Sociedad Europea de Cardiología20, puede contribuir a explicar el beneficio del tratamiento antitrombótico combinado sobre la monoterapia anticoagulante. De acuerdo con la nueva cascada, la actividad de la plaqueta tiene un papel fundamental en la activación de factores de la coagulación durante las fases de amplificación y propagación de la cascada. Consecuentemente, la inhibición de la actividad plaquetaria, en presencia de concentraciones terapéuticas de inhibidores de la protrombina, puede favorecer una mayor reducción de la génesis de trombina. La monoterapia anticoagulante es efectiva para el control de los eventos vasculares en los pacientes con FA y riesgo moderado, pero no ofrece el mismo beneficio a los pacientes en alto riesgo, puesto que la tasa de eventos en los pacientes con antecedentes de embolia previa fue de 8,5 en el estudio EAFT12 y de 11,1 en nuestro grupo de pacientes con embolia previa mayores de 75 años5. Por otra parte, los estudios sobre inhibidores del factor X o de la trombina no han demostrado superioridad sobre los inhibidores de la vitamina K20 para solucionar este problema. Son necesarios más estudios dirigidos a mejorar el beneficio de la monoterapia anticoagulante en los pacientes en alto riesgo, que representan alrededor del 28% (pacientes con embolia previa) o del 25% (mayores de 75 años) del total de enfermos con FA3.
El tratamiento antitrombótico combinado quedó desprestigiado tras el estudio SPAF III15, pero el nivel de anticoagulación en este estudio fue subterapéutico y la dosis de AAS, demasiado alta. El estudio NASPEAF demostró que la terapia combinada con triflusal 600 mg/día, comparada con la anticoagulación estándar, ofrece un beneficio significativo para prevenir eventos vasculares3-5. Estos 11 años de seguimiento a largo plazo de pacientes aleatorizados confirman nuestros resultados previos, con muy baja incidencia de hemorragias no gástricas. En el momento actual, el único posible beneficio adicional al que ofrece la anticoagulación estándar debe conseguirse agregando algún fármaco inhibidor de la actividad plaquetaria. Nuestro grupo ha usado con éxito el triflusal, que es un fármaco que inhibe la ciclooxigenasa de forma más débil que el AAS. Es posible que no sea precisa una inhibición muy potente de la actividad plaquetaria para asegurar un efecto antitrombótico suficiente en la terapia combinada con anticoagulantes. No se ha conseguido demostrar un beneficio superior con triflusal en dosis de 300 mg/ día como estrategia antiplaquetaria alternativa, y el AAS 100 mg/día condicionó una incidencia muy alta de eventos hemorrágicos graves. El nivel de anticoagulación fue el mismo en los tres grupos de pacientes que recibieron terapia combinada, pero el tratamiento no fue aleatorizado, algunos grupos tenían pocos pacientes y las prevalencias de factores de riesgo fueron diferentes, aunque este aspecto fue considerado al aplicar en el análisis el modelo de regresión de Cox con ajuste de las variables predictoras de eventos. Por todo ello, estos resultados no deben negar el papel del AAS en el tratamiento combinado, sino que plantean el hecho de que no conocemos aún la dosis ideal: > 300 mg/día, usada en estudios previos21, se asoció con un riesgo hemorrágico elevado, al igual que en nuestra experiencia con 100 mg/día. Por otro lado, un estudio aleatorizado reciente realizado en enfermos con cardiopatía coronaria22, demostró que 75 mg/día combinados con una intensidad anticoagulante (INR 2,0-2,5) similar a la utilizada por nuestro grupo no incrementó significativamente la tasa de complicaciones hemorrágicas. Por lo tanto, son necesarios futuros estudios para evaluar el papel del AAS en el tratamiento antitrombótico combinado.
Hemorragia gástrica durante el tratamiento antitrombótico combinado
La mayor parte de las hemorragias gástricas se registraron en pacientes asignados al tratamiento combinado con triflusal que no recibían tratamiento adicional con inhibidores de la bomba de protones, tratamiento que añadimos progresivamente desde 2002 a los pacientes con terapia combinada, una vez fue completado el análisis de nuestro estudio NASPEAF. En el grupo 2 hemos registrado 7 hemorragias gástricas antes de junio de 2001 y sólo 1 después de iniciar progresivamente el tratamiento de protección gástrica. En el grupo 3 algunos pacientes sufrieron hemorragias gástricas, pero todos estos eventos ocurrieron en los que no tomaban omeprazol. La endoscopia gástrica, realizada a todos los pacientes ingresados por hemorragia gástrica durante el tratamiento combinado, mostró afección superficial de la mucosa, lo que se ha relacionado con el componente ácido del fármaco antiplaquetario23,24. El daño causado por el fármaco es menor cuando tiene cubierta entérica23 y se evita al añadir al tratamiento inhibidores de la bomba de protones25. Ninguno de los pacientes incluidos en el grupo de tratamiento con AAS sufrió hemorragia gástrica, probablemente debido al bajo componente ácido de 100 mg de AAS y el uso de tabletas con cubierta entérica.
La parte del estudio dirigida a investigar estrategias alternativas del tratamiento antiplaquetario tiene algunas limitaciones: a) el bajo número de pacientes, especialmente en el grupo con AAS; b) aunque la recogida de datos fue prospectiva, la asignación del tratamiento no fue aleatorizada; c) la prevalencia de factores de riesgo resultó ser no homogénea, aunque fueron ajustados por el modelo de regresión de Cox, y d) las limitaciones en la interpretación de los resultados propias de los estudios que utilizan variables de resultado combinadas.
CONCLUSIONES
La duda acerca del beneficio del AAS en el tratamiento combinado justifica un estudio multicéntrico aleatorizado utilizando dosis bajas del fármaco.
ABREVIATURAS
AAS: ácido acetilsalicílico.
FA: fibrilación auricular.
NASPEAF: Estudio Nacional para la Prevención del Embolismo en la Fibrilación Auricular.
VÉASEEDITORIALENPÁGS. 972-5
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. R. Bover Freire.
Secretaría de Cardiología. Hospital Clínico San Carlos. 28040 Madrid. España.
Correo electrónico: ramonbover@secardiologia.es
Recibido el 16 de julio de 2008.
Aceptado para su publicación el 14 de abril de 2009.