El riesgo de ictus en la fibrilación auricular es heterogéneo y depende de las características clínicas subyacentes que se incluyen en los actuales esquemas de estratificación del riesgo. La escala de riesgo CHA2DS2-VASc se ha incluido recientemente en las guías de práctica clínica para una valoración más completa de los factores de riesgo de ictus que son frecuentes en la práctica clínica diaria y para una definición útil de individuos con un riesgo «realmente bajo». Nuestro objetivo es evaluar la utilidad de la escala CHA2DS2-VASc para obtener una perspectiva pronóstica adicional respecto a los eventos adversos y la mortalidad en la práctica clínica real en pacientes con fibrilación auricular anticoagulados, que a menudo son ancianos con múltiples comorbilidades.
MétodosSe reclutó a pacientes ambulatorios consecutivos con fibrilación auricular permanente/paroxística no valvular y puntuación CHA2DS2-VASc ≥ 2 y anticoagulación oral estabilizada (razón internacional normalizada 2,0-3,0) durante al menos los 6 meses previos a su inclusión en el estudio. Se seleccionó a pacientes con CHA2DS2-VASc ≥ 2. Se registraron los eventos adversos cardiovasculares (incluidos ictus, síndrome coronario agudo e insuficiencia cardiaca), las hemorragias mayores y la mortalidad durante un seguimiento de más de 2,5 años.
ResultadosDe los 933 pacientes (93,5%) evaluados, 432 eran varones, con una mediana de edad de 76 (71-81) años. Tras un seguimiento de 946 (782-1.068) días, 109 pacientes (11,7%) presentaron eventos adversos cardiovasculares, 80 (8,6%) sufrieron hemorragias mayores, 101 (10,8%) fallecieron y 230 (24,6%) sufrieron eventos adversos mayores (objetivo de valoración combinado). Un aumento de 1 punto en la escala CHA2DS2-VASc tuvo una repercusión significativa en la frecuencia de eventos cardiovasculares (hazard ratio = 1,27; intervalo de confianza del 95%, 1,13-1,44; p < 0,001). la mortalidad (hazard ratio = 1,36; intervalo de confianza del 95%, 1,19-1,54; p < 0,001) y los eventos adversos mayores (hazard ratio = 1,23; intervalo de confianza del 95%, 1,13-1,34; p < 0,001). La escala CHA2DS2-VASc no se asoció a los episodios de hemorragia mayor.
ConclusionesEn los pacientes con fibrilación auricular de alto riesgo tratados con anticoagulación oral, la escala de riesgo CHA2DS2-VASc predice satisfactoriamente los eventos cardiovasculares y la mortalidad, pero no las hemorragias mayores.
Palabras clave
La fibrilación auricular (FA) aumenta en 5 veces el riesgo de ictus y tromboembolia1. No obstante, el riesgo de ictus de los pacientes con FA no es homogéneo2, sino que depende de la presencia de otras características clínicas subyacentes3. Estos factores de riesgo se han utilizado para formular los esquemas de clasificación del riesgo de ictus empleados en la práctica clínica para estratificar el riesgo embólico (bajo, moderado o alto) en la FA, y para elegir la medicación antitrombótica más adecuada, sobre todo teniendo en cuenta que hasta hace poco solamente disponíamos de un anticoagulante de uso «incómodo», el antagonista de la vitamina K4, 5. La anticoagulación oral (ACO) es muy eficaz para reducir el riesgo de ictus y las tasas de mortalidad de los pacientes con FA6, pero también incrementa el riesgo de hemorragias, al menos en los ensayos clínicos históricos7, 8. Los datos más actuales muestran que el riesgo de hemorragia mayor con ácido acetilsalicílico no debe ser significativamente diferente del que se da con la ACO, sobre todo en los ancianos9, 10, 11.
Se han planteado varios esquemas de estratificación del riesgo derivados de los grupos de tratamiento sin warfarina de ensayos clínicos o del consenso de grupos de expertos12. El esquema de estratificación de riesgo más popular ha sido la escala CHADS2 (por las siglas en inglés de insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus [doble])13, ya que es fácil de recordar y calcular4, 5 y en algunos estudios puede tener un valor predictivo superior al de otros esquemas de riesgo13. Más recientemente se ha discutido la utilidad del esquema CHADS2, dado que no incluye muchos de los factores de riesgo de ictus y por otras limitaciones14, 15. Así pues, se ha redefinido y mejorado la escala CHADS2 mediante el esquema CHA2DS2-VASc (en inglés, insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes, ictus [doble], enfermedad vascular y categoría de sexo [mujeres]) para hacer énfasis en un enfoque basado en factores de riesgo12. Para ello se ha modificado la clasificación de los factores de riesgo ya incluidos y se han incorporado otros nuevos (tales como el sexo femenino y la enfermedad vascular)12, 16. La CHA2DS2-VASc proporciona un resultado consistentemente superior al de la escala CHADS2 en la identificación de los pacientes de bajo riesgo, y obtiene un resultado igual, y posiblemente superior, en la identificación de los pacientes que sufrirán ictus o tromboembolia12, 17, 18. En consecuencia, la guía de la Sociedad Europea de Cardiología4, 5 recomienda el uso de los esquemas CHADS2 y CHA2DS2-VASc para perfeccionar la estratificación de los pacientes y facilitar las decisiones en cuanto a profilaxis antitrombótica. Una posible crítica planteada a esta escala de riesgo es la que señala que no puede aportar más información después de iniciada la ACO19. Un reciente estudio en España ha mostrado incluso que el esquema de estratificación del riesgo CHA2DS2-VASc permitía una mejor discriminación entre pacientes con un riesgo de complicaciones tromboembólicas bajo e intermedio en comparación con otros20.
El objetivo de este estudio es evaluar la utilidad del esquema CHA2DS2-VASc para diferenciar y predecir la evolución cardiovascular adversa y la mortalidad en pacientes con FA tratados con ACO. Evaluamos la utilidad del CHA2DS2-VASc para obtener una perspectiva pronóstica adicional respecto a los acontecimientos adversos y la mortalidad en la práctica clínica real con pacientes con FA anticoagulados, que a menudo son ancianos con múltiples comorbilidades.
MétodosPoblación en estudioReclutamos para el estudio a 998 pacientes ambulatorios consecutivos con diagnóstico de FA permanente o paroxística, no valvular, de nuestra consulta ambulatoria de anticoagulación. Todos ellos recibían tratamiento de ACO con acenocumarol y presentaban valores de razón internacional normalizada (INR) estabilizados (INR 2,0-3,0) desde al menos 6 meses antes de la inclusión en el estudio. Se calculó la puntuación CHA2DS2-VASc según lo descrito con anterioridad12. Seleccionamos a los pacientes con una puntuación CHA2DS2-VASc ≥ 2 (riesgo alto de ictus). Por este motivo, se excluyó a 65 (6,5%) pacientes. Finalmente, se incluyó a 933 pacientes en el presente estudio, a los que se realizó un seguimiento de más de 2 años.
Los criterios de inclusión fueron los siguientes: edad superior a 18 años, ausencia de todo trastorno hematológico o contraindicación para la ACO en los 6 meses previos a la inclusión en el estudio, ausencia de eventos isquémicos (síndrome coronario agudo, técnicas de intervención, ictus o inestabilidad hemodinámica) que requieran hospitalización al menos en los 6 meses previos a la inclusión del paciente en el presente estudio, ausencia de FA reumática y válvulas cardiacas artificiales. La información sobre las características clínicas y demográficas, así como los datos detallados sobre los tratamientos antitrombóticos recibidos/prescritos se obtuvieron de las historias clínicas (tabla 1).
El seguimiento se realizó mediante visitas concertadas en nuestra clínica ambulatoria de anticoagulación. Durante el periodo de estudio, no hubo cambios en la clase de medicación anticoagulante. Las intervenciones dentales se afrontaron sin interrumpir la ACO. Detectamos 60 intervenciones quirúrgicas programadas en las que se utilizó un tratamiento puente con heparinas de bajo peso molecular, sin que hubiera eventos adversos asociados. Se registraron los eventos adversos, incluidos los trombóticos y los cardiovasculares (como ictus, tanto isquémicos como embólicos, síndrome coronario agudo o insuficiencia cardiaca aguda), los eventos de hemorragia mayor y la mortalidad total y cardiovascular. Las hemorragias mayores se evaluaron según los criterios de 2005 de la International Society on Thrombosis and Haemostasis21. Además, se definieron los eventos adversos mayores (EAM) mediante una variable de valoración combinada que integraba los eventos cardiovasculares, la hemorragia mayor y la mortalidad.
Análisis estadísticoLas variables se presentan en forma de porcentajes o como medianas [intervalo intercuartílico] según la naturaleza de los datos, discretos o continuos, respectivamente. Se utilizó la prueba de Kolmogorov-Smirnov para verificar la distribución normal de los datos de variables continuas. La repercusión clínica del valor calculado del esquema CHA2DS2-VASc se determinó con un modelo de regresión de Cox y se utilizó la puntuación obtenida como variable dependiente. Para todos los eventos adversos estudiados (eventos cardiovasculares, hemorragia mayor, mortalidad y variable de valoración combinada), se calcularon las tasas de eventos por año después de la estratificación de los pacientes entre 2 y 9 puntos (según el sistema de puntuación de la CHA2DS2-VASc). Además, se obtuvo la hazard ratio (HR) correspondiente al incremento en 1 punto para cada aumento de la puntuación de riesgo a partir del modelo de regresión de Cox. La potencia del valor pronóstico de la CHA2DS2-VASc se determinó mediante el cálculo del área bajo la curva de características operativas del receptor y el valor del estadístico c. El estadístico c cuantifica y discrimina la capacidad (valor de p ≥ 0,5), mientras que la HR cuantifica el aumento del riesgo relativo de la ocurrencia de eventos adversos en los diversos estratos de puntuación. Se aceptaron como estadísticamente significativos todos los valores de p < 0,05. El análisis estadístico se realizó con el programa SPSS 15.0 para Windows (SPSS, Inc.; Chicago, Illinois, Estados Unidos).
ResultadosLas características clínicas basales de los 933 (93,5%) pacientes incluidos y evaluados en cuanto a la puntuación de la escala CHA2DS2-VASc ≥ 2 y los eventos adversos se muestran en la Tabla 1. La mediana de edad fue de 76 [71-81] años, y 432 (46%) de los pacientes eran varones. Todos los pacientes evaluados tenían una puntuación CHA2DS2-VASc ≥ 2 y la mediana de puntuación de la CHA2DS2-VASc fue 4 [3-5], mientras que la mediana de la CHADS2 fue 2 [2-3].
Tabla 1. Características clínicas basales de los pacientes con fibrilación auricular tratados con anticoagulación oral
| Pacientes | N=933 |
| Varones | 432 (46) |
| Edad (años) | 76 [71-81] |
| Edad ≥ 75 años | 570 (61) |
| Hipertensión | 796 (85) |
| Diabetes | 253 (27) |
| Hipercolesterolemia | 298 (32) |
| Hábito tabáquico actual | 127 (14) |
| Insuficiencia cardiaca congestiva | 360 (39) |
| Ictus o AIT previos | 190 (20) |
| Enfermedad coronaria | 185 (20) |
| Enfermedad vascular periférica | 87 (9) |
| Puntuación CHA2DS2-VASc | 4 [3-5] |
| Puntuación CHADS2 | 2 [2-3] |
| Tratamiento concomitante | |
| Tratamiento antiagregante plaquetario | 160 (17) |
| IECA | 246 (26) |
| Bloqueadores del sistema angiotensina-renina | 212 (23) |
| Antagonista del calcio | 209 (22) |
| Bloqueadores beta | 285 (30) |
| Estatinas | 199 (21) |
| Digoxina | 177 (19) |
| Diuréticos | 402 (43) |
AIT: accidente isquémico transitorio; IECA: inhibidor de la enzima de conversión de la angiotensina.
Los datos expresan n (%) o mediana [intervalo intercuartílico].
La mediana de duración del seguimiento fue de más de 2,5 años (mediana, 946 [782-1.068] días). Durante este periodo, un total de 109 pacientes (11,7%) presentaron un evento cardiovascular adverso, 80 pacientes (8,6%) sufrieron un evento de hemorragia mayor y 101 pacientes (10,8%) fallecieron; en 30 (3,2%) de ellos la muerte fue de causa vascular y 9 (0,9%) fallecieron tras un evento hemorrágico. Los EAM, como variable de valoración combinada de los eventos cardiovasculares, la hemorragia mayor y la mortalidad, se dieron en un total de 230 pacientes (24,6%) (Tabla 2).
Tabla 2. Tasas totales de eventos por año
| Variables de valoración | n (%) | Tasa(%/año) |
| Eventos cardiovasculares | 109 (11,7) | 4,5 |
| Ictus | 38 (4,1) | 1,6 |
| SCA | 41 (4,4) | 1,7 |
| IC aguda | 31 (3,3) | 1,3 |
| Hemorragia mayor | 80 (8,6) | 3,3 |
| Intracraneal | 17 (1,8) | 0,7 |
| Total de muertes | 101 (10,8) | 2,7 |
| Muerte cardiovascular | 30 (3,2) | 1,2 |
| Causa hemorrágica | 9 (0,9) | 0,4 |
| EAM | 230 (24,6) | 9,5 |
EAM: eventos adversos mayores; IC: insuficiencia cardiaca; SCA: síndrome coronario agudo.
El tamaño de la muestra total evaluada fue de 933 pacientes con fibrilación auricular tratados con anticoagulación oral, que tenían un riesgo de ictus elevado (CHA2DS2-VASc ≥ 2). La mediana [intervalo intercuartílico] de seguimiento fue de 946 [782-1.068] días.
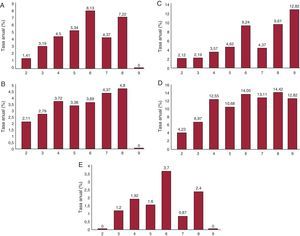
En la Tabla 3 y en la Figura presentamos las tasas de eventos por año según la puntuación de la escala CHA2DS2-VASc. Se pone claramente de manifiesto el aumento de las tasas de eventos por cada aumento de 1 unidad de la puntuación de la CHA2DS2-VASc para los eventos cardiovasculares (Tabla 3A), los episodios de hemorragia mayor (Tabla 3B), la tasa de mortalidad (Tabla 3C) y los EAM (Tabla 3D).
Tabla 3. Tasas de eventos por año según la puntuación CHA2DS2-VASc
| Puntuación CHA2DS2-VASc | Tasa de eventos/año (%) | No | Sí | Total |
| A. Eventos cardiovasculares | ||||
| 2 | 1,41 | 105 | 4 | 109 |
| 3 | 3,19 | 177 | 16 | 193 |
| 4 | 4,50 | 219 | 29 | 248 |
| 5 | 5,34 | 186 | 30 | 216 |
| 6 | 8,13 | 82 | 22 | 104 |
| 7 | 4,37 | 39 | 5 | 44 |
| 8 | 7,22 | 13 | 3 | 16 |
| 9 | 0 | 3 | 0 | 3 |
| Total | 824 | 109 | 933 | |
| B. Tasa de hemorragias mayores | ||||
| 2 | 2,11 | 103 | 6 | 109 |
| 3 | 2,79 | 179 | 14 | 193 |
| 4 | 3,72 | 224 | 24 | 248 |
| 5 | 3,38 | 197 | 19 | 216 |
| 6 | 3,69 | 94 | 10 | 104 |
| 7 | 4,37 | 39 | 5 | 44 |
| 8 | 4,80 | 14 | 2 | 16 |
| 9 | 0 | 3 | 0 | 3 |
| Total | 853 | 80 | 933 | |
| C. Tasa de mortalidad | ||||
| 2 | 2,12 | 103 | 6 | 109 |
| 3 | 2,19 | 182 | 11 | 193 |
| 4 | 3,57 | 225 | 23 | 248 |
| 5 | 4,62 | 190 | 26 | 216 |
| 6 | 9,24 | 79 | 25 | 104 |
| 7 | 4,37 | 39 | 5 | 44 |
| 8 | 9,61 | 12 | 4 | 16 |
| 9 | 12,82 | 2 | 1 | 3 |
| Total | 832 | 101 | 933 | |
| D. Tasa de eventos adversos mayores | ||||
| 2 | 4,23 | 97 | 12 | 109 |
| 3 | 6,97 | 158 | 35 | 193 |
| 4 | 12,55 | 185 | 63 | 248 |
| 5 | 10,68 | 156 | 60 | 216 |
| 6 | 14,05 | 66 | 38 | 104 |
| 7 | 13,11 | 29 | 15 | 44 |
| 8 | 14,42 | 10 | 6 | 16 |
| 9 | 12,82 | 2 | 1 | 3 |
| Total | 703 | 230 | 933 | |
| E. Tasa de ictus | ||||
| 2 | 0 | 109 | 0 | 109 |
| 3 | 1,20 | 187 | 6 | 193 |
| 4 | 1,92 | 237 | 11 | 248 |
| 5 | 1,60 | 207 | 9 | 216 |
| 6 | 3,70 | 94 | 10 | 104 |
| 7 | 0,87 | 43 | 1 | 44 |
| 8 | 2,40 | 15 | 1 | 16 |
| 9 | 0 | 3 | 0 | 3 |
| Total | 895 | 38 | 985 | |
Figura. A: eventos cardiovasculares según la puntuación de la escala CHA2DS2-VASc (tasa anual). B: eventos hemorrágicos según la puntuación de la escala CHA2DS2-VASc (tasa anual). C: mortalidad según la puntuación de la escala CHA2DS2-VASc (tasa anual). D: eventos adversos mayores según la puntuación de la escala CHA2DS2-VASc (tasa anual). E: ictus según la puntuación de la escala CHA2DS2-VASc (tasa anual).
La CHA2DS2-VASc tuvo un estadístico c de 0,61 (intervalo de confianza del 95% [IC95%], 0,59-0,66; p < 0,001) para los eventos cardiovasculares, mientras que para la mortalidad, el estadístico c fue de 0,64 (IC95%, 0,58-0,70; p < 0,001), y para los EAM, 0,61 (IC95%, 0,57-0,65; p < 0,001) (Tabla 4). El estadístico c para los eventos de hemorragia mayor no fue significativo (0,54; IC95%, 0,48-0,61; p = 0,179).
Tabla 4. Valor predictivo y repercusión clínica del aumento de la puntuación CHA2DS2-VASc respecto a la aparición de episodios de la variable de valoración: índices del estadístico c y razones de riesgos según el análisis de regresión de Cox
| CHA2DS2-VASc | ||||
| Variable de valoración | Valor predictivo, estadístico c (IC95%) | p | Análisis de Cox, HR (IC95%) | p |
| Eventos cardiovasculares | 0,61 (0,59-0,66) | < 0,001 | 1,27 (1,13-1,44) | 0,001 |
| Eventos de hemorragia mayor | 0,54 (0,48-0,61) | 0,179 | 1,14 (0,98-1,32) | 0,092 |
| Mortalidad | 0,64 (0,58-0,70) | < 0,001 | 1,36 (1,19-1,54) | < 0,001 |
| EAM | 0,61 (0,57-0,65) | < 0,001 | 1,23 (1,13-1,34) | < 0,001 |
EAM: eventos adversos mayores (variable de valoración combinada que incluye eventos cardiovasculares, hemorragia mayor y mortalidad); HR: razón de riesgos; IC95%: intervalo de confianza del 95%.
El aumento de las puntuaciones de CHA2DS2-VASc y CHADS2 corresponde al incremento en 1 unidad de cada puntuación de estratificación de riesgo.
Se consideraron estadísticamente significativos todos los valores de p < 0,05.
Los aumentos en la puntuación de la escala CHA2DS2-VASc mostraron una asociación significativa con la aparición de eventos clínicos, incluida la aparición de eventos cardiovasculares (HR = 1,27; IC95%, 1,13-1,44; p = 0,001), la mortalidad por cualquier causa (HR = 1,36; IC95%, 1,19-1,54; p < 0,001) y los EAM (HR = 1,23; IC95%, 1,13-1,34; p < 0,001) (Tabla 4). No hubo una asociación significativa entre la puntuación CHA2DS2-VASc y los episodios de hemorragia mayor (HR = 1,14; IC95%, 0,98-1,32; p = 0,092).
DiscusiónLos resultados del presente estudio indican que el sistema de puntuación de la escala de riesgo CHA2DS2-VASc puede ser un instrumento útil para predecir los eventos adversos, más allá del riesgo tromboembólico, en los pacientes con FA que toman ACO. Observamos que un aumento de 1 unidad en la puntuación CHA2DS2-VASc12 en pacientes de alto riesgo (que tienen valores de 2 a 9 puntos) se asociaba de manera significativa a una tasa de eventos más alta, en especial por lo que respecta a los eventos cardiovasculares y la mortalidad, a pesar de que todos los pacientes incluidos en el estudio estaban en tratamiento con ACO. No hubo ninguna asociación estadísticamente significativa entre la puntuación de la escala CHA2DS2-VASc y los eventos de hemorragia mayor.
Observamos que los valores crecientes en los estratos de puntuación CHA2DS2-VASc (analizados como incrementos de 1 unidad) aumentaban de manera constante en 1,23 y 1,36 veces el riesgo (HR) de sufrir alguno de los eventos adversos o muerte. Así pues, la estratificación por subtipos en diversas categorías de alto riesgo basada en el cálculo de la escala CHA2DS2-VASc podría reflejar la realidad del riesgo en los pacientes con FA de riesgo elevado tratados con ACO. En un estudio de cohorte de 11.245 pacientes, Baruch et al22 concluyeron que a los pacientes de riesgo alto se los puede tratar con estrategias terapéuticas más agresivas que a los pacientes de riesgo moderado. Otros autores han evaluado anteriormente el riesgo individual de ictus y tromboembolia en pacientes con FA en función de sus características clínicas subyacentes7, por ejemplo, para establecer su objetivo de INR óptima o para mejorar las decisiones de profilaxis antitrombótica, pero sin éxito. Quizá habría que investigar esto para facilitar unas decisiones de tromboprofilaxis más exactas en el manejo de los «pacientes de alto riesgo clásicos» en función de su clasificación en un «estrato de subtipo de alto riesgo» según la escala CHA2DS2-VASc.
Los pacientes con FA tienen un riesgo elevado de sufrir eventos tanto cardiovasculares como hemorrágicos23. Es de destacar que un gran número de los factores de riesgo incluidos en la escala CHADS2 son también factores de riesgo hemorrágico24, como es el caso del ictus previo, los pacientes ancianos, el deterioro de la función renal o la hipertensión25, según la conocida escala de valoración HAS-BLED26. Esto implica que, a medida que aumenta el riesgo de ictus y tromboembolia (medido, por ejemplo, con la escala CHADS2), se incrementa también el riesgo de hemorragia27, 28. Con los nuevos ACO, la tendencia ha sido a incluir en mayor número, y no a excluir, los factores de riesgo de ictus29. Así pues, la escala CHA2DS2-VASc incluye los nuevos factores de riesgo y perfecciona la asignación de puntos a los demás, y en varias cohortes independientes se ha comparado la capacidad de la escala CHA2DS2-VASc y la de otros esquemas de estratificación de riesgo actuales para predecir o evaluar la repercusión en la aparición de eventos adversos, y se ha observado que el esquema CHA2DS2-VASc identifica consistentemente mejor a los pacientes con un riesgo de ictus y tromboembolia realmente bajo o moderado y que da un resultado igual, y posiblemente mejor, en la identificación del riesgo «alto» de tromboembolia12, 17, 30, 31, 32. Recientemente hemos puesto de manifiesto que la escala HAS-BLED puede aportar una información pronóstica importante respecto a la mortalidad y los eventos cardiovasculares, y no sólo respecto al riesgo de hemorragia33. Sin embargo, no pudimos demostrar un valor predictivo significativo de la escala CHA2DS2-VASc respecto al riesgo de hemorragia en la presente cohorte. La mediana de puntuación de la escala HAS-BLED en nuestra población fue de 2 [2-3]. Esto puede explicar, al menos en parte, el menor riesgo de hemorragia en nuestra población. Recientemente hemos demostrado33, en una población tratada con acenocumarol, que las tasas de hemorragia sólo superaron a los eventos trombóticos cuando la puntuación de la escala HAS-BLED era ≥ 3, tal como se había observado anteriormente27. Además, el acenocumarol, dadas sus características farmacocinéticas34 que pueden aumentar el riesgo de tener una INR > 6, debe ser más recomendable para los pacientes con un «riesgo hemorrágico bajo» para conseguir una ACO más estable dentro de ventana terapéutica (TTR, time in therapeutic range). Es de destacar que, aunque hay un menor número de estudios que han comparado los efectos terapéuticos del acenocumarol con los de la warfarina, el acenocumarol parece conducir a un TTR menos estable34, 35, si bien en nuestra población seleccionada no observamos este inconveniente con el tratamiento con acenocumarol. En consecuencia, el riesgo hemorrágico relativamente bajo y la anticoagulación basada en el acenocumarol, junto con el TTR más alto al inicio del estudio en nuestra cohorte, puede hacer que se trate de una población más estable, con un reducido riesgo trombótico y hemorrágico. Esto puede explicar el moderado valor predictivo del esquema CHA2DS2-VASc observado en nuestro estudio. Por consiguiente, en futuras investigaciones se deberá explorar la repercusión clínica y el valor predictivo del CHA2DS2-VASc en los pacientes con TTR del 60-65% con una anticoagulación basada en el acenocumarol (ya que en las poblaciones tratadas con warfarina se observa un valor predictivo uniforme para los eventos trombóticos y hemorrágicos con la evaluación basada en la CHA2DS2-VASc) o con una puntuación HAS-BLED ≥ 3.
La mayor parte de los esquemas actuales de estratificación del riesgo derivan de los grupos sin tratamiento de warfarina de cohortes de ensayos clínicos históricos (que incluyeron en la asignación aleatoria a menos del 10% de los pacientes inicialmente examinados para ello), en los que es frecuente que los factores de riesgo se hayan definido o registrado de manera inadecuada. Además, su capacidad predictiva en pacientes tratados con ACO no está tan validada36. Se han realizado algunos estudios de validación (como es el caso de algunos metaanálisis recientes) que no se han basado en cohortes de ensayos clínicos y han aplicado los esquemas de estratificación del riesgo de ictus publicados a pacientes no seleccionados identificados en la práctica clínica general para comparar su valor predictivo12, 17, 31, 32, y en algunos casos los resultados publicados corresponden a pacientes seleccionados, sin indicación para ACO30, a diferencia de nuestro estudio.
LimitacionesÚnicamente incluimos a pacientes en tratamiento estable con ACO, con objeto de disponer de una cohorte homogénea, por lo que se excluyeron otras posibles variables. Hemos reclutado a una población con un buen control de anticoagulación en el momento de su inclusión, a diferencia de otros estudios de cohortes clínicas en los que se reclutó únicamente a pacientes con un TTR del 60 al 75%. Por consiguiente, nuestros resultados pueden no ser aplicables a pacientes con una anticoagulación inestable (con TTR bajo), que son más propensos a sufrir eventos adversos, o a pacientes en una fase inicial del tratamiento con ACO, en los que es más probable la aparición de eventos trombóticos27, 37. En nuestros pacientes, la anticoagulación se realizó solamente con acenocumarol (el antagonista de vitamina K más ampliamente utilizado en España), que difiere de la warfarina en su semivida más corta; el fármaco parece tener ciertas ventajas en la práctica clínica. Hemos observado un moderado valor predictivo de la puntuación de la escala CHA2DS2-VASc (< 70%), lo cual difiere de lo indicado por los datos de estudios previos. La buena ACO al inicio, el uso de acenocumarol y, por lo tanto, la población de pacientes más estable evaluada en nuestro estudio podrían explicar el moderado valor del estadístico c observado. Además, el aumento exponencial de la tasa de ictus, descrito anteriormente13, es amortiguado para puntuaciones CHA2DS2-VASc más altas, probablemente por el reducido número de pacientes con alto riesgo de ictus en nuestro estudio. Esto puede ser una limitación para alcanzar diferencias estadísticas. La escala CHA2DS2-VASc es un perfeccionamiento de la CHADS2 y aporta una discriminación consistentemente mejor de los pacientes de riesgo bajo y moderado18, al tiempo que da un resultado igual de bueno (y posiblemente mejor) en la identificación de los pacientes con un riesgo de tromboembolia alto. Así pues, el aumento exponencial del riesgo de ictus con el esquema CHADS2 puede ser lábil cuando se evalúa mediante el CHA2DS2-VASc, debido al mayor riesgo de estratificar en mayor número de categorías de riesgo alto. Hemos estudiado a poblaciones de origen caucásico, sin ninguna prevalencia de otras razas, por lo que nuestros resultados deben ser específicos para nuestra población de pacientes y tal como fueron tratados.
ConclusionesEn conclusión, la escala de estratificación del riesgo de ictus CHA2DS2-VASc predice con éxito los eventos cardiovasculares y la mortalidad, pero no las hemorragias mayores, en pacientes con FA de alto riesgo tratados con ACO.
Conflicto de interesesGregory Y.H. Lip ha sido consultor de Bayer, Astellas, Merck, AstraZeneca, Sanofi, BMS/Pfizer, Biotronik, Portola y Boehringer Ingelheim, y ha formado parte del panel de conferenciantes de Bayer, BMS/Pfizer, Boehringer Ingelheim y Sanofi-Aventis. Francisco Marín ha sido consultor de Bayer y Boehringer Ingelheim, y ha formado parte del panel de conferenciantes de Boehringer Ingelheim y Boston Scientific.
Agradecimientos
Este trabajo ha sido financiado en parte por la Sociedad Española de Cardiología y por las subvenciones RD06/0014/039 (RECAVA) y PI11/1256 del Instituto de Salud Carlos III (ISCIII). E. Jover disfruta de una beca de investigación del ISCIII. La Dra. Hernández-Romero ocupa un puesto posdoctoral financiado por el Instituto de Salud Carlos III.
Recibido 12 Diciembre 2011
Aceptado 5 Febrero 2012
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Virgen de la Arrixaca, Ctra. Madrid-Cartagena s/n, 30120 El Palmar, Murcia, España. fcomarino@hotmail.com