A pesar del progresivo desarrollo en el diseño de los stents y la mayor eficacia del tratamiento antiplaquetario, la trombosis de stent (TS) continúa siendo un evento adverso conocido y temido, con una incidencia del 1 al 5%1,2 y una mortalidad que supera el 10% en todas las series3,4. En la TS, el implante de un stent adicional se ha relacionado con un desenlace desfavorable, mayor riesgo de retrombosis e incremento de mortalidad1,2. La ecografía intravascular (EIC) es una herramienta imprescindible para estudiar el mecanismo causal de la TS; sin embargo, el número de TS estudiadas con EIC en nuestro ámbito es reducido1,5.
Se describen los hallazgos de EIC en TS definitivas remitidas entre 2008 y 2011 a un centro, y se compara el manejo terapéutico realizado en el grupo de pacientes estudiados con EIC respecto a los pacientes no analizados con EIC.
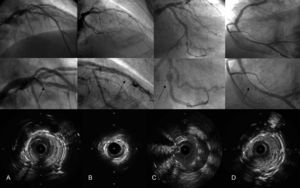
Se trató a 2.028 pacientes con 3.004 stents. Se recogieron 45 TS definitivas, 18 de ellas (40%) estudiadas con EIC. La descripción de los hallazgos de la EIC se muestra en la tabla. Las TS agudas y subagudas se estudiaron con EIC en mayor frecuencia, en comparación con los cuadros de TS tardía o muy tardía. En la mayoría de los casos se detectaron varios mecanismos relacionados con la TS. En el grupo de TS precoz (aguda y subaguda), la infraexpansión y la lesión en el borde del stent fueron los hallazgos ecográficos más frecuentes. En los pacientes con trombosis tardía y muy tardía, se encontró con mayor frecuencia proliferación en el stent, con estenosis grave y, en 1 caso, malaposición por remodelado positivo del vaso. En la Figura se muestran los cuatro mecanismos de TS detectados.
Hallazgos por ecografía intravascular en los pacientes incluidos y manejo terapeútico
| Caso | Edad | Vaso | Stent | Tiempo (días) | Hallazgos angiográficos | Hallazgos en ecografía intracoronaria | Manejo terapéutico |
| 1 | 68 | DA | SF | 0 | Oclusión completa del borde proximal del stent | Infraexpansión y trombo adherido | Aspiración trombótica, abciximab y posdilatación |
| 2 | 70 | CD | SC | 1 | Oclusión completa del borde proximal del stent | Flap intimal en el borde proximal del stent | Aspiración trombótica e implante de nuevo SC |
| 3 | 69 | CD | SC | 4 | Imagen de trombo organizado en el stent, con flujo distal TIMI 1 | Infraexpansión ligera. Lesión grave en el borde distal del stent | Aspiración trombótica e implante de nuevo SC |
| 4 | 72 | DA | SF | 4 | Oclusión completa del stent en el solapamiento de dos stents implantados en tándem | Infraexpansión grave (anillo de calcio de 360° en el vaso) (Figura B) | Posdilatación a altas presiones con balones de perfil creciente |
| 5 | 63 | DA | SF | 4 | Oclusión completa del borde proximal del stent | Flap intimal en el borde distal del stent, malaposición | Aspiración trombótica, abciximab e implante de nuevo SF |
| 6 | 69 | DA | SF | 4 | Oclusión completa del borde proximal del stent | Infraexpansión del stent y malaposición | Aspiración trombótica, abiximab y posdilatación |
| 7 | 47 | CD | SF | 4 | Oclusión completa del stent (borde distal) | Flap intimal en el borde distal del stent con puerta de entrada visible distalmente y proximalmente atrapada por el stent. Arco de 60-90° | Aspiración trombótica, abciximab y nuevo SF |
| 8 | 76 | Cx | SF | 5 | Oclusión completa del borde proximal del stent | Infraexpansión grave, malaposición | Aspiración trombótica, abciximab y posdilatación |
| 9 | 72 | CD | SC | 5 | Stents en V a nivel de la bifurcación con oclusión desde el origen del stent de la posterolateral | Infraexpansión del stent de la posterolateral | Abciximab y posdilatación |
| 10 | 40 | DA | SC | 8 | Oclusión completa anterior al stent con imagen de placa rota en el borde proximal del stent | Flap intimal en el borde proximal del stent. Trombo adherido (Figura A) | Aspiración trombótica, abciximab y nuevo SF |
| 11 | 83 | Dx | SC | 9 | Oclusión completa desde el origen del stent de la primera diagonal | Struts del stent ajustados al ostium de la diagonal sobresaliendo en descendente anterior. Infraexpansión | Aspiración trombótica hacia la DA, abciximab y posdilatación |
| 12 | 64 | CD | SC | 14 | Trombosis del stent de coronaria derecha media con flujo TIMI 0 | Infraexpansión del stent | Aspiración trombótica, abciximab y posdilatación |
| 13 | 71 | VSI | SF | 240 | Reestenosis crítica focal en el stent en el borde distal del puente (anastomosis hacia la obtusa marginal) con flujo distal TIMI 1 | Hiperplasia concéntrica grave | Aspiración trombótica, abciximab y nuevo SF |
| 14 | 58 | OM | SF | 290 | Imagen de trombo en el stent con dilatación aneurismática del vaso en el borde proximal del stent | Malaposición por remodelado positivo del vaso (Figura C) | Aspiración trombótica, abciximab y posdilatación; comprobación de resultado con EIC |
| 15 | 49 | CD | SF | 350 | Oclusión completa del borde proximal del stent | Stent bien apuesto y sin proliferación. Trombo adherido | Aspiración trombótica y abciximab |
| 16 | 69 | IVP | SF | 683 | Oclusión completa del stent (en segmento medio) implantado en coronaria derecha distal hacia descendente posterior | Infraexpansión y trombo adherido | Abciximab y posdilatación |
| 17 | 70 | DA | SF | 1.858 | Imagen de trombo organizado en el stent con flujo distal TIMI 1 | Infraexpansión, malaposición y trombo residual | Aspiración trombótica, abciximab y posdilatación |
| 18 | 51 | CD | SC | 2.221 | Oclusión completa del borde proximal del primer stent (dos stents solapados) | Proliferación difusa en el stent (probable neoaterosclerosis) con estenosis grave (Figura D) | Abciximab e implante de SF |
| Manejo terapéutico realizado en ambos grupos | p | ||
| Estudio con EIC (n=18) | Sin estudio EIC (n=27) | ||
| Trombosis precoz | 12 (66,7) | 5 (3,7) | 0,01* |
| Trombosis tardía | 6 (33,3) | 14 (51,8) | 0,22 |
| Stents convencionales | 7 (38,9) | 9 (33,3) | 0,71 |
| Stents farmacoactivos | 11 (61,1) | 18 (66,7) | 0,71 |
| Aspiración | 14 (77,8) | 13 (48,2) | 0,05* |
| Abciximab | 15 (83,3) | 14 (51,8) | 0,03* |
| Implante de un nuevo stent | 6 (33,3) | 17 (62,9) | 0,05* |
| Mortalidad | 4 (22,2) | 4 (14,8) | 0,52 |
| Retrombosis | 1 (5,5) | 3 (11,1) | 0,52 |
CD: coronaria derecha; Cx: circunfleja; DA: descendente anterior; Dx: diagonal; EIC: ecografía intravascular; IVP: interventricular posterior; OM: obtusa marginal; SC: stent convencional; SF: stent farmacoactivo; TIMI: Thrombolysis in Myocardial Infarction; VSI: vena safena interna.
Malaposición: al menos un strut sin contacto con la pared del vaso, exceptuando el origen de una rama secundaria. Infraexpansión: área mínima en el stent <80% de la media de las áreas de referencia proximal y distal.
*Resultado con significación estadística.
Esquema de los cuatro mecanismos principales de trombosis de stent. En la tira superior se muestran las angiografías una vez recuperado el flujo distal; en la tira central, el detalle del stent ampliado, y en la tira inferior, los cortes transversales de la imagen de ecografía intracoronaria. A: flap intimal en el borde del stent. B: infraexpansión del stent. C: malaposición por remodelado positivo del vaso. D: proliferación neointimal con estenosis grave.
Con respecto al manejo terapéutico, en los casos con trombosis tardía se precisó con más frecuencia predilatación con balón para conseguir avanzar la sonda de EIC, lo que podría sobrestimar el área mínima medida en el stent. En 17 pacientes la EIC llegó a detectar el mecanismo definitivo de trombosis. En sólo 1 paciente con trombosis tardía, el cuadro se relacionó con suspensión de la doble antiagregación, sin hallazgos patológicos en el estudio mediante EIC. La utilización de inhibidores de la glucoproteína IIb/IIIa y dispositivos de aspiración trombótica fue más frecuente en el grupo de pacientes valorados con EIC. Las TS valoradas con EIC se trataron menos frecuentemente con implante de un segundo stent. El estudio con EIC permitió guiar y optimizar el tratamiento realizado en todos los casos. No se detectaron diferencias significativas en el resultado angiográfico, la mortalidad o la retrombosis.
Los hallazgos de EIC de la TS precoz y tardía en nuestra serie presentan distintos perfiles, lo que podría apuntar a que se trata de dos entidades con mecanismos fisiopatológicos distintos. La relación entre factores mecánicos durante el procedimiento del implante y la trombosis precoz ya se había identificado en estudios previos. Cheneau et al6 relacionaron la TS subaguda con un resultado inadecuado en el procedimiento del implante, con áreas en el stent significativamente menores y otros hallazgos ecográficos como disección, trombo residual o prolapso del tejido entre los struts. En el registro más amplio publicado, Amstrong et al4 identificaron múltiples factores clínicos, angiográficos y pronósticos en función de la temporalidad de las TS, lo que indicaría que cada entidad debe de corresponder a un mecanismo etiológico distinto. Además, detectaron mayor tendencia a implantar stents en los pacientes con trombosis muy tardía que en el grupo de trombosis precoces.
El implante de un stent adicional en los cuadros de trombosis se identificó como factor independiente predictor de mortalidad y recurrencia de TS en el registro ESTROFA1. En nuestra serie, los pacientes estudiados con EIC recibieron con menor frecuencia un segundo stent en el manejo de la trombosis, sin observarse diferencias en mortalidad o retrombosis. Sin embargo, las trombosis precoces se estudiaron con EIC con más frecuencia que las tardías, lo cual podría sobrestimar el valor de la EIC a la hora de evitar el implante de un segundo stent.
La EIC resulta de gran utilidad para estudiar el mecanismo causal del cuadro de trombosis, pues detecta factores fisiopatológicos subestimados por angiografía convencional e identifica a los pacientes en quienes el implante de un stent adicional podría aportar algún beneficio.