La guía europea de tratamiento de las dislipemias es una moderada evolución en tiempo y evidencia de la guía europea de prevención del riesgo cardiovascular de 2007. En los apartados que hacen referencia al tratamiento lipídico farmacológico, se acopla a la nueva definición de riesgo y crea una gradación consistente en la aplicación de las medidas terapéuticas. Mantiene como el objetivo primordial de tratamiento la reducción del colesterol unido a lipoproteínas de baja densidad mediante estatinas. Las diversas familias farmacológicas contribuyen al frenado del colesterol unido a lipoproteínas de baja densidad perimetralmente a las estatinas y a menudo complementándolas o colaborando con ellas. El tratamiento farmacológico de colesterol unido a lipoproteínas de alta densidad y triglicéridos plantea no solo la dificultad de las distintas sustancias para tratarlas eficazmente, sino también la dificultad de interpretación del significado de esas partículas lipídicas en la fisiopatología de la enfermedad cardiovascular y su patogenia, hasta de si son solo marcadores de enfermedad, más que factores de riesgo.
Palabras clave
La nueva «Guía para el manejo de las dislipemias» (GDL) de la Sociedad Europea de Cardiología (ESC)1, publicada a mediados de 2012, es una evolución y ampliación de la anterior guía de riesgo cardiovascular (GRCV) de la ESC2. Es un proceso evolutivo: no han sido unas guías que hayan roto con la línea anterior de opinión, sino que han incorporado buena parte de la evidencia asentada desde las anteriores.
Se basan fundamentalmente en la reclasificación de los pacientes según su riesgo. Y esa clasificación nueva es muy clara y, aunque opinable, posee buenas características para definir el tipo de paciente al que tratar la alteración de los lípidos según su riesgo. No obstante, como hizo anteriormente la GRCV, la GDL hace hincapié en que el tratamiento de las dislipemias es parte del tratamiento integral del riesgo cardiovascular (RCV). Lo que implica que si, por la razón que sea, no se puede alcanzar y superar los objetivos de colesterol unido a lipoproteínas de baja densidad (cLDL) que las guías marcan, se debe aumentar la presión para alcanzar otros objetivos del perfil de riesgo del paciente: de presión arterial, de aumento del colesterol unido a lipoproteínas de alta densidad (cHDL), tabaquismo, sobrepeso, alimentación, etcétera.
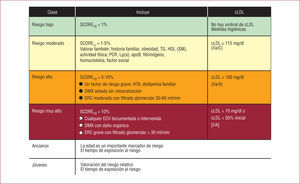
Para adentrarnos en el tratamiento lipídico directamente, debemos revisar la clasificación de pacientes. La ESC clasifica el riesgo en cuatro clases: bajo, moderado, alto y muy alto riesgo (fig. 1)1,3. Salvo el grupo de bajo riesgo (para el que no define una concentración de colesterol determinada), en los demás grupos determina una cifra objetivo de cLDL que mejorar: 115mg/dl para el de riesgo moderado, 100mg/dl para el de alto riesgo y 70mg/dl para el de muy alto riesgo (cifras que corresponden a 3, 2,5 y 1,8mmol/l respectivamente). La gradación de riesgo es progresiva, razonable, sencilla y bien basada en la evidencia.
Grupos de riesgo de la Sociedad Europea de Cardiología 2011 y objetivos de cLDL. apoB: apolipoproteína B; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; ERC: enfermedad renal crónica; HDL: hiperdislipemia; Lp(a): lipoproteína (a); PCR: proteína C reactiva; SM: síndrome metabólico; TG: triglicéridos. Adaptado de Catapano et al1 y de Perk et al3 con permiso.
En el proceso de decisión de tratamiento de la dislipemia como prevención del RCV (que es a lo que hace referencia la GDL), se debe delimitar bien los casos que tratar, cuándo comenzar el tratamiento, cuánto o hasta qué intensidad tratar y con qué herramientas hacerlo. El párrafo anterior correspondería al «cuánto tratar» del proceso de decisión de tratamiento y, en buena parte también, delimita los casos que tratar. Aunque la GDL navega posteriormente por la casuística concreta de situaciones clínicas diferenciadas: dislipemias familiares, niños, mujeres, ancianos, síndrome metabólico (SM) y diabetes mellitus (DM) tipos 1 y 2, síndromes coronarios agudos (SCA) e intervencionismo coronario, insuficiencia cardiaca, valvulopatías, insuficiencia o enfermedad renal crónica, enfermedad cerebrovascular y arterial periférica, enfermedades autoinmunitarias y pacientes trasplantados, y pacientes con sida.
Otros elementos del perfil lipídico no tienen la misma consideración que el cLDL, porque la evidencia sobre la seguridad de las modificaciones de este es abrumadora en comparación con los demás. En todo caso, hace una especial referencia al cHDL, indicando que no hay objetivos específicos deducidos con evidencia de seguridad, aunque los valores de cHDL elevados predicen regresión de aterosclerosis, y el cHDL bajo está asociado a un exceso de episodios cardiovasculares y de mortalidad, incluso si el cHDL bajo concurre con un cLDL en objetivos de 70mg/dl.
En la GDL de la ESC, con cada grupo de riesgo se hace una indicación de manejo terapéutico que depende tanto del grupo de riesgo como del cLDL de inicio. En la figura 2 se muestran las indicaciones para acometer el tratamiento de cambio de estilo de vida asociado o no a la indicación de fármacos para reducir el cLDL. Es el «cuándo tratar » del proceso de decisión. La aplicación del tratamiento también es progresiva y acumulativa. Para todos los casos de riesgo indica cambio del estilo de vida, del que se hace referencia amplia en la anterior GRCV. En la situación de bajo riesgo solo hace esa indicación, lo que valdría para la población general (tramos verde y verde claro de la fig. 2). Sin embargo, conforme se avanza en el grado de riesgo, se va haciendo primero una indicación tentativa de tratar cuando, pese a las medidas higiénico-dietéticas, los valores de cLDL se mantengan elevados, o de plantearse directamente dar medicación antidislipémica cuando el grado de riesgo progresa (tramos amarillo y naranja). Y en los casos en que se asocian cifras de cLDL proporcionalmente elevadas y riesgo más alto, la indicación de usar sistemáticamente fármacos para reducir el cLDL (tramos rojos).
Tratamiento farmacológico de las dislipemias en la GDLSupone la toma de sustancias que modifiquen el metabolismo de los lípidos para reducir su concentración plasmática. Todas las sustancias de las que disponemos, y que la GDL menciona, modifican el perfil lipídico completo, sin embargo su indicación es por el efecto mayor, para el que tienen una indicación preferente. La GDL orienta el uso de un primer grupo de sustancias que está en cierto modo relacionado con la modificación del estilo de vida, cuáles son los suplementos dietéticos y alimentos funcionales, que no son alimentos como tales, sino sustancias añadidas a la alimentación. Un gran segundo grupo lo forman los antidislipémicos orientados a disminuir el cLDL. Un tercer grupo, los orientados a elevar el cHDL, y un cuarto grupo, a la disminución de la hipertrigliceridemia (triglicéridos [TG]). Todo ello entendiendo que el elemento nuclear del tratamiento de la dislipemia orientada al control del RCV son las estatinas (STA, inhibidores de la hidroximetil-glutaril-coenzima A reductasa).
Suplementos dietéticos y alimentos funcionalesDeterminadas sustancias naturales, algunas de ellas presentes en la misma alimentación, añadidas a los alimentos (alimentos funcionales) o tomadas aisladamente (nutracéuticos), pueden tener cierto efecto en el metabolismo lipídico. Son sustancias casi sin efectos indeseables y con un suave efecto antidislipémico. Sin embargo, no se dispone de evidencia lo suficientemente amplia en número de pacientes, consistente en los resultados y de largo seguimiento para afirmar que su uso como terapia activa única4 sea relevante en la historia natural de la enfermedad cardiovascular (ECV)5.
Los fitosteroles (esteroles vegetales presentes en los frutos secos, vegetales, legumbres, etc., o sus derivados semisintéticos, los ésteres de estanoles, por hidrogenación más esterificación de esteroles) compiten por la ocupación micelar en el tracto digestivo y posiblemente en el ciclo de la lecitin-colesterol-acil-transferasa (LCAT) en la célula intestinal. Su influencia en las concentraciones de cLDL es escasa y actualmente no hay evidencia sólida de que su uso exclusivo modere el desarrollo de la ECV6.
Los ácidos grasos insaturados omega-3 (n-3) (docosahexaenoico [DHA] y eicosapentaenóico [EPA]), procedentes sobre todo de aceites de pescados grasos de aguas frías, aunque también de los frutos secos (alfalinolénico [ALA]), se han utilizado como moduladores del perfil lipídico y reductores de la hipertrigliceridemia; sin embargo, no hay evidencias sólidas de que su suplementación dietaria reduzca los episodios de ECV7.
La fibra alimentaria, especialmente la soluble (inulina, pectina, betaglucano y otros oligosacáridos), más que la insoluble, tiene la propiedad de reducir la concentración de colesterol total y cLDL. La GDL la recomienda en dosis de 5–15g/día por su buena tolerabilidad digestiva8. Otras sustancias como las proteínas de soja y los policosanoles tienen un efecto más moderado. Quizá merezca una reseña, que en el medio europeo tiene escasa relevancia, la presencia de una sustancia con un efecto inhibidor de la hidroximetilglutaril coenzima A reductasa (como las estatinas) en la levadura roja de arroz9, un saborizante usado en la cocina oriental, que induce lógicamente una reducción del cLDL, pero del que hay escasos estudios que demuestren disminución de los episodios de ECV10.
Fármacos para tratar el cLDLComo ya se ha comentado antes, el elemento nuclear del tratamiento del riesgo lipídico en la ECV es la reducción de la concentración de cLDL. Y las estatinas (inhibidores de la hidroximetilglutaril coenzima A reductasa, bloqueo de la síntesis de colesterol) son las sustancias que atesoran la más sólida evidencia en cuanto a reducción de episodios de ECV y moderación de su evolución natural clínica y anatómica. El control del RCV mediante estatinas en estudios controlados indica que, por cada mmol/l de concentración plasmática (39mg/dl) que se reduzca el cLDL, se reducen aproximadamente un 20% los episodios de ECV (el 17% en enfermedad cerebrovascular [EVC] y el 23% en enfermedad coronaria)11. Los efectos secundarios por la toma de estatinas incluyen aumento de las transaminasas, y que superen el triple del valor normal obliga a moderar o suspender temporalmente el tratamiento, ya que la insuficiencia hepática es extremadamente rara. También se describen efectos secundarios musculares que abarcan desde la mialgia a la rabdomiolisis, con elevaciones de creatincinasa en más de 5 veces su valor normal, especialmente con dosis elevadas de estatinas12. El mecanismo del efecto secundario sobre el músculo no está claro, pero puede estar relacionado con su metabolismo vía el citocromo P450 (CYP450), a través de varias de sus isoenzimas (CYP450-3A4, -2C8, -2C9, -2C19 y -2D6); un efecto que puede estar potenciado por otras sustancias que también usan esa vía, como ha sucedido especialmente con gemfibrozilo. Las interacciones de las estatinas con muchas sustancias pueden tener la metabolización como nexo13. Se plantea también la posibilidad de una mayor incidencia de DM; sin embargo, los beneficios de las estatinas sobrepasan con mucho los posibles riesgos respecto a la DM inducida, máxime si la eventual incidencia con sesgo alcanza 1 caso cada 255 tratados con dosis crónicas de estatinas y en pacientes con sobrepeso o SM14.
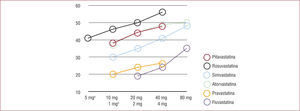
Las estatinas disponibles son diferentes en cuanto a potencia por miligramo para reducir el cLDL (fig. 3)15–17. Sin embargo, en cuanto a la protección contra la ECV, la evidencia no hace distingos entre moléculas, sino en relación con la reducción del cLDL plasmático, ya sea mejorando los objetivos o al menos superando una reducción del 50% respecto del cLDL inicial1. De tal manera que la GDL recomienda una táctica clínica que se expresa en la tabla 1. En el caso de prevención primaria (P1) es necesaria la adecuada precaución si se decide administrar estatinas a personas en bajo riesgo18.
Secuencia clínica en la aplicación de tratamiento con estatinas
| Paso | Acción |
| 1 | Calcular el riesgo del paciente (grupo de riesgo) |
| 2 | Implicar al paciente en las decisiones de tratamiento del riesgo |
| 3 | Identificar el cLDL objetivo a superar |
| 4 | Calcular el porcentaje de reducción de cLDL plasmático necesaria |
| 5 | Elegir una estatina que pueda conseguir ese objetivo |
| 6 | Titular la estatina sucesivamente para superar el objetivo |
| 7 | Si la estatina no supera el objetivo, considere agregar otros fármacos |
cLDL: colesterol unido a lipoproteínas de baja densidad.
Los inhibidores de la absorción del colesterol, de los que actualmente disponemos de una sola molécula, la ezetimiba (EZE) (bloqueador de NPC1L1 en la absorción intestinal, y consecuente sobreexpresión de receptores hepáticos de LDL [LDLr]), que en monoterapia reduce el cLDL en un 15–22%, algo parecido a la reducción adicional que origina al asociarla con estatinas. Con esta combinación se ha demostrado una reducción en la ECV del 17%19. A la dosis recomendada de 10mg/día no se han descrito efectos secundarios. Su indicación está en las intolerancias a estatinas y en la asociación con estatinas para incrementar la reducción del cLDL.
Las resinas secuestradoras de ácidos biliares (RSAB) ejercen su acción en la luz intestinal evitando en parte la micelación grasa, por lo que reducen la absorción de colesterol, efecto que se asocia a una regulación al alza de los LDLr. Ambos mecanismos colaboran para reducir la concentración plasmática de cLDL. Reducen asimismo la glucohemoglobina (HbA1c), pero sus efectos secundarios digestivos y la significativa elevación de TG limitan su uso pese a que se ha demostrado20 su eficacia frenando la ECV. El ácido nicotínico o niacina (NIA) tiene un efecto reductor del cLDL como modulador del perfil lipídico que es. La reducción alcanza un 15–18% y va asociada a cambios en el cHDL y los TG y reducción de lipoproteína (a) –Lp(a)–, que es una partícula de la familia de las LDL que posee tanto apoB como una apolipoproteína propia, apo(a). La Lp(a) es proaterosclerótica y tiene un perfil independiente de las demás partículas lipoproteicas21.
La GDL da una especial consideración a la combinación de fármacos, especialmente en el caso de pacientes que no toleran las estatinas o soportan mal las dosis elevadas necesarias para alcanzar los objetivos; estas indicaciones se muestran en la tabla 2. En esos casos es necesario combinar fármacos. Las combinaciones de sustancias recomendadas22 incluyen el frenado de la síntesis y la absorción simultáneamente: mediante estatinas unidas a EZE o RSAB. La combinación de estatinas y RSAB obtiene un incremento de reducción de cLDL entre 15 y 20 puntos porcentuales más allá de la reducción que alcanza la estatina23. La combinación de estatinas y EZE obtiene un aumento similar del frenado de la concentración plasmática de cLDL, pero sin los efectos secundarios de las RSAB19–24. De ambas combinaciones hay evidencia de reducción de la ECV. Otras combinaciones posibles son EZE y RSAB en caso de intolerancia a las estatinas. O EZE más NIA, eventualmente combinados con estatinas (triple terapia). Se puede usar esteroles vegetales combinados con estatinas, pero no hay estudios controlados adecuados para verificar si la bajada de 5 a 10 puntos porcentuales adicionales a la bajada que induce la estatina obtiene mejoría adicional de la ECV25.
Recomendaciones de la Sociedad Europea de Cardiología para el tratamiento de la hipercolesterolemia
| Paso | Acción | Evidencia | Esquema |
| 1 | Prescribir estatinas titulándolas hasta la dosis más alta recomendada o la más alta que el paciente tolere para superar el objetivo adecuado | I/A | Estatina |
| 2a | Si se demuestra intolerancia, considere la posibilidad de usar resinas secuestradoras de ácidos biliares o niacina | IIa/B | Niacina o RSAB |
| 2b | Si hay intolerancia a estatinas, considere un inhibidor de la absorción añadido a los fármacos indicados en 2a | IIb/C | EZE + niacina o RSAB |
| 3 | Si no se alcanzan los objetivos de cLDL necesarios, considere agregar una estatina a un inhibidor de la absorción de colesterol o una RSAB | IIb/C | Estatina + EZE |
cLDL: colesterol unido a lipoproteínas de baja densidad; RSAB: resinas secuestradoras de ácidos biliares.
La GDL reconoce el cHDL como un factor protector, con base en metaanálisis26 que evidencian que la elevación de cHDL junto con reducción significativa de cLDL tiene relación directa con la reducción de la placa de ateroma. Igualmente, el cHDL bajo forma parte de la dislipemia diabética, altamente aterogénica. Y como el metabolismo del cHDL es extremadamente complejo, la modificación que los fármacos inducen en el perfil lipídico es igualmente muy variable en relación con las subfracciones de HDL modificadas, muy dependiente de la sustancia27, y más efectiva cuanto más bajos sean los valores de cHDL.
Las opciones terapéuticas para elevar el cHDL no tienen la amplitud y la intensidad que en el caso del cLDL, al menos hasta ahora. Las medidas de mejora del estilo de vida son muy útiles para elevar el cHDL: el abandono del tabaco, el ejercicio, el control del peso y una ingesta moderada de alcohol pueden llegar a elevar el cHDL un 10%1.
Entre las posibilidades farmacológicas para elevar el cHDL, las estatinas pueden llevar a aumentar discretamente la concentración de cHDL, pero su eficacia como tratamiento de la ECV se puede malinterpretar porque queda oscurecida por la eficacia para reducir el cLDL28. Los fibratos son sustancias (receptor activado por proliferadores peroxisomales [PPAR] alfa) que se han mostrado capaces de reducir significativamente los TG y elevar concomitantemente el cHDL hasta en un 5–10%. Sin embargo, en el caso de los pacientes diabéticos, que es un grupo de pacientes de elevado riesgo y con cHDL muy frecuentemente bajo, solo lo aumentan un 5% a largo plazo29.
La niacina es una sustancia con capacidad de influir en la síntesis y la degradación de partículas de cHDL, y aumenta su concentración en un 15–35% al tiempo que reduce moderadamente el cLDL y significativamente los TG. Ha mostrado eficacia en la reducción de la placa de ateroma y en el grosor intimomedial carotídeo30, y hay grandes estudios pendientes de resultado para dilucidar su eficacia en la reducción de episodios de ECV1. Las recomendaciones de la GDL respecto al tratamiento del cHDL se recogen en la tabla 3.
Recomendaciones de tratamiento farmacológico si se decide aumentar el colesterol unido a lipoproteínas de alta densidad
| Recomendación | Evidencia | Esquema |
| La niacina se debe plantear como tratamiento porque actualmente es el más eficaz | IIa/A | Niacina |
| Se puede plantear las estatinas y los fibratos; ambos tienen una potencia parecida | IIb/B | Estatinas o fibratos |
| Si el paciente es diabético tipo 2, los fibratos tienen menor eficacia | IIb/B | Fibratos |
Se ha discutido si la hipertrigliceridemia (HTG) es un factor de riesgo, y no hay evidencia sólida de que represente algo más que un marcador de riesgo en el entorno del síndrome cardiometabólico31. De hecho, parece que hay mayor relación entre la HTG no en ayunas o posprandial y el riesgo de ECV32. Lo confirma que la reducción de concentración de TG en pacientes con DM2 no corrige habitualmente la concentración de apoA-II33. Al colesterol no HDL (no-HDL) se lo considera un marcador sustituto (surrogate marker) de la HTG y el resto de las partículas residuales de quilomicrones y lipoproteínas de muy baja densidad (VLDL), todas significativamente aterogénicas y en cierto modo relacionadas con la HTG posprandial en los síndromes cardiometabólicos34. En cuanto a la decisión de si se debe tratar la HTG, y dada la evidencia existente, debe hacerse valorando en todo caso el riesgo del paciente, y proceder a tratar el cLDL de manera prioritaria, ya que la HTG no supone una prioridad terapéutica (teniendo en cuenta posibles causas de HTG secundaria)1.
El estilo de vida tiene una influencia determinante en la HTG (y en el cHDL) y es especialmente eficaz en pacientes con DM2 o con síndrome metabólico. Los fibratos, activadores de los PPARα, reducen eficazmente tanto la HTG en ayunas como la posprandial, moderando en este caso la concentración de partículas residuales del metabolismo de quilomicrones y VLDL, partículas lipoproteicas ricas en TG (TGRL). Se ha demostrado repetidamente que los fibratos reducen, aunque solo moderadamente, los episodios agudos (realmente en revisiones post-hoc), sobre todo en caso de HTG asociada a cHDL bajo29. Comparados con placebo, los fibratos presentan efectos secundarios hepáticos y musculares como las estatinas, si bien es muy probable que el fenofibrato produzca menos efectos secundarios que el gemfibrozilo.
La niacina, ya referida en el apartado de cHDL, actúa de forma compleja reduciendo la HTG y elevando el cHDL cuando este está bajo. Las limitaciones de la interpretación sobre si los resultados de la niacina son resultado del frenado de la HTG o sobre la mejora del cHDL, o sobre otras lipopartículas particularmente aterogénicas como la Lp(a), impiden la recomendación sistemática de la sustancia en lo que a HTG se refiere35. A ello se une la frecuente aparición de efectos secundarios, especialmente el brusco rubor cutáneo, la frecuente elevación de la glucemia y la afección hepática (menos frecuente con formulaciones galénicas no muy retardadas). Los ácidos grasos omega- 3 (DHA y EPA), también referidos en el apartado del cHDL, son capaces de reducir los TG en un 20–30% de manera dependiente de la dosis administrando entre 2 y 4g/día, y para HTG superiores a unos 500mg/dl en plasma36. Su capacidad para controlar la progresión de la ECV es discutible y su capacidad antitrombótica hace que puedan darse efectos secundarios al combinarlos con antiagregantes1. La tabla 4 recoge el resumen de las indicaciones de terapia farmacológica en caso de que sea necesario tratar la HTG.
Recomendaciones para tratamiento farmacológico de la hipertrigliceridemia
| Recomendación para pacientes de riesgo particularmente alto | Evidencia |
| Tratamiento recomendado | |
| Fibratos | I/B |
| Tratamiento que considerar | |
| Niacina | IIa/B |
| Ácidos grasos omega-3 | IIa/B |
| Estatina + niacina | IIa/A |
| Estatina + fibrato | IIa/C |
| Tratamiento que se podría tomar en consideración | |
| Combinaciones con ácidos grasos omega-3 | IIb/C |
En caso de dislipemias complejas, con elevación de cLDL y TG y disminución de cHDL, la GDL recomienda como primer paso el uso exclusivo de una estatina; si no se logran los objetivos en todos los parámetros lipídicos, se puede considerar combinarla con niacina. Aunque teniendo en cuenta el riesgo de mal cumplimiento por los efectos secundarios, especialmente el rubor cutáneo brusco, se puede considerar también la combinación con fibratos, pero excluyendo el gemfibrozilo de cualquier combinación con alguna estatina. En caso de que la concentración plasmática de TG fuera la que no se hubiera podido controlar con las anteriores combinaciones, se debe tomar en consideración la de ácidos grasos omega-3 con estatinas, que es una combinación bien tolerada y segura1.
ConclusionesLa GDL representa la evolución de la GRCV en el tiempo y la evidencia, un avance moderado que representa la evidencia publicada hasta principios de 2011. En los apartados que hacen referencia al tratamiento lipídico, especialmente el tratamiento farmacológico, se acopla a la nueva definición de riesgo y crea una consistente gradación en la aplicación de las medidas terapéuticas. Mantiene como el objetivo primordial de tratamiento la reducción del cLDL mediante estatinas. Las diversas familias farmacológicas contribuyen al frenado del cLDL de forma perimetral a las estatinas y frecuentemente complementándolas o colaborando con ellas. El tratamiento farmacológico del cHDL bajo y la HTG plantea no solo la dificultad de las distintas sustancias para corregir eficazmente su concentración en plasma, sino también la difícil interpretación del significado de esos lípidos en la fisiopatología de la ECV y su colaboración en la evolución de la enfermedad (hasta la posibilidad de que solo sean marcadores de esta).
Conflicto de interesesNinguno.