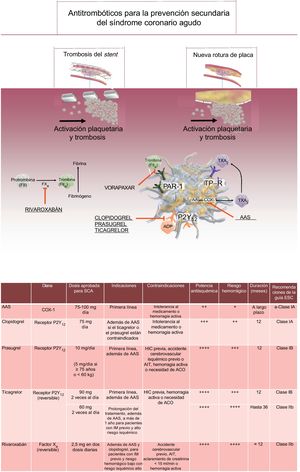
El tratamiento antitrombótico tras un síndrome coronario agudo (SCA) desempeña una función clave en la reducción de las complicaciones, pero entraña serias dificultades debido al frágil equilibrio entre el riesgo hemorrágico y el isquemico1. Los pacientes con SCA están expuestos, por definición, a un alto riesgo isquémico, ya que su fenotipo muestra tendencia a la rotura de placa y a la trombosis vascular2–4. Sin embargo, la mayoría de ellos además tienen enfermedades concomitantes que los exponen a un exceso de riesgo hemorrágico durante el tratamiento antitrombótico, lo que también influye en el pronóstico5. Por esta razón, en las guías de práctica clínica internacionales se aboga por ajustar el tratamiento a las características de los pacientes6. Es de suma importancia seleccionar la opción idónea para los pacientes con SCA, que incluya tanto el tipo como la duración del tratamiento antiagregante plaquetario doble (TAPD).
TIPO DE TRATAMIENTO ANTIAGREGANTE PLAQUETARIO DOBLE TRAS UN SÍNDROME CORONARIO AGUDOEl TAPD es el tratamiento de elección en la prevención secundaria del SCA6. Se fundamenta en una doble inhibición de la activación plaquetaria en la que el ácido acetilsalicílico actúa por la vía de la ciclooxigenasa 1 (COX-1) y el clopidogrel, el prasugrel o el ticagrelor inhiben el receptor del P2Y12 (figura). Aunque el clopidogrel ha sido durante muchos años el tratamiento de elección en la prevención secundaria del SCA, en los últimos 10 años 2 estudios de referencia han demostrado la superioridad del prasugrel y el ticagrelor en este contexto3,4. Las vigentes guías internacionales apelan al uso de prasugrel o ticagrelor como tratamiento de primera línea para los pacientes con SCA, mientras que se restringe la prescripción del clopidogrel a los pacientes con contraindicación a los antiagregantes plaquetarios de gran potencia, como es el caso de los que necesitan tratamiento anticoagulante oral por largo tiempo6.
Antitrombóticos orales aprobados para la prevención secundaria del SCA: dianas moleculares, mecanismos de acción e indicaciones/contraindicaciones clínicas para los antitrombóticos orales aprobados en el contexto de un SCA. AA: ácido araquidónico; AAS: ácido acetilsalcílico; ACO: anticoagulantes orales; ADP: adenosina difosfato; AIT: accidente isquémico transitorio; COX-1: ciclooxigenasa 1; ESC: European Society of Cardiology; FII: factor II; FX: factor X; HIC: hemorragia intracraneal; IM: infarto de miocardio; P2Y12: receptor plaquetario P2Y12; PAR-1: receptor activado por la proteasa; SCA: síndrome coronario agudo; TP: receptor de tromboxano; TXA2: tromboxano A2.
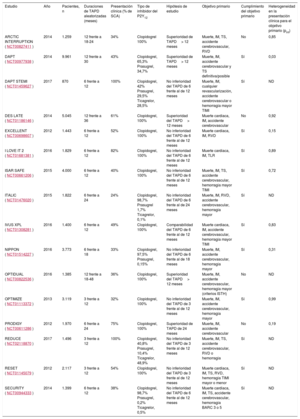
La mayoría de las guías internacionales recomiendan generalmente una duración de 12 meses al prescribir TAPD a pacientes con SCA. La elección de esta duración sigue un criterio arbitrario conforme a los resultados del ensayo CURE, el primer ensayo clínico que probó el TAPD con ácido acetilsalicílico y clopidogrel en pacientes con SCA2. No obstante, la duración óptima del TAPD ha sido objeto de intenso debate en el seno de la investigación clínica. Prueba de ello son los 16 ensayos clínicos controlados y aleatorizados que evalúan distintas estrategias de duración del TAPD y cuestionan la recomendación estándar de 12 meses (tabla). Estos estudios se clasifican en 2 grupos según su hipótesis principal: los estudios que evalúan la no inferioridad de reducir la duración del TAPD a 3 o 6 meses y los estudios que evalúan la superioridad de prolongar el TAPD más allá de los 12 meses. En resumen, los estudios revelan que un TAPD prolongado se asocia no solo con un efecto significativamente favorable en la recurrencia de las complicaciones isquémicas, guarden o no relación con un stent, sino también con un incremento significativo de las hemorragias. Por el contrario, un TAPD más corto reduce significativamente el riesgo hemorrágico respecto a otras duraciones, aunque su efecto en la mortalidad o la mortalidad cardiovascular sigue suscitando cierta controversia. Para decidir la opción temporal idónea, es de suma importancia entender la estrategia que aporta el mayor beneficio clínico neto en las tasas absolutas de isquemia y hemorragias. Cabe mencionar que algunos factores, como la presentación clínica y la complejidad anatómica7,8, han mostrado tener un papel determinante a la hora de elegir la duración del tratamiento. De ahí que un enfoque individualizado del tratamiento facilite la elección de la estrategia idónea9.
Ensayos clínicos controlados y aleatorizados que han evaluado estrategias temporales del tratamiento antiagregante plaquetario doble en pacientes con síndrome coronario agudo
| Estudio | Año | Pacientes, n | Duraciones de TAPD aleatorizadas (meses) | Presentación clínica (% de SCA) | Tipo de inhibidor del P2Y12 | Hipótesis de estudio | Objetivo primario | Cumplimiento del objetivo primario | Heterogeneidad en la presentación clínica para el objetivo primario (pint) |
|---|---|---|---|---|---|---|---|---|---|
| ARCTIC INTERRUPTION (NCT00827411) | 2014 | 1.259 | 12 frente a 18-24 | 34% | Clopidogrel 100% | Superioridad de TAPD> 12 meses | Muerte, IM, TS, accidente cerebrovascular, RVD | No | 0,85 |
| DAPT (NCT00977938) | 2014 | 9.961 | 12 frente a 30 | 43% | Clopidogrel, 65,3% Prasugrel, 34,7% | Superioridad de TAPD> 12 meses | Muerte, IM, accidente cerebrovascular y TS definitiva/posible | Sí | 0,03 |
| DAPT STEMI (NCT01459627) | 2017 | 870 | 6 frente a 12 | 100% | Clopidogrel, 42% Prasugrel, 29,5% Ticagrelor, 28,5% | No inferioridad del TAPD de 6 frente al de 12 meses | Muerte, IM, cualquier revascularización, accidente cerebrovascular o hemorragia mayor TIMI | Sí | ND |
| DES LATE (NCT01186146) | 2014 | 5.045 | 12 frente a 36 | 61% | Clopidogrel, 100% | Superioridad del TAPD> 12 meses | Muerte cardiaca, IM, accidente cerebrovascular | No | 0,92 |
| EXCELLENT (NCT00698607) | 2012 | 1.443 | 6 frente a 12 | 52% | Clopidogrel, 100% | No inferioridad del TAPD de 6 frente al de 12 meses | Muerte cardiaca, IM, RVD | Sí | 0,15 |
| I LOVE IT 2 (NCT01681381) | 2016 | 1.829 | 6 frente a 12 | 82% | Clopidogrel, 100% | No inferioridad del TAPD de 6 frente al de 12 meses | Muerte cardiaca, IM, TLR | Sí | 0,89 |
| ISAR SAFE (NCT00661206) | 2015 | 4.000 | 6 frente a 12 | 40% | Clopidogrel, 100% | No inferioridad del TAPD de 6 frente al de 12 meses | Muerte, IM, TS, accidente cerebrovascular, hemorragia mayor TIMI | Sí | 0,72 |
| ITALIC (NCT01476020) | 2015 | 1.822 | 6 frente a 24 | 24% | Clopidogrel, 98,7% Prasugrel 1,7% Ticagrelor, 0,1% | No inferioridad del TAPD de 6 frente al de 24 meses | Muerte, IM, RVD, accidente cerebrovascular, hemorragia mayor | Sí | ND |
| IVUS XPL (NCT01308281) | 2016 | 1.400 | 6 frente a 12 | 49% | Clopidogrel, 100% | Comparabilidad del TAPD de 6 frente al de 12 meses | Muerte cardiaca, IM, accidente cerebrovascular, hemorragia mayor TIMI | Sí | 0,83 |
| NIPPON (NCT01514227) | 2016 | 3.773 | 6 frente a 18 | 33% | Clopidogrel, 97,5% Prasugrel, 0,15% | No inferioridad del TAPD de 6 frente al de 18 meses | Muerte, IM, accidente cerebrovascular, hemorragia mayor | Sí | 0,31 |
| OPTIDUAL (NCT00822536) | 2016 | 1.385 | 12 frente a 18-48 | 36% | Clopidogrel, 100% | Superioridad del TAPD> 12 meses | Muerte, IM, accidente cerebrovascular, hemorragia mayor (criterios ISTH) | No | ND |
| OPTIMIZE (NCT01113372) | 2013 | 3.119 | 3 frente a 12 | 32% | Clopidogrel, 100% | No inferioridad del TAPD de 3 frente al de 12 meses | Muerte, IM, accidente cerebrovascular, hemorragia mayor | Sí | 0,99 |
| PRODIGY (NCT00611286) | 2012 | 1.970 | 6 frente a 24 | 75% | Clopidogrel, 100% | Superioridad de TAPD de 24 meses | Muerte, IM, accidente cerebrovascular | No | 0,19 |
| REDUCE (NCT02118870) | 2017 | 1.496 | 3 frente a 12 | 100% | Clopidogrel, 40,8% Prasugrel, 10,4% Ticagrelor, 48,9% | No inferioridad del TAPD de 3 frente al de 12 meses | Muerte, IM, TS, accidente cerebrovascular, RVD o hemorragia | Sí | ND |
| RESET (NCT01145079) | 2012 | 2.117 | 3 frente a 12 | 54% | Clopidogrel, 100% | No inferioridad del TAPD de 3 frente al de 12 meses | Muerte cardiaca, IM, TS, RVD, hemorragia TIMI mayor o menor | Sí | ND |
| SECURITY (NCT00944333) | 2014 | 1.399 | 6 frente a 12 | 38% | Clopidogrel, 98,7% Prasugrel, 0,2% Ticagrelor, 0,5% | No inferioridad del TAPD de 6 frente al de 12 meses | Muerte cardiaca, IM, TS, accidente cerebrovascular, hemorragia BARC 3 o 5 | Sí | ND |
BARC: Bleeding Academic Research Consortium; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IM: infarto de miocardio; ISTH: International Society of Thrombosis and Haemostasis; ND: no disponible; RVD: revascularización del vaso diana; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; TIMI: Thrombolysis in Myocardial Infarction; TLR: revascularización de la lesión tratada; TS: trombosis del stent.
Con objeto de disponer de información suficiente para tomar la decisión adecuada sobre la duración del DAPT, se han incorporado recientemente puntuaciones de riesgo para el cálculo del riesgo específico de cada paciente en relación con los eventos adversos, que las guías internacionales han adoptado6. La puntuación PRECISE-DAPT, que incluye 5 factores clínicos de riesgo para medir el riesgo de hemorragia específico de cada paciente en el momento de implantar el stent, se ha generado a partir de un conjunto de datos integrado de 8 ensayos clínicos controlados y aleatorizados y 14.963 pacientes con TAPD indicado sometidos a intervención coronaria percutánea (ICP) electiva, urgente o emergente10. Este instrumento asigna puntos según la edad del paciente, el aclaramiento de creatinina, los valores de hemoglobina, el recuento leucocitario y el antecedente de hemorragias espontáneas. Se probó internamente el rendimiento predictivo de la puntuación PRECISE-DAPT, validado en 2 cohortes externas de pacientes: la primera, participante en el ensayo PLATO, incluyó a 8.595 pacientes con SCA tratados con TAPD de clopidogrel o ticagrelor, y una segunda cohorte de 6.172 pacientes del registro BernPCI, un registro real de pacientes no seleccionados10. La puntuación PRECISE-DAPT mostró una buena discriminación en ambas cohortes de validación y se evaluó después en pacientes aleatorizados a TAPD (n=10.081), con el fin de determinar su valor en la discriminación del beneficio neto para una duración del TAPD más larga (12-24 meses) frente a una más corta (3-6 meses).
Los pacientes estratificados conforme a la puntuación PRECISE-DAPT y con una puntuación alta (25 puntos) presentaron un incremento significativo de las hemorragias después de un TAPD de mayor duración, sin que redundara en una reducción de las complicaciones isquémicas10. Un TAPD más largo en este subgrupo tuvo como resultado una hemorragia mayor por cada 38 pacientes tratados. Por otro lado, en el caso de los pacientes que no alcanzaron una puntuación PRECISE-DAPT alta (< 25 puntos), la extensión del TAPD no se asoció con un número excesivo de hemorragias, sino a una reducción significativa de la variable isquémica combinada de infarto de miocardio (IM), trombosis del stent determinada, accidente cerebrovascular y revascularización del vaso diana. Un TAPD prolongado en este subgrupo previno una complicación isquémica en cada 65 pacientes tratados. Reviste importancia que los resultados de este algoritmo de toma de decisiones mantuvieran su constancia al restringir el análisis a los pacientes que sufrían un SCA en el momento del implante del stent, lo cual sustenta la aplicabilidad de la puntuación también a esta población de mayor riesgo10.
La puntuación DAPT, calculada a partir del conjunto de datos del ensayo DAPT (n=11.648), incluye 9 variables clínicas y del procedimiento que determinan el beneficio neto del TAPD en la isquemia y la hemorragia tras 12 meses sin desenlaces y, además, ofrece información suficiente para decidir sobre si interrumpir el tratamiento a los 12 meses o prolongarlo hasta los 30 meses tras una ICP11. Entre los factores integrados en este algoritmo, 8 son predictores independientes y exclusivos de isquemia (a saber, insuficiencia cardiaca congestiva o fracción de eyección del ventrículo izquierdo reducida, endoprotésis con injerto de vena, IM al ingreso, IM previo o ICP, diabetes mellitus, diámetro del stent<3mm, portador de stent liberador de paclitaxel, tabaquismo actual) y 1 es un predictor independiente y exclusivo de hemorragia (la edad). La puntuación DAPT oscila entre –2 y+10 puntos e identifica con baja puntuación a los pacientes con riesgo hemorrágico excesivo frente a riesgo isquémico (puntuación DAPT <2) y con puntuación más alta a los pacientes con riesgo isquémico excesivo frente al hemorrágico (puntuación DAPT ≥ 2). Cobra importancia que, de entre los pacientes aleatorizados a la duración del TAPD, aquellos con una puntuación DAPT más alta (es decir, ≥ 2) obtuvieran más beneficio en IM y trombosis del stent después de alargar el TAPD a 30 meses comparada con el estándar de 12 meses (diferencia de riesgo, 3,0%; intervalo de confianza del 95% [IC95%], 4,1-2,0%; p <0,001), con tan solo un discreto incremento de hemorragias mayores (diferencia de riesgo, 0,4%; IC95%, 0,3-1,0%; p=0,26)10. A su vez, para los pacientes con una puntuación DAPT baja (es decir, <2), la prolongación del TAPD no supuso ventaja alguna en complicaciones isquémicas (diferencia de riesgo, 0,7%; IC95%, 1,4-0,09%; p=0,07), sino que mostró un incremento significativo de las hemorragias mayores (diferencia de riesgo, 1,5%; IC95%, 0,8-2,3%; p <0,001). Los resultados de la puntuación DAPT concordaron en el subgrupo de pacientes tratados por IAM en el momento de la intervención de referencia, lo cual respalda su uso también para pacientes con SCA11. En su conjunto, las puntuaciones de riesgo diseñadas como guía de la duración del TAPD (es decir, PRECISE-DAPT y puntuación DAPT) pueden facilitar la toma de decisiones clínicas y se han validado en la población que ingresa por SCA. Es relevante que, a pesar de la amplia validación realizada, esos instrumentos nunca podrán reemplazar a la evaluación individualizada de cada paciente ni al criterio clínico, además de que no se haya evaluado todavía ninguna de ellas en un estudio prospectivo, por lo que exigen más estudio.
TRATAMIENTO DE DOBLE VÍA: MÁS ALLÁ DEL TRATAMIENTO ANTIAGREGANTE PLAQUETARIO DOBLESe ha propuesto recientemente ampliar la estrategia terapéutica del SCA más allá del TAPD clásico, lo cual representa un posible avance en esta área. A pesar de una inhibición plaquetaria de mayor potencia, se observó una tasa anual de entre el 9,8 y el 9,9% de complicaciones isquémicas recurrentes tras un SCA3,4, lo que significa que, aunque se haya producido un bloqueo adecuado del receptor P2Y12, todavía es posible una mejoría mediante la inhibición de otras vías alternativas o complementarias. La coagulación influye de manera notable en la trombosis vascular, y su activación permanente se asocia con los resultados clínicos. Se ha planteado últimamente la inhibición de la generación de trombina mediante el bloqueo de la activación del factor Xa con la administración de los nuevos anticoagulantes orales no antagonistas de la vitamina K (NACO), que supone una nueva estrategia antitrombótica de doble vía para pacientes con SCA. El ensayo ATLAS-ACS 2ha evaluado la incorporación de una dosis menor de rivaroxabán al TAPD con ácido acetilsalicílico y clopidogrel12. En este ensayo a doble ciego y controlado con placebo, de aleatorizó a 15.526 pacientes con un episodio reciente de SCA a placebo o a 2 dosis diarias de 2,5 y 5,0mg de rivaroxabán, además del tratamiento estándar con ácido acetilsalicílico y clopidogrel. La duración media del tratamiento tras la inclusión fue de 13 meses. El rivaroxabán redujo significativamente las tasas de eventos adversos cardiacos mayores y mortalidad cardiovascular. En la mencionada evaluación de dosis únicas de rivaroxabán frente a placebo, la dosis de 2,5mg de rivaroxabán mostró un mejor perfil en el beneficio clínico neto, al reducir en un 1,6% las complicaciones cardiovasculares agudas más graves y de manera significativa tanto la muerte cardiovascular como la de cualquier causa en el 1,4 y el 1,6% respectivamente. Sin embargo, se produjo un aumento de hemorragias mayores según Thrombolysis in Myocardial Infarction (TIMI) no asociadas con cirugía de revascularización coronaria (CABG) en un 1,2% en la escala absoluta y se multiplicó por 3,5 veces en la relativa, sin excesivas hemorragias con desenlace de muerte12.
El incremento significativo de las hemorragias mayores fue una cuestión preocupante que impidió extender la aplicación de esta estrategia a la práctica clínica. Con objeto de disminuir la carga de hemorragias, el ensayo GEMINI-ACS-1 evaluó una estrategia semejante que excluía el ácido acetilsalicílico del grupo experimental aleatorizando a los pacientes a 2 dosis diarias de 2,5mg de rivaroxabán o a ácido acetilsalicílico junto con un inhibidor del receptor plaquetario P2Y1213. Se incluyó en el estudio a 3.037 pacientes con SCA. Se inició el tratamiento aleatorizado en una mediana de 5,5 días tras la complicación de referencia y continuó hasta los 291 días13. Se administró una dosis diaria de 75mg de clopidogrel (43,9%), como inhibidor del receptor plaquetario P2Y12, o 2 dosis diarias de 90mg de ticagrelor (56,1%), a discreción del investigador. El objetivo primario de hemorragia TIMI clínicamente significativa no asociada con CABG se cumplió en el 5% de los pacientes asignados al grupo de tratamiento con rivaroxabán y el 5% de los del grupo con ácido acetilsalicílico (hazard ratio [HR]=1,09; IC95%, 0,80-1,50; p=0,58). Aunque el ensayo no se diseñó para analizar las complicaciones isquémicas, no se observaron diferencias entre los 2 grupos de estudio en la variable combinada de muerte cardiovascular, IM, accidente cerebrovascular o trombosis del stent definitiva (HR=1,06; IC95%, 0,77-1,46; p=0,73)13.
En el ensayo COMPASS se observaron resultados semejantes14. Este incluyó a pacientes con enfermedad cardiovascular estable/estabilizada, definida como la presencia de enfermedad coronaria (es decir, IM previo, coronariopatía multivaso, ICP o CABG multivaso previa) o arteriopatía periférica14. Además, los pacientes con enfermedad coronaria debían tener también 2 factores de riesgo complementarios que se incorporarían en caso de edad <65 años (a saber, fumadores activos, diabetes mellitus, aclaramiento de creatinina <60 ml/min, insuficiencia cardiaca o accidente cerebrovascular isquémico no lacunar más de 1 mes antes). Se excluyó del estudio a los pacientes con alto riesgo hemorrágico. Por último, se aleatorizó a 27.395 pacientes a 2 dosis diarias de 2,5mg de rivaroxabán más ácido acetilsalicílico o 2 dosis diarias de 5mg de rivaroxabán en monoterapia o ácido acetilsalicílico en monoterapia durante un seguimiento medio de 23 meses. El estudio se interrumpió precozmente debido a que se demostró que el tratamiento con 2,5mg de rivaroxabán más ácido acetilsalicílico tenía mayor eficacia que el ácido acetilsalicílico en monoterapia, lo cual se asoció con una reducción absoluta del 1,3% en el objetivo primario (muerte cardiovascular, accidente cerebrovascular o IM) y reducciones absolutas de muerte cardiovascular y de cualquier causa del 0,5 y el 0,7% respectivamente, con la consiguiente reducción significativa en el número de ingresos hospitalarios14. Por el contrario, el tratamiento con 2 dosis diarias de 5mg de rivaroxabán en monoterapia no se asoció con una reducción significativa del objetivo primario14. No obstante, el tratamiento con ambas dosis de rivaroxabán se asoció con un aumento de las hemorragias mayores (principalmente gastrointestinales), aunque no con sangrados mortales. En consecuencia, el beneficio clínico neto, teniendo en cuenta tanto la isquemia como las hemorragias, se inclinó a favor del tratamiento con 2,5mg de rivaroxabán más ácido acetilsalicílico y contra el tratamiento con 5mg de rivaroxabán en monoterapia comparado con ácido acetilsalicílico en monoterapia14. Sin embargo, a pesar de la acumulación de datos sobre el efecto del rivaroxabán en los pacientes con SCA, los resultados obtenidos de los otros NACO no han sido concluyentes hasta la fecha. El ensayo APPRAISE-II incorporó 2 dosis diarias de 5mg de apixabán además del TAPD, con lo cual no se demostró beneficio, y tuvo que terminar antes de lo previsto debido a que se multiplicó significativamente por 2,5 el número de hemorragias mayores, incluidas intracraneales y mortales15. También en el más discreto ensayo RE-DEEM, la inclusión de dabigatrán además del TAPD se asoció con un incremento lineal de las complicaciones hemorrágicas, que aumentaron desde un+77% hasta un+327% conforme aumentaba la dosis del medicamento16. El estudio, no ostante, no se diseñó para evaluar el beneficio clínico neto en isquemia y hemorragias con una estrategia terapéutica del SCA con dabigatrán. En resumen, el tratamiento antitrombótico de doble vía representa un abordaje altenativo al TAPD clásico para pacientes con SCA y es prometedora la reducción observada de muerte por cualquier causa en esta población o en pacientes seleccionados con enfermedad cardiovascular estable. Sin embargo, su aplicación a la práctica clínica diaria tiene ciertas limitaciones, por el preocupante aumento relativo de las hemorragias y por el coste del medicamento, cuando actualmente el único inhibidor del factor Xa aprobado en Europa para la prevención secundaria del SCA es rivaroxabán 2,5mg.
CONCLUSIONESEl tratamiento antitrombótico sigue siendo esencial en la reducción de la carga de complicaciones isquémicas recurrentes tras un SCA. El abordaje personalizado defendido por las guías internacionales facilita la elección del tratamiento idóneo para cada paciente, al tiempo que reduce el exceso de riesgo hemorrágico. En lo que respecta al tipo y la duración del inhibidor del P2Y12, debe sopesarse con cautela la elección del tratamiento tras un SCA, puesto que las nuevas estrategias terapéuticas para la tromboembolia cardiaca, dirigidas a actuar sobre múltiples vías antitrombóticas, son prometedoras pero todavía distan mucho de ser aplicables a la práctica clínica.
CONFLICTO DE INTERESESS. Brugaletta recibió una subvención de investigación para su institución de AstraZeneca y honorarios por conferencias de Abbott Vascular y Boston Scientific.