El tratamiento antiarrítmico crónico de la fibrilación auricular ha experimentado pocos cambios en los últimos años hasta la irrupción de la dronedarona. Su papel probablemente quedará restringido a pacientes con fibrilación auricular paroxística o persistente sin clínica de insuficiencia cardiaca asociada. La decisión más importante que debe adoptar el cardiólogo sigue siendo si luchar por mantener el ritmo cardiaco o simplemente mantener una frecuencia cardiaca adecuada. La primera opción es más recomendable para pacientes sintomáticos sin demasiada cardiopatía estructural; la segunda, para pacientes poco sintomáticos o asintomáticos, de edad avanzada y con cardiopatía estructural asociada que haga previsible que el ritmo sinusal no se mantenga. La combinación con tratamientos no farmacológicos, como la ablación, actualmente es una realidad que probablemente será más notable aún en un futuro cercano.
Palabras clave
El manejo de la fibrilación auricular (FA) persigue unos objetivos bien definidos:
- •
Prevención de las tromboembolias.
- •
Mejora de los síntomas.
- •
Manejo óptimo y concomitante de la enfermedad cardiovascular o de los factores de riesgo relacionados con el inicio o el mantenimiento de la FA.
- •
Control de la frecuencia cardiaca (FC) o corrección del ritmo mediante su paso a ritmo sinusal.
Este artículo se centra en el tratamiento farmacológico antiarrítmico a largo plazo, por lo que hay que distinguir cuál es la estrategia fundamental que se va a adoptar, es decir, luchar por mantener el ritmo sinusal o simplemente controlar la FC mediante fármacos moduladores del nodo auriculoventricular (NAV).
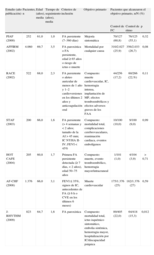
¿Control del ritmo o control de la frecuencia cardiaca?Tradicionalmente los cardiólogos teníamos tendencia a revertir la FA a ritmo sinusal, basándonos en estudios epidemiológicos que demostraban un aumento de la morbimortalidad asociado a la presencia de FA1,2. Sin embargo, en los últimos 8 o 10 años han ido apareciendo diversos estudios aleatorizados que demuestran un beneficio similar para pacientes con FA en los que se comparaba control del ritmo mediante el uso de fármacos antiarrítmicos (FAA) con el control de la FC3–5. La tabla 1 resume los principales estudios realizados para dilucidar esta cuestión; de ellos, sólo en el J-RHYTHM, estudio japonés que incluyó a más de 800 pacientes con FA paroxística, fue superior la estrategia del control del ritmo cardiaco a la de la frecuencia en su objetivo primario, compuesto de mortalidad total, ictus isquémico sintomático, embolia sistémica, hemorragia mayor, hospitalización por insuficiencia cardiaca (IC) y discapacidad psíquica, no así respecto a la mortalidad6.
Principales estudios que comparan estrategia de control de ritmo frente a control de frecuencia cardiaca.
| Estudio (año publicación) | Pacientes, n | Edad (años), media | Tiempo de seguimiento (años), media | Criterios de inclusión | Objetivo primario | Pacientes que alcanzaron el objetivo primario, n/N (%) | ||
| Control de FC | Control de ritmo | p | ||||||
| PIAF (2000) | 252 | 61,0 | 1,0 | FA persistente (7–360 días) | Mejoría sintomática | 70/127 (60,8) | 76/125 (55,1) | 0,32 |
| AFFIRM (2002) | 4.060 | 69,7 | 3,5 | FA paroxística o FA persistente, edad ≥ 65 años o riesgo de ictus o muerte | Mortalidad por cualquier causa | 310/2.027 (25,9) | 356/2.033 (26,7) | 0,08 |
| RACE (2002) | 522 | 68,0 | 2,3 | FA persistente o aleteo auricular de menos de 1 año y 1–2 cardioversiones en los últimos 2 años y anticoagulación oral | Compuesto: muerte cardiovascular, IC, hemorragia intensa, implantación de MP, efectos tromboembólicos y efectos adversos graves de los FAA | 44/256 (17,2) | 60/266 (22,%) | 0,11 |
| STAF (2003) | 200 | 66,0 | 1,6 | FA persistente (>4 semanas y <2 años; tamaño de la AI >45mm; IC NYHA II-IV; FEVI <45% | Compuesto: mortalidad total, complicaciones cerebrovasculares, reanimación cardiaca, eventos embolígenos | 10/100 (10,0) | 9/100 (9,0) | 0,99 |
| HOT CAFE (2004) | 205 | 60,8 | 1,7 | Primera FA persistente detectada (≥ 7 días, <2 años), edad 50–75 años | Compuesto: muerte, evento tromboembólico, hemorragia mayor/intracraneal | 1/101 (1,0) | 4/104 (3,9) | >0,71 |
| AF-CHF (2008) | 1.376 | 66,0 | 3,1 | FEVI ≤ 35%, signos de IC, antecedentes de FA (≥ 6h o CVE en los últimos 6 meses) | Muerte cardiovascular | 175/1.376 (25) | 182/1.376 (27) | 0,59 |
| J-RHYTHM (2009) | 823 | 64,7 | 1,6 | FA paroxística | Compuesto: mortalidad total, ictus isquémico sintomático, embolia sistémica, hemorragia mayor, hospitalización por IC/discapacidad psíquica | 89/405 (22,0) | 64/418 (15,3) | 0,012 |
AI: aurícula izquierda; CVE: cardioversión eléctrica; FA: fibrilación auricular; FAA: fármacos antiarrítmicos; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; MP: marcapasos; NYHA: New York Heart Association.
En los demás estudios no fue así, ni siquiera en el AF-CHF, que comparaba ambas estrategias en pacientes con disfunción ventricular izquierda e IC7. Tampoco mejoró la calidad de vida de los pacientes con control del ritmo cardiaco8 ni hubo un empeoramiento clínico ni ecocardiográfico en un grupo o en otro en los subestudios realizados9 (aunque en un subestudio del RACE se observó una mejora de los parámetros ecocardiográficos en los pacientes del brazo de control del ritmo10, estos datos no se confirmaron en el estudio AFFIRM).
Si analizamos específicamente la mortalidad y la hospitalización, tampoco hubo diferencias significativas entre los grandes estudios. En un análisis post-hoc del estudio AFFIRM, se observó que el efecto deletéreo de los FAA (aumento de mortalidad del 49%) había compensado el efecto beneficioso de mantener el ritmo sinusal (disminución de mortalidad del 53%). Igualmente, un análisis de la base de datos del estudio RACE indicó que la enfermedad cardiaca subyacente influía más en el pronóstico que la propia FA (tabla 1).
Como ya se ha señalado, queda por dilucidar si estos estudios aleatorizados con FAA han sido una buena estrategia para mantener el ritmo sinusal. Tal vez las medidas no farmacológicas como la ablación pudieran mejorar los resultados del control del ritmo comparadas con la estrategia de la FC. Estudios como el CABANA (Catheter Ablation vs Antiarrhythmic Drug Therapy for Atrial Fibrillation) o el EAST (Early treatment of Atrial fibrillation for Stroke prevention Trial) se han diseñado para tal fin, pero aún no tenemos los resultados. No obstante, hay que pensar que la FA es la epidemia del siglo XXI, y hoy es difícil pensar a priori que el tratamiento ablativo pueda aplicarse a la población general con FA. Por todo ello, queda claro que los FAA siguen y seguirán teniendo un papel relevante en el tratamiento a largo plazo.
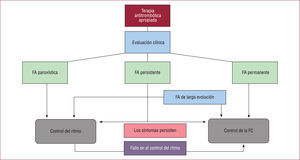
Después de asimilar estos conceptos, nos queda tomar la decisión de qué ofrecer a nuestros pacientes con FA. Hay que tomar esta decisión basándose en la edad del paciente, el tiempo de evolución de la FA, el tipo de FA (paroxística, persistente, persistente de larga duración o permanente), la enfermedad cardiaca subyacente, el tamaño de la aurícula izquierda y, en definitiva, en relación con el riesgo de recidiva. Por otro lado, se debe tener muy en cuenta los síntomas de los pacientes. Así, para los poco sintomáticos, digamos EHRA I o incluso II, el manejo de la FA mediante el control de FC parece la mejor opción, mientras que para los pacientes sintomáticos o muy sintomáticos, el control del ritmo es la estrategia con más sentido común. La figura 1 representa las recomendaciones de las guías europeas en función del tipo de FA11, teniendo en cuenta que en cualquier circunstancia una y otra estrategia son válidas.
Estrategia de control del ritmo mediante fármacos antiarrítmicosLos FAA no son el tratamiento óptimo para mantener el ritmo sinusal, pero en ausencia de criterios para utilizar tratamientos no farmacológicos como la terapia ablativa, son la única opción disponible. Hay una serie de principios generales que se debe tener en cuenta cuando se considera utilizar esta estrategia de tratamiento:
- •
El motivo de tratar con FAA es exclusivamente mejorar los síntomas, no la mortalidad.
- •
La eficacia de los FAA para mantener el ritmo sinusal es moderada.
- •
Un tratamiento es eficaz si reduce el número de recidivas. Es difícil esperar una desaparición de la FA sólo con FAA.
- •
Los efectos proarritmogénicos o efectos adversos extracardiacos no son infrecuentes con este tipo de fármacos.
- •
Por todo ello, la seguridad, más que la eficacia, ha de ser el motivo fundamental para tratar con FAA.
La flecainida, la propafenona, el sotalol, la amiodarona y recientemente la dronedarona se están utilizando para mantener el ritmo sinusal. En general, usar FAA dobla la probabilidad de mantener el ritmo sinusal frente al placebo12.
FlecainidaEste bloqueador de los canales del sodio es un antiarrítmico de clase IC. Prácticamente dobla las posibilidades de mantener el ritmo sinusal después de la cardioversión eléctrica y se ha mostrado útil en el tratamiento de pacientes con paroxismos de FA. Permite la estrategia de pill in the pocket13 —es decir, para pacientes que han respondido previamente al fármaco y se ha demostrado su seguridad—, darlo puntualmente en dosis de 200 o 300mg en una sola dosis para revertir la arritmia. No se debe administrar a pacientes con cardiopatía estructural, especialmente isquémica, pacientes con disfunción ventricular izquierda ni pacientes con trastornos de la conducción intraventricular, especialmente con bloqueo bifascicular. Como cualquier otro FAA, tiene un potencial proarritmogénico importante, y es capaz de prolongar el QT y el QRS, facilitar el bloqueo auriculoventricular por estrés infrahisiano e inducir patrón de Brugada tipo 1 en pacientes con ECG previamente normal o con formas no diagnósticas de Brugada, con el consiguiente riesgo arritmogénico. Asimismo, es capaz de inducir la aparición de aleteo auricular de conducción más lenta, que a veces puede permitir conducción 1:1 al ventrículo.
PropafenonaTambién es un bloqueador de los canales del sodio de la clase IC, similar a la flecainida, pero con cierto efecto de bloqueo beta añadido. Al igual que el anterior, debe evitarse en pacientes con antecedentes de cardiopatía isquémica o mala función ventricular. También se puede utilizar con la estrategia pill in the pocket y, al igual que la flecainida, puede facilitar la conversión de FA en aleteo auricular.
SotalolEs un antiarrítmico de clase III, bloqueador de los canales de potasio, pero con la particularidad de un efecto de bloqueo beta bien marcado. La eficacia antiarrítmica en la prevención de recurrencias de FA es similar a las de la flecainida y la propafenona e inferior a la de amiodarona en el estudio SAFE-T14. Sin embargo, en ese mismo estudio se demostró que su eficacia antiarrítmica en la prevención de FA en el grupo de pacientes isquémicos es similar a la de amiodarona. El sotalol presenta como principal inconveniente su proarritmogenia, pues es un conocido prolongador del intervalo QT. No se recomienda a mujeres, pacientes con marcada hipertrofia ventricular izquierda, bradicardia importante, disfunción renal, hipopotasemia o hipomagnesemia.
AmiodaronaAunque la amiodarona está clasificada como antiarrítmico de clase III por su efecto bloqueador de los canales de potasio, en realidad es un fármaco multicanal: bloquea las corrientes de sodio, potasio y calcio, y además tiene efecto de bloqueo beta. Es con mucho el mejor FAA en comparación con los ya comentados. Por otro lado, y a diferencia de los anteriores FAA, puede administrarse con seguridad a pacientes con disfunción ventricular en IC. Al igual que otros FAA, tiene efectos proarritmogénicos, pero menos marcados que los demás FAA ya comentados, probablemente por su efecto multicanal. El principal inconveniente de la amiodarona es su toxicidad a largo plazo tiroidea, ocular, pulmonar y hepática, fundamentalmente.
DronedaronaEs un fármaco similar a la amiodarona (derivado benzofurano) al que se ha retirado la molécula de yodo y se ha añadido un radical metilsulfonamida para hacerlo más hidrosoluble y evitar su acumulación en tejido graso, como ocurre con la amiodarona15. Diferentes estudios han mostrado una eficacia antiarrítmica superior a la del placebo16, pero su eficacia antiarrítmica respecto a la amiodarona17 ha resultado inferior en el estudio DYONISOS18. No se debe administrar a pacientes con disfunción ventricular izquierda grave o con insuficiencia cardiaca de clases III y IV por el resultado negativo del estudio ANDROMEDA19, en el que asignaron al azar a 627 pacientes con insuficiencia cardiaca de clases II-IV (sobre todo III-IV) y fracción de eyección ventricular izquierda ≤ 35%, con exclusión de aquellos con infarto de miocardio en los 7 días previos, a recibir 400mg de dronedarona dos veces al día o placebo. El estudio se detuvo prematuramente después de 7 meses debido a un aumento de más del doble del riesgo de mortalidad (p=0,03) con dronedarona.
El estudio ATHENA20 mostró una disminución en el objetivo primario hospitalización y mortalidad respecto al placebo en pacientes con FA paroxística o persistente con factores de riesgo cardiovascular asociado. Tiene además un efecto de bloqueo beta que posibilita disminuir la frecuencia cardiaca en caso de FA permanente. Sin embargo, la reciente paralización del estudio PALLAS21, tras la inclusión de más de 3.200 pacientes, por aumento de mortalidad cardiovascular, ictus e insuficiencia cardiaca entre los pacientes con FA permanente y el aviso de la Food and Drug Administration (FDA) estadounidense sobre la potencial hepatotoxicidad del producto hacen que su futuro sea incierto. No obstante, en la última puesta al día de las guías de la European Society of Cardiology (ESC)11, continúan situándolo en primera línea terapéutica para el mantenimiento del ritmo sinusal de pacientes sin cardiopatía estructural, junto al resto del arsenal terapéutico (flecainida, propafenona y sotalol), así como para pacientes con cardiopatía hipertensiva, especialmente aquellos con cierto grado de hipertrofia ventricular izquierda y pacientes con cardiopatía isquémica. No se recomienda la dronedarona para pacientes con cualquier grado de insuficiencia cardiaca o FA permanente11. La razón de que el PALLAS muestre resultados discrepantes respecto al ATHENA ha sido objeto de debate. De hecho, uno de los motivos de plantear el estudio PALLAS fue haber observado que, en el subgrupo de pacientes del ATHENA que quedaban en FA permanente, se mantenía el beneficio de la dronedarona. Que se trate de una FA paroxística o permanente no debería afectar sustancialmente al objetivo primario, pero en el Euro Heart Survey on atrial fibrillation se demostró que los pacientes con FA permanente tenían peor pronóstico que los pacientes con FA paroxística. Además entre los dos estudios hay otras diferencias sustanciales como, por ejemplo, que los pacientes del PALLAS fueran discretamente más ancianos que los del ATHENA y, sobre todo, que tuvieran una proporción mucho mayor de pacientes con insuficiencia cardiaca en NYHA II-III (el 70% en el PALLAS frente al 21% en el ATHENA). Además, un tercio de los pacientes del PALLAS estaban tomando digoxina, y al tomarla con dronedarona aumentaban un 33% la concentración sérica de la primera, lo que podría explicar el aumento de mortalidad cardiovascular de manera similar a como se demostró en el análisis post-hoc del estudio DIG (Digitalis Investigation Grup)22.
¿Cómo elegir el FAA que necesita mi paciente?Las recientes guías de la ESC publicadas en agosto de 2012 hacen unas recomendaciones basadas más en la seguridad que en la eficacia de los FAA. Esta filosofía se basa en la falta de confianza en la eficacia a largo plazo de los FAA y su alto grado de complicaciones, especialmente su proarritmogenia. Las nuevas guías distinguen entre los pacientes según tengan cardiopatía estructural o no. La dronedarona, por su falta de efectos adversos, queda en primera línea terapéutica en uno u otro supuesto, excepto para pacientes con insuficiencia cardiaca y/o disfunción ventricular, por los resultados de los estudios ANDROMEDA y PALLAS.
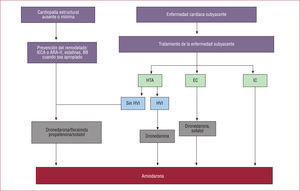
En cualquier caso, si no hay cardiopatía estructural, se puede utilizar en primera línea terapéutica cualquiera de los FAA que hemos mencionado, excepto la amiodarona que, por sus efectos adversos a largo plazo, se prefiere reservar como segunda línea. En caso de cardiopatía estructural, se distingue entre cardiopatía isquémica, insuficiencia cardiaca y cardiopatía hipertensiva. En el grupo de cardiopatía isquémica de primera línea estarían la dronedarona (por los resultados del ATHENA) o el sotalol (por los resultados del estudio SAFE-T, en cuyo subgrupo de cardiopatía isquémica se demostró la misma eficacia que con amiodarona). Para los pacientes con insuficiencia cardiaca, independientemente de su clase funcional, sería la amiodarona el tratamiento de primera elección después de la publicación del estudio PALLAS. De los pacientes con cardiopatía hipertensiva, se distingue entre con y sin hipertrofia ventricular izquierda. Si no la hay o es ligera, se debe tratarlos como a los pacientes sin cardiopatía estructural; por el contrario, si es moderada-grave, se debe intentar en primera opción dronedarona. En cualquier caso, la amiodarona quedaría de fármaco de segunda elección por sus efectos adversos a largo plazo, excepto para pacientes con insuficiencia cardiaca. El esquema del tratamiento se observa en la figura 2.
Algoritmo farmacológico recomendado por la Sociedad Europea de Cardiología para control farmacológico del ritmo en pacientes con fibrilación auricular. ARA-II: antagonistas de los receptores de la angiotensina II; BB: bloqueadores beta; EC: enfermedad coronaria; HTA: hipertensión pulmonar; HVI: hipertrofia ventricular izquierda; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina.
La dronedarona quedaría asimismo excluida para pacientes con toxicidad hepática o pulmonar relacionada con el uso previo de amiodarona. La Agencia Europea del Medicamento recomienda realizar ECG cada 6 meses, antes de empezar cualquier tratamiento con dronedarona, y test de función hepática a la semana de iniciado el tratamiento y durante los primeros 6 meses desde el inicio, y luego en los meses 9 y 12, y posteriormente controles anuales de la función hepática. Recomienda asimismo controlar la función renal a la semana.
Estrategia del control de la frecuencia cardiacaTradicionalmente se ha considerado que un buen control de la frecuencia cardiaca (FC) era lo que mantenía a los pacientes con FC en reposo alrededor de 60–80 lat/min, y se aceptaban hasta 90–115 lat/min en ejercicio, con base en la estrategia que se siguió en el estudio AFFIRM. Este control estricto de la FC llevó a la implantación de marcapasos en hasta el 7,3% de los pacientes del AFFIRM. La publicación del estudio RACE II23 permitió abrir el margen de latidos por minuto en los que no se observaba el efecto deletéreo de FC mayores. En este estudio, que incluyó a más de 600 pacientes, se comparó la estrategia de un control estricto de la FC (<80 lat/min en reposo) frente a un control más laxo (FC <110 lat/min); el objetivo primario era el compuesto de hospitalización por insuficiencia cardiaca, muerte cardiovascular, hemorragias o embolias y eventos arrítmicos graves. En un seguimiento mínimo de 2 años, se observó que no había diferencias significativas en el objetivo primario entre una estrategia y otra, y que además el control más laxo llegaba al objetivo terapéutico en un número de casos significativamente mayor que con la estrategia de control estricto. Asimismo, el control estricto requería de mayor número de visitas que el control más laxo. Extrapolar de un solo estudio de 614 pacientes que un control laxo de la FC es adecuado para controlar la FC sería poco menos que atrevido; si miramos bien a la población del RACE II, se trata de pacientes con FE muy conservada y baja incidencia de insuficiencia cardiaca (más del 60% estaban en NYHA I); ahora bien, es una estrategia válida en este subgrupo de pacientes.
¿Cómo debemos actuar, pues?Lo más sensato es iniciar un control más laxo de la FC, y si con ello se controlan los síntomas del paciente tanto en reposo como en ejercicio, esta estrategia sería suficiente. De lo contrario, se debería aumentar las dosis de los fármacos o iniciar combinaciones hasta conseguir el control de los síntomas. Si se opta por un control estricto de la FC, se debería monitorizar con Holter para evitar bradicardias extremas o pausas críticas. En pacientes que persistan sintomáticos a pesar del control estricto de la FC, se debería reevaluar la opción de control del ritmo o valorar medidas no farmacológicas de control de la FC, como la implantación de marcapasos acompañada de ablación del NAV.
¿De qué arsenal terapéutico disponemos para el control de la frecuencia cardiaca?Básicamente, los fármacos utilizados para frenar el NAV son los cuatro clásicos, es decir, digoxina, antagonistas del calcio no dihidropiridínicos (diltiazem y verapamilo) y bloqueadores beta. La amiodarona y la dronedarona, aunque tienen efecto multicanal y por lo tanto frenan el NAV, lo hacen de manera más discreta.
DigoxinaLa digoxina es un frenador de la FC utilizado desde hace muchos años, pero tiene poco efecto en situación de adrenergia como, por ejemplo, en ejercicio. Por lo tanto, raramente se suele dar en solitario, sino que se asocia a bloqueadores beta o antagonistas del calcio. Se debe tener especial precaución con los pacientes mayores en insuficiencia renal, pues puede producirse intoxicación digitálica, que puede causar serios problemas e incluso la muerte.
Antagonistas del calcio no dihidropiridínicosTanto diltiazem como verapamilo se han utilizado para frenar la FC de pacientes con FA. Se ha de tener especial precaución, y de hecho se recomienda no administrarlos, ante pacientes con disfunción ventricular, y están contraindicados si hay insuficiencia cardiaca. Sólo se puede administrarlos en caso de que la insuficiencia cardiaca tenga origen en la alta frecuencia ventricular, siempre y cuando se compruebe que la fracción de eyección está preservada.
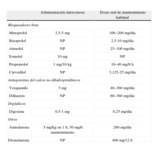
Bloqueadores betaSon excelentes bloqueadores del NAV, especialmente en pacientes con adrenergia. Se puede utilizar cualquiera de ellos, pero se utilizan generalmente los de acción corta o muy corta para el control agudo en situación de urgencia y los de acción prolongada para el tratamiento crónico a largo plazo. La tabla 2 muestra las dosis de los fármacos utilizados para el control de la FC.
Fármacos utilizados para frenar la frecuencia cardiaca con sus dosis habituales.
| Administración intravenosa | Dosis oral de mantenimiento habitual | |
| Bloqueadores beta | ||
| Metoprolol | 2,5-5mg | 100–200mg/día |
| Bisoprolol | NP | 2,5-10mg/día |
| Atenolol | NP | 25–100mg/día |
| Esmolol | 10mg | NP |
| Propranolol | 1mg/10kg | 10–40mg/8h |
| Carvedilol | NP | 3,125-25mg/día |
| Antagonistas del calcio no dihidropiridínicos | ||
| Verapamilo | 5mg | 40–360mg/día |
| Diltiazem | NP | 60–360mg/día |
| Digitálicos | ||
| Digoxina | 0,5-1mg | 0,25mg/día |
| Otros | ||
| Amiodarona | 5mg/kg en 1h; 50mg/h mantenimiento | 200mg/día |
| Dronedarona | NP | 400mg/12h |
NP: no procede.
No se suele prescribir de forma crónica para el control de la FC por los efectos adversos que su utilización a largo plazo puede producir. Ocasionalmente ocurre que en pacientes con FA paroxística o persistente, para quienes se ha optado por control del ritmo, estas acaban convirtiéndose en FA permanante y se mantiene el fármaco hasta nuevo control clínico; no obstante, en ese caso la recomendación de las guías es retirarla cuando se ha decidido que la FA es ya permanente. Sin embargo, en la fase aguda, endovenosa, sola o en combinación con digoxina, puede ayudar a controlar la FC de pacientes hemodinámicamente inestables o con insuficiencia cardiaca, situaciones en que no se puede utilizar bloqueadores beta ni antagonistas del calcio.
DronedaronaEl estudio ERATO24 mostró una discreta reducción de la FC en pacientes con FA permanente en este estudio; sin embargo, raramente se controla la FC con este fármaco en monoterapia. Además, la reciente paralización del estudio PALLAS, que incluía a pacientes con FA permanente, hoy contraindica la utilización de este fármaco en FA permanente para el control de la FC.
En conclusión, el tratamiento antiarrítmico crónico de la FA ha sufrido pocos cambios en los últimos años, hasta la irrupción de la dronedarona. Su papel queda restringido a pacientes con FA paroxística —o FA persistente si se planea cardioversión eléctrica— y que no tengan asociada clínica de insuficiencia cardiaca. No obstante, antes de iniciar el tratamiento con este nuevo fármaco, debemos seguir los controles analíticos que la EMA aconseja. Por otro lado, la decisión más importante que debe adoptar el cardiólogo sigue siendo si luchar por mantener el ritmo cardiaco o simplemente mantener una FC adecuada. La primera opción es más recomendable en pacientes sintomáticos sin demasiada cardiopatía estructural; la segunda, para pacientes poco sintomáticos o asintomáticos, de edad avanzada y con cardiopatía estructural asociada que haga previsible que no se mantenga el ritmo sinusal. La combinación con tratamientos no farmacológicos, como la ablación, actualmente es una realidad, que probablemente será aún más notable en un futuro cercano.
Conflicto de interesesNinguno.