La vigente guía de práctica clínica para el tratamiento de la hipercolesterolemia recomienda mantener la terapia intensiva con estatinas de los pacientes tratados con implante de stent farmacoactivo (SFA). Sin embargo, el tratamiento intensivo con estatinas, una vez estabilizado el paciente, con frecuencia no se lleva a cabo en la práctica clínica tras la revascularización con SFA. Actualmente se desconoce el impacto de mantener esa terapia intensiva con estatinas en estos pacientes estables. Se estudia la reducción de eventos adversos en pacientes clínicamente estables en monoterapia con ácido acetilsalicílico tras el implante de un SFA según la terapia de alta o baja intensidad con estatinas.
MétodosSe aleatorizó a pacientes estables a los 12 meses del implante de un SFA y en monoterapia con ácido acetilsalicílico a recibir terapia de alta intensidad con estatinas (atorvastatina 40 mg; n = 1.000) o terapia de baja intensidad (pravastatina 20 mg; n = 1.000). El objetivo primario fueron los eventos clínicos adversos a los 12 meses de seguimiento (objetivo compuesto de muerte, infarto de miocardio, revascularización, trombosis del stent, accidente cerebrovascular, insuficiencia renal, necesidad de intervención arterial periférica y nuevo ingreso hospitalario por eventos cardiacos).
ResultadosEl objetivo primario a los 12 meses de seguimiento se produjo en 25 pacientes (2,5%) en tratamiento de alta intensidad con estatinas y en 40 (4,1%) en tratamiento de baja intensidad (HR = 0,58; IC95%, 0,36-0,92; p = 0,018). Esta diferencia se debió principalmente a la menor incidencia de muerte cardiaca (0 frente al 0,4%; p = 0,025) y de infarto de miocardio no relacionado con el vaso diana (el 0,1 frente al 0,7%; p = 0,033) en el grupo de tratamiento de alta intensidad con estatinas.
ConclusionesEntre los pacientes clínicamente estables en monoterapia con ácido acetilsalicílico, el tratamiento de alta intensidad con estatinas redujo la incidencia de eventos comparado con el tratamiento de baja intensidad.
Registro de ensayos clínicos: URL: http://www.clinicaltrials.gov. Identificador único: NCT01557075.
Palabras clave
Los stents farmacoactivos (SFA) han sido objeto de un proceso de mejora continua para reducir las tasas de eventos clínicos adversos relacionados con su uso1,2. En ensayos aleatorizados y metanálisis, se ha observado que los SFA de nueva generación tienen más seguridad y eficacia que los SFA de primera generación3. Sin embargo, continúan produciéndose eventos clínicos adversos tardíos (más de 12 meses después del implante del SFA), como la trombosis muy tardía del stent o la reestenosis tardía (late catch-up), en los pacientes a los que se practica una intervención coronaria percutánea (ICP) con un SFA de nueva generación1, debido a mecanismos como la inflamación crónica, el retraso en la cicatrización de la neoíntima y la neoateroesclerosis4–6. Los enfoques adecuados para prevenir estas complicaciones tardías no están claramente establecidos. Aunque se puede considerar el uso de un tratamiento antiagregante plaquetario combinado doble prolongado más de 12 meses tras el implante del SFA7, la consiguiente mayor incidencia de episodios hemorrágicos se ha relacionado con un aumento de la mortalidad por cualquier causa en los pacientes tratados con SFA8.
El tratamiento con estatinas de alta intensidad puede reducir la morbilidad y la mortalidad de los pacientes con enfermedad coronaria. Estos efectos protectores de las estatinas están relacionados no solo con unas concentraciones de colesterol unido a lipoproteínas de baja densidad reducidas6, sino también con sus efectos pleotrópicos, como la reducción de la inflamación9,10, la actividad antiagregante plaquetaria/antitrombótica11,12, la mejora de la función endotelial13,14, la inhibición de la progresión de la placa15 y la estabilización de las placas vulnerables16. Además, el tratamiento con estatinas puede acelerar la cobertura de los struts del stent tras el implante del SFA13,17 y puede reducir la viscosidad de la sangre, con lo que disminuyen las fuerzas de cizalladura en la pared y se previene la rotura de la placa18. Por otra parte, un estudio reciente indica que una reducción intensiva de las concentraciones lipídicas puede tener efectos favorables en los aspectos cualitativos del tejido de la neoíntima tras el implante del SFA19.
Las guías del American College of Cardiology y la American Heart Association sobre el tratamiento del colesterol en sangre recomiendan mantener continuamente el tratamiento con estatinas de alta intensidad a los pacientes tratados con SFA20–22. Sin embargo, el tratamiento con estatinas de alta intensidad a menudo se infrautiliza en la práctica clínica tras la estabilización de los pacientes a los que se ha implantado un SFA23,24. Dichos pacientes reciben a veces un tratamiento con estatinas de baja intensidad. En consecuencia, se ha evaluado la influencia de un tratamiento continuo con estatinas de alta intensidad en los eventos adversos tardíos en pacientes con SFA clínicamente estables y en tratamiento con ácido acetilsalicílico en monoterapia.
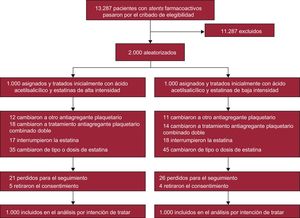
MÉTODOSDiseño del estudio y participantesSe llevó a cabo un estudio multicéntrico, de grupos paralelos, aleatorizado, de diseño abierto e iniciado por el investigador en 15 centros de Corea. Se estudió a pacientes clínicamente estables a los que se había implantado un SFA aproximadamente 12 meses antes y luego recibieron tratamiento con ácido acetilsalicílico en monoterapia; la administración de clopidogrel se suspendió en el momento de la inclusión, entre agosto de 2010 y noviembre de 2014. Se consideró no aptos para el estudio a los pacientes que presentaran alguna de las siguientes características: a) haber experimentado eventos adversos clínicos en los 12 meses siguientes al implante del SFA; b) uso actual de tratamiento antiagregante plaquetario combinado único o doble, aparte del ácido acetilsalicílico; c) alergia o haber presentado efectos adversos del ácido acetilsalicílico o las estatinas; d) edad < 20 años; e) embarazo; f) esperanza de vida ≤ 2 años, o g) indicación para un tratamiento con estatinas de alta intensidad prolongado. Mediante un sistema interactivo a través de Internet, se aleatorizó a los pacientes en relación 1:1 a tratamiento con estatinas de alta intensidad (atorvastatina 40 mg/día) o con estatinas de baja intensidad (pravastatina 20 mg/día), utilizando un tamaño de bloque de 4 para los 2 grupos de estudio. La atorvastatina y la pravastatina son estatinas que se prescriben con frecuencia en Corea. La aleatorización con enmascaramiento se estratificó según los centros de inclusión y la presencia de síndrome coronario agudo en la ICP de calificación para el estudio. Se ocultó a los investigadores, los pacientes, los analistas de los datos y el promotor del estudio la secuencia de aleatorización. Realizaron la inclusión los médicos encargados del tratamiento. Inmediatamente después de la asignación aleatoria, los médicos encargados del tratamiento prescribieron a los pacientes las estatinas asignadas. En consecuencia, todos los pacientes incluidos recibieron inicialmente el tratamiento asignado (fig. 1). No se ocultó a los pacientes ni a los médicos encargados del tratamiento la identidad del tratamiento asignado. El protocolo del estudio fue aprobado por los consejos de revisión de cada uno de los centros participantes, y todos los pacientes dieron su consentimiento informado por escrito. La coordinación del estudio, la gestión de los datos y la gestión de los centros tuvieron lugar a través de un centro de gestión de los datos clínicos (Cardiovascular Research Center, Seúl, Corea). Los monitores de ensayo clínico designados revisaron la exactitud y la completitud de los datos a intervalos de tiempo apropiados y verificaron el cumplimiento del protocolo del estudio, que no se modificó a lo largo de toda su realización. Un consejo de vigilancia de datos y seguridad, formado por médicos independientes con acceso a los datos sin enmascaramiento, se encargó de supervisar la seguridad del estudio.
Seguimiento y objetivo del estudioCon objeto de investigar el efecto integral del tratamiento con estatinas de alta intensidad en cuanto a la reducción de diversos eventos cardiovasculares, el objetivo principal fue el compuesto de muerte por cualquier causa, infarto de miocardio, trombosis del stent, revascularización del vaso diana o de un vaso no diana, ictus, deterioro de la función renal, intervención por una enfermedad arterial periférica y el ingreso por eventos cardiacos importantes (definido como el ingreso por dolor torácico intenso, disnea, edema, palpitaciones o síncope) en un seguimiento de 12 meses. Los eventos clínicos se definieron según lo establecido por el Academic Research Consortium25. Todas las muertes se consideraron de causa cardiaca, a menos que se pudiera identificar una causa no cardiaca definitiva. El infarto de miocardio se definió como la presencia de síntomas clínicos, alteraciones electrocardiográficas o signos de imagen indicativos de un infarto de miocardio, conjuntamente con un aumento de la fracción de banda miocárdica de la creatincinasa por encima del límite superior de la normalidad o un aumento de troponinas T o I hasta un valor superior al percentil 99 del límite superior de la normalidad. Si el territorio del infarto de miocardio estaba irrigado por la arteria coronaria que contenía el SFA implantado, esto se definía como un infarto de miocardio relacionado con el vaso diana. La trombosis del stent definitiva, probable o posible se definió según las recomendaciones del Academic Research Consortium25. La revascularización del vaso diana o uno no diana se definió como una nueva ICP o cirugía de bypass arterial coronario del vaso diana o como la ICP o cirugía de bypass de un vaso no diana, junto con una de las 2 características siguientes: a) síntomas isquémicos o prueba de estrés positiva y estenosis angiográfica ≥ 50% del diámetro en el análisis cuantitativo de la angiografía coronaria, o b) estenosis angiográfica ≥ 70% del diámetro en el análisis cuantitativo de la angiografía coronaria sin síntomas isquémicos o con prueba de estrés positiva. El deterioro de la función renal se definió como un aumento de creatinina en suero > 25% o > 0,5 mg/dl. El ictus, detectado por la presencia de un déficit neurológico de nueva aparición, se confirmó mediante una exploración neurológica y técnicas de imagen. Se realizaron evaluaciones de los eventos clínicos y de la adherencia a la medicación al cabo de 1, 3, 6 y 12 meses de la aleatorización, en visitas en la consulta del médico. Se recomendaron análisis de laboratorio tras la aleatorización y en el seguimiento a los 12 meses. Durante las evaluaciones, se recogieron todos los datos y especialistas del centro de gestión de datos clínicos los introdujeron en una base de datos informatizada. Un comité independiente de adjudicación de eventos clínicos se encargó de validar, sin conocer el tratamiento asignado, todos los componentes del objetivo principal, sin examinar los documentos fuente originales de los pacientes.
Cálculo del tamaño muestral y análisis estadísticoEl cálculo del tamaño de la muestra se basó en el objetivo principal. El análisis principal consistió en una comparación de superioridad del tratamiento con estatinas de alta intensidad respecto al tratamiento con estatinas de baja intensidad por lo que respecta a la aparición del objetivo de valoración principal. El cálculo del tamaño de la muestra se basó en una prueba bilateral de 2 muestras. Con base en estudios previos26,27, se asumió que la incidencia general de eventos clínicos adversos tardíos sería del 4,0% de los pacientes tratados con estatinas de alta intensidad y el 7,0% de los pacientes con estatinas de baja intensidad entre 1 y 2 años después del implante del SFA. Se previó que el tratamiento con estatinas de alta intensidad reduciría el objetivo principal en un 50%. Con el diseño de evaluación de la superioridad, eran necesarios 1.000 pacientes en cada grupo de tratamiento, asumiendo un nivel de alfa bilateral de 0,05, una potencia estadística del 80% y una tasa estimada de abandonos del 10%.
El análisis principal se realizó con el criterio de intención de tratar para determinar si el tratamiento con estatinas de alta intensidad era superior al de estatinas de baja intensidad por lo que respecta a la frecuencia del objetivo principal. Se calcularon las tasas acumuladas del objetivo principal y de cada uno de sus componentes empleando estimaciones de Kaplan-Meier y se compararon las de los 2 grupos de tratamiento mediante tests de log rank.. Además, se estimaron las hazard ratio y los intervalos de confianza del 95% para la asociación entre la dosis de estatina y el objetivo principal, utilizando para ello un modelo de riesgos proporcionales de Cox, con ajuste por los centros de reclutamiento y las características clínicas y angiográficas basales (edad, sexo, diabetes mellitus, síndrome coronario agudo, fracción de eyección del ventrículo izquierdo, colesterol unido a lipoproteínas de baja densidad, ICP multivaso, tipos de SFA y tamaños del SFA). A los pacientes perdidos para el seguimiento (n=47 [2,4%]) y los que retiraron el consentimiento (n=9 [0,5%]), se los evaluó en el último momento en que se tenía constancia de que continuaban sin eventos. Aunque los pacientes podían presentar más de 1 componente del objetivo principal, en el análisis se evaluó a cada paciente 1 sola vez durante el tiempo transcurrido hasta la aparición del primer evento. Se realizaron análisis de subgrupos para determinados subgrupos preespecificados. La evaluación se realizó empleando términos de interacción en un modelo de riesgos proporcionales de Cox. Las variables discretas se presentan mediante número (porcentaje) y se compararon con la prueba de la χ2 o la exacta de Fisher. Las variables continuas se presentan en forma de media ± desviación estándar o mediana [intervalo intercuartílico] y se compararon con la prueba de la t de Student o la de la U de Mann-Whitney. Todos los análisis se llevaron a cabo con el programa informático SPSS (versión 23, IBM; Chicago, Illinois, Estados Unidos). Todas las pruebas fueron bilaterales y se consideraron estadísticamente significativos los valores de p < 0,05.
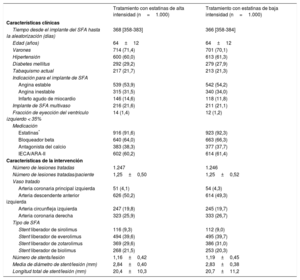
RESULTADOSSe aleatorizó a los pacientes a tratamiento con estatinas de alta intensidad (n=1.000) o con estatinas de baja intensidad (n=1.000) (fig. 1). Completaron el seguimiento de 1 año 974 pacientes (97,4%) del grupo de tratamiento con estatinas de alta intensidad y 970 (97,0%) del grupo de estatinas de baja intensidad (p=0,588). Las características clínicas basales y las características de la intervención estuvieron bien equilibradas en los 2 grupos (tabla 1). En el conjunto de ambos grupos, la mediana de tiempo transcurrido entre el implante del SFA y la aleatorización fue 367 [358-383] días. La mayoría de los pacientes (91%) estaban tratados con un SFA de nueva generación.
Características clínicas basales y de la intervención
| Tratamiento con estatinas de alta intensidad (n=1.000) | Tratamiento con estatinas de baja intensidad (n=1.000) | |
|---|---|---|
| Características clínicas | ||
| Tiempo desde el implante del SFA hasta la aleatorización (días) | 368 [358-383] | 366 [358-384] |
| Edad (años) | 64±12 | 64±12 |
| Varones | 714 (71,4) | 701 (70,1) |
| Hipertensión | 600 (60,0) | 613 (61,3) |
| Diabetes mellitus | 292 (29,2) | 279 (27,9) |
| Tabaquismo actual | 217 (21,7) | 213 (21,3) |
| Indicación para el implante de SFA | ||
| Angina estable | 539 (53,9) | 542 (54,2) |
| Angina inestable | 315 (31,5) | 340 (34,0) |
| Infarto agudo de miocardio | 146 (14,6) | 118 (11,8) |
| Implante de SFA multivaso | 216 (21,6) | 211 (21,1) |
| Fracción de eyección del ventrículo izquierdo < 35% | 14 (1,4) | 12 (1,2) |
| Medicación | ||
| Estatinas* | 916 (91,6) | 923 (92,3) |
| Bloqueador beta | 640 (64,0) | 663 (66,3) |
| Antagonista del calcio | 383 (38,3) | 377 (37,7) |
| IECA/ARA-II | 602 (60,2) | 614 (61,4) |
| Características de la intervención | ||
| Número de lesiones tratadas | 1.247 | 1.246 |
| Número de lesiones tratadas/paciente | 1,25±0,50 | 1,25±0,52 |
| Vaso tratado | ||
| Arteria coronaria principal izquierda | 51 (4,1) | 54 (4,3) |
| Arteria descendente anterior izquierda | 626 (50,2) | 614 (49,3) |
| Arteria circunfleja izquierda | 247 (19,8) | 245 (19,7) |
| Arteria coronaria derecha | 323 (25,9) | 333 (26,7) |
| Tipo de SFA | ||
| Stent liberador de sirolimus | 116 (9,3) | 112 (9,0) |
| Stent liberador de everolimus | 494 (39,6) | 495 (39,7) |
| Stent liberador de zotarolimus | 369 (29,6) | 386 (31,0) |
| Stent liberador de biolimus | 268 (21,5) | 253 (20,3) |
| Número de stents/lesión | 1,16±0,42 | 1,19±0,45 |
| Media de diámetro de stent/lesión (mm) | 2,84±0,40 | 2,83±0,38 |
| Longitud total de stent/lesión (mm) | 20,4±10,3 | 20,7±11,2 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina; SFA: stent farmacoactivo.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
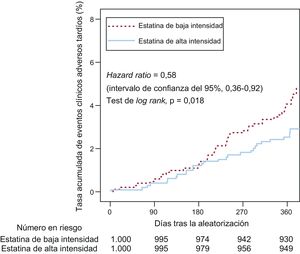
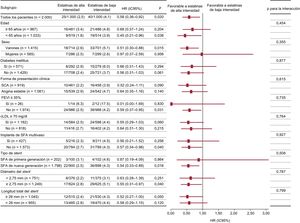
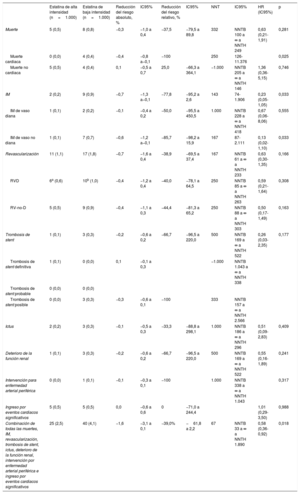
En el seguimiento de 12 meses, se produjeron eventos del objetivo principal en 25 pacientes (2,5%) del grupo de tratamiento con estatinas de alta intensidad y 40 (4,1%) del de estatinas de baja intensidad (hazard ratio=0,58; intervalo de confianza del 95%, 0,36-0,92; test de log rank, p=0,018) (fig. 2). La diferencia se debe principalmente a una menor frecuencia de muertes cardiacas (0 frente al 0,4%; p=0,025) e infartos de miocardio de vasos no diana (el 0,1 frente al 0,7%; p=0,033) en los pacientes con estatinas de alta intensidad (tabla 2). Los análisis de subgrupos preespecificados no mostraron interacciones estadísticamente significativas entre el tratamiento con estatinas y las características clínicas o angiográficas (fig. 3).
Resultados clínicos a los 12 meses
| Estatina de alta intensidad (n=1.000) | Estatina de baja intensidad (n=1.000) | Reducción del riesgo absoluto, % | IC95% | Reducción del riesgo relativo, % | IC95% | NNT | IC95% | HR (IC95%) | p | |
|---|---|---|---|---|---|---|---|---|---|---|
| Muerte | 5 (0,5) | 8 (0,8) | −0,3 | −1,0 a 0,4 | −37,5 | −79,5 a 89,8 | 332 | NNTB 100 a ∞ a NNTH 249 | 0,63 (0,21-1,91) | 0,281 |
| Muerte cardiaca | 0 (0,0) | 4 (0,4) | −0,4 | −0,8 a−0,1 | −100 | 250 | 126-11.376 | 0,025 | ||
| Muerte no cardiaca | 5 (0,5) | 4 (0,4) | 0,1 | −0,5 a 0,7 | 25,0 | −66,3 a 364,1 | −1.000 | NNTB 205 a ∞ a NNTH 146 | 1,36 (0,36-5,15) | 0,746 |
| IM | 2 (0,2) | 9 (0,9) | −0,7 | −1,3 a−0,1 | −77,8 | −95,2 a 2,6 | 143 | 74-1.906 | 0,23 (0,05-1,05) | 0,033 |
| IM de vaso diana | 1 (0,1) | 2 (0,2) | −0,1 | −0,4 a 0,2 | −50,0 | −95,5 a 450,5 | 1.000 | NNTB 228 a ∞ a NNTH 418 | 0,67 (0,06-8,06) | 0,555 |
| IM de vaso no diana | 1 (0,1) | 7 (0,7) | −0,6 | −1,2 a−0,1 | −85,7 | −98,2 a 15,9 | 167 | 87-2.111 | 0,13 (0,02-1,10) | 0,033 |
| Revascularización | 11 (1,1) | 17 (1,8) | −0,7 | −1,6 a 0,4 | −38,9 | −69,5 a 37,4 | 167 | NNTB 61 a ∞ a NNTH 233 | 0,63 (0,30-1,35) | 0,166 |
| RVD | 6a (0,6) | 10b (1,0) | −0,4 | −1,2 a 0,4 | −40,0 | −78,1 a 64,5 | 250 | NNTB 85 a ∞ a NNTH 263 | 0,59 (0,21-1,64) | 0,308 |
| RV-no-D | 5 (0,5) | 9 (0,9) | −0,4 | −1,1 a 0,3 | −44,4 | −81,3 a 65,2 | 250 | NNTB 88 a ∞ a NNTH 303 | 0,50 (0,17-1,49) | 0,163 |
| Trombosis de stent | 1 (0,1) | 3 (0,3) | −0,2 | −0,6 a 0,2 | −66,7 | −96,5 a 220,0 | 500 | NNTB 169 a ∞ a NNTH 522 | 0,26 (0,03-2,35) | 0,177 |
| Trombosis de stent definitiva | 1 (0,1) | 0 (0,0) | 0,1 | −0,1 a 0,3 | −1.000 | NNTB 1.043 a ∞ a NNTH 338 | ||||
| Trombosis de stent probable | 0 (0,0) | 0 (0,0) | ||||||||
| Trombosis de stent posible | 0 (0,0) | 3 (0,3) | −0,3 | −0,6 a 0,1 | −100 | 333 | NNTB 157 a ∞ a NNTH 2.566 | |||
| Ictus | 2 (0,2) | 3 (0,3) | −0,1 | −0,5 a 0,3 | −33,3 | −88,8 a 298,1 | 1.000 | NNTB 186 a ∞ a NNTH 296 | 0,51 (0,09-2,83) | 0,409 |
| Deterioro de la función renal | 1 (0,1) | 3 (0,3) | −0,2 | −0,6 a 0,2 | −66,7 | −96,5 a 220,0 | 500 | NNTB 169 a ∞ a NNTH 522 | 0,55 (0,16-1,89) | 0,241 |
| Intervención para enfermedad arterial periférica | 0 (0,0) | 1 (0,1) | −0,1 | −0,3 a 0,1 | −100 | 1.000 | NNTB 338 a ∞ a NNTH 1.043 | 0,317 | ||
| Ingreso por eventos cardiacos significativos | 5 (0,5) | 5 (0,5) | 0,0 | −0,6 a 0,6 | 0 | −71,0 a 244,4 | 1,01 (0,29-3,50) | 0,988 | ||
| Combinación de todas las muertes, IM, revascularización, trombosis de stent, ictus, deterioro de la función renal, intervención por enfermedad arterial periférica e ingreso por eventos cardiacos significativos | 25 (2,5) | 40 (4,1) | −1,6 | −3,1 a 0,1 | −39,0% | −61,8 a 2,2 | 67 | NNTB 33 a ∞ a NNTH 1.890 | 0,58 (0,36-0,92) | 0,018 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; NNT: número de pacientes que es preciso tratar; NNTB: NNT para obtener beneficio; NNTH: NNT para causar daño; RVD: revascularización de vaso diana; RV-no-D: revascularización de vaso no diana.
Salvo otra indicación, los valores expresan n (%) (tasa de eventos acumulada a los 12 meses).
Análisis de subgrupos del objetivo principal en el seguimiento a los 12 meses. Los valores expresan número de eventos/número de pacientes (%) (tasa acumulada de eventos a los 12 meses). cLDL: colesterol unido a lipoproteínas de baja densidad; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; SCA: síndrome coronario agudo; SFA: stent farmacoactivo.
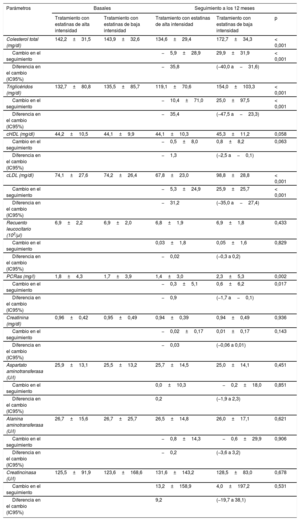
Los parámetros analíticos basales de los 2 grupos eran similares (tabla 3). Sin embargo, en el seguimiento a los 12 meses, las cifras de colesterol total, triglicéridos, colesterol unido a lipoproteínas de baja densidad y proteína C reactiva de alta sensibilidad eran significativamente menores en los pacientes del grupo con estatinas de alta intensidad que en el grupo con estatinas de baja intensidad. Los cambios observados en las concentraciones de enzimas hepáticas, creatinina y creatincinasa entre la situación inicial y el seguimiento a los 12 meses fueron similares en los 2 grupos. La incidencia de abandonos del tratamiento con estatinas también fue similar en los 2 grupos (17 pacientes con estatinas de alta intensidad frente a 18 con estatinas de baja intensidad) (fig. 1). Se observó diabetes de nueva aparición que requirió tratamiento hipoglucemiante oral en 10 de 708 pacientes (1,4%) del grupo con estatinas de alta intensidad y 6 de 721 (0,8%) del grupo con estatinas de baja intensidad (p=0,297).
Parámetros hematológicos basales y del seguimiento a los 12 meses
| Parámetros | Basales | Seguimiento a los 12 meses | |||
|---|---|---|---|---|---|
| Tratamiento con estatinas de alta intensidad | Tratamiento con estatinas de baja intensidad | Tratamiento con estatinas de alta intensidad | Tratamiento con estatinas de baja intensidad | p | |
| Colesterol total (mg/dl) | 142,2±31,5 | 143,9±32,6 | 134,6±29,4 | 172,7±34,3 | < 0,001 |
| Cambio en el seguimiento | −5,9±28,9 | 29,9±31,9 | < 0,001 | ||
| Diferencia en el cambio (IC95%) | −35,8 | (−40,0 a−31,6) | |||
| Triglicéridos (mg/dl) | 132,7±80,8 | 135,5±85,7 | 119,1±70,6 | 154,0±103,3 | < 0,001 |
| Cambio en el seguimiento | −10,4±71,0 | 25,0±97,5 | < 0,001 | ||
| Diferencia en el cambio (IC95%) | −35,4 | (−47,5 a−23,3) | |||
| cHDL (mg/dl) | 44,2±10,5 | 44,1±9,9 | 44,1±10,3 | 45,3±11,2 | 0,058 |
| Cambio en el seguimiento | −0,5±8,0 | 0,8±8,2 | 0,063 | ||
| Diferencia en el cambio (IC95%) | −1,3 | (−2,5 a−0,1) | |||
| cLDL (mg/dl) | 74,1±27,6 | 74,2±26,4 | 67,8±23,0 | 98,8±28,8 | < 0,001 |
| Cambio en el seguimiento | −5,3±24,9 | 25,9±25,7 | < 0,001 | ||
| Diferencia en el cambio (IC95%) | −31,2 | (−35,0 a−27,4) | |||
| Recuento leucocitario (103/μl) | 6,9±2,2 | 6,9±2,0 | 6,8±1,9 | 6,9±1,8 | 0,433 |
| Cambio en el seguimiento | 0,03±1,8 | 0,05±1,6 | 0,829 | ||
| Diferencia en el cambio (IC95%) | −0,02 | (−0,3 a 0,2) | |||
| PCRas (mg/l) | 1,8±4,3 | 1,7±3,9 | 1,4±3,0 | 2,3±5,3 | 0,002 |
| Cambio en el seguimiento | −0,3±5,1 | 0,6±6,2 | 0,017 | ||
| Diferencia en el cambio (IC95%) | −0,9 | (−1,7 a−0,1) | |||
| Creatinina (mg/dl) | 0,96±0,42 | 0,95±0,49 | 0,94±0,39 | 0,94±0,49 | 0,936 |
| Cambio en el seguimiento | −0,02±0,17 | 0,01±0,17 | 0,143 | ||
| Diferencia en el cambio (IC95%) | −0,03 | (−0,06 a 0,01) | |||
| Aspartato aminotransferasa (U/l) | 25,9±13,1 | 25,5±13,2 | 25,7±14,5 | 25,0±14,1 | 0,451 |
| Cambio en el seguimiento | 0,0±10,3 | −0,2±18,0 | 0,851 | ||
| Diferencia en el cambio (IC95%) | 0,2 | (−1,9 a 2,3) | |||
| Alanina aminotransferasa (U/l) | 26,7±15,6 | 26,7±25,7 | 26,5±14,8 | 26,0±17,1 | 0,621 |
| Cambio en el seguimiento | −0,8±14,3 | −0,6±29,9 | 0,906 | ||
| Diferencia en el cambio (IC95%) | −0,2 | (−3,6 a 3,2) | |||
| Creatincinasa (U/l) | 125,5±91,9 | 123,6±168,6 | 131,6±143,2 | 128,5±83,0 | 0,678 |
| Cambio en el seguimiento | 13,2±158,9 | 4,0±197,2 | 0,531 | ||
| Diferencia en el cambio (IC95%) | 9,2 | (−19,7 a 38,1) | |||
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; IC95%: intervalo de confianza del 95%; PCRas: proteína C reactiva de alta sensibilidad.
Salvo otra indicación, los valores expresan media±desviación estándar.
En este ensayo multicéntrico y aleatorizado, el tratamiento con estatinas de alta intensidad, en comparación con el de estatinas de baja intensidad, redujo significativamente los eventos adversos tardíos en pacientes clínicamente estables sometidos a implante de SFA 12 meses antes y tratados con ácido acetilsalicílico en monoterapia tras la suspensión del clopidogrel.
Dos estudios anteriores han demostrado también que el tratamiento con estatinas de alta intensidad reduce los eventos clínicos a largo plazo en los pacientes con una ICP previa de manera más efectiva que el tratamiento con estatinas estándar o de baja intensidad26,27. El estudio Treating to New Targets, en el que participaron 5.407 pacientes sometidos a ICP por una enfermedad coronaria estable, puso de manifiesto que el tratamiento con atorvastatina 80 mg/día reduce significativamente la incidencia de eventos cardiovasculares mayores (es decir, muerte por enfermedad coronaria, infarto de miocardio, parada cardiaca recuperada e ictus) en un 21% y las revascularizaciones posteriores en un 27%, en comparación con atorvastatina 10 mg/día durante una mediana de seguimiento de 4,9 años27. El estudio PCI-PROVE IT, en el que participaron 2.867 pacientes sometidos a ICP por síndrome coronario agudo, mostró también que el tratamiento con atorvastatina 80 mg/día reduce significativamente la incidencia del objetivo principal (es decir, la combinación de muerte por cualquier causa, infarto de miocardio, revascularización, ictus y rehospitalización) en un 22% y las nuevas revascularizaciones en un 24%, en comparación con pravastatina 40 mg/día26. Sin embargo, ambos estudios se llevaron a cabo en la época de los stents metálicos, mientras que, junto con el desarrollo de los SFA, ha habido mejoras importantes en los equipos y las técnicas de ICP y en la farmacología. Así pues, son necesarios datos clínicos aplicables a nuestra práctica clínica actual, en la que el uso de SFA es predominante. En el presente estudio se incluyó exclusivamente a pacientes tratados con SFA, la mayoría de ellos (90%) SFA de nueva generación. En consecuencia, nuestro estudio refleja con mayor exactitud la realidad de la práctica clínica actual.
En la práctica clínica real, el tratamiento con estatinas de alta intensidad está infrautilizado. Por ejemplo, en Corea se mantiene en este tratamiento solo a un 14% de los pacientes con síndrome coronario agudo sometidos a ICP23. Además, en Estados Unidos se prescribe tratamiento con estatinas de alta intensidad a solo un 35% de los pacientes con eventos coronarios (es decir, infarto de miocardio o revascularización coronaria) en los 12 meses siguientes al alta hospitalaria24. Los factores que podrían contribuir a la infrautilización del tratamiento con estatinas de alta intensidad son la angina inestable en vez de infarto de miocardio, la obtención de bajas concentraciones lipídicas al alta, los obstáculos de coste, las transiciones tras el alta, incluidos los traslados, la preocupación por los efectos adversos de las estatinas de alta intensidad, la comorbilidad hepática/renal combinada, la adherencia a las estatinas de intensidad baja/intermedia antes del evento y la conciliación de la medicación entre paciente y médico23,24. Sin embargo, las preocupaciones relacionadas con la dosis de estatinas, como la diabetes de nueva aparición (50-100/10.000 pacientes), la miopatía (5/10.000 pacientes), la lesión hepática grave (1/100.000 pacientes) o el deterioro de la función renal son muy poco frecuentes o no están respaldadas por la evidencia existente28. Además, los efectos nocivos de las estatinas pueden revertirse suspendiendo el tratamiento, mientras que los eventos cardiacos o vasculares debidos a una infrautilización de las estatinas pueden ser devastadores28. En el presente estudio, se incluyó exclusivamente a pacientes tratados con éxito con un SFA 12 meses antes y que luego realizaron satisfactoriamente un cambio al tratamiento con ácido acetilsalicílico en monoterapia sin presentar eventos clínicos adversos. Dado que se supone que estos pacientes tienen bajo riesgo de eventos adversos tardíos, podría haber cierta resistencia a mantener el tratamiento con estatinas de alta intensidad, lo cual conduce a una infrautilización de dicho tratamiento en la práctica clínica real. Sin embargo, se observa que el tratamiento con estatinas de alta intensidad redujo de manera significativa los eventos clínicos adversos tardíos en un 42% en comparación con las estatinas de baja intensidad. Así pues, se recomienda vivamente el empleo de estatinas de alta intensidad incluso para pacientes con SFA clínicamente estables y en monoterapia con ácido acetilsalicílico.
Dado que la mayoría de los pacientes (92%) en tratamiento con estatinas de alta intensidad ya estaban tomando estatinas de intensidad alta o intermedia en el momento de la inclusión, sus cifras basales de colesterol unido a lipoproteínas de baja densidad eran bajas y la reducción adicional durante el seguimiento a los 12 meses fue mínima. En cambio, el colesterol unido a lipoproteínas de baja densidad de los pacientes en tratamiento con estatinas de baja intensidad había aumentado a los 12 meses, probablemente por la potencia relativamente débil de la pravastatina29. Además, el tratamiento con estatinas de alta intensidad redujo la proteína C reactiva de alta sensibilidad de manera más efectiva que el tratamiento con estatinas de baja intensidad. Estos resultados indican que la reducción de los eventos clínicos adversos tardíos se produce a través de los efectos hipolipemiantes y pleotrópicos (p. ej., antiinflamatorios) del tratamiento con estatinas de alta intensidad26.
En el presente estudio, la muerte súbita inexplicada, definida como la muerte cardiaca y la posible trombosis del stent, se dieron en 3 pacientes en tratamiento con estatinas de baja intensidad. En cambio, no hubo ningún evento de este tipo entre los pacientes en tratamiento con estatinas de alta intensidad, tal vez porque este puede impedir los procesos de cicatrización vascular tardíos y la inflamación vascular crónica, que son factores predisponentes a la trombosis muy tardía del stent4 después del implante de un SFA6,10,17. Se observa también una menor incidencia de infarto de miocardio de vaso no diana en los pacientes tratados con estatinas de alta intensidad, lo cual podría explicarse por estabilización de la placa e inhibición de la progresión de la placa15,16.
LimitacionesEste estudio tiene varias limitaciones. Primero, la tasa total observada de eventos del objetivo principal fue inferior a la prevista; esto podría deberse a que los cálculos de la tasa de eventos esperada y del tamaño muestral se basaron en estudios previos realizados en la época de los stents metálicos, mientras que la mejora de los SFA actuales puede haber reducido la tasa de eventos clínicos adversos. Segundo, solo se incluyó a pacientes estables que no habían presentado ningún evento adverso en los 12 meses siguientes al implante del SFA; así pues, serán necesarios estudios más inclusivos para evaluar la efectividad del tratamiento con estatinas de alta intensidad en la prevención secundaria de eventos clínicos adversos. Tercero, un seguimiento de 12 meses es relativamente corto para evaluar la influencia del tratamiento con estatinas de alta intensidad en los resultados clínicos de los pacientes tratados con un SFA que están estables. Cuarto, el estudio utilizó un diseño abierto. Quinto, se trató a cada grupo de tratamiento con estatinas diferentes (atorvastatina y pravastatina). Y sexto, no se evaluaron claramente los efectos adversos asociados con las estatinas, como miopatía y lesión hepática.
CONCLUSIONESDebe considerarse la posible conveniencia de mantener continuamente el tratamiento con estatinas de alta intensidad incluso a pacientes con SFA clínicamente estables, en monoterapia con ácido acetilsalicílico y con riesgo bajo de presentar eventos adversos.
FINANCIACIÓNEste estudio ha sido financiado con subvenciones del Korea Healthcare Technology Research & Development Project, Ministerio de Salud y Bienestar, República de Corea (números A085136 y H115C1277), el Mid-career Researcher Program a través de la National Research Foundation financiada por el Ministerio de Educación, Ciencia y Tecnología, República de Corea (número 2015R1A2A2A01002731), Yuhan Corporation, Corea, CJ HealthCare, Corea, Daiichi Sankyo Korea Co, Ltd. y el Cardiovascular Research Center, Seúl, Corea.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Las guías actuales recomiendan mantener continuamente el tratamiento con estatinas de alta intensidad para los pacientes tratados con SFA. Sin embargo, con frecuencia se infrautiliza en la práctica clínica tras la estabilización del paciente al que se ha implantado un SFA.
- –
En pacientes con un SFA clínicamente estables en monoterapia con ácido acetilsalicílico, el tratamiento con estatinas de alta intensidad redujo de manera significativa los eventos clínicos adversos tardíos respecto al tratamiento con estatinas de baja intensidad tras un seguimiento de 12 meses.