La fibrilación auricular es la arritmia cardiaca más frecuente, con una morbilidad significativa asociada a los síntomas, insuficiencia cardiaca y tromboembolia, que tienen relación con exceso de mortalidad. Durante los últimos 10 años, muchos centros de todo el mundo han descrito unas tasas elevadas de éxitos y pocas complicaciones tras una única intervención de ablación en pacientes con fibrilación auricular paroxística. Estudios recientes indican superioridad a corto y a largo plazo de la ablación percutánea respecto al tratamiento convencional con medicación antiarrítmica, en cuanto a recurrencia de la arritmia, calidad de vida y progresión de la arritmia. En consecuencia, la ablación percutánea se está convirtiendo en un tratamiento de primera línea para muchos pacientes con fibrilación auricular. Sin embargo, en los pacientes con fibrilación auricular persistente de larga evolución, la ablación percutánea es más compleja y laboriosa, y con frecuencia requiere intervenciones repetidas para alcanzar unas tasas de éxito igual de altas que en la fibrilación auricular paroxística. Sin embargo, en un futuro próximo, con más experiencia y el perfeccionamiento de la tecnología, la ablación percutánea de la fibrilación auricular podrá extenderse también a los pacientes con una fibrilación auricular de larga evolución.
Palabras clave
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente y comporta una morbimortalidad significativa, concretamente un aumento del riesgo de ictus y de insuficiencia cardiaca1. Además, la FA progresa de manera natural a una FA persistente en un porcentaje estimado del 15 al 30% en un periodo de 1 a 3 años2, 3, 4, 5, con el consiguiente aumento de los riesgos y las complicaciones. Es bien sabido que la FA dobla la posibilidad de muerte, principalmente debido a la mayor incidencia de episodios tromboembólicos y la aparición de insuficiencia cardiaca. Los objetivos más importantes del tratamiento son evitar las complicaciones arrítmicas graves y la progresión, al tiempo que se mejora la calidad de vida mediante el mantenimiento de un ritmo sinusal estable. Aunque los fármacos antiarrítmicos (FAA) pueden influir en la actividad eléctrica del corazón evitando el inicio y la perpetuación de la arritmia, se ha descrito que los FAA, solos o en combinación, pueden ser eficaces a largo plazo sólo en una minoría de los pacientes con FA. Además, es necesaria una administración crónica para mantener un ritmo sinusal estable, lo que a menudo se asocia a efectos secundarios graves o intolerables que obligan a suspender los FAA. La ablación percutánea de la FA se propuso hace muchos años como alternativa al tratamiento con FAA a largo plazo, pero la ablación de la FA es una intervención relativamente nueva y se desconocen sus resultados a largo plazo. En un gran estudio prospectivo, de seguimiento y no aleatorizado en pacientes con FA paroxística o crónica, realizado por nuestro grupo, se puso de manifiesto por primera vez un efecto beneficioso a largo plazo de la ablación percutánea en cuanto a recurrencia de la arritmia, morbilidad y mortalidad, en comparación con los FAA6. En los últimos años, los resultados obtenidos en estudios aleatorizados han puesto de relieve superioridad a corto plazo de la ablación percutánea respecto a los FAA convencionales en el tratamiento de los pacientes con FA paroxística o crónica7, 8, 9, 10, 11, 12, 13, 14. Tras estos datos alentadores, actualmente se ha establecido una recomendación de clase I para el uso de la ablación percutánea, con un nivel de evidencia A para los pacientes con FA paroxística sintomática y una aurícula izquierda (AI) normal o levemente dilatada y una fracción de eyección ventricular izquierda normal o levemente deprimida1, pero los datos a largo plazo para sustanciar esta recomendación son escasos. Un estudio aleatorizado publicado más recientemente por nuestro grupo15 ha descrito los resultados finales del estudio APAF14, en el que se compararon los FAA y la ablación por radiofrecuencia (ARF) en 198 pacientes a los que inicialmente se asignó aleatoriamente al tratamiento de ablación percutánea (98 pacientes) o FAA (98 pacientes). Los resultados obtenidos a los 4 años de la asignación aleatoria mostraron por primera vez que la ablación percutánea es más eficaz que los FAA crónicos con el empleo de flecainida, sotalol o amiodarona (solos o en combinación) en muchos pacientes asignados inicialmente de forma aleatoria a la ablación percutánea, con nuevas intervenciones en alrededor de una tercera parte de ellos15. En cambio, el tratamiento con FAA convencionales resultó ineficaz o se asoció a efectos cardiacos graves en casi todos los pacientes, y con frecuencia fue necesario un cambio al otro grupo de tratamiento para pasar a la ARF, debido a la arritmia recurrente y las complicaciones asociadas o a la progresión de la arritmia15. En consecuencia, estos nuevos datos aportan mayor respaldo a las recomendaciones recientes, según lo indicado en las guías actuales1, ya que la estrategia de ablación percutánea con intervenciones repetidas según sea necesario, en vez de los FAA crónicos, puede aportar un beneficio a largo plazo en cuanto a arritmia recurrente, complicaciones y calidad de vida. La estrategia de tratamiento crónico con FAA convencionales a las dosis estándar para pasar a la ablación percutánea sólo si el paciente no presenta una respuesta es menos eficaz que la estrategia de utilizar la ARF de entrada15, 16, 17, 18. En el estudio APAF, los pacientes asignados aleatoriamente a la ARF presentaron una mejora significativa a largo plazo de las puntuaciones de calidad de vida al final del estudio, mientras que casi todos los pacientes asignados inicialmente a los FAA y antes de pasar a la ablación percutánea, mostraron peor calidad de vida, que sólo mejoró tras el cambio de grupo de tratamiento para pasar a la ARF15. Así pues, a diferencia del control de la frecuencia o los FAA, la ablación percutánea brinda la posibilidad de una curación duradera y parece apropiado ahora ampliar sus indicaciones. Con el tiempo y la experiencia de los operadores, la ablación percutánea de la FA ha resultado una estrategia muy eficaz para la FA, con unas tasas de éxitos similares en los estudios presentados por varios grupos diferentes.
Estrategia de ablación percutánea en la fibrilación auricularActualmente la ablación percutánea es una de las técnicas en cardiología con un crecimiento más rápido y, dado el elevado número de pacientes con FA que podrían ser candidatos a esta intervención, será preciso dedicar una cantidad importante de recursos para poder tratarlos en los próximos años. No se ha definido todavía una estrategia óptima de ablación que pueda aplicarse con éxito a todas las formas de FA, desde la paroxística a la permanente. El aislamiento de las venas pulmonares (AVP) o la ablación venosa pulmonar circular (AVPC) han surgido como alternativa óptima al empleo crónico de FAA en los pacientes con FA paroxística, dado que un número significativo de los episodios de FA se inicia en el área de las VP19, 20, 21, 22. La efectividad de estas técnicas en estos pacientes es de un 70-90%, pero en alrededor de un 10-25% es necesaria una segunda intervención. La inmensa mayoría de los individuos a los que se practica una ablación de la FA no sufren ninguna complicación; sin embargo, como con cualquier intervención invasiva, estas pueden producirse23. Pueden ser menores, como hemorragia o equimosis en lugares de acceso del catéter (1-2%), muy poco frecuentes; las complicaciones mayores, como ictus, infarto de miocardio o punción de corazón, pulmones o esófago, se dan en menos del 1% de los pacientes. El riesgo de obstrucción de las VP fue motivo de mayor preocupación solamente con el AVP solo, tal como propuso inicialmente el grupo de Burdeos, pero la AVPC tal como nuestro grupo la propuso inicialmente y la técnica actual del AVP reducen al mínimo este riesgo. Si la intervención tiene éxito, el paciente no tiene que continuar tomando FAA y la arritmia se cura definitivamente. Sin embargo, algunos pacientes pueden necesitar medicación antiarrítmica tras la intervención, para prevenir las recurrencias de la FA. Las medicaciones que antes de la ablación de la FA eran ineficaces pueden ser mucho más efectivas tras ella. Las opciones para los pacientes muy sintomáticos y que no responden a la ablación de la FA incluyen las medicaciones para el control de la frecuencia o una ablación del nódulo auriculoventricular (AV) y un marcapasos. Se estima que cada año se realizan muchos miles de intervenciones de ablación de FA en Europa, y su número ha aumentado exponencialmente en los últimos años; la disponibilidad de técnicas y equipamientos más sofisticados ha producido un notable aumento del número de centros en los que se realiza la ablación de la FA. Muchos pacientes están asintomáticos, pero solicitan la ablación percutánea como alternativa a la anticoagulación a largo plazo con warfarina. Los sistemas de obtención de mapas tridimensionales (3D), las técnicas robóticas, las nuevas fuentes de energía y los nuevos catéteres más fiables están facilitando la ablación y mejorando su eficacia y su seguridad20, 21, 22. Una estrategia de ablación óptima como curación permanente para la FA persistente requiere identificar y eliminar todos los focos y sustratos arritmógenos para hacer que desaparezca la FA. Así pues, el enfoque adoptado ante esos pacientes, que ahora se remite cada vez más a la ablación percutánea, está todavía en fase de evolución24. La presencia de fibrosis y de una AI notablemente dilatada se asocia a menor probabilidad de resultado satisfactorio. Por consiguiente, en una población de pacientes de este tipo, es preciso evaluar de manera individualizada los riesgos y beneficios de la intervención. Los excelentes resultados iniciales obtenidos en pacientes con FA paroxística aislada o en pacientes con una cardiopatía estructural mínima alentaron a muchos electrofisiólogos a incluir a pacientes con FA crónica, pero se observaron peores resultados a largo plazo con el empleo de AVP solo24, mientras que los resultados fueron mejores con la AVPC que incluye la aplicación de lesiones lineales adicionales en la AI tras el AVP8. Se puso claramente de manifiesto que la ablación percutánea de los desencadenantes de VP por si sola no es capaz de mantener un ritmo sinusal estable en muchos pacientes con arritmias persistentes, en los que las áreas de conducción lenta permiten la transformación de la actividad ectópica en múltiples circuitos de reentrada y una actividad fibrilatoria continua24. Por eso la ablación lineal adicional, tal como se realizó inicialmente en la AVPC, se ha convertido en una estrategia válida en el tratamiento de los pacientes con FA paroxística o persistente que se aplica de manera creciente en todo el mundo para tratar a los pacientes con FA. Desde 1999, nuestro equipo utiliza la estrategia de ablación lineal bajo guía de sistemas de mapas 3D para reducir la cantidad de tejido disponible para mantener la reentrada en pacientes con FA paroxística o crónica20, 21, 25, 26, 27, 28. En cambio, la imposibilidad de eliminar la FA paroxística en muchos pacientes y el considerable número de recurrencias de la FA persistente tras el AVP solo confirmaron que la reducción del sustrato (o «reducción de masa auricular») mediante ablación lineal debe considerarse un objetivo importante para la eliminación de la FA, incluso en pacientes con FA paroxística, según la hipótesis que planteó por primera vez nuestro grupo20, 21. En nuestra experiencia, el éxito de la ablación lineal requiere un uso amplio de sistemas de mapas 3D que integren la información anatómica y electrofisiológica para evitar posibles lagunas, con lo que se minimizan las complicaciones como las taquicardias auriculares (TA) tras la ablación28. En los pacientes con FA paroxística y una cardiopatía estructural mínima o nula, que constituyen sólo una importante minoría de los pacientes con FA, la aplicación de múltiples lesiones lineales en la AI puede ser innecesaria y, sin el empleo de sistemas de mapas electroanatómicos 3D, pueden ser proarrítmicas en muchos pacientes. Sin embargo, en la gran mayoría de los pacientes con FA que necesitan una ablación lineal tras el AVP, no se puede definir con exactitud las dianas anatómicas con la fluoroscopia sola, debido al número limitado de proyecciones y la variación que se produce de un latido a otro en el contacto del catéter. Además, la validación de las lesiones lineales sin el uso de sistemas 3D puede resultar difícil y laboriosa. En nuestra experiencia, los sistemas electroanatómicos 3D permiten un seguimiento en línea de la punta del catéter, con colocación y rastreo exactos de la lesión, lo cual da lugar a identificación y ablación rápidas de todas las dianas anatómicas con unos tiempos de intervención y de fluoroscopia inferiores y una menor aplicación de energía de RF. Desde 1999, nuestro grupo ha utilizado sistemáticamente la ablación lineal con guía de sistemas electroanatómicos 3D, que aseguran la continuidad y la transmuralidad de las lesiones alrededor de las VP y en cualquier lugar de la AI, lo que se traduce en un mejor resultado, según lo descrito en estudios previos de nuestro grupo en un elevado número de pacientes con FA6, 14, 15, 20, 21. Entre 1999 y 2011 llevamos a cabo más de 25.000 intervenciones de ablación de FA, con unos porcentajes de éxito más altos con una sola intervención al utilizar la estrategia de ablación lineal; otros grupos han confirmado recientemente nuestros excelentes resultados sin el empleo de los sistemas de mapas 3D, aunque se necesitaron nuevas intervenciones para alcanzar un porcentaje de éxitos del 90%. Creemos que el empleo sistemático de sistemas de mapas electroanatómicos 3D es deseable en cualquier laboratorio de electrofisiología moderno para realizar lesiones lineales que reduzcan al mínimo la cantidad de ablación y hagan la intervención más sencilla y menos «ciega» (Figura 1).
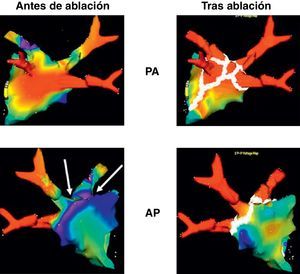
Figura 1. Reconstrucción electroanatómica tridimensional (NavX®) de la aurícula izquierda, antes (izquierda) y después (derecha) de la ablación percutánea en dos proyecciones que muestran el conjunto estándar de lesiones (puntos blancos), tal como se realizan en la ablación venosa pulmonar circular. Se aprecian claramente las porciones tubulares de cada una de las cuatro venas pulmonares en todas las proyecciones. Obsérvese que algunas zonas, como se aprecia en la cara posterior tridimensional, muestran un voltaje bajo (< 0,1 mV, áreas rojas) antes de la ablación, lo cual indica múltiples áreas de fibrosis. AP: proyección anteroposterior; PA: proyección posteroanterior.
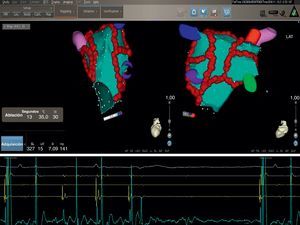
Estrategia de ablación percutánea en la fibrilación auricular paroxísticaLa ablación percutánea se utiliza mucho actualmente como tratamiento definitivo para la FA paroxística1. Generalmente, la inmensa mayoría de pacientes con FA paroxística remitidos a nuestro laboratorio para una ablación percutánea son sintomáticos y presentan recurrencias frecuentes, de cardiopatías estructurales, comorbilidades y aurículas dilatadas; sólo una minoría tiene solamente FA. En una población de pacientes de este tipo, realizamos una AVPC que consiste en un AVP y la aplicación de una ablación lineal adicional, mediante una punta de catéter irrigada guiada con sistemas electroanatómicos 3D para reducir en mayor medida el sustrato de la reentrada (Figura 1, Figura 2, Figura 3). El aislamiento de las VP constituye el primer paso y las lesiones lineales circulares se realizan luego punto a punto para rodear las VP derechas e izquierdas, individualmente o en pares homolaterales, según la anatomía venosa y la preferencia del operador, para desconectar eléctricamente todas las VP (Figura 1, Figura 2, Figura 3). El aislamiento eléctrico distal completo puede conseguirse con el abatimiento del potencial auricular (reducción > 90% de la amplitud del electrograma) y con una reducción de la amplitud del electrograma de < 0,1mV alrededor y dentro de las áreas rodeadas (Figura 2, Figura 3), validada con un catéter de Lasso29. Tras el AVP realizamos otras lesiones adicionales, como una que conecta las dos lesiones circulares que rodean las venas pulmonares y una que conecta el anillo de la válvula mitral con la lesión circular que rodea la VP izquierda. Con lesiones realizadas punto a punto a lo largo de la parte posterior y el techo de la AI entre los dos conjuntos de VP se conectan las VP superiores e inferiores y el anillo de la válvula mitral. La línea del istmo mitral se despliega mediante la creación de una línea de ablación lineal que une el anillo mitral lateral con la VP inferior izquierda (Figura 1) con objeto de reducir en mayor medida el sustrato, así como prevenir las TA izquierdas de macrorreentrada tras la ablación28. Conseguir que la línea del istmo mitral sea completa (bloqueo bidireccional de la conducción en el istmo mitral) es un objetivo clave y debe validarse durante un marcapasos de seno coronario (SC) mediante mapas endocárdicos y del SC, buscando potenciales dobles ampliamente espaciados a través de la línea del bloqueo, confirmados mediante marcapasos diferencial28. La ablación del istmo mitral y la validación del bloqueo pueden resultar difíciles, pero con el empleo sistemático de los sistemas 3D se asegura la estabilidad del catéter y sólo excepcionalmente se necesita una ablación en el interior del SC para conseguir el bloqueo del istmo mitral. Durante la intervención, se eliminan todos los reflejos vagales, lo cual potencia la eficacia de la intervención en cuanto a los resultados a largo plazo (Figura 4). En una minoría de pacientes se identifican desencadenantes que no están en las VP. Si la FA persiste tras el AVP y las lesiones estándar adicionales o la identificación de posibles puntos desencadenantes fuera de las VP, se realiza una cardioversión eléctrica, que da resultado en todos los pacientes.
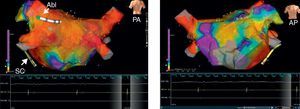
Figura 2. La figura muestra mapas de voltaje bipolares electroanatómicos tridimensionales con el empleo del sistema de fusión NavX® en dos proyecciones después de una ablación venosa pulmonar circular estándar. Hay un abatimiento significativo del voltaje evidente en las áreas abordadas tal como se hace en la ablación venosa pulmonar circular. No se observa abatimiento del potencial en la pared anterior (panel de la derecha). Los voltajes están codificados con colores según las correspondientes barras de colores. En la escala de colores, el rojo corresponde a los potenciales de voltaje mínimo (valor de corte bipolar, < 0,1 mV), mientras que el violeta corresponde a las áreas de potenciales más altos. Abl: ablación; AP: proyección anteroposterior; PA: proyección posteroanterior; SC: seno coronario.
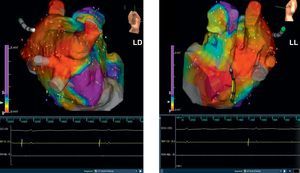
Figura 3. Mismo paciente que en la figura 2 . Se muestran los mapas de voltaje electroanatómicos tridimensionales después de una ablación venosa pulmonar circular en las proyecciones lateral derecha y laterolateral. LD: lateral derecha; LL: laterolateral.
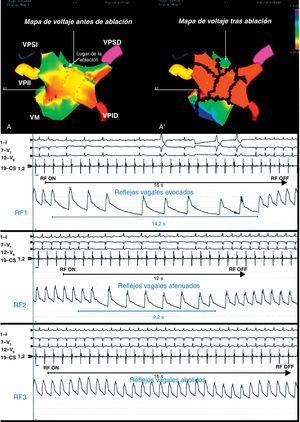
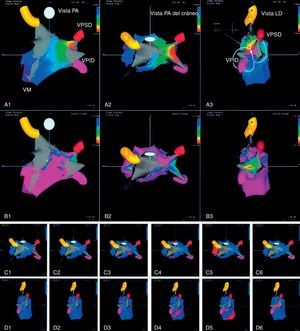
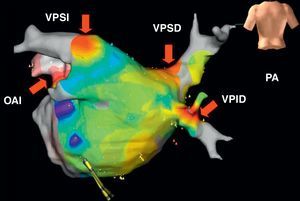
Figura 4. Mapas de voltaje electroanatómicos tridimensionales previo a la ablación (A) y posterior a ella (A’), en un paciente con reflejos vagales evocados y abolidos alrededor de la vena pulmonar superior izquierda (flecha). Reproducido con permiso de Pappone et al 22 . RF: radiofrecuencia; VM: válvula mitral; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Estrategia de ablación percutánea en la fibrilación auricular persistenteAunque propusimos el uso de la ablación percutánea como tratamiento de primera línea en algunos pacientes con FA seleccionados, no creemos que esta estrategia de tratamiento deba ofrecerse en primer lugar a todos los pacientes con FA, puesto que su posible beneficio depende en gran medida del operador, sobre todo en los pacientes con FA persistente. Dado que el AVP en la arritmia persistente puede asociarse a unas tasas de recurrencia elevadas, en los últimos años se han propuesto estrategias de ablación basadas en nuevas hipótesis, entre las que se encuentran la ablación lineal adicional tras el AVP, para mejorar los resultados a largo plazo de esta población de pacientes. En un estudio multicéntrico y aleatorizado7, nuestro grupo demostró por primera vez la utilidad de las lesiones lineales adicionales en pacientes con FA crónica. En este enfoque escalonado, que incluye múltiples lesiones lineales secuenciales después del AVP, las áreas críticas se identifican secuencialmente mediante el impacto de la ablación en la prolongación de la longitud del ciclo (LC) de la FA, de manera que la aurícula deja de ser capaz de sostener el proceso fibrilatorio y la arritmia se interrumpe, bien por conversión directa a ritmo sinusal o, con mayor frecuencia, a una TA, que puede localizarse en el mapa para realizar una ablación definitiva. La validación de las líneas mediante bloqueo bidireccional puede ser difícil, pero es necesaria porque el bloqueo incompleto facilita el desarrollo de la TA tras la ablación. El objetivo de la intervención es la reversión a un ritmo sinusal o a una TA intermedia; si no se alcanza este objetivo tras la primera lesión lineal, se realizan nuevas lesiones. En la actualidad, la estrategia escalonada ha pasado a ser el enfoque estándar utilizado en los pacientes con una FA persistente de larga duración en muchos laboratorios, incluido el nuestro.
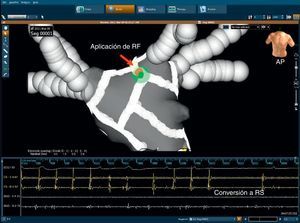
Ablación del seno coronario epicárdicaLa ablación en el interior del SC (ablación epicárdica) se realiza si persisten potenciales del SC. Generalmente las aplicaciones de RF se inician distalmente (a las cuatro del reloj en una proyección oblicua anterior izquierda) y van hasta el ostium abordando potenciales locales, rápidos, bruscos y fraccionados (Figura 5). Se despliegan otras aplicaciones adicionales de RF alrededor del ostium del SC originado en la aurícula derecha. La potencia aplicada se limita a un máximo de 25 W y la irrigación se ajusta manualmente para alcanzar el ajuste de potencia deseado. La desconexión del SC se valida mediante la disociación o eliminación de los potenciales bruscos en los primeros 3 cm.
Figura 5. Mapas electroanatómicos con el empleo del sistema CartoMerge® en dos proyecciones (laterolateral en la izquierda y posteroanterior en la derecha) en un paciente con fibrilación auricular persistente. Al final del conjunto estándar de lesiones (líneas de puntos rojos), realizadas con ablación venosa pulmonar circular, la fibrilación auricular muestra una conversión a una taquicardia auricular intermedia. Inmediatamente después de iniciada la aplicación de radiofrecuencia en el ostium del seno coronario (punta del catéter de ablación en rojo), la taquicardia auricular se interrumpe, con restablecimiento del ritmo sinusal.
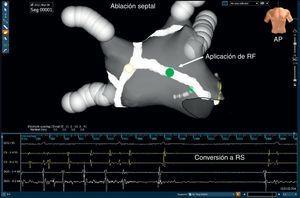
Ablación del tabiqueLa ablación lineal del tabique interauricular se realiza a criterio del operador en los lugares de actividad eléctrica continua, actividad fraccionada compleja y áreas de LC más corto que la LC media de la orejuela auricular izquierda (OAI). La aplicación de la RF se inicia en la cara anterior de la lesión que rodea la VP superior derecha y llega al anillo mitral anterior (Figura 6). Al igual que en la ablación del SC, el objetivo es la eliminación de los electrogramas locales o, alternativamente, la prolongación de la LC en esa región; la validación del bloqueo completo de la conducción a través de esa lesión no se realiza de manera sistemática. Durante la ablación del tabique anterior, hay que evitar las aplicaciones de RF cerca del haz de His.
Figura 6. Un mapa electroanatómico, obtenido con el empleo del sistema NavX® (gris) en una proyección con inclinación anteroposterior en un paciente con fibrilación auricular persistente, muestra una línea de ablación en el tabique (blanco) que, tras la aplicación de la radiofrecuencia en la parte media del tabique (punto verde), revirtió a ritmo sinusal mediante una taquicardia auricular intermedia. AP: proyección anteroposterior; RF: radiofrecuencia; RS: ritmo sinusal.
Ablación de la aurícula izquierdaLa ablación se realiza habitualmente empezando en la lesión que rodea la VP superior izquierda y ampliando luego la lesión en sentido inferior y superior. El objetivo es la eliminación completa de los electrogramas endocárdicos locales que limitan la OAI (posterior, inferior y anterior) para aumentar la LC de los potenciales bruscos que se observan de manera característica en la OAI (Figura 7).
Figura 7. Un mapa electroanatómico con el empleo del sistema NavX Dyne CT® (gris) en un paciente con fibrilación auricular persistente (proyección anteroposterior). Obsérvese que al final de la orejuela auricular izquierda, la fibrilación auricular/taquicardia auricular rodeada revirtió a ritmo sinusal. AP: proyección anteroposterior; RF: radiofrecuencia; RS: ritmo sinusal.
Ablación del seno coronario endocárdicaLa ablación lineal se realiza empezando a lo largo de la cara endocárdica del SC y se completa desde el interior del vaso. El catéter de ablación se arrastra a lo largo del endocardio de la parte inferior de la AI, en paralelo con el catéter del SC. La aplicación de RF empieza en la parte inferior de la AI, a lo largo del anillo mitral posterior, y avanza hasta cerca del ostium del SC llegando a la parte lateral de la AI (a las cuatro del reloj en la proyección oblicua anterior izquierda). El objetivo es la eliminación completa de los potenciales bruscos fraccionados y rápidos en el interior del SC.
Ablación de la aurícula derecha linealEn una minoría de pacientes (< 10%) hay zonas auriculares situadas fuera de la AI, como la aurícula derecha o la vena cava superior, que pueden ser causa de la posible perpetuación de la FA. Las diferencias de LC entre la orejuela auricular derecha y la OAI (LC medida en la aurícula derecha inferior [> 20 ms] a la medida en la AI) pueden indicar que se debe obtener un mapa y realizar una ablación en la aurícula derecha. Puede desplegarse una lesión lineal entre la vena cava inferior y el istmo del anillo tricuspídeo para crear un bloqueo de conducción bidireccional a través del istmo. La validación del bloqueo bidireccional se realiza durante el ritmo sinusal. No se realiza sistemáticamente un aislamiento de la vena cava superior, sino sólo en presencia de focos arritmógenos.
Monitorización de la longitud del ciclo de la fibrilación auricularEl efecto de las aplicaciones de RF es objeto de una monitorización continua mediante la determinación de los cambios de la LC de la FA antes y después de cada paso de ablación, promediando 10 ciclos consecutivos y en el momento de la interrupción de la FA. La LC de la FA se determina desde dentro del SC y las orejuelas auriculares derecha e izquierda. Se considera que determinada localización tiene un impacto significativo si su ablación da lugar a una interrupción de la FA o a la prolongación de la LC de la FA (evaluada en la OAI excepto si se especifica lo contrario) en 20 ms o más, en comparación con la LC máxima de la FA durante los pasos previos. Aunque una secuencia específica no es crucial, en nuestra experiencia, el SC, el tabique interauricular y la base de la OAI son áreas clave para la interrupción de la FA, y se debe incluirlas a todas en cualquier estrategia de ablación lineal para la FA persistente (Figura 6, Figura 7).
Taquicardias auriculares de nuevo inicio tras la ablaciónEn la FA paroxística, el AVP o la AVPC pueden dar lugar al desarrollo de TA de nuevo inicio tras la ablación en una minoría de casos, lo que depende sobre todo de la presencia de lagunas residuales en las líneas de lesión. En nuestra experiencia con la AVPC, las TA tras la ablación son transitorias, pero en alrededor del 5% de los casos son incesantes y mal toleradas, por lo que requieren una reintervención con un mapa de activación para eliminarlas. Los mapas de activación convencionales o electroanatómicos 3D han demostrado que muchas TA tras ablación en pacientes con FA paroxística son de macrorreentrada (Figura 8), pero en algunos pacientes se encuentra un mecanismo focal o multifocal (Figura 9). En pacientes con FA persistente, las lesiones lineales secuenciales pueden facilitar la interrupción de la FA, pero también la transición a una o más TA, lo cual no constituye necesariamente un fenómeno proarrítmico, sino un paso necesario antes del restablecimiento del ritmo sinusal. Nuestro grupo utiliza sistemáticamente mapas 3D en el tratamiento de los pacientes con FA persistente, puesto que permiten un análisis en línea y la obtención de un mapa en color de las TA. Si la arritmia para la que se establece el mapa es una TA focal, el momento de activación más temprano es el del lugar de la ablación. En los lugares en que la ablación de la TA local es satisfactoria, generalmente el electrograma bipolar más temprano en la región roja precede a la onda P en al menos 30 ms. Sin embargo, las TA de macrorreentrada requieren un mapa exacto y una interpretación cuidadosa de los mapas de activación codificados con colores. Si se ha obtenido un mapa completo de todo el circuito de la TA de macrorreentrada, el área roja (la activación más temprana) debe estar adyacente a una zona púrpura (la activación más tardía) para completar el circuito. En nuestro laboratorio, generalmente obtenemos al menos 150 puntos para las TA de macrorreentrada y menos de 100 puntos para las focales, y generalmente se elige un electrograma auricular intracardiaco estable. La transición de la TA depende principalmente de la cantidad de área de ablación y su aparición es más frecuente en los pacientes en quienes se realiza una ablación más extensa. En el momento de la transición de la TA, suele realizarse un mapa de activación convencional con ritmo de marcapasos de encarrilamiento (entrainment) para incluir o excluir la macrorreentrada como mecanismo de la arritmia. En nuestra experiencia, durante una ablación amplia escalonada, se produce una prolongación gradual de la LC de la FA, de manera que los incrementos máximos se observan durante las aplicaciones de RF en el tabique interauricular, la región del SC y la región de la OAI, lo que en muchos casos conduce a la conversión a RS sin una TA intermedia. Las TA tras ablación suelen ser macrorreentradas perimitrales o de la línea del techo28, 30 y excepcionalmente afectan al istmo cavotricuspídeo; las TA focales se observan con menor frecuencia y en muchos casos están situadas en las VP o en la OAI28, 30. En muchos centros experimentados, una estrategia de ablación escalonada es un enfoque útil para el tratamiento de los pacientes con una FA persistente de larga evolución, aurículas dilatadas y comorbilidades. Sin embargo, generalmente se necesitan intervenciones repetidas para alcanzar unos porcentajes de éxito elevados. Así pues, la ablación percutánea temprana que incluye AVP y una ablación lineal menos amplia que la que se realiza en la AVPC puede considerarse una nueva indicación en pacientes con FA y riesgo de progresión rápida a FA persistente.
Figura 8. Mapas de activación (A1-A3), voltaje (B1-B3) y propagación (C1-C6, D1-D6) de una taquicardia auricular izquierda de macrorreentrada, con un istmo crítico entre las venas pulmonares superior derecha e inferior derecha. Reproducido con permiso de Pappone et al 28 . LD: proyección lateral derecha; PA: proyección posteroanterior; VM: válvula mitral; VPID: vena pulmonar inferior derecha; VPSD: vena pulmonar superior derecha.
Figura 9. Un mapa de activación electroanatómico con el empleo del sistema NavX Dyne CT® en una proyección posteroanterior en un paciente con fibrilación auricular persistente, que muestra taquicardias auriculares multifocales originadas en las venas pulmonares y la orejuela auricular izquierda (flechas rojas). En la escala de colores, las zonas de color rojo indican los lugares de activación más temprana y de ablación satisfactoria. OAI: orejuela auricular izquierda; PA: proyección posteroanterior; VPID: vena pulmonar inferior derecha; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Perspectivas futurasDadas las dificultades que plantea el tratamiento farmacológico antiarrítmico y anticoagulante a largo plazo, creemos que la ablación percutánea pasará a ser un tratamiento de primera línea para muchos pacientes con FA. Ya se han alcanzado porcentajes de éxito elevados con una sola intervención en muchos centros de todo el mundo en la FA paroxística, con el empleo de mapas manuales y a distancia y una ablación31, 32, 33, 34, pero en la FA persistente de larga evolución, la estrategia de ablación percutánea es más compleja y laboriosa, y a menudo requiere intervenciones repetidas para alcanzar un porcentaje de éxitos igual de alto que en la FA paroxística. En un futuro próximo, con más experiencia y la evolución de la tecnología, es posible que la ablación percutánea de la FA pueda extenderse también a los pacientes con FA de larga evolución; sin embargo, creemos que identificar y evaluar la cantidad de cicatrización o fibrosis de la AI es crucial para evitar intervenciones innecesarias en esta población de pacientes.
Conflicto de interesesEl Prof. Carlo Pappone tiene relación con Biotronik y St. Jude Medical. El Dr. Vincenzo Santinelli no tiene ningún conflicto de intereses.
Recibido 15 Diciembre 2011
Aceptado 17 Diciembre 2011
Autor para correspondencia: Dipartimento di Aritmologia, Maria Cecilia Hospital, Via Corriera 1, 48010 Cotignola, Rávena, Italia. cpappone@gvm-vmc.it