Está demostrado que el oxigenador extracorpóreo de membrana (ECMO) es una terapia eficaz que proporciona asistencia pulmonar y circulatoria a pacientes en situación de shock cardiogénico refractario y/o insuficiencia respiratoria grave1. Aunque en un principio esta terapia estaba limitada a algunos centros terciarios con trasplante, en los últimos años, muchos centros han iniciado un programa de ECMO. El desarrollo de los nuevos dispositivos, mucho más compactos, permite trasladar con relativa comodidad a pacientes en situaciones críticas en unas condiciones hemodinámicas más favorables y seguras. En este sentido, la creación de unidades móviles de personal entrenado que implante una asistencia in situ, seguida de estabilización y transporte a un centro especializado, permite ofrecer a estos pacientes una posibilidad de supervivencia2.
En octubre de 2013, el Hospital Universitario de Salamanca puso en marcha su programa de ECMO, que se hizo extensivo a un programa de ECMO móvil desde junio de 2014. Realizamos un análisis retrospectivo de pacientes ingresados con soporte con ECMO. Durante ese tiempo se han realizado 9 traslados interhospitalarios en ECMO. El objetivo de este trabajo es evaluar la factibilidad y la seguridad de un programa de transporte interhospitalario de pacientes críticos en ECMO. Se describen los problemas logísticos, las indicaciones, las complicaciones y la evolución de nuestra serie.
Nuestro programa de ECMO móvil tiene en cuenta 2 posibilidades: la primera es trasladar a cualquier paciente en ECMO desde nuestro hospital a un centro de referencia para trasplante cardiaco o pulmonar. En ese caso, el equipo está formado por un perfusionista, un médico y un enfermero expertos en ECMO; la segunda posibilidad es desplazar un equipo a un centro sin programa de ECMO con el objetivo de implantar allí la asistencia y a continuación trasladarlo a nuestro centro. En tal caso, al equipo previo se añade un médico experto en canulación que, en función del tipo, será un cardiólogo o un cirujano. Los tiempos de atención en nuestro programa son < 90 min desde la decisión de puesta en marcha del equipo hasta su salida, y este está disponible permanentemente todos los días del año.
El desplazamiento se realiza en ambulancia de soporte vital avanzado. El dispositivo utilizado es el CARDIOHELP-system (MAQUET-Cardiopulmonary-AG; Alemania). La canulación es periférica según técnica de Seldinger con acceso femoral. Las cánulas van desde los 17-21 Fr arteriales y los 21-29 Fr venosas. Se realiza canulación de la arteria femoral superficial con catéter de 6-7 Fr guiado por eco-Doppler para la perfusión de la extremidad distal. El control del implante se realiza mediante ecocardiograma transesofágico. Los transportes se realizan con el paciente sedoanalgesiado y conectado a ventilación mecánica.
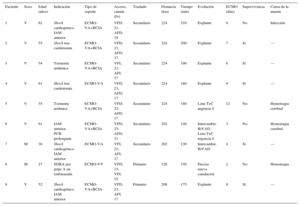
Desde octubre de 2013 hasta agosto de 2016, 9 pacientes en estado crítico (7 varones y 2 mujeres; media de edad, 51,7 ± 11,7 [intervalo, 27-62] años) requirieron traslados en ECMO. En 2 casos el equipo se trasladó a otros centros para el implante del ECMO, y en el resto los pacientes se trasladaron desde nuestro hospital a otros centros con trasplante cardiaco. Las características demográficas y las causas que generaron la necesidad del soporte circulatorio/pulmonar se resumen en la tabla. La indicación más frecuente fue shock cardiogénico por infarto de miocardio en 4 casos (44,4%). Ocho pacientes precisaron soporte con ECMO venoarterial; 6 de ellos, también balón de contrapulsación intraaórtico, y en 1 caso, se implantó un ECMO venovenoso por síndrome de distrés respiratorio agudo. En 7 casos la canulación fue percutánea y en 2 casos de shock tras cardiotomía, que se realizó mediante abordaje quirúrgico. La distancia media recorrida fue 206,4 ± 31,7 km y el tiempo medio de transporte, 172,8 ± 27,3min. Los pacientes no sufrieron complicaciones ni morbimortalidad relacionada con el transporte, ni hubo complicaciones logísticas/técnicas relacionadas con el dispositivo. El tiempo medio en soporte fue de 6,7 (2-12) días. La supervivencia hospitalaria fue del 55,6%, y todos los pacientes estaban vivos al momento de redactarse este texto. Las causas de muerte más frecuentes fueron las complicaciones hemorrágicas (75,0%) y las infecciones (25,0%). Se consiguió realizar el destete del ECMO en el 55,6% de los pacientes, aunque el paciente 1 acabó falleciendo 2 semanas después por una sepsis secundaria a una neumonía; 2 pacientes (casos 6 y 7) precisaron más tiempo de soporte, por lo que se lo cambió a una asistencia biventricular de más larga duración; solo la paciente 7ha sobrevivido; 2 pacientes fallecieron en lista de trasplante (urgencia 0) por complicaciones hemorrágicas.
Características demográficas y variables en relación con el traslado y la evolución de los pacientes incluidos
| Paciente | Sexo | Edad (años) | Indicación | Tipo de soporte | Acceso, cánula (Fr) | Traslado | Distancia (km) | Tiempo (min) | Evolución | ECMO (días) | Supervivencia | Causa de la muerte |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | V | 62 | Shock cardiogénico. IAM anterior. | ECMO-VA+BCIA | VFD, 21; AFD, 19 | Secundario | 224 | 210 | Explante | 9 | No | Infección |
| 2 | V | 55 | Shock tras cardiotomía | ECMO-VA+BCIA | VFD, 21; AFD, 17 | Secundario | 224 | 200 | Explante | 7 | Sí | — |
| 3 | V | 54 | Tormenta arrítimica | ECMO-VA+BCIA | VFI, 21; AFI, 17 | Secundario | 224 | 190 | Explante | 6 | Sí | — |
| 4 | V | 61 | Shock tras cardiotomía | ECMO-VA | VFD, 23; AFD, 17 | Secundario | 224 | 180 | Explante | 9 | Sí | — |
| 5 | V | 55 | Tormenta arrítmica | ECMO-VA+BCIA | VFD, 23; AFD, 17 | Secundario | 224 | 180 | Lista TxC urgencia 0 | 12 | No | Hemorragia cerebral |
| 6 | V | 61 | IAM anterior. PCR prolongada | ECMO-VA+BCIA | VFD, 23; AFD, 21 | Secundario | 202 | 140 | Intercambio BiVAD. Lista TxC urgencia 0 | 3 | No | Hemorragia cerebral |
| 7 | M | 38 | Shock cardiogénico. IAM anterior | ECMO-VA | VFI, 21; AFI, 17 | Secundario | 202 | 130 | Intercambio BiVAD | 4 | Sí | — |
| 8 | M | 27 | SDRA por gripe A en embarazada | ECMO-VV | VFD, 23; VFI, 19 | Primario | 126 | 150 | Precisa nueva canulación | 2 | No | Hemorragia |
| 9 | V | 52 | Shock cardiogénico. IAM anterior | ECMO-VA+BCIA | VFD, 23; AFI, 17 | Primario | 208 | 175 | Explante | 8 | Sí | — |
AFD: arteria femoral derecha; AFI: arteria femoral izquierda; BCIA: balón de contrapulsación intraaórtico; BiVAD: asistencia biventricular; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; ECMO-VV: oxigenador extracorpóreo de membrana venovenoso; IAM: infarto agudo de miocardio; M: mujer; PCR: parada cardiorrespiratoria; SDRA: síndrome de distrés respiratorio agudo; TxC: trasplante cardiaco; V: varón; VFD: vena femoral derecha; VFI: vena femoral izquierda.
Un porcentaje de pacientes en situación crítica no responden a tratamiento convencional y se tiene que transferirlos a centros con más dotación técnica. En muchos casos, estos traslados se realizan en condiciones de inestabilidad hemodinámica, con el consiguiente aumento del riesgo3. En estos escenarios, la aparición del ECMO proporciona un soporte circulatorio y respiratorio que facilita y mejora el pronóstico. Son muchos los datos publicados de transporte interhospitalario en ECMO2,3, pero en nuestro país los datos son escasos. Grupos con grandes volúmenes indican mínimas complicaciones y pequeñas tasas de mortalidad durante el traslado, en torno al 0,5%3. Nosotros no hemos tenido ninguna complicación durante estos traslados.
No existe una definición estandarizada de «centro-ECMO», pero diferentes publicaciones hablan de un mínimo de 20 casos/año para una adecuada curva de aprendizaje y una disminución de la mortalidad a partir de 30 casos/año4.
La experiencia creciente en nuestro centro en el uso de ECMO hizo que extendiésemos su uso para otro tipo de indicaciones menos habituales como ya publicamos previamente en la Revista5. La intención de este trabajo es mostrar nuestra experiencia en el traslado interhospitalario de pacientes en soporte con ECMO. Se trata de una opción segura y eficaz para el transporte de pacientes inestables. Su generalización podría facilitar la creación de redes asistenciales para el tratamiento del shock en nuestro país con la intención de centralizar la experiencia y mejorar su pronóstico.