La trombosis del stent (TS) es una complicación infrecuente pero potencialmente grave. La tomografía de coherencia óptica (OCT) ofrece imágenes de alta resolución e información adicional a la angiografía en el estudio de esta enfermedad.
MétodosEstudio prospectivo en el que se incluyó a todos los pacientes con una TS a los que se realizó una OCT durante el procedimiento.
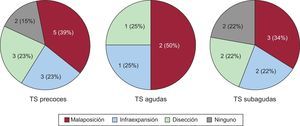
ResultadosSe incluyó a un total de 40 pacientes con TS consecutivos, con una media de edad de 69 ± 13 años; el 83% eran varones. Las TS fueron precoces (≤ 30 días) en 16 pacientes y tardías (> 30 días) en 24. En 17 pacientes la TS se produjo en stents convencionales y en 23, en farmacoactivos. En 34 casos (85%) se realizó estudio con OCT en el momento de la TS. En las TS precoces, el mecanismo predominante (39%) fue la malaposición del stent. En las TS tardías se observaron frecuentemente (46%) struts no recubiertos y áreas de malaposición (17%), especialmente en pacientes con stents farmacoactivos. Además, la presencia de neoateroesclerosis fue muy elevada (67%) en los pacientes con TS tardía. Tras la intervención se observó una mejora en la longitud de la malaposición y la cantidad de trombo en el stent.
ConclusionesLa OCT permite conocer los mecanismos subyacentes potencialmente implicados en la TS y guiar el intervencionismo en estos pacientes. La reintervención disminuye el área y la longitud de la malaposición, así como la cantidad de trombo residual.
Palabras clave
Vídeo del artículo

La trombosis del stent (TS) supone una complicación rara pero grave del intervencionismo coronario, con una incidencia que se sitúa en torno al 1%1–5. A pesar de un tratamiento precoz adecuado, esta afección conlleva una elevada morbimortalidad1–5. La TS incluye 4 categorías: aguda (< 24 h), subaguda (de 24 h a ≤ 30 días), tardía (de > 30 días a 1 año) y muy tardía (> 1 año)3–5. Su mecanismo fisiopatológico puede ser muy variado1–5. Estudios previos establecen mecanismos patológicos diferentes en función de si se trata de un stent convencional (SC) o un stent farmacoactivo (SFA), así como atendiendo al tiempo desde el implante del stent hasta el evento clínico3–5. Varios trabajos han observado que las principales causas de las TS precoces (agudas y subagudas, ≤ 30 días) son la infraexpansión y/o malaposición del stent. A su vez, se ha señalado que la neoateroesclerosis con rotura de placa podría tener un papel muy importante en las TS muy tardías3–5.
La angiografía convencional es insuficiente para determinar las causas íntimas que condicionan la TS. Diferentes investigadores han utilizado la ecografía intracoronaria para obtener información morfológica adicional y detectar problemas mecánicos en estos pacientes4. La mayoría de estos problemas no se identifican con la angiografía4–9. Más recientemente, la tomografía de coherencia óptica (OCT), con mayor resolución y calidad de imagen, ha permitido realizar un análisis mucho más preciso de las posibles causas de la TS. Sin embargo, debido a lo infrecuente de esta complicación, los datos disponibles hasta el momento son muy escasos10,11.
El objetivo de este trabajo es estudiar el uso de la OCT en los pacientes que sufren una TS analizando datos relevantes que pueden ayudar a identificar las características anatómicas potencialmente relacionadas con esta temible complicación.
MÉTODOSPacientes e intervencionismoDesde octubre de 2013 hasta marzo de 2016, se incluyó a todos los pacientes consecutivos que ingresaron en nuestro centro con diagnóstico de TS. Durante ese tiempo, se siguió un protocolo prospectivo y sistemático que incluía la realización de una OCT antes y después del procedimiento. Lo primordial era garantizar la seguridad de los pacientes y solo se realizó en caso de que la situación clínica y hemodinámica lo permitiera. Si presentaban un flujo TIMI (Thrombolisis in Myocardial Infarction) 0-1 tras la administración intracoronaria de nitroglicerina y cruce de la guía de angioplastia, se realizó sistemáticamente tromboaspiración con un dispositivo de 6 Fr. Si esta maniobra no era capaz de conseguir un flujo anterógrado adecuado, se avanzaba un balón de pequeño diámetro (≤ 2 mm) hasta el segmento ocluido y se inflaba a bajas presiones.
No se establecieron criterios específicos para guiar el intervencionismo, y se dejó la elección del tratamiento empleado en cada caso al juicio del cardiólogo intervencionista.
El diagnóstico de TS se realizó según los criterios del Academic Research Consortium12. Todos los pacientes incluidos cumplían criterios angiográficos de TS «definitiva» y se los trató de manera acorde con la guía de práctica clínica sobre revascularización1.
Se informó del protocolo del estudio a todos los participantes, que firmaron el consentimiento informado. El comité ético del hospital aprobó el estudio.
Tomografía de coherencia ópticaTodos los estudios se realizaron con el sistema de OCT Frecuency Domain (Dragon Fly, Light Lab, St. Jude Medical; St. Paul, Minnesota, Estados Unidos) mediante técnica no oclusiva, avanzando el catéter 10 mm distal al stent.
Inicialmente se realizó una valoración cualitativa de todas las secuencias de OCT obtenidas para confirmar que su calidad era adecuada para permitir su análisis. Los struts metálicos se identificaron como estructuras brillantes con señal de alta intensidad y sombra posterior. Las medidas del vaso de referencia se tomaron a 5-10 mm de los bordes del stent, intentando que la sección elegida tuviese la menor enfermedad posible4,13. Posteriormente se realizó un análisis morfométrico cuantitativo, con medidas de área y diámetros seccionales. Se midió el área luminal y del stent a lo largo de toda su longitud a intervalos de 1 mm. Se determinó el área luminal mínima y el área mínima del stent antes y después de la intervención. El área de referencia media se calculó como la media de las áreas de referencia proximal y distal. En los casos en que la retirada no incluía imágenes de los segmentos proximales y distales, se utilizó únicamente el área de referencia que estaba visible. El índice de expansión del stent (IES) se calculó como el área mínima del stent dividida por el área de referencia media13.
En todos los cortes se evaluó la presencia de trombo, el recubrimiento de los struts, la malaposición y la presencia de neoateroesclerosis13. Se excluyeron todas las secciones en que la presencia de trombo no permitía estudiar adecuadamente al menos 2 cuadrantes de la circunferencia del vaso. Se estudió el área máxima del trombo en la sección que presentaba mayor cantidad de trombo intraluminal. Se consideraron no cubiertos (clásicamente considerados como no endotelizados) los struts si alguna parte de este aparecía directamente expuesta a la luz del vaso, y se contabilizaron los cortes en que al menos un strut del stent se veía como no recubierto. Se definió la malaposición de un strut cuando la distancia axial entre la superficie de este y la superficie del vaso era mayor que el grosor de los struts. Se realizó un análisis longitudinal «imagen a imagen» en el que se contabilizó el número de secciones en los que al menos 1 strut del stent presentaba malaposición, y se determinaron el área y la distancia máxima de malaposición. A su vez, la longitud máxima de malaposición se obtuvo desde la representación longitudinal de la imagen13–15.
Los cambios ateroescleróticos de la neoíntima (neoateroesclerosis) se definieron como la presencia de: a) tejido lipídico dentro del stent (definido como una región con baja señal, de bordes difusos y que causaba atenuación de la señal llegando incluso a ensombrecer los struts del stent); b) fibroateroma (tanto fibroateroma de capa fina [≤ 65 μm] como de capa gruesa [> 65 μm]), o c) neoíntima calcificada.
Dado que algunos estudios previos indican que el mecanismo fisiopatológico de las TS es diferente en función del tiempo transcurrido desde el implante3–5, se dividió la muestra en 2 grupos principales: TS precoces (≤ 30 días) y TS tardías (> 30 días). Además, en todos los casos también se evaluó la causa predominante de la TS considerada como más probable, generalmente asociada a la zona de mayor trombo. Se especificaron como posibles mecanismos de TS: malaposición del stent, infraexpansión grave del stent, neoateroesclerosis, disección del borde proximal o distal y la placa rota en el segmento coronario adyacente fuera del stent. En las TS tardías también se consideró como potencial causa la falta de recubrimento de los struts.
Análisis estadísticoLas variables continuas se presentan como media ± desviación estándar o como mediana [intervalo intercuartílico] según su distribución. Se estableció la normalidad de los datos con el test de Kolmogorov-Smirnov. Para determinar las diferencias entre grupos, se usó el test de la t de Student o el test de la mediana (variables continuas) y el test de la χ2, el test exacto de Fisher o el test de McNemar (variables cualitativas). Se consideró estadísticamente significativo un valor de p < 0,05.
RESULTADOSCaracterísticas basalesLas características basales de los pacientes se resumen en la tabla 1. Se incluyó a un total de 40 pacientes con diagnóstico de TS definitiva consecutivos. La media de edad era 69 años, el 83% eran varones y la prevalencia de factores de riesgo cardiovascular era elevada (tabla 1). La mayoría de los stents trombosados eran SFA (58%). La presentación clínica más frecuente fue el infarto agudo de miocardio con elevación del segmento ST (n = 30; 75%), con flujo TIMI 0 (n = 32; 80%), y el vaso más frecuentemente afectado fue la arteria descendente anterior (n = 19; 48%). No se observaron diferencias estadísticamente significativas en cuanto a las características clínicas entre el grupo de pacientes con TS precoces (≤ 30 días) y el de TS tardías (> 30 días), salvo mayor frecuencia de pacientes hipertensos en el primero. Los tratamientos finales de la TS más frecuentemente utilizados fueron el implante final de un nuevo stent (n = 18; 45%) y la dilatación con balón exclusivamente (n = 13; 33%) (tabla 1).
Características basales y angiográficas de los pacientes con trombosis del stent
| Todos | TS precoces | TS tardías | |||||
|---|---|---|---|---|---|---|---|
| Agudas (< 24 h) | Subagudas (24 h-≤ 30 días) | p | Tardías (> 30 días-1 año) | Muy tardías (> 1 año) | p | ||
| Pacientes, n | 40 | 6 | 10 | 4 | 20 | ||
| Edad (años) | 69 ± 13 | 67 ± 10 | 73 ± 16 | NS | 70 ± 15 | 66 ± 11,4 | NS |
| Varones | 33 (83) | 5 (83) | 7 (70) | NS | 3 (75) | 18 (90) | NS |
| Hipertensión | 27 (68) | 5 (83) | 9 (90) | NS | 0 | 13 (65) | * |
| Dislipemia | 24 (60) | 4 (67) | 5 (50) | NS | 1 (25) | 14 (70) | NS |
| Diabetes mellitus | 15 (38) | 1 (17) | 6 (60) | * | 1 (25) | 7 (35) | NS |
| Fumador | 16 (40) | 3 (50) | 1 (10) | * | 1 (25) | 11 (55) | NS |
| IAM previo | 10 (25) | 2 (33) | 2 (20) | NS | 1 (25) | 5 (25) | NS |
| Cirugía coronaria previa | 3 (8) | 0 | 1 (10) | NS | 0 | 2 (10) | NS |
| Insuficiencia renal | 4 (10) | 1 (17) | 1 (10) | NS | 1 (25) | 1 (5) | NS |
| Presentación clínica | |||||||
| Angina inestable | 1 (3) | 0 | 0 | NS | 1 (25) | 0 | NS |
| IAMSEST | 9 (23) | 0 | 3 (30) | NS | 2 (50) | 4 (20) | NS |
| IAMCEST | 30 (75) | 6 (100) | 7 (70) | NS | 1 (25) | 16 (80) | NS |
| CK máxima | 1.413 ± 2.097 | 960 ± 831 | 1.067 ± 890 | NS | 229 ± 168 | 1.958 ± 2.780 | NS |
| TnT-us máxima | 4.249 ± 5.359 | 3.768 ± 5.325 | 3.773 ± 4.913 | NS | 800 ± 557 | 5.196 ± 5.993 | NS |
| Stent convencional | 17 (43) | 2 (33) | 3 (30) | NS | 0 | 12 (60) | * |
| SFA | |||||||
| SFA 1.a generación | 4 (10) | 0 | 0 | NS | 0 | 4 (20) | NS |
| SFA 2.a generación | 12 (30) | 2 (33) | 6 (60) | NS | 2 (50) | 2 (10) | NS |
| Stents bioabsorbibles | 4 (10) | 2 (33) | 1 (10) | NS | 0 | 1 (5) | NS |
| Desconocido | 3 (8) | 0 | 0 | NS | 2 (50) | 1 (5) | NS |
| Diámetro del stent (mm) | 3 ± 0,5 | 3,4 ± 0,6 | 2,9 ± 0,6 | NS | 3,4 ± 0,2 | 2,8 ± 0,4 | NS |
| Longitud del stent (mm) | 18 ± 7,5 | 16 ± 5 | 18 ± 8 | NS | 11 ± 2 | 20 ± 8 | NS |
| Vaso afectado | |||||||
| Descendente anterior | 19 (48) | 5 (83) | 4 (40) | NS | 2 (50) | 8 (40) | NS |
| Circunfleja | 6 (14) | 0 | 2 (20) | NS | 1 (25) | 3 (15) | NS |
| Coronaria derecha | 15 (38) | 1 (17) | 4 (40) | NS | 1 (25) | 9 (45) | NS |
| Angiografía cuantitativa | |||||||
| Diámetro de referencia proximal (mm) | 2,7 ± 0,5 | 3,2 ± 0,3 | 2,5 ± 0,4 | * | 2,4 ± 0,6 | 2,6 ± 0,6 | NS |
| Diámetro luminal mínimo (mm) | 0,3 ± 0,6 | 0,4 ± 0,9 | 0,5 ± 0,8 | NS | 0,5 ± 1,1 | 0,1 ± 0,3 | NS |
| Estenosis (%) | 89,6 ± 24,1 | 88,5 ± 28,2 | 82,8 ± 29,7 | NS | 77,5 ± 45 | 96,2 ± 11,1 | NS |
| Flujo TIMI | |||||||
| 0 | 32 (80) | 5 (83) | 7 (70) | NS | 3 (75) | 17 (85) | NS |
| 1 | 0 | 0 | 0 | NS | 0 | 0 | NS |
| 2 | 2 (5) | 1 (17) | 0 | NS | 0 | 1 (5) | NS |
| 3 | 6 (15) | 0 | 3 (30) | NS | 1 (25) | 2 (10) | NS |
| Tratamiento antiplaquetario | |||||||
| Ninguno | 6 (15) | 0 | 1 (10) | NS | 1 (25) | 4 (20) | NS |
| Un antiagregante | 16 (40) | 0 | 0 | NS | 0 | 16 (80) | NS |
| Doble antiagregación | 18 (45) | 6 (100) | 9 (90) | NS | 3 (75) | 0 | NS |
| Tratamiento antes de la OCT | |||||||
| Ninguno | 8 (23) | 2 (40) | 2 (25) | NS | 1 (25) | 3 (17) | NS |
| Tromboaspiración | 17 (49) | 2 (40) | 2 (25) | NS | 1 (25) | 12 (66) | NS |
| Dilatación con balón | 1 (3) | 0 | 1 (12) | NS | 0 | 0 | NS |
| Ambos | 9 (25) | 1 (20) | 3 (38) | NS | 2 (50) | 3 (17) | NS |
| Tratamiento de la TS | |||||||
| Tratamiento médico | 4 (11) | 0 | 2 (20) | NS | 1 (25) | 1 (5) | NS |
| Dilatación con balón | 13 (33) | 4 (66) | 4 (40) | NS | 1 (25) | 4 (20) | NS |
| Implante de nuevo stent | 18 (45) | 2 (34) | 4 (40) | NS | 2 (50) | 10 (50) | NS |
| Balón farmacoactivo | 2 (5) | 0 | 0 | NS | 0 | 2 (10) | NS |
| Mortalidad | 6 (15) | 2 (33) | 1 (10) | NS | 0 | 3 (15) | NS |
CK: creatincinasa; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; NS: no significativo; SFA: stent farmacoactivo; OCT: tomografía de coherencia óptica; TIMI: Thrombolisis in Myocardial Infarction; TnT-us: troponina T ultrasensible; TS: trombosis del stent.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
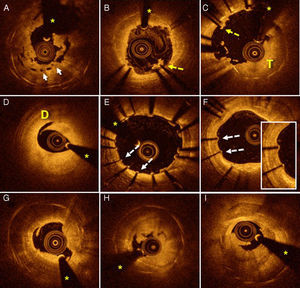
Del total de pacientes ingresados por TS, se realizó OCT basal a 35 (14 con TS precoz y 21 con TS tardía). En 1 paciente con TS precoz, las imágenes de la OCT basal no tenían una calidad adecuada para su interpretación por artefacto de sangre y gran cantidad de trombo. Por ese motivo, finalmente se analizaron los resultados de 34 pacientes. En un 77% de los pacientes fue necesario el uso de tromboaspiración y/o predilatación con balón para recuperar un flujo distal TIMI 2 y obtener una calidad de imágenes de OCT adecuada. La figura 1 muestra ejemplos de OCT en pacientes con TS.
Trombosis del stent valoradas mediante OCT. A: infraexpansión grave de dispositivo vascular bioabsorbible (flechas). B: áreas de malaposición (flecha punteada) con trombo asociado. C: amplias áreas de malaposición (flecha punteada) con gran carga trombótica (T). D: disección importante (D) en el borde distal del dispositivo implantado varias horas antes. E: amplias áreas con déficit de recubrimiento (flechas punteadas) y otras zonas con leve malaposición. F: paciente con TS muy tardía cuya OCT muestra struts no recubiertos (flechas punteadas). G-I: pacientes con TS muy tardía con imágenes de neoateroesclerosis con sombra posterior que borra los struts de los stents; además, imágenes de placa rota con trombo asociado. Los asteriscos corresponden a la sombra causada por el artefacto de la guía. OCT: tomografía de coherencia óptica; TS: trombosis del stent. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
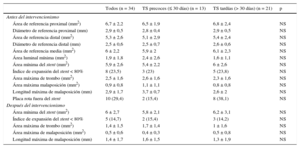
Los datos obtenidos por OCT aparecen en la tabla 2. Antes del tratamiento, el área de referencia media era de 6,0 ± 2,2 mm2 y el área mínima del stent, 5,9 ± 2,6 mm2. Tras el tratamiento se observó un aumento muy ligero en el área mínima del stent (6 ± 2,7 mm2; p = 0,59), incremento que fue algo mayor en el subgrupo de pacientes con TS precoces (pasando de 5,4 ± 2,2 a 5,8 ± 2,1 mm2; p = 0,29) (tabla 2). El número de pacientes con un IES < 0,8 también disminuyó, aunque de nuevo sin diferencias estadísticamente significativas. Se observó un IES < 0,8 en el 24% de los pacientes (n = 8) antes del tratamiento frente al 15% (n = 5) después de la intervención. Asimismo se observó una tendencia a disminución en el porcentaje de cortes con visualización de struts mal apuestos tras el intervencionismo (el 6,8 ± 11,9% antes del intervencionismo frente al 4,2 ± 7% tras él; p = 0,2) y a una disminución en el área de malaposición (0,87 ± 0,8 frente a 0,45 ± 0,6 mm2; p = 0,15). Además, se apreció una disminución significativa en la longitud de la malaposición (2,93 ± 1,7 frente a 1,43 ± 1,7mm; p = 0,015).
Análisis de las lesiones por tomografía de coherencia óptica antes y después del intervencionismo en todas las trombosis del stent
| Todos (n = 34) | TS precoces (≤ 30 días) (n = 13) | TS tardías (> 30 días) (n = 21) | p | |
|---|---|---|---|---|
| Antes del intervencionismo | ||||
| Área de referencia proximal (mm2) | 6,7 ± 2,2 | 6,5 ± 1,9 | 6,8 ± 2,4 | NS |
| Diámetro de referencia proximal (mm) | 2,9 ± 0,5 | 2,8 ± 0,4 | 2,9 ± 0,5 | NS |
| Área de referencia distal (mm2) | 5,3 ± 2,6 | 5,1 ± 2,9 | 5,4 ± 2,4 | NS |
| Diámetro de referencia distal (mm) | 2,5 ± 0,6 | 2,5 ± 0,7 | 2,6 ± 0,6 | NS |
| Área de referencia media (mm2) | 6 ± 2,2 | 5,9 ± 2 | 6,1 ± 2,3 | NS |
| Área luminal mínima (mm2) | 1,9 ± 1,8 | 2,4 ± 2,6 | 1,6 ± 1,1 | NS |
| Área mínima del stent (mm2) | 5,9 ± 2,6 | 5,4 ± 2,2 | 6 ± 2,6 | NS |
| Índice de expansión del stent < 80% | 8 (23,5) | 3 (23) | 5 (23,8) | NS |
| Área máxima de trombo (mm2) | 2,5 ± 1,6 | 2,6 ± 1,6 | 2,3 ± 1,6 | NS |
| Área máxima malaposición (mm2) | 0,9 ± 0,8 | 1,1 ± 1,1 | 0,8 ± 0,8 | NS |
| Longitud máxima de malaposición (mm) | 2,9 ± 1,7 | 3,7 ± 0,7 | 2,6 ± 2 | NS |
| Placa rota fuera del stent | 10 (29,4) | 2 (15,4) | 8 (38,1) | NS |
| Después del intervencionismo | ||||
| Área mínima del stent (mm2) | 6 ± 2,7 | 5,8 ± 2,1 | 6,2 ± 3,1 | NS |
| Índice de expansión del stent < 80% | 5 (14,7) | 2 (15,4) | 3 (14,2) | NS |
| Área máxima de trombo (mm2) | 1,4 ± 1,5 | 1,7 ± 1,4 | 1 ± 1,6 | NS |
| Área máxima de malaposición (mm2) | 0,5 ± 0,6 | 0,4 ± 0,3 | 0,5 ± 0,8 | NS |
| Longitud máxima de malaposición (mm) | 1,4 ± 1,7 | 1,6 ± 1,5 | 1,3 ± 1,9 | NS |
NS: no significativo; TS: trombosis del stent.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
En cuanto a la carga trombótica, se observó una disminución significativa tras el tratamiento (área máxima de trombo, 2,5 ± 1,6 mm2 antes del tratamiento frente a 1,4 ± 1,5 mm2 después; p < 0,001). Estos datos se observaron tanto en el subgrupo de pacientes con TS precoces (2,6 ± 1,6 frente a 1,7 ± 1,4 mm2; p = 0,006) como en el de las tardías (2,3 ± 1,6 frente a 1 ± 1,6 mm2; p < 0,001).
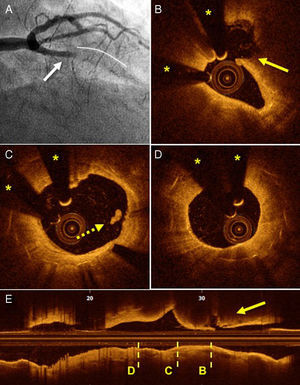
En 8 pacientes (25%) se observó una placa rota fuera del stent. En todos estos casos, la imagen angiográfica era la de una TS clásica que cumplía criterios del Academic Research Consortium. Todos estos pacientes (4 SC y 4 SFA) presentaron TS tardías, mayoritariamente (5 pacientes) muy tardías. En todos estos casos, la placa rota se observó en el segmento coronario proximal al stent, y en 4 de ellos se encontraba a una distancia > 5 mm del borde proximal del stent. En la mayoría de estos casos no se observaron datos de complicación en el stent, aunque en 2 no fue posible descartar completamente que hubiera alteraciones en su borde proximal debido a la presencia de material trombótico con sombra posterior (figura 2).
Angiografía y OCT de un paciente con TS tardía secundaria a placa rota fuera del stent. A: oclusión trombótica de la arteria descendente anterior (flecha) proximal al stent (línea continua). B: imagen de placa rota (flecha) fuera del stent. C: borde proximal del stent completamente recubierto, con imágenes de pequeño trombo (flecha punteada). D: neoateroesclerosis no oclusiva sin datos de rotura intimal. E: corte longitudinal en el que se señalan los cortes transversales correspondientes a las letras B-D. OCT: tomografía de coherencia óptica; TS: trombosis del stent. Los asteriscos corresponden a la sombra causada por el artefacto de la guía. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
No se detectaron complicaciones que se pudiera atribuir directa o indirectamente al uso de la OCT. Se observó una mortalidad hospitalaria total del 15% (n = 6), el 13% (n = 5) de origen cardiovascular, sin diferencias en cuanto al tiempo de la TS.
Trombosis precocesDe los 16 pacientes que sufrieron una TS precoz, 5 tenían 1 SC y 11, 1 SFA (tabla 1). No se observaron diferencias estadísticamente significativas en las variables clínicas y angiográficas entre ambos subgrupos (tabla 1). En 13 de estos pacientes (81%) se obtuvieron imágenes de OCT de calidad adecuada (tabla 2). Los hallazgos más frecuentemente observados fueron la malaposición, la infraexpansión grave y la disección del borde (figura 3).
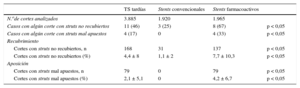
Trombosis tardíasDe los 24 pacientes que presentaron TS tardía, 12 tenían 1 SC y otros 12, 1 SFA (tabla 1). No se observaron diferencias en las variables clínicas o angiográficas entre las trombosis tardías y las muy tardías. En 21 de estos pacientes (88%), se pudo obtener imágenes de buena calidad para su análisis (tabla 2). La tabla 3 muestra los datos de recubrimiento y malaposición de los struts en función del tipo de stent. La mayoría de los pacientes con TS tardías en SFA mostraban al menos 1 sección con struts no recubiertos, mientras que en 1 tercio de los casos había datos de malaposición. En cambio, en las TS tardías de SC, solo 3 pacientes mostraban secciones con struts no recubiertos, mientras que ningún paciente tenía datos de malaposición (tabla 3). Además, analizando el porcentaje de imágenes con struts no recubiertos o mal apuestos, el grupo con SFA presentó un porcentaje significativamente mayor de struts no recubiertos y mal apuestos. De los 11 pacientes con TS tardías con falta de recubrimiento, en 6 la TS ocurrió más de 7 años tras el implante.
Valores de recubrimiento y malaposición de los struts estudiados por tomografía de coherencia óptica en las trombosis del stent tardías
| TS tardías | Stents convencionales | Stents farmacoactivos | ||
|---|---|---|---|---|
| N.ode cortes analizados | 3.885 | 1.920 | 1.965 | |
| Casos con algún corte con struts no recubiertos | 11 (46) | 3 (25) | 8 (67) | p < 0,05 |
| Casos con algún corte con struts mal apuestos | 4 (17) | 0 | 4 (33) | p < 0,05 |
| Recubrimiento | ||||
| Cortes con struts no recubiertos, n | 168 | 31 | 137 | p < 0,05 |
| Cortes con struts no recubiertos (%) | 4,4 ± 8 | 1,1 ± 2 | 7,7 ± 10,3 | p < 0,05 |
| Aposición | ||||
| Cortes con struts mal apuestos, n | 79 | 0 | 79 | p < 0,05 |
| Cortes con struts mal apuestos (%) | 2,1 ± 5,1 | 0 | 4,2 ± 6,7 | p < 0,05 |
TS: trombosis del stent.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Finalmente, en la mayoría de los pacientes con TS tardía, se demostró neoateroesclerosis (n = 14; 67%). No se observaron diferencias en la presencia de este fenómeno según el tipo de stent (SC o SFA). Es interesante que la neoateroesclerosis se detectara asociada a la zona con mayor cantidad de trombo en 11 de los pacientes. Además, en la mayoría de los pacientes con neoateroesclerosis (n = 9), el tiempo trascurrido desde el implante del stent fue > 5 años. La presencia de calcio en el stent fue frecuente (el 50% de los casos). Por último, se observó una mayor proporción de rotura intimal en los casos con neoateroesclerosis (el 93 frente al 71%).
DISCUSIÓNLa incidencia de la TS ha disminuido en los últimos años debido a la mejora en las nuevaeneraciones de stents y los avances en el tratamiento antiagregante concomitante5. Sin embargo, continúa siendo una entidad de gran importancia debido a que la brusca oclusión trombótica del vaso suele ocasionar infartos extensos y elevada mortalidad4. Por consiguiente, conocer los mecanismos fisiopatológicos de este proceso es sumamente importante y, en este sentido, la OCT aporta datos únicos para desvelar el sustrato.
Los principales resultados de nuestro estudio son: a) el uso de la OCT durante la TS es seguro y factible y aporta datos exclusivos sobre el sustrato que no se puede obtener con la angiografía convencional; b) la OCT permite guiar las reintervenciones, disminuir la longitud de la malaposición y visualizar la disminución de la carga trombótica; c) en un número de casos no despreciable, se detectaron imágenes de placa rota fuera del stent; d) en las TS precoces, el principal hallazgo detectado fue la malaposición del stent; e) en las TS tardías, se observó una alta tasa de struts no recubiertos y mal apuestos, hallazgos que fueron muy prevalentes en los pacientes con SFA, y f) la neoateroesclerosis fue muy frecuente en los pacientes con TS muy tardías.
La OCT presenta una mayor resolución que otras técnicas de imagen intracoronaria, pero con 2 limitaciones claras: menor profundidad de la imagen y aparición de sombra detrás de las imágenes de trombo13. Debido a estas limitaciones, el uso de la OCT en situaciones clínicas en que la carga trombótica es muy grande, como la TS, podría ser menos útil.
Nuestro estudio demuestra que la OCT es una técnica segura y factible en este escenario clínico tan adverso. Debido a su alta resolución, a pesar de la presencia de trombo residual en el 85% de los casos se logró realizar un análisis adecuado de la anatomía subyacente. La información aportada fue de gran relevancia para llegar al diagnóstico definitivo de los posibles mecanismos implicados.
Además, el estudio sistemático con OCT tras el intervencionismo en la TS permitió guiar la técnica en un intento de optimizar los resultados finales. A pesar del tamaño relativamente pequeño de la presente serie, en nuestro conocimiento no existen series más amplias en las que se haya analizado sistemáticamente el resultado de la OCT tras la intervención. Nuestros hallazgos apuntan a un aumento muy ligero en el área mínima del stent, una disminución del IES, una reducción del área máxima y la longitud de la malaposición y una importante reducción de la carga trombótica. Algunos estudios previos —con menor número de pacientes, pero que utilizaron protocolos más agresivos de optimización guiada por OCT— demostraron mayores cambios en el stent tras la intervención4. Es posible que la falta de criterios de optimización estrictos y que frecuentemente la infraexpansión se debiera a una calcificación muy grave del vaso expliquen estas diferencias. Son necesarios nuevos estudios para confirmar si una optimización más agresiva de los stents que sufren una TS podría mejorar los resultados clínicos a largo plazo de estos pacientes.
En un 25% de nuestros pacientes se observó una placa rota fuera de stents con buena cobertura que no tenían problemas mecánicos evidentes en su interior. Aunque este fenómeno ya se había descrito, los casos hasta ahora publicados eran anecdóticos16. Los criterios angiográficos actuales para el diagnóstico de TS12 son insuficientes para detectar este fenómeno subyacente, por lo que, en nuestra opinión, la OCT es una herramienta imprescindible para llegar a este diagnóstico. Además, la identificación de esta etiología puede tener importantes implicaciones en el tratamiento de los pacientes con TS. Así, en estos casos, el tratamiento debe limitarse al tratamiento de la placa rota, y no es necesaria una nueva intervención en el stent previamente implantado.
Dividiendo las TS en función del tiempo, se observaron mecanismos fisiopatológicos diferentes, como ya se ha descrito17–19. Así, el hallazgo más frecuente en los pacientes con TS precoces fue la malaposición del stent, tanto en las TS agudas como en las subagudas. Kim et al.18 observaron una alta tasa de struts mal apuestos en pacientes asintomáticos, así como una mayor prevalencia de trombos asociados a estas áreas de malaposición. No existen datos firmes que demuestren de modo fehaciente que la malaposición tras el implante del stent se asocie a una mayor tasa de TS. Tampoco está demostrado que la realización de posdilataciones muy agresivas para corregir la malaposición durante el implante inicial del stent logre disminuir los eventos adversos durante el seguimiento clínico.
Casi la mitad de los pacientes que presentaron una TS tardía tenían struts no recubiertos, mientras que el 17% de ellos mostraban struts mal apuestos. Estudios previos realizados en autopsias han observado que el sustrato más frecuente en la TS tardía es el retraso o la incompleta endotelización de los struts20. Estudios21,22 en pacientes con TS tardías han observado una media de struts no recubiertos del 12-14% y de struts malapuestos del 4-6%. En nuestra serie, el porcentaje de imágenes con struts no recubiertos y malapuestos fueron ligeramente inferiores, el 4,4 y el 2,1% respectivamente. Esto podría deberse a que la presentación de la TS en nuestra serie fue más tardía que en los estudios antes mencionados. Estos datos indican que, aunque la proporción de struts no recubiertos disminuye con el tiempo, este fenómeno puede asociarse con la aparición de TS incluso varios años después del implante del stent. El déficit de recubrimiento o la malaposición fueron más frecuentes en los SFA. Algunos estudios previos ya habían descrito estos hallazgos14,15. En nuestra muestra, podría estar en relación con que el tiempo desde el implante del stent a la TS fue menor en los pacientes con SFA que con SC (mediana, 740 frente a 3.321 días; p < 0,05). Es importante señalar que también se ha descrito la aparición tardía de struts mal apuestos (malaposición adquirida) debido a un remodelado positivo del vaso. Como en nuestra serie no hay datos de OCT tras el implante, no se puede diferenciar entre malaposición persistente y adquirida.
Por último, en nuestro estudio se observó neoateroesclerosis en un elevado porcentaje de casos con TS tardía. Estudios previos ya habían señalado que la neoateroesclerosis podía ser una causa de TS tardía. En el estudio de Taniwaki et al.23, que utilizó OCT en 64 pacientes con trombosis tardía de SFA, se detectó neoateroesclerosis en 1 de cada 4 casos. De nuevo, pensamos que la mayor prevalencia de neoateroesclerosis en nuestro estudio podría deberse al mayor tiempo trascurrido entre el implante del stent y la TS.
LimitacionesEste estudio tiene varias limitaciones importantes. La primera es que no se dispone de un grupo de control. En segundo lugar, no se pudo realizar OCT a algunos pacientes o las imágenes no fueron de suficiente calidad, lo que podría ocasionar un sesgo de selección. La OCT no permite actualmente confirmar la correcta endotelizacion de los struts, ya que no logra esclarecer la composición del tejido que los cubre. Por dicho motivo, en este estudio se ha preferido utilizar el término recubrimiento del strut. Una limitación inherente a la técnica es el efecto sombra que causa el trombo rojo, que inevitablemente conlleva una pérdida de información anatómica. Por otra parte, la valoración del grado de recubrimiento de los struts puede ser especialmente difícil en presencia de trombo, y además un trombo laminar puede ser indistinguible de un recubrimiento con neoíntima. Los resultados observados en el estudio pueden estar limitados por la falta de detección de struts no recubiertos o con aposición incompleta en zonas con gran cantidad trombótica. No obstante, el número de casos que no se pudo analizar o que no ofrecieron información suficiente para obtener conclusiones diagnósticas fue muy escaso. Por último, en nuestra serie la falta de estudio con OCT basal hace que no se pudiera diferenciar las aposiciones persistentes de las adquiridas.
CONCLUSIONESPara los pacientes que sufren una TS, la OCT es una técnica segura y factible que aporta información de gran importancia para completar un diagnóstico preciso y guiar el tratamiento. La rotura de placas adyacentes al stent no es infrecuente, aunque en la angiografía es indistinguible de una TS de origen en el stent. En las TS precoces, el mecanismo más frecuente potencialmente implicado es la malaposición. En las TS tardías, a menudo se visualizan struts no recubiertos y mal apuestos y neoateroesclerosis, especialmente en los SFA.
FINANCIACIÓNEste estudio ha sido financiado en parte por el proyecto Europeo del 7.° Programa Marco PRESTIGE (PREvention of late Stent Thrombosis by an interdisciplinary Global European effort) (Número de proyecto: 260309).
CONFLICTO DE INTERESESNinguno.
- –
La TS es una complicación grave del intervencionismo coronario. Las técnicas de imagen intracoronaria aportan datos de gran importancia para el diagnóstico y guiar el intervencionismo. Hay pocos datos disponibles sobre el uso de OCT en esta afección.
- –
La OCT en la TS es una técnica segura y factible que aporta información exclusiva sobre los mecanismos fisiopatológicos subyacentes y puede ayudar a guiar el intervencionismo.