A pesar de los avances en el tratamiento farmacológico de la hipertensión pulmonar, en particular de la hipertensión arterial pulmonar (HAP), sigue siendo una enfermedad mortal. La insuficiencia ventricular derecha (IVD) debida a HAP refractaria a tratamiento finalmente se produce y permanece como una causa importante de muerte en estos pacientes. Disminuir la impedancia pulmonar con diferentes fármacos específicos para HAP es el objetivo terapéutico obvio en la IVD secundaria a una poscarga crónicamente aumentada. Sin embargo, se puede esperar una ganancia clínica potencial a partir de los intentos para descargar el corazón derecho y aumentar el gasto cardiaco. La septostomía auricular, la anastomosis de Potts y la denervación de la arteria pulmonar son procedimientos intervencionistas que sirven para este propósito. La angioplastia pulmonar percutánea con balón, otra terapia intervencionista, ha resurgido en los últimos años como una alternativa clara para el tratamiento de pacientes con hipertensión pulmonar tromboembólica crónica distal no operable. En esta revisión se presentarán los antecedentes fisiológicos, la evidencia experimental y los posibles beneficios clínicos y hemodinámicos de todas estas terapias de intervención con respecto a su uso en el contexto de la IVD secundaria a hipertensión pulmonar grave.
Palabras clave
La hipertensión pulmonar (HP) se define por una presión arterial pulmonar (PAP) media > 25mmHg en reposo, medida durante un cateterismo cardiaco derecho1. El término hipertensión arterial pulmonar (HAP) describe a una subpoblación de los pacientes con HP (grupo 1 de la clasificación clínica actual) caracterizada por una HP precapilar con presión arterial pulmonar enclavada < 15mmHg y una resistencia vascular pulmonar > 3 UW1,2. La HAP es un trastorno progresivo y mortal que afecta a los vasos sanguíneos pulmonares y al corazón, y no tiene cura. La insuficiencia ventricular derecha (IVD) progresiva continúa siendo la principal causa de muerte en esta población.
En las últimas 2 décadas se han producido avances extraordinarios en el tratamiento de la HAP. El empleo de fármacos específicos para la HAP, dirigidos a las vías disfuncionales que conducen al remodelado vascular característico de ese trastorno, ha mejorado tanto la calidad de vida como la supervivencia1–3. Sin embargo, no siempre se dispone de estos fármacos específicos para la HAP y, lo que es más importante, no todos los pacientes responden a ellos1,4,5. Además, el estado de muchos pacientes sigue deteriorándose con el paso del tiempo a pesar del tratamiento, y por consiguiente se debe considerar otras alternativas terapéuticas. A este respecto, se han aplicado intervenciones específicas en pacientes con HAP seleccionados1,3,6–15. Entre ellas se encuentran operaciones bien establecidas y ampliamente difundidas, como la septostomía auricular (SA), y estrategias emergentes atractivas, como la derivación (anastomosis) de Potts1,3,8–11, la denervación de la arteria pulmonar (DNAP)12–14 y la angioplastia pulmonar con balón (APB) para pacientes con HP tromboembólica crónica (HPTEC) inoperable1,6,7,15. En este artículo de revisión se presenta el conocimiento actual y el posible papel de estas intervenciones en el tratamiento de la IVD en la HP.
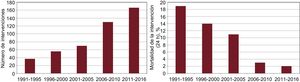
SEPTOSTOMÍA AURICULAR CON BALÓNHay datos clínicos y experimentales que indican que la creación de una comunicación interauricular puede aportar un efecto beneficioso en el contexto de la HAP. Desde un punto de vista clínico, se sabe que los pacientes con HP primaria y foramen oval permeable viven más que los pacientes sin esa comunicación16. Además, se ha identificado que los pacientes con síndrome de Eisenmenger que tienen un grado de HP comparable viven más y tienen menor IVD que los pacientes con HP primaria17. En varios estudios experimentales se ha observado el posible efecto beneficioso de una comunicación derecha-izquierda en la HP18,19. Hace unos años, se desarrollaron varias técnicas para llevar a cabo una SA sin toracotomía20,21 y en 1983 Rich y Lam22 realizaron la primera SA en un paciente con HAP. Sin embargo, no está claro el papel exacto que debe desempeñar la SA en el tratamiento de la HAP, ya que la mayor parte de nuestro conocimiento procede de series pequeñas, no controladas, o de presentaciones de casos y de una percepción algo generalizada de que la intervención conlleva un riesgo inaceptablemente alto. Tiene interés señalar que la experiencia con la SA ha aumentado considerablemente en los últimos pocos años (figura 1).
Experiencia mundial con la septostomía auricular en el tratamiento de la hipertensión arterial pulmonar. A la izquierda se muestra el número de intervenciones a lo largo de los años. A la derecha se muestra que la mortalidad inmediata asociada con la intervención se ha reducido como resultado de la experiencia y las modificaciones de la técnica.
Desde la última revisión23, se han añadido 5 nuevas series10,24–27 y algunas presentaciones de casos28–31. Hasta la fecha se han realizado 461 intervenciones en 364 pacientes, según lo descrito en 28 series (tabla 1 del material suplementario) y 26 presentaciones de casos. La septostomía auricular se ha realizado tanto en niños como en adultos (en su mayoría mujeres [68%]) con HAP idiopática (76%) en estadios avanzados de la enfermedad (clases funcionales III y IV) y sin respuesta al tratamiento médico.
La IVD persistente sola (53,4%) o acompañada de síncopes (21,4%) sigue siendo la indicación más frecuente de la operación (tabla 2 del material suplementario). La SA con dilatación con balón (SADB) es, con mucho, la técnica más ampliamente utilizada (83%). Las series presentadas muestran unos efectos hemodinámicos favorables, con una disminución de un ∼20% en la presión auricular derecha (PArD), un aumento de un ∼30% en el índice cardiaco y, tal como se preveía, una disminución de un ∼10% en la saturación arterial de oxígeno (SaO2%). Además, la mortalidad asociada con la intervención se ha reducido de manera significativa en los últimos años (figura 1).
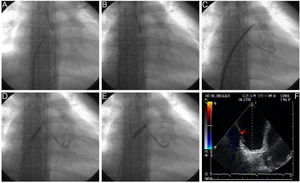
Aspectos técnicos de la intervenciónLa SA con dilatación con balón requiere un cateterismo cardiaco derecho-izquierdo estándar. La punción del tabique se realiza en la mayoría de los casos con una aguja Brockenbrough estándar y un dilatador y una vaina larga (es decir, vaina de tipo Mullins) con objeto de atravesar el tabique auricular. La septoplastia auricular estática secuencial se lleva a cabo gradualmente con balones periféricos no distensibles de diferentes tamaños, mediante un abordaje cuidadoso y controlado (por etapas)32,33 (figura 2). Se toma la decisión relativa al diámetro final de la septostomía cuando se alcanzan los siguientes cambios hemodinámicos: una reducción de la SaO2% inicial de no más de un 10% o un aumento de la presión telediastólica del ventrículo izquierdo. Nosotros recomendamos mantenerla por debajo de 18mmHg. En conjunto, estas recomendaciones son importantes para evitar una hipoxemia refractaria o un edema pulmonar, que son 2 complicaciones de la operación que pueden poner en peligro la vida. En la experiencia mundial existente, el tamaño medio de la comunicación auricular es de 11mm (intervalo de valores, 8-18). En 71 ocasiones se han realizado reintervenciones por observarse el cierre espontáneo de la comunicación en el seguimiento.
Septostomía auricular con dilatación con balón. La intervención implica un cateterismo cardiaco derecho e izquierdo estándar. A: imagen del dilatador Mullins con la aguja Brockenbrough en la punta; se realiza una pequeña inyección de contraste para indicar el lugar de punción pretendido, que puede llevarse a cabo empleando ecocardiografía intracardiaca. B: una vez realizada la perforación del tabique, se coloca una guía terminal circular Inoue en la aurícula izquierda. C: se realiza una dilatación inicial de 4mm del tabique auricular con el dilatador Inoue, y se completa con un balón de 8mm (D y E). Ocasionalmente, la dilatación del tabique auricular puede ofrecer una resistencia moderada, pero siempre se ha conseguido abrirla con hinchado manual, que se ha medido hasta alcanzar de 4-6atm. Se aumenta el hinchado solo lo suficiente para eliminar la cintura del balón (D) y se repite como mínimo 2 veces para contrarrestar la retracción elástica. F: imagen de ecocardiografía transesofágica de la comunicación creada. Modificado de Sandoval et al.32 con permiso.
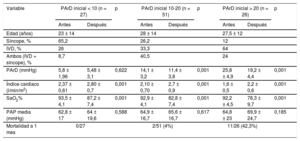
Los cambios hemodinámicos tras la septostomía dependen de la PArD basal23 (tabla); cuanto más alta es la PArD inicial, más pronunciado es el efecto hemodinámico, en especial en los pacientes con PArD > 20mmHg. Sin embargo, este es el subgrupo de pacientes considerado en alto riesgo de complicaciones, incluida la muerte durante la intervención, como consecuencia de una hipoxemia refractaria. La PArD > 20mmHg se ha asociado con un riesgo de muerte más de 10 veces superior en esos pacientes23. Nosotros no aplicamos la SA a esa población. Así pues, puede considerarse que la mejor relación riesgo-beneficio es la que se da en los pacientes con una PArD de entre 10 y 20mmHg. Por último, la mayor parte de los datos publicados respecto a las repercusiones hemodinámicas tras la SADB se han obtenido en estado de reposo; sin embargo, es durante el ejercicio cuando la septostomía debería resultar aún más útil como válvula de alivio de presión18. Esto se pone de relieve en los datos que muestran una mejora de la tolerancia al ejercicio tras la creación de la comunicación auricular33–35.
Efectos hemodinámicos de la septostomía auricular según la presión auricular derecha en la situación inicial
| Variable | PArD inicial < 10 (n = 27) | p | PArD inicial 10-20 (n = 51) | p | PArD inicial > 20 (n = 26) | p | |||
|---|---|---|---|---|---|---|---|---|---|
| Antes | Después | Antes | Después | Antes | Después | ||||
| Edad (años) | 23 ± 14 | 28 ± 14 | 27,5 ± 12 | ||||||
| Síncope, % | 65,2 | 26,2 | 12 | ||||||
| IVD, % | 26 | 33,3 | 64 | ||||||
| Ambos (IVD + síncope), % | 8,7 | 40,5 | 24 | ||||||
| PArD (mmHg) | 5,8 ± 1,96 | 5,48 ± 3,1 | 0,622 | 14,1 ± 3,2 | 11,4 ± 3,8 | 0,001 | 25,8 ± 4,9 | 19,2 ± 4,4 | 0,001 |
| Índice cardiaco (l/min/m2) | 2,37 ± 0,61 | 2,80 ± 0,7 | 0,001 | 2,10 ± 0,70 | 2,7 ± 0,9 | 0,001 | 1,6 ± 0,5 | 2,2 ± 0,6 | 0,001 |
| SaO2% | 93,5 ± 4,1 | 87,2 ± 7,4 | 0,001 | 92,9 ± 4,1 | 82,8 ± 7,4 | 0,001 | 92,2 ± 4,5 | 78,3 ± 9,7 | 0,001 |
| PAP media (mmHg) | 62,8 ± 17 | 64 ± 19,6 | 0,588 | 64,9 ± 16,7 | 65,6 ± 16,7 | 0,617 | 64,8 ± 23 | 69,9 ± 24,7 | 0,185 |
| Mortalidad a 1 mes | 0/27 | 2/51 (4%) | 11/26 (42,3%) | ||||||
IVD: insuficiencia ventricular derecha; PAP: presión arterial pulmonar; PArD: presión auricular derecha; SaO2%: saturación de oxígeno arterial.
Reproducido de Sandoval et al.8 con permiso.
La reciente disminución de la mortalidad relacionada con la intervención puede atribuirse a varios factores. La primera y más importante es que los intervencionistas han seguido las recomendaciones de 1998 para minimizar el riesgo de muerte durante la intervención36, en especial evitando operar a pacientes con una muerte inminente y realizándola solo en centros con experiencia tanto en HAP como en SA. En segundo lugar, se han introducido modificaciones técnicas para mejorar la seguridad durante la septostomía. La técnica ha evolucionado desde la época en que se describió por primera vez la SA con bisturí-balón22, en la que el control del tamaño de la comunicación era incierto, a diferencia de la tendencia reciente a pasar a la SADB, descrita por primera vez por Hausknecht et al.37 y Rothman et al.38, que nuestro grupo adoptó al poco tiempo, en 199833. Como ya se ha mencionado, realizar una intervención por etapas ha conducido a una menor mortalidad relacionada con la operación. Otro aspecto relevante respecto a la seguridad de la intervención es la introducción de la ecocardiografía intracardiaca como guía de la punción transeptal, que describieron por primera vez Moscussi et al.39 y adoptaron rápidamente muchos otros27,40–44.
Preservación de la permeabilidad de la comunicaciónEl cierre espontáneo de la comunicación auricular se observa con frecuencia después de la septostomía en un seguimiento a medio plazo. Se han utilizado varios enfoques para abordar este problema. Uno de ellos son los implantes de oclusores fenestrados hechos individualizadamente tras la septostomía (figura 3)44–50. Otro enfoque consiste en usar un stent fenestrado durante la septostomía, según lo descrito por Stumper en 2003 con la técnica denominada de stent fenestrado en diabolo24, utilizado en algunas series recientes27,35, o un «stent en mariposa», descrito por Prieto et al.40 y modificado por Roy et al.42. Recientemente, Guerrero et al.28 han descrito el empleo de la crioplastia para congelar el borde de la comunicación auricular recién creada con objeto de mantener su permeabilidad. Aunque se ha descrito su éxito a corto plazo, continúa por determinarse si estos dispositivos e intervenciones son útiles y duraderos a largo plazo. Ciertamente, este es un campo de investigación y desarrollo interesante y prometedor para el futuro próximo50 (véase también el ensayo PROPHET, NCT03022851).
Resultados tras la septostomía y repercusiones de la septostomía en la supervivencia a largo plazoEn la mayoría de las series se ha descrito una mejora inmediata de la clase funcional, los síntomas como el síncope o la IVD en la mayoría de los pacientes que sobreviven a la operación. Sin embargo, no se ha realizado ningún análisis formal sobre los resultados a medio plazo. En una reciente publicación, Chiu et al.25 señalan que, de los pacientes cuya indicación fue una IVD refractaria (n = 21), la mitad mejoró y solo 5 fallecieron por IVD. De los sometidos a septostomía por síncopes (n = 19), la mayoría mejoró y solo 2 fallecieron durante el primer año. Las repercusiones de la septostomía en la supervivencia de estos pacientes son difíciles de establecer, ya que no se dispone de estudios controlados de larga duración, pero los trabajos de Kerstein et al.51, Sandoval et al.33, Law et al.52 y Troost et al.35, y más recientemente los de Chiu et al.25 y Sandoval et al.9, han puesto de manifiesto un efecto favorable en la supervivencia a 1, 2 y 3 años, cuando se compara la supervivencia con la de controles históricos o con la supervivencia esperada. Sin embargo, en todos estos estudios se observa un descenso de las curvas de supervivencia a lo largo del tiempo, lo cual refleja el carácter paliativo de la intervención.
En resumen, según lo indicado por un examen del conjunto de la evidencia obtenida en todo el mundo, la SADB constituye una estrategia adicional en el tratamiento de la IVD grave en el contexto de la HAP y mejora las variables hemodinámicas que están correlacionadas con la mejoría clínica y la supervivencia. Aunque se realice en un estadio avanzado de la enfermedad, la SA proporciona un efecto beneficioso clínico y hemodinámico y una tendencia a la mejora de la supervivencia. La mortalidad asociada con la intervención está disminuyendo, ya que las nuevas técnicas de imagen (es decir, la ecocardiografía intracardiaca) y las técnicas de punción del tabique (es decir, el uso de radiofrecuencia) han simplificado la intervención39,43,53. La septostomía auricular es útil para los pacientes en los que ha fracasado un tratamiento farmacológico combinado27, utilizada como estrategia puente para el trasplante38 o cuando no hay ninguna otra opción de tratamiento disponible. Todas ellas son indicaciones para la intervención1,3,8,23,32.
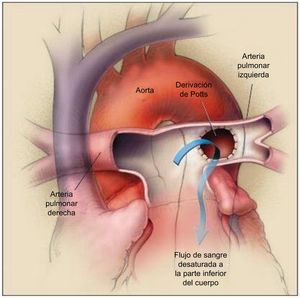
ANASTOMOSIS (DERIVACIÓN) DE POTTSLa derivación de Potts consiste en crear una anastomosis entre la arteria pulmonar izquierda y la aorta descendente. Inicialmente, esta derivación se utilizó con el objetivo de aliviar la cianosis en varias formas de cardiopatía congénita (es decir, la tetralogía de Fallot y la atresia pulmonar)54. Ha habido un nuevo interés por su aplicación en el tratamiento de la HAP, como alternativa a la SA, utilizando los mismos concepto y fundamento: crear un cortocircuito derecha-izquierda para aumentar el gasto cardiaco sistémico55 (figura 4). En teoría, la ventaja de una derivación de Potts respecto a la SA es que evita la desaturación de oxígeno en la parte superior del cuerpo, como el cerebro y las arterias coronarias56.
Operación de derivación de Potts. La arteria pulmonar izquierda se anastomosa a la aorta descendente, lo cual permite que la sangre desaturada pase de la arteria pulmonar izquierda a la parte inferior del cuerpo (flecha). La arteria pulmonar derecha pasa por delante de la aorta ascendente, ya que se ha realizado una intervención de cambio arterial. Reproducido con permiso de Blanc et al.55.
La primera descripción del uso de una derivación de Potts en el contexto de la HP es la publicada por Blanc et al.55. Dentro de este mismo grupo, Baruteau et al.56 describieron la experiencia a largo plazo con las intervenciones realizadas en 8 niños con HAP grave refractaria al tratamiento médico. La intervención de Potts se realizó a través de una toracotomía izquierda sin circulación extracorpórea. Se produjeron 2 muertes relacionadas con la intervención a causa de un bajo gasto cardiaco atribuido a la interrupción del tratamiento médico preoperatorio o a una anastomosis restrictiva. El resultado a largo plazo de los 6 supervivientes fue excelente por lo que respecta a la clase funcional y la capacidad de ejercicio. Esch et al.57 describieron una derivación de Potts percutánea (DPP) alternativa. En ese estudio, se intervino con DPP en anestesia general a 4 pacientes con HAP grave. La perforación vascular se realizó con guía por fluoroscopia y se colocó un stent recubierto entre la arteria pulmonar y la aorta. Aunque se consideró un éxito desde un punto de vista técnico, 1 paciente falleció durante la intervención a causa de un hemotórax masivo y otro, a causa de una neumonía relacionada con el respirador. Los 2 supervivientes presentaron una significativa mejoría sintomática y no hubo complicaciones tardías en el seguimiento.
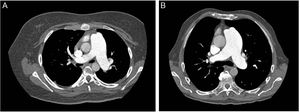
Dado que la hemorragia es la complicación más temida de la DPP, obtener una tomografía computarizada torácica antes de la intervención podría ser útil para la selección de los candidatos ideales, según lo propuesto por Guo et al.58. Hay 2 tipos de relaciones entre la arteria pulmonar inferior izquierda y la aorta descendente (figura 5); en el tipo 1, prácticamente no hay distancia entre los vasos (candidato ideal), mientras que en el tipo 2 hay un espacio considerable entre estas estructuras, lo cual aumenta el riesgo de hemorragia. El enfoque de perforación asistida con radiofrecuencia es otro perfeccionamiento destinado a mejorar el perfil de seguridad en la creación de la DPP59.
La tomografía computarizada de tórax antes de la intervención podría ser útil para seleccionar a los candidatos ideales para una anastomosis de Potts. Existen 2 tipos de relaciones entre la arteria pulmonar inferior izquierda y la aorta descendente. En el tipo 1 (A), la distancia entre los vasos es mínima y en el tipo 2 (B) la distancia es mayor, con lo que aumenta el riesgo de hemorragia. Los pacientes con una relación de tipo 1 son mejores candidatos para una anastomosis de Potts.
Es muy aconsejable que la derivación de Potts se lleve a cabo en un centro especializado en HAP que disponga de equipos quirúrgicos e intervencionistas sólidos. Baruteau et al.11 han publicado recientemente una recopilación de su experiencia en 24 niños tratados con anastomosis quirúrgica (n = 19) o DPP (n = 5) en el contexto de la HAP. Tras una mediana de seguimiento de 2,1 años, hubo una mejora drástica de la clase funcional y de la capacidad de ejercicio en los 21 supervivientes. Además, este fundamento fisiológico se ha ampliado a las poblaciones de recién nacidos y lactantes con HP suprasistémica de diversas etiologías mediante la implantación de stents en el conducto arterioso (residual o permeable)60.
La anastomosis de Potts (quirúrgica o percutánea) es, ciertamente, un método innovador en el tratamiento de la HAP y una interesante alternativa a la SA. Sin embargo, serán necesarios una mayor experiencia y perfeccionamientos técnicos para reducir los riesgos asociados con la intervención quirúrgica y establecer la DPP como una modalidad terapéutica aceptada para la HAP avanzada.
DENERVACIÓN DE LA ARTERIA PULMONARLa denervación de la arteria pulmonar es otro enfoque intervencionista innovador y muy atractivo para el tratamiento de la HP. Pretende abolir la inervación simpática de las arterias pulmonares principales, y con ello reducir el aumento de estimulación simpática de la circulación pulmonar61–72.
Aumento de la actividad simpática en la HAPVarias investigaciones han demostrado un aumento de la actividad simpática en los pacientes con HAP61–63. La causa no se conoce por completo66,71. Parece que las presiones de llenado crecientes, la reducción del gasto cardiaco y un control barorreflejo anormal participarían en el aumento de la activación simpática. Tiene interés señalar que el aumento de la actividad simpática se ha reducido significativamente tras la SADB en los pacientes con HAP64. La estimulación adrenérgica excesiva en la HAP, a través de una desensibilización de la vía de los receptores adrenérgicos β1, tal como se observa en otras formas de insuficiencia cardiaca, puede implicar también un deterioro de la función del VD65. En consecuencia, una estimulación simpática excesiva puede ser un mecanismo importante en la fisiopatología de la IVD en el contexto de la HAP.
Estudios experimentales sobre los efectos de la DNAPPublicaciones previas han mostrado que la distensión y oclusión de una de las ramas de la arteria pulmonar da lugar a un aumento de la presión y la resistencia vascular pulmonar al parecer inducido por un reflejo pulmo-pulmonar66,67. Se ha propuesto que los barorreceptores están situados en la proximidad de la bifurcación de la arteria pulmonar principal e intervienen en la facilitación de un reflejo neural como resultado de la activación de receptores de distensión, y que podría impedirse que se produjera este reflejo67. Teniendo en cuenta estas observaciones, los primeros 2 intentos de DNAP in vivo se realizaron en un modelo canino de HP, inducida por el inflado de un balón en la arteria pulmonar68; en ellos se demostró que la ablación mediante radiofrecuencia a través de un catéter en una zona proximal a la bifurcación principal de la arteria pulmonar es la zona en que la DNAP es más eficaz. En estudios experimentales posteriores se han confirmado el patrón de lesión nerviosa que se produce tras la DNAP12, los efectos beneficiosos hemodinámicos relativamente persistentes69 y la posible reducción de la actividad del sistema renina-angiotensina-aldosterona en el tejido local tras la intervención70. Aunque estos modelos experimentales son de corta duración y no se asemejan necesariamente a la HAP humana71, aportan evidencia sobre la importancia del sistema nervioso simpático en la patogenia de la HAP y también de que la DNAP, al interrumpir la activación simpática, puede desempeñar un papel en el tratamiento de la HAP.
Experiencia en seres humanos con la DNAP en la HAPA la vista de la evidencia experimental existente y adoptando el concepto de la denervación de la arteria renal en el tratamiento de la hipertensión sistémica refractaria, recientemente ha habido mucho interés en la DNAP como intervención terapéutica en la HAP6,7,13,14. La experiencia existente con esa intervención en la HAP humana se limita a un par de estudios realizados por el mismo grupo de investigadores13,14. El estudio piloto PADN-1, un estudio unicéntrico y el primero en seres humanos, realizado por Chen et al.13, incluyó a 21 pacientes con HAP que no habían respondido al tratamiento médico. A 13 pacientes se les practicó una DNAP en la bifurcación de la arteria pulmonar principal y el ostium de las arterias pulmonares principales derecha e izquierda mediante un catéter de ablación por radiofrecuencia específico para este fin (figura 6). Se alcanzó el éxito de la denervación de la arteria pulmonar, definido como una reducción de la PAP > 10mmHg sin que se produjeran complicaciones, en 12 de los 13 pacientes. Tras una media de seguimiento de 3 meses, la PAP media se redujo (de 55 ± 5 a 36 ± 5 mmHg; p < 0,01) y hubo también una mejora en los resultados de la prueba de los 6min de marcha. Este trabajo inicial fue recibido con escepticismo debido al carácter no aleatorizado del estudio, la estratificación de bajo riesgo de la cohorte y el corto periodo de seguimiento.
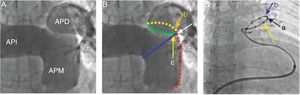
Arteriografía pulmonar, posición de los electrodos e intervención de denervación de la arteria pulmonar. A: proyección anteroposterior y craneal (200) de la arteriografía pulmonar. B: la línea roja indica la pared lateral de la arteria pulmonar principal (APP); la línea azul indica la pared anterior de la arteria pulmonar izquierda (API), y el punto en el que se cortan las 2 líneas es el punto a; la intersección de las líneas amarilla (pared posterior de la API) y roja es el punto b, que está de 1-2mm por detrás del punto a; la línea verde va de la pared anterior de la arteria pulmonar derecha (APD) al punto a, y el punto c se encuentra a ese nivel 1-2mm por delante del punto a. C: se coloca un catéter de denervación de la arteria pulmonar con 10 electrodos en la parte distal de la APP; los electrodos a, b y c se sitúan en los puntos a, b y c respectivamente. Reproducido con permiso de Chen et al.14. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En una publicación posterior (fase II) del estudio Pulmonary Artery Denervation-1, Chen et al.14 ampliaron su experiencia y presentaron las respuestas hemodinámica, funcional y clínica a la DNAP de 66 pacientes con HP de diferentes etiologías. No hubo complicaciones durante la intervención, aunque el dolor torácico fue un efecto adverso importante14. A los 6 meses se había reducido la PAP media, de 53 ± 19 a 44,8 ± 16,4mmHg (p < 0,001), y este efecto persistía en el seguimiento a 1 año, sin que pareciera relacionado con el tratamiento médico concomitante, ya que los fármacos específicos para la HAP se suspendieron tras la realización de la DNAP. Se documentaron mejoras en la prueba de los 6min de marcha, la clase funcional y la función cardiaca. En el transcurso del año de seguimiento, hubo un número considerable de eventos relacionados con la HP (incluidas 6 muertes) que indican progresión de la enfermedad. Sin embargo, algunos autores argumentan que, aunque no se demostró, algunas de estas muertes podrían haber estado relacionadas directamente con la retirada de los tratamientos farmacológicos efectivos72.
Aunque los datos experimentales y la experiencia clínica favorables a la DNAP como enfoque novedoso y específico para el tratamiento de la HAP van aumentando lentamente, como otros autores6,7,71, personalmente considero que, dado que las poblaciones estudiadas son pequeñas y heterogéneas, los estudios no tienen un diseño controlado y la experiencia procede de 1 solo centro, todavía no es posible extraer conclusiones o recomendaciones firmes por lo que respecta a la eficacia y el momento óptimo para realizar la DNAP en el contexto de la HAP humana. No obstante, la seguridad y la eficacia de la intervención de DNAP merecen una evaluación más detallada y está pendiente su demostración en ensayos clínicos aleatorizados y controlados con placebo más amplios, como el estudio DENERV’AP (NCT02525926).
ANGIOPLASTIA PULMONAR PERCUTÁNEA CON BALÓNLa APB percutánea es otra técnica intervencionista que está emergiendo como una nueva opción para el tratamiento de la HPTEC inoperable. La HP tromboembólica crónica es una forma diferenciada de HP de carácter devastador y mortal, que se incluye como grupo 4 en la clasificación clínica de la HP1,73,74. Se cree que se debe a la obstrucción del lecho vascular pulmonar como consecuencia de una resolución incompleta de los tromboémbolos pulmonares agudos que se organizan para dar lugar a un tejido fibroso en el interior de las arterias pulmonares principales. En los vasos no ocluidos, el remodelado microvascular conduce a una arteriopatía pulmonar similar a la de la HAP, que contribuye de manera significativa a producir la alteración anatomopatológica presente en la HPTEC1,73,75. A su vez, esto aumenta la resistencia vascular pulmonar y ello da lugar a HP progresiva, IVD y muerte. El diagnóstico precoz, la evaluación apropiada y el tratamiento por un equipo multidisciplinario experto son imprescindibles, ya que la HPTEC es una forma de HP potencialmente curable1,15,73,76–78.
El tratamiento de elección para la HPTEC es la endarterectomía pulmonar (EAP) quirúrgica. Actualmente las tasas de mortalidad periintervención se han reducido considerablemente en centros con experiencia de Estados Unidos y Europa. En los supervivientes se ha demostrado una mejora sustancial de la hemodinámica pulmonar, la calidad de vida y la supervivencia1,15,73,76. Sin embargo, no todos los pacientes con HPTEC son candidatos adecuados para una EAP. Según los resultados del International Prospective Registry on CTEPH15,74,79, se consideró inoperables una parte sustancial de los pacientes con HPTEC a causa de una localización distal inaccesible quirúrgicamente o la presencia de comorbilidades importantes que impedían la cirugía. También se ha establecido que, hasta un 10-15% de los pacientes operados tienen HP persistente15,73,76,77,80. Los pacientes considerados inoperables o con HP persistente o recurrente tras la EAP constituyen una población a la que el tratamiento específico para la HAP (es decir, riociguat) y la APB percutánea pueden aportar un efecto beneficioso 1,15,73,77,81–101.
AntecedentesFeinstein et al.81 exploraron en 2001 por primera vez la angioplastia pulmonar con balón en el contexto de la HPTEC en una serie de 18 pacientes con HPTEC inoperable. En ese estudio, se demostraron mejorías hemodinámica (disminución de la PAP de 43 ± 12 a 37,7 ± 10,7mmHg), de la clase funcional y de la capacidad de ejercicio tras una media de 3 años de seguimiento. Sin embargo, hubo complicaciones importantes, como edema pulmonar de reperfusión en 11 de 18 pacientes, perforación de la AP y muerte (1 paciente cada una). A pesar de los resultados iniciales desalentadores, el interés por la APB percutánea ha aumentado en los últimos 5 años como tratamiento efectivo para las formas de HPTEC distales e inoperables, principalmente debido a las modificaciones técnicas y los mejores resultados observados en numerosos estudios, sobre todo de grupos japoneses1,15,82–85.
Experiencia actual con la APB en la HPTECKataoka et al.82 y Sugimura et al.83 volvieron a estudiar la APB y demostraron resultados satisfactorios en cuanto a la eficacia y un margen de seguridad relativamente bueno. Esta experiencia exitosa con la APB percutánea en Japón se amplió luego a otros muchos centros de Europa86–90. En una reciente revisión muy detallada de la experiencia de todo el mundo, Lang et al.15 llevaron a cabo un análisis cuidadoso de las 3.568 intervenciones realizadas en 885 pacientes con HPTEC descritos en las 21 series publicadas hasta la fecha. Son muchas las enseñanzas que aporta esta revisión acerca de las indicaciones, la técnica y el perfeccionamiento de las exploraciones de diagnóstico por la imagen, así como respecto a la seguridad y la eficacia, los resultados a largo plazo y las perspectivas futuras de la APB en el tratamiento de la HPTEC. Tras esa revisión se han publicado otros estudios más recientes89,90.
La APB percutánea solo debe realizarse en centros especializados que dispongan de las instalaciones apropiadas y de programas de tratamiento intervencionista sólidos para la HPTEC. Disponer de un equipo de EAP multidisciplinario no solo es necesario, sino que se debe considerar imprescindible, ya que la primera consideración en la APB debe ser definir la viabilidad de la EAP1,15,74,76,77. Se puede considerar la angioplastia pulmonar con balón para pacientes con una enfermedad de localización distal inoperable o que presenten un relación riesgo-beneficio alta en la EAP. Los criterios de inaccesibilidad quirúrgica por motivos técnicos deben ser establecidos como mínimo por una segunda opinión de otro equipo quirúrgico experto1,15,73,76. La determinación de que la enfermedad es inoperable como consecuencia de un riesgo elevado a causa de las comorbilidades no está tan bien definida15. Otras indicaciones para la intervención pueden ser las de los pacientes con una HP persistente o lesiones residuales tras la EAP que no respondan a los nuevos fármacos específicos para la HAP15,77,80,91–93. Sin embargo, lo que está claro es que la APB no debe intentarse en los pacientes con trombos centrales grandes o con una oclusión total unilateral15. Además, al considerar la posibilidad de una APB, es importante reconocer que se trata de una intervención muy exigente y está claro que no exenta de complicaciones15,90,94.
La técnica de la APB ha evolucionado con los años como resultado de los avances técnicos y el aumento de la experiencia. El objetivo de la intervención es abrir los vasos distales obstruidos o ensanchar las lesiones estenóticas para mejorar la perfusión pulmonar y la hemodinámica, en un intento de mejorar la función del VD o prevenir la IVD, que es la principal causa de muerte de esos pacientes. De manera resumida, una vez identificadas las lesiones vasculares que tratar, se introduce una guía por la lesión o la oclusión, y se emplea una dilatación con un balón de tamaño pequeño (cociente balón/arteria bajo) para abrir la lesión mediante un aplastamiento del material fibroso contra la pared del vaso15 (figura 7); a diferencia de la EAP, durante la APB no se extrae material obstructivo fibroso. La angioplastia pulmonar con balón implica cateterismos repetidos con múltiples dilataciones durante cada sesión para alcanzar un resultado óptimo. En una revisión de la experiencia existente en todo el mundo16, el número medio de intervenciones por paciente fue de 4 (3.568 intervenciones/885 pacientes) y el número de sesiones por paciente osciló entre 3 y 10. El número de sesiones parece estar relacionado con la experiencia del operador y con el grado de enfermedad (localización y tipo de lesión). Con una selección adecuada de los pacientes candidatos al tratamiento, los resultados de la APB son gratificantes. En la mayor parte de las series publicadas ha habido mejoras significativas de los parámetros hemodinámicos, la clase funcional y la capacidad de ejercicio15. Se ha documentado también una repercusión en la supervivencia a largo plazo82,83,90.
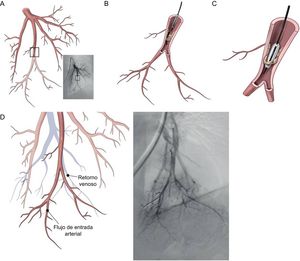
Angioplastia pulmonar con balón percutánea. A: angiografía pulmonar en la que se observa una estenosis en el subsegmento de la 10.a arteria segmentaria (proyección anterior). B: el catéter se introduce en una estenosis en red. C: la guía se introduce entre el material fibroso y se hincha el balón, lo cual causa una rotura de la red. D: la angiografía después de la angioplastia pulmonar con balón muestra una mejora del flujo sanguíneo, con mejor perfusión del parénquima y retorno venoso rápido. A diferencia de la endarterectomía pulmonar, el material fibroso no se retira de las arterias, sino que se aplasta contra la pared vascular. Reproducido con permiso de Lang et al.15.
En manos expertas, la APB es una intervención relativamente segura, ya que solo se han descrito 13 muertes asociadas con la intervención en 885 pacientes (1,46%)15. Sin embargo, los operadores deben conocer las complicaciones como la lesión vascular pulmonar (perforación de la arteria pulmonar con la guía, disección), hemoptisis y la complicación más frecuente y temida, el edema pulmonar de reperfusión, cuya gravedad puede requerir el uso de ventilación mecánica, y estar preparados para tratarlas15,94. En este contexto puede ser útil el índice PEPSI (Pulmonary Edema Predictive Scoring Index), que evalúa el flujo en el vaso diana antes y después de la APB84. La exposición a la radiación y la insuficiencia renal inducida por medios de contraste son otras consideraciones importantes en la APB15,95.
Papel de las exploraciones de imagenLas técnicas de imagen vascular han contribuido de manera importante al desarrollo y el perfeccionamiento de la técnica de la APB y su papel es crucial para definir y abordar apropiadamente las lesiones vasculares15,95–99. Según la opinión de los expertos, la angiografía pulmonar de sustracción digital es el método más usado y útil15,96,97. Otras técnicas de imagen, como la tomografía con contraste, la tomografía computarizada de haz cónico, la tomografía de coherencia óptica y la resonancia magnética, son métodos complementarios para la evaluación de los pacientes15,95,98,99. Además, la tomografía computarizada de energía dual podría ser útil para documentar y evaluar el aumento de la perfusión pulmonar tras la APB15,100.
Perspectivas futurasQuedan algunas cuestiones pendientes respecto al papel actual y futuro de la APB en el tratamiento de la HPTEC. Para muchos pacientes con una HPTEC proximal, la EAP continúa siendo la intervención de elección1,73,76. Cuando hay clara evidencia de una enfermedad de localización distal inoperable, debe considerarse la posible conveniencia de una APB o un tratamiento farmacológico específico para la HP1,15,73,77. No se dispone de comparaciones de estos tratamientos, pero la respuesta, como mínimo por lo que respecta a la eficacia, podría obtenerse en el ensayo clínico RACE (Riociguat Versus Balloon Pulmonary Angioplasty in Non-operable Chronic thromboEmbolic Pulmonary Hypertension), actualmente en curso (NCT02634203). En este grupo concreto de pacientes, tal vez la combinación de APB y fármacos específicos para la HAP sea la forma apropiada de tratamiento. Por último, es preciso considerar el caso de los pacientes con una enfermedad limítrofe proximal-distal. No hay todavía un abordaje claramente definido para estos pacientes, pero se ha ensayado con éxito una estrategia combinada de EAP y APB101. Según afirman Lang et al.15, es posible que el tratamiento futuro de la HPTEC consista en el uso de EAP, APB y un tratamiento médico dirigido combinados, simultáneos o en secuencia según las necesidades del paciente.
CONCLUSIONESA pesar de los importantes avances que se han producido en los tratamientos farmacológicos, la HP, y en especial la HAP, continúa siendo una enfermedad incurable. Los tratamientos intervencionistas y quirúrgicos se han utilizado como medidas paliativas en una fase avanzada del curso de la enfermedad. La demostración clara de la seguridad y la eficacia de cualquier tratamiento intervencionista existente se ha visto limitada por la falta de estudios prospectivos y controlados, el éxito relativo de los tratamientos específicos para la HAP en los últimos años y, sobre todo, la falta de capacitación/conocimiento experto respecto a estas intervenciones en todo el mundo. Sin embargo, el hecho de que estas estrategias mejoren la hemodinámica y la calidad de vida y prolonguen la supervivencia en una población de alto riesgo de pacientes con HAP es algo que no debe pasarse por alto. Mientras esperamos la introducción de nuevos tratamientos dirigidos eficaces, se deberá tener en cuenta estas estrategias adicionales para intentar una mejor asistencia al VD cuando se produce una insuficiencia. Por otra parte, la APB, tras la demostración de su eficacia y su seguridad, está pasando rápidamente a ocupar un lugar definitivo en el algoritmo de tratamiento de la HPTEC inoperable. Personalmente, propongo encarecidamente que estas estrategias quirúrgicas o intervencionistas estén disponibles en los centros de HP de referencia.
CONFLICTO DE INTERESESNo se declara ninguno.
Los autores desean agradecer a Juan Pablo Sandoval su inestimable ayuda en la corrección del manuscrito.