El periodo de uso recomendado del tratamiento antiagregante plaquetario combinado doble tras implante de stents farmacoactivos va de los 6 a los 12 meses o más. Ensayos recientes indican que es seguro utilizar un tratamiento antiagregante plaquetario combinado doble durante 6 meses, si bien ciertas limitaciones de estos estudios hacen que sea escasa la aplicabilidad de esta estrategia de tratamiento antiagregante plaquetario combinado doble de menor duración en la práctica clínica real.
MétodosSe puso en marcha un registro con la inscripción de pacientes consecutivos a los que se había implantado stent farmacoactivo de nueva generación seguido de una prescripción de 6 meses de tratamiento antiagregante plaquetario combinado doble. Se realizó una igualación por puntuación de propensión con una cohorte histórica de pacientes tratados con stents farmacoactivos de segunda generación que recibieron luego 12 meses de tratamiento antiagregante plaquetario combinado doble del registro ESTROFA-2. El tamaño muestral se calculó para el criterio de no inferioridad y el objetivo principal fue la combinación de muerte cardiaca, infarto de miocardio, revascularización o hemorragia mayor a los 12 meses.
ResultadosSe incluyó en el análisis a 1.286 pacientes de cada grupo, que no presentaban diferencias significativas en sus características basales. Se produjeron episodios del objetivo principal en el 5,0 y el 6,6% de los pacientes en los grupos de 6 y de 12 meses respectivamente (p = 0,001 para no inferioridad). La incidencia de trombosis del stent definitiva o probable fue del 0,5 y el 0,7% en los grupos de tratamiento de 6 y 12 meses respectivamente (p = 0,4). Los episodios de hemorragia mayor fueron menos en el grupo de 6 meses que en el de 12 (el 0,8 y el 1,4%; p = 0,2).
ConclusionesEn pacientes seleccionados de este amplio estudio multicéntrico, la seguridad y la eficacia de 6 meses de tratamiento antiagregante plaquetario combinado doble después del implante de stents farmacoactivos de nueva generación fueron no inferiores a las observadas con 12 meses de tratamiento antiagregante plaquetario combinado doble.
Palabras clave
Los stents farmacoactivos (SFA) se asocian a unas tasas de revascularización de la lesión diana significativamente inferiores que las de los stents metálicos sin recubrimiento (SMSR). Sin embargo, invariablemente resulta necesario un tratamiento antiagregante plaquetario combinado doble (TAPD) para evitar la trombosis tardía del stent relacionada con una cicatrización tardía, lo que impide el uso frecuente de SFA en pacientes con un riesgo de hemorragia elevado. Durante muchos años, las guías han recomendado un periodo de TAPD de al menos 12 meses basándose en lo observado con los SFA de primera generación1. Recientemente, las guías europeas han recomendado el empleo de 6 meses de TAPD para pacientes estables (nivel de evidencia B)2. Los ensayos y registros de SFA de nueva generación han mostrado unas tasas de trombosis más bajas que las que se dan con los SFA de primera generación o incluso con los SMSR3–7. En un análisis retrospectivo de estudios de SFA de nueva generación, se señaló que la retirada o la interrupción temprana del TAPD más allá de los primeros 1-3 meses después del implante no parecían aumentar el riesgo8,9.
En varios ensayos se han comparado distintas duraciones del TAPD (3-6 meses frente a 12-24 meses)10–16. En los análisis de cada uno de estos ensayos por separado y de cuatro ensayos juntos, se ha demostrado que las pautas de TAPD de corta duración presentan similares tasas de episodios isquémicos, al tiempo que reducen la incidencia de episodios hemorrágicos10–17.
No obstante, hay ciertas limitaciones que hacen que la aplicabilidad general de estos ensayos sea escasa; por ejemplo, el diseño retrospectivo del análisis y los sesgos asociados a ello, el pequeño tamaño muestral de algunos de los estudios, la poca adherencia a los protocolos y el uso frecuente de SFA que ya han quedado desfasados. Por ejemplo, se sabe que la versión del stent liberador de zotarolimus utilizado en estos ensayos muestra un grado relativamente alto de pérdida luminal tardía, lo cual le ha valido una reputación de ser un stent con una conducta que se sitúa entre la de los SMSR y la de los SFA de nueva generación. Además, en estos ensayos se incluyeron también SMSR y SFA de primera generación.
Se presenta un registro prospectivo multicéntrico destinado a evaluar la seguridad de una estrategia de TAPD de 6 meses en pacientes tratados con SFA que no eran de primera generación en comparación con los resultados de una serie de pacientes de iguales características tratados con 12 meses de TAPD.
MÉTODOSEn el registro prospectivo y multicéntrico ESTROFA-DAPT participan 18 centros de toda España. Este análisis forma parte del Proyecto y la Red de Estudios ESTROFA y contó con el apoyo de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología. En cada centro, se prescribió a los pacientes un TAPD con ácido acetilsalicílico y clopidogrel durante 6 meses después del implante de un SFA, con los siguientes criterios:
- •
Una indicación clínica para la intervención percutánea con un SFA que no fuera de primera generación en cualquiera de los siguientes contextos clínicos: a) isquemia silente; b) angina estable; c) angina inestable sin ningún grado de elevación de la troponina; d) pacientes con infarto de miocardio sin elevación del segmento ST o con elevación del segmento ST, sin riesgo hemorrágico estimado bajo en TAPD a largo plazo pero que aun así se consideraran candidatos a tratamiento con SFA (es decir, pacientes de edad > 75 años, pacientes con antecedentes de enfermedad ulcerosa péptica sin hemorragia, insuficiencia renal crónica moderada-grave o hepatopatía moderada o pacientes con cirugía no cardiaca electiva en un plazo > 6 meses).
- •
Por lo que respecta a la intervención, se excluyeron las lesiones del tronco común de la coronaria izquierda, las de bifurcaciones tratadas con dos stents; se excluyó asimismo a los pacientes que necesitaron más de tres stents o con antecedentes previos de trombosis tardía de SFA.
La decisión de utilizar estos criterios de inclusión se basó en los siguientes motivos de preocupación en cuanto a la seguridad: a) el uso de TAPD durante 12 meses después de un síndrome coronario agudo (SCA) está respaldado por la evidencia y se recomienda en diversas guías clínicas y documentos de consenso1,2,18–21, y solo podía incluirse a pacientes con SCA de riesgo bajo y cierto riesgo hemorrágico, y b) el estudio utilizó un protocolo basado en la seguridad; por lo tanto, se evitó la inclusión de pacientes con un riesgo superior de trombosis de stent (más de tres stents, técnicas de dos stents para bifurcaciones y trombosis tardía previa con un SFA) con con alto riesgo de muerte con un episodio trombótico (stents del tronco común de la coronaria izquierda).
De hecho, estos subgrupos (SCA, lesiones múltiples y lesiones complejas) mostraron tendencia a obtener mayor efecto beneficioso tras un periodo de TAPD más largo en comparación con los subgrupos con angina estable o lesiones únicas del ensayo PRODIGY10.
Todos los datos clínicos, angiográficos y de intervención basales se registraron en una base de datos común específicamente diseñada para este estudio. Se presentó también información sobre el seguimiento clínico, y estos datos fueron actualizados regularmente durante el registro y las revisiones de la base de datos hospitalaria, así como a través del contacto con el paciente. Se requirió la verificación del TAPD durante el periodo de TAPD ≤ 6 meses y se confirmó a través del contacto con el paciente. Dos investigadores que no conocían la asignación del tratamiento (Dres. De la Torre y García Camarero) realizaron la validación de los eventos finales en el centro de coordinación (Hospital Universitario Marqués de Valdecilla).
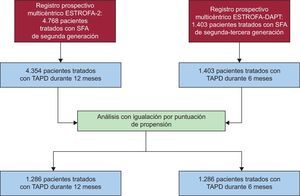
Para comparar esta cohorte con la cohorte de 12 meses de TAPD, se revisó la base de datos del estudio ESTROFA-2, publicado en 201022. Dicho estudio es un registro prospectivo y multicéntrico, diseñado para evaluar la incidencia de trombosis después del implante de un SFA de segunda generación, e incluyó a un total de 4.768 pacientes; de ellos, se trató a 4.354 con 12 meses de TAPD. Usando las bases de datos de ambos registros (ESTROFA-DAPT y ESTROFA-2), se llevó a cabo un análisis de puntuación de propensión para obtener dos cohortes de pacientes comparables a los que se hubiera tratado con 6 o con 12 meses de TAPD.
Estos dos registros, aunque realizados en épocas diferentes, se elaboraron con una metodología similar. El equipo de dirección y coordinación fue el mismo y los formularios de registro clínico a través de internet utilizaron un formato común. La mayoría de los centros activos en el ESTROFA-DAPT incluyeron también a pacientes en el ESTROFA-2 (13 de los 18 centros). Por último, los investigadores principales que participaron en el análisis de las dos bases de datos de registro fueron los mismos. La validación de los eventos se realizó con unas definiciones de eventos preestablecidas y se solicitó información adicional según fuera necesaria para la adecuada validación final.
Objetivos y definicionesEl objetivo principal del estudio fue la supervivencia libre de episodios a los 12 meses (muerte cardiaca, infarto de miocardio, revascularización y hemorragia mayor) en los dos grupos de TAPD. Los objetivos secundarios fueron: muerte por cualquier causa, muerte cardiaca, infarto de miocardio no mortal, revascularización coronaria, trombosis de stent definitiva, trombosis de stent definitiva o probable, trombosis de stent definitiva o probable en el periodo de 6 a 12 meses después de la intervención coronaria percutánea de cualificación para el estudio y episodios hemorrágicos mayores.
Las definiciones específicas de los eventos adversos cardiovasculares mayores fueron las siguientes. El infarto de miocardio se definió como un aumento típico y una reducción gradual (troponina), o un aumento y disminución más rápidas (creatincinasa-MB) de los marcadores bioquímicos compatible con una necrosis miocárdica de manera asociada a al menos una de las siguientes características: síntomas isquémicos, aparición de ondas Q patológicas en el electrocardiograma, cambios en el electrocardiograma indicativos de isquemia (elevación o depresión del segmento ST) o resultados patológicos compatibles con un infarto agudo de miocardio. La revascularización se definió como cualquier tipo de revascularización coronaria percutánea o quirúrgica clínicamente indicada. La trombosis de stent definitiva o probable se estableció según las definiciones del Academic Research Consortium23. Los episodios hemorrágicos se clasificaron según los criterios del Bleeding Academic Research Consortium (BARC)24.
Análisis estadísticoBasándose en los datos previos del ESTROFA-2 en el subgrupo de ese registro con un perfil similar al incluido en el ESTROFA-DAPT, se asumió una tasa de la variable de valoración principal de un 6,5-7,0% para ambos grupos. En consecuencia, con una potencia estadística del 80% y un error de tipo I unilateral del 5%, un tamaño muestral de 1.200 pacientes en cada grupo permitiría demostrar la no inferioridad entre los dos grupos para la variable de valoración principal, con un margen de no inferioridad fijo del 2,5%, que concuerda con los márgenes de no inferioridad utilizados en ensayos contemporáneos de SFA y en un ensayo de comparación de diferentes periodos de TAPD13. Si el límite superior del intervalo de confianza del 95% de la diferencia entre los tratamientos (TAPD a corto frente a largo plazo) era inferior al 2,5%, se rechazaría la hipótesis nula, lo cual indicaría que el grupo de tratamiento a corto plazo era no inferior respecto al grupo de tratamiento a largo plazo por lo que respecta al objetivo principal a los 12 meses.
Las variables continuas se presentan en forma de media ± desviación estándar. Las variables discretas se expresan en porcentajes. Las variables continuas se compararon con la prueba de la t de Student si seguían una distribución normal y con pruebas de Wilcoxon cuando no era así (evaluación del tipo de distribución con la prueba de Kolmogorov-Smirnov). Las variables discretas se compararon con la prueba de la χ2 o la exacta de Fischer, según fuera necesario. Se obtuvieron las curvas de Kaplan-Meier para la supervivencia libre de episodios de cada grupo o subgrupo considerado en el análisis y se compararon mediante la prueba de orden logarítmico (log rank test). Se realizaron pruebas de interacción para identificar subgrupos que conllevaran riesgos de trombosis de stent diferentes en los dos periodos distintos de TAPD.
Se aplicaron dos medidas para seleccionar series de pacientes comparables de estos dos registros. En primer lugar, se aplicaron los criterios de exclusión del ESTROFA-DAPT a la base de datos del ESTROFA-2, de manera que se excluyó del análisis a los pacientes tratados por lesiones del tronco común de la coronaria izquierda, pacientes con lesiones de bifurcaciones tratados con dos stents, pacientes con más de tres stents implantados y pacientes con antecedentes previos de trombosis tardía de SFA. En segundo lugar, se aplicó un proceso de apareamiento mediante igualación de la puntuación de propensión. Todas las variables incluidas en las tablas 1 y 2 se introdujeron como covariables para obtener las puntuaciones de propensión. Se utilizó el diálogo individualizado psmatching junto con el programa SPSS versión 19. El programa psmatching realiza todos los análisis en R mediante el SPSS R-Plugin (versión 2.10.1). El procedimiento constaba de tres fases: a) se estiman las puntuaciones de propensión con una regresión logística en la que se utiliza la prescripción de una pauta de TAPD de 6 meses como objetivo y todas las covariables como factores predictivos; b) se iguala a los pacientes, en relación 1:1, usando la igualación más próxima, que se basa en un algoritmo de igualación «avaro» (greedy) que clasifica las observaciones del grupo de TAPD de 6 meses según su puntuación de propensión estimada; este algoritmo iguala entonces cada unidad secuencialmente con la unidad del grupo de TAPD de 12 meses con la puntuación de propensión más próxima; para excluir los casos de mala igualación, se impone un límite de 0,2 en la desviación estándar del logit de la puntuación de propensión; para mejorar el equilibrio de las covariables, se desestiman las unidades situadas fuera del área de apoyo común (definida como la región de las distribuciones de las puntuaciones de propensión estimadas en los grupos de TAPD de 6 y 12 meses para las que se observaron unidades en ambos grupos), y c) se realiza una serie de verificaciones de la idoneidad del modelo para comprobar si se alcanza un equilibrio adecuado de las covariables a través del procedimiento de igualación; esto se hace calculando la medida de desequilibrio global y a través de cinco gráficos diagnósticos: histogramas de las puntuaciones de propensión de ambos grupos antes y después de la igualación, un gráfico de puntos de las puntuaciones de propensión individuales de las unidades del grupo de control y del grupo de tratamiento, con o sin igualación, histogramas de las diferencias estandarizadas de todos los términos (covariables, término cuadrático, interacciones) antes y después de la igualación, un diagrama de puntos que muestra la magnitud de las diferencias estandarizadas antes y después de la igualación para cada covariable, y un gráfico de líneas de las diferencias medias estandarizadas antes y después de la igualación. Se presenta una prueba de la χ2 del desequilibrio global. Esta prueba estadística, relacionada con la bien conocida prueba de T2 de Hotelling, evalúa simultáneamente si alguna variable o combinación lineal de variables está significativamente desequilibrada después de la igualación. En esta prueba se examinaron todas las covariables utilizadas para estimar la puntuación de propensión. Se calcularon las diferencias estandarizadas para todas las covariables antes y después de la igualación para evaluar el equilibrio después de esta. Una diferencia estandarizada < 10% en una covariable determinada indica un desequilibrio relativamente bajo.
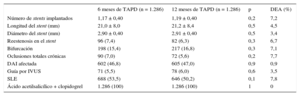
Características clínicas en los grupos igualados
| 6 meses de TAPD (n = 1.286) | 12 meses de TAPD (n = 1.286) | p | DEA (%) | |
|---|---|---|---|---|
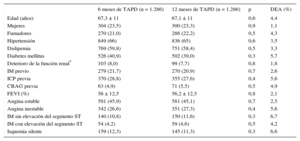
| Edad (años) | 67,3 ± 11 | 67,1 ± 11 | 0,6 | 4,4 |
| Mujeres | 304 (23,5) | 300 (23,3) | 0,9 | 1,1 |
| Fumadores | 270 (21,0) | 286 (22,2) | 0,5 | 4,3 |
| Hipertensión | 849 (66) | 836 (65) | 0,6 | 3,5 |
| Dislipemia | 769 (59,8) | 751 (58,4) | 0,5 | 3,3 |
| Diabetes mellitus | 526 (40,9) | 502 (39,0) | 0,3 | 5,7 |
| Deterioro de la función renal* | 103 (8,0) | 99 (7,7) | 0,8 | 1,8 |
| IM previo | 279 (21,7) | 270 (20,9) | 0,7 | 2,6 |
| ICP previa | 370 (28,8) | 355 (27,6) | 0,4 | 5,6 |
| CBAG previa | 63 (4,9) | 71 (5,5) | 0,5 | 4,9 |
| FEVI (%) | 56 ± 12,5 | 56,2 ± 12,5 | 0,8 | 2,1 |
| Angina estable | 591 (45,9) | 581 (45,1) | 0,7 | 2,5 |
| Angina inestable | 342 (26,6) | 351 (27,3) | 0,4 | 5,6 |
| IM sin elevación del segmento ST | 140 (10,8) | 150 (11,6) | 0,3 | 6,7 |
| IM con elevación del segmento ST | 54 (4,2) | 59 (4,6) | 0,5 | 4,2 |
| Isquemia silente | 159 (12,3) | 145 (11,3) | 0,3 | 6,6 |
CBAG: cirugía de revascularización aortocoronaria; DEA: diferencia estandarizada absoluta; FEVI: fracción de eyección ventricular izquierda; ICP: intervención coronaria percutánea; IM: infarto de miocardio; TAPD: tratamiento antiagregante plaquetario combinado doble.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
Características de la intervención en los grupos igualados
| 6 meses de TAPD (n = 1.286) | 12 meses de TAPD (n = 1.286) | p | DEA (%) | |
|---|---|---|---|---|
| Número de stents implantados | 1,17 ± 0,40 | 1,19 ± 0,40 | 0,2 | 7,2 |
| Longitud del stent (mm) | 21,0 ± 8,0 | 21,2 ± 8,4 | 0,5 | 4,5 |
| Diámetro del stent (mm) | 2,90 ± 0,40 | 2,91 ± 0,40 | 0,5 | 3,4 |
| Reestenosis en el stent | 96 (7,4) | 82 (6,3) | 0,3 | 6,7 |
| Bifurcación | 198 (15,4) | 217 (16,8) | 0,3 | 7,1 |
| Oclusiones totales crónicas | 90 (7,0) | 72 (5,6) | 0,2 | 7,7 |
| DAI afectada | 602 (46,8) | 605 (47,0) | 0,9 | 0,9 |
| Guía por IVUS | 71 (5,5) | 78 (6,0) | 0,6 | 3,5 |
| SLE | 688 (53,5) | 646 (50,2) | 0,1 | 7,8 |
| Ácido acetilsalicílico + clopidogrel | 1.286 (100) | 1.286 (100) | 1 | 0 |
DAI: descendente anterior izquierda; DEA: diferencia estandarizada absoluta; IVUS: ecografía intravascular; SLE: stents liberadores de everolimus; TAPD: tratamiento antiagregante plaquetario combinado doble.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
Se consideró estadísticamente significativo un valor de p < 0,05. Todos los análisis estadísticos se realizaron con el programa SPSS versión 19 para Windows.
RESULTADOSTal como se muestra en el diagrama de flujo del estudio (figura 1), partiendo de las cohortes originales del ESTROFA-2 y el ESTROFA-DAPT y después de realizar la igualación de la puntuación de propensión, se obtuvieron dos grupos de 1.268 pacientes cada uno: TAPD de 6 meses y TAPD de 12 meses. Las características clínicas y de la intervención de los dos grupos se presentan en las tablas 1 y 2. Se presentan las diferencias estandarizadas tras el apareamiento estimadas para todas las covariables. Todas fueron < 10%, lo que indica un equilibrio adecuado entre los grupos. No se observaron diferencias en el perfil de riesgo cardiovascular, el tipo de presentación clínica y las características de la intervención entre los grupos de TAPD de 6 y de 12 meses. Es de destacar que, como resultado de los criterios de inclusión aplicados en el ESTROFA-DAPT, el 60% de los pacientes de cada grupo se encontraban en una situación clínica estable, y solo un 15% de ellos habían presentado un infarto de miocardio.
Por lo que respecta a la distribución de los SFA, el utilizado con mayor frecuencia en ambos grupos fue el stent liberador de everolimus (el 53,5% del grupo de TAPD de 6 meses frente al 50,2% del grupo de TAPD de 12 meses; p = 0,1). El stent liberador de zotarolimus se utilizó en el 28,8% de los pacientes del grupo de TAPD de 6 meses y el 49,8% del grupo de 12 meses, lo cual corresponde a las marcas Resolute® y Endeavor® respectivamente. El stent liberador de biolimus se utilizó en el 12,7% de los pacientes del grupo de TAPD de 6 meses.
No se perdió el seguimiento de ningún paciente y las tasas de adherencia al tratamiento fueron del 97 y el 95% en los grupos de TAPD de 6 y de 12 meses respectivamente. Esto significa que solo un 3% de los pacientes del grupo de TAPD de 6 meses ampliaron la terapia doble más allá de los 6 meses y solo un 5% de los pacientes del grupo de TAPD de 12 meses prolongaron la terapia doble más allá del primer año.
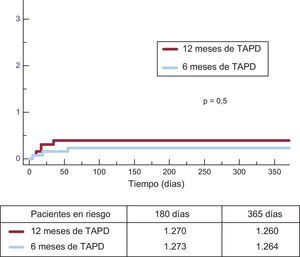
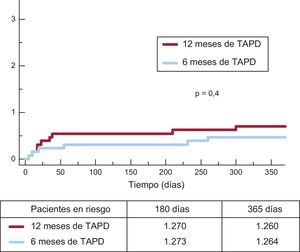
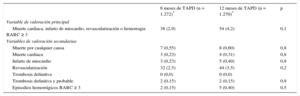
En la tabla 3 se muestran los eventos clínicos en un seguimiento de 12 meses. No se observaron diferencias significativas entre los grupos por lo que respecta al objetivo principal (hazard ratio = 0,75; intervalo de confianza del 95%, 0,54-1,05 para el grupo de TAPD de 6 meses frente al de 12 meses) o cualquiera de las variables de valoración consideradas (p = 0,001 para la no inferioridad). No solo hubo una incidencia similar de episodios isquémicos en los grupos de TAPD de 6 y 12 meses, sino que además la incidencia de la trombosis definitiva o trombosis definitiva o probable fue numéricamente inferior en el grupo de TAPD de 6 meses (figuras 2 y 3). Los episodios hemorrágicos mayores fueron numéricamente más frecuentes en el grupo de TAPD de 12 meses, pero no hubo una diferencia significativa en comparación con el grupo de TAPD de 6 meses. La incidencia de eventos clínicos en el periodo de 6 a 12 meses se muestra en la tabla 4, mientras los pacientes no recibían/sí recibían TAPD en los grupos de TAPD de 6 y de 12 meses, respectivamente. No se observaron diferencias entre los grupos en este periodo.
Variables de valoración a los 12 meses de seguimiento
| 6 meses de TAPD (n = 1.286) | 12 meses de TAPD (n = 1.286) | p | |
|---|---|---|---|
| Variable de valoración principal | |||
| Muerte cardiaca, infarto de miocardio, revascularización o hemorragia BARC ≥ 3 | 65 (5,0) | 85 (6,6) | 0,09 |
| Variables de valoración secundarias | |||
| Muerte por cualquier causa | 21 (1,6) | 24 (1,9) | 0,4 |
| Muerte cardiaca | 11 (0,9) | 13 (1,0) | 0,9 |
| Infarto de miocardio | 10 (0,85) | 13 (1,00) | 0,8 |
| Revascularización | 41 (3,2) | 55 (4,3) | 0,1 |
| Trombosis definitiva | 3 (0,24) | 5 (0,40) | 0,5 |
| Trombosis definitiva y probable | 6 (0,5) | 9 (0,7) | 0,4 |
| Episodios hemorrágicos BARC ≥ 3 | 10 (0,8) | 18 (1,4) | 0,2 |
BARC: Bleeding Academic Research Consortium; TAPD: tratamiento antiagregante plaquetario combinado doble.
Los datos expresan n (%).
Resultados del mes 6 al mes 12
| 6 meses de TAPD (n = 1.272)* | 12 meses de TAPD (n = 1.270)* | p | |
|---|---|---|---|
| Variable de valoración principal | |||
| Muerte cardiaca, infarto de miocardio, revascularización o hemorragia BARC ≥ 3 | 38 (2,9) | 54 (4,2) | 0,1 |
| Variables de valoración secundarias | |||
| Muerte por cualquier causa | 7 (0,55) | 8 (0,60) | 0,8 |
| Muerte cardiaca | 3 (0,23) | 4 (0,31) | 0,8 |
| Infarto de miocardio | 3 (0,23) | 5 (0,40) | 0,8 |
| Revascularización | 32 (2,5) | 44 (3,5) | 0,2 |
| Trombosis definitiva | 0 (0,0) | 0 (0,0) | |
| Trombosis definitiva y probable | 2 (0,15) | 2 (0,15) | 0,9 |
| Episodios hemorrágicos BARC ≥ 3 | 2 (0,15) | 5 (0,40) | 0,5 |
BARC: Bleeding Academic Research Consortium; TAPD: tratamiento antiagregante plaquetario combinado doble.
Los datos expresan n (%).
Un análisis de subgrupos no reveló interacciones significativas. Es de destacar que, en el subgrupo de pacientes con infarto de miocardio con o sin elevación del segmento ST, que constituía un 15% del total de pacientes del grupo de TAPD de 6 meses y un 16,2% del grupo de TAPD de 12 meses, se produjeron episodios del objetivo principal en un 7,7 y 8,1%, respectivamente (p = 0,8).
DISCUSIÓNLos resultados de este estudio indican que, para pacientes seleccionados (que constituyen alrededor de un 40% de los pacientes tratados con SFA), una pauta de TAPD de 6 meses parece ser igual de segura que una pauta de TAPD de 12 meses en cuanto a tasas de eventos isquémicos.
El uso de SFA reduce significativamente la necesidad de nuevas intervenciones de revascularización coronaria. Los SFA de nueva generación, en especial los stents liberadores de everolimus, se asocian a reducciones de las tasas de trombosis en comparación con los SFA de primera generación o incluso con los SMSR3–7. En consecuencia, una importante limitación en el uso de los SFA está en la necesidad de una pauta de TAPD de mayor duración en vez de la pauta de TAPD de 1 mes que se usa tras el implante de SMSR. El TAPD a largo plazo se asocia a mayor riesgo de hemorragia y mayor coste. Estas limitaciones explican por qué, en algunos contextos sin restricciones aparentes para el uso de SFA, hasta un 15-20% de los pacientes no se beneficiarían del SFA, sobre todo los de edad avanzada.
Varios ensayos han comparado un periodo breve de 3 a 6 meses con un periodo más largo de 12 a 24 meses10–16. Un análisis combinado de los primeros cuatro ensayos aportó evidencia de ausencia de diferencias significativas en cuanto a los episodios isquémicos entre los periodos de tratamiento más corto y más prolongado, pero la incidencia de hemorragias fue mayor en el tratamiento más largo17. Se han presentado recientemente otros tres ensayos que han abordado la comparación de los periodos de TAPD corto y largo14–16. En el ensayo SECURITY14, se comparó el TAPD de 6 meses con el de 12 meses en un total de 1.399 pacientes de bajo riesgo tratados con SFA de segunda generación en la angina estable o inestable (se excluyó el infarto como indicación para la intervención coronaria percutánea). No se observaron diferencias en ninguno de los objetivos clínicos a los 12 meses. Las principales limitaciones son el tamaño muestral, la baja adherencia al protocolo (un 34% de los pacientes asignados a un TAPD de 6 meses continuaron con el tratamiento después de ese lapso) y la inclusión de pacientes con un riesgo anatómico bajo. En el ensayo ITALIC15, se asignó aleatoriamente a 1.894 pacientes con demostrada ausencia de resistencia al ácido acetilsalicílico a TAPD de 6 o de 24 meses tras implante de un stent Xience®. No se observaron diferencias en ninguno de los objetivos clínicos, incluidas las complicaciones hemorrágicas. Por último, en el ensayo ISAR-SAFE16, que no se ha publicado todavía, se programó la inclusión de 6.000 pacientes, pero el estudio se interrumpió tras la inclusión de 4.000, a los que se asignó aleatoriamente a TAPD de 6 o de 12 meses tras implante de SFA (el 89% de nueva generación). Nuevamente, no se observaron diferencias en ninguno de los objetivos de eficacia o de seguridad.
Sin embargo, estos estudios tienen algunas limitaciones. Al tratarse de ensayos clínicos, su representatividad clínica es limitada, la adherencia al protocolo fue insuficiente10,14, se utilizaron SFA de primera generación10,11,16 y SMSR10, se evaluó previamente la resistencia al ácido acetilsalicílico15 y se utilizó ampliamente o incluso exclusivamente la primera versión de los stents liberadores de zotarolimus, con una pérdida luminal próxima a la de los SMSR10,12,13.
En el amplio ensayo DAPT25 se evaluó un periodo de TAPD de más de 12 meses después del implante de SFA. En ese estudio participaron pacientes con un periodo de 12 meses sin incidencias tras una intervención coronaria percutánea, y se los asignó aleatoriamente la retirada del TAPD en ese momento o tras una extensión del periodo de TAPD (hasta los 30 meses). Se incluyó a pacientes tratados con SFA de primera y de segunda generación. El periodo de TAPD más largo (30 meses) produjo una disminución de los acontecimientos adversos cardiacos, pero con un aumento de las hemorragias en comparación con el periodo de 12 meses. Sin embargo, el tipo de SFA alcanzó la interacción para el objetivo de valoración (hazard ratio = 0,52 para el stent liberador de paclitaxel y hazard ratio = 0,89 para el stent liberador de everolimus; p = 0,048 para la interacción).
Los registros clínicos que evalúan el riesgo de trombosis después de una retirada temprana del TAPD tienen también limitaciones por su diseño retrospectivo8,9. Hay varios sesgos destacables, puesto que la retirada del tratamiento podría haberse decidido tras considerar cuidadosamente el riesgo de trombosis. No hay registros prospectivos amplios basados en la práctica clínica real que evalúen periodos de TAPD más cortos.
Por último, una limitación importante de la aplicabilidad de una pauta de TAPD de corta duración es que los pacientes que se encuentran en el contexto de un evento coronario inestable (la mayoría de los pacientes tratados con intervención coronaria percutánea en la actualidad) obtienen un efecto beneficioso con un periodo de 12 meses de TAPD en comparación con 1 mes18,19. Sin embargo, no se sabe si este beneficio se mantiene para la pauta de 12 meses en comparación con un tratamiento de 6 meses. En consecuencia, el debate continúa abierto y serán necesarios ensayos y registros prospectivos adecuadamente diseñados en los que se utilicen SFA de la actual generación.
Atendiendo a estas consideraciones, se diseñó el registro prospectivo y multicéntrico ESTROFA-DAPT para evaluar la pauta de TAPD de 6 meses. Los criterios de inclusión se establecieron para incluir principalmente a pacientes con enfermedad coronaria estable. Por lo que respecta a los pacientes inestables, solo se incluyó a los que presentaban angina inestable sin aumento de los marcadores cardiacos. También se incluyó a pacientes con infarto de miocardio con elevación del segmento ST o con infarto de miocardio sin elevación del segmento ST que tenían un riesgo de hemorragia que no obviaba la necesidad de un SFA para optar por un SMSR. Existen varias puntuaciones del riesgo de hemorragia en el hospital que pueden usarse en pacientes con SCA, pero estos algoritmos no se diseñaron ni se estandarizaron para predecir el riesgo de hemorragia en el contexto de un TAPD de larga duración. En consecuencia, esta decisión se dejó al criterio de los investigadores para que evaluaran la relación entre el riesgo de reestenosis y el riesgo de hemorragia. Por lo que respecta a la intervención, se excluyó a los pacientes con stents para lesiones del tronco común de la coronaria izquierda y a los tratados en bifurcaciones con una estrategia de dos stents o que necesitaron más de tres stents, dado el riesgo considerablemente superior de trombosis del stent en estos casos10.
Para poder comparar de manera efectiva los resultados de esta serie de TAPD de 6 meses con cohortes de TAPD de 12 meses, se utilizó la cohorte de 12 meses de TAPD de la base de datos del estudio ESTROFA-222. Este registro publicado anteriormente incluyó prospectivamente a un total de 4.768 pacientes tratados con SFA de segunda generación; entre ellos, 4.354 (91%) pacientes tratados con una pauta de TAPD de 12 meses según lo establecido en la guía actualmente en vigor.
Se aplicaron dos medidas para obtener series de pacientes comparables de estos registros. En primer lugar, se excluyó a los pacientes del ESTROFA-2 que cumplían criterios de exclusión del ESTROFA-DAPT (concretamente los tratados por lesiones del tronco común, con bifurcaciones tratadas con dos stents, con implante de más de tres stents y los que tenían antecedentes de trombosis tardía del SFA). En segundo lugar, se aplicó un proceso de igualación por puntuación de propensión.
Por último, se incluyeron dos grupos comparables para todas las características clínicas y de intervención en el análisis de los resultados. Solo se incluyeron SFA que no eran de primera generación en ambos registros, con un porcentaje similar de stents liberadores de everolimus. Sin embargo, el modelo de stent liberador de zotarolimus fue diferente, puesto que se utilizó el Endeavor® en el TAPD de 12 meses (ESTROFA-2) y el Resolute® en el TAPD de 6 meses (ESTROFA-DAPT). El stent Endeavor®, que es la primera versión del stent liberador de zotarolimus, mostró una pérdida luminal tardía próxima a la observada con el SMSR (0,6mm), mientras que el stent Resolute® mostró una pérdida luminal tardía de alrededor de 0,15mm. De hecho, en los ensayos RESET y OPTIMIZE se observó ausencia de diferencias entre el TAPD de 3 meses y el de 12 meses con el stent Endeavor®12,13. En consecuencia, este factor diferencial podría haber influido negativamente en los resultados del grupo de TAPD de 6 meses, pero no parece que haya sido así. En consecuencia, esta diferencia respalda los resultados de la estrategia de TAPD de 6 meses.
LimitacionesUna limitación importante de este estudio es que no hubiera asignación aleatoria. Los registros conllevan el problema de un sesgo secundario a factores de confusión conocidos y desconocidos, lo que no siempre se tiene en cuenta en un ajuste estadístico cuidadoso con análisis igualados como el de la puntuación de propensión.
No obstante, aunque los ensayos aleatorizados son el diseño más apropiado para comparar tratamientos, los registros siguen siendo una fuente importante de conocimientos e información, teniendo en cuenta las limitaciones conocidas de los ensayos aleatorizados, como el coste que limita el tamaño muestral, la inclusión restrictiva más allá de los criterios de exclusión, la investigación no independiente o el tratamiento y seguimiento de los pacientes que no es «plenamente la práctica clínica real».
Una segunda limitación es el tamaño muestral relativamente bajo de varios de los subgrupos, especialmente el de SCA, lo cual no permite extraer conclusiones sólidas respecto a la seguridad del TAPD de corta duración en estos contextos. Otra limitación es la naturaleza de la selección de los pacientes. Tal como se describe en el apartado «Métodos», el estudio tuvo como enfoque principal la seguridad. Se excluyó sistemáticamente de los ensayos clínicos a los subgrupos con un efecto beneficioso demostrado tras 12 meses de TAPD (pacientes con SCA sin riesgo alto de hemorragia)18,19 y los que tenían mayor riesgo de trombosis y mostraron tendencia a un efecto beneficioso con un TAPD más largo10.
Una consideración importante es que los periodos de inscripción fueron diferentes en cada registro. Sin embargo, la posible influencia de esta diferencia de tiempo podría haberse atenuado por los siguientes factores: a) en ambos registros se utilizaron solamente SFA de nueva generación; b) solo se incluyó en el análisis a los pacientes tratados con clopidogrel, y en el registro más reciente (ESTROFA-DAPT) no se trató a los pacientes con nuevos fármacos antiagregantes plaquetarios según el protocolo, basándose en los criterios de inclusión (pacientes en un estado clínico estable o tras haber presentado un SCA pero con un riesgo de hemorragia moderadamente alto), y c) las metodologías de ambos registros fueron muy similares, como ya se ha indicado en «Métodos».
CONCLUSIONESUn periodo de TAPD de 6 meses tras el implante de un SFA de nueva generación parece ser no inferior a un TAPD de 12 meses en los contextos clínicos y angiográficos evaluados en este estudio multicéntrico.
FINANCIACIÓNEste estudio ha sido financiado por el Grupo de Trabajo Español de Cardiología Intervencionista de la Sociedad Española de Cardiología para el cuaderno de recogida de datos (CRD) electrónico basado en la red.
CONFLICTO DE INTERESESNinguno.