En este trabajo se comentan los principales avances en arritmias y estimulación cardiaca aparecidos entre 2013 y 2014 seleccionados como más relevantes. Se revisan especialmente las publicaciones referidas al tratamiento intervencionista de la fibrilación auricular y de las arritmias ventriculares, y los avances en estimulación cardiaca y desfibrilador automático implantable, con mención especial al paciente mayor.
Palabras clave
La elevada prevalencia de la fibrilación auricular (FA) en nuestro entorno1, con su elevado impacto sociosanitario, está conduciendo a un gran esfuerzo para la evolución científica de la ablación de FA, especialmente en lo que concierne al desarrollo de diferentes técnicas y a la selección de candidatos.
Resultados generales de la ablación en diferentes poblacionesLa eficacia tras un primer procedimiento de ablación de FA en un candidato «óptimo» (FA paroxística, sin cardiopatía ni dilatación auricular) es del 60-80%. Datos derivados de un metanálisis publicado recientemente confirman, de manera uniforme, la clara superioridad de la ablación respecto al tratamiento antiarrítmico, con recurrencias del 28 y el 65%, respectivamente2. El estudio CAMTAF3 traslada esta superioridad de la ablación respecto al tratamiento médico a pacientes con insuficiencia cardiaca, fracción de eyección (FE) deprimida y FA persistente. La ablación mejoró además la FE (del 32±8 al 40±12%), la calidad de vida, el consumo de oxígeno y el péptido natriurético tipo B. Como contrapartida, este estudio pone de manifiesto una moderada eficacia de un solo procedimiento (del 38%), ya que 11 de 26 pacientes (42%) requieren como mínimo un segundo procedimiento.
El estudio RAAFT-2 demuestra que la ablación como primer tratamiento de la FA paroxística es superior a los fármacos antiarrítmicos, aunque con un índice de recurrencias tras un primer procedimiento no óptimo (55%)4.
Respecto a la eficacia de la ablación en pacientes con FA persistente, este año se han publicado los resultados del estudio multicéntrico español SARA5, primer estudio aleatorizado y controlado publicado en la literatura mundial que compara la FA con la ablación. En 146 pacientes, la eficacia de la ablación en la supresión de episodios de FA al año fue claramente superior a la de los fármacos antiarrítmicos (70,4 y 43,7%), con una reducción del riesgo absoluto del 26,6%.
El índice de complicaciones graves relacionadas con el procedimiento parece decrecer (especialmente en lo referente a la estenosis de las venas pulmonares) y actualmente es del 1-5%6.
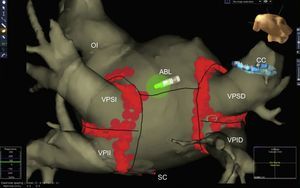
Avances en técnicas y estrategia de la ablaciónEl aislamiento de venas pulmonares mediante catéter de radiofrecuencia con sistemas de navegación no fluoroscópica, asociado o no a integración de la imagen segmentada de la aurícula izquierda obtenida mediante angiografía por tomografía computarizada o resonancia magnética, continúa siendo el estándar de entre todas las técnicas de ablación de FA (figura 1). Entre las nuevas maniobras diagnósticas durante ablación de FA, cabe destacar la documentación de captura local y bloqueo de salida en una vena pulmonar durante la estimulación desde la vena pulmonar ipsilateral, lo cual confirma el aislamiento eléctrico de ambas venas pulmonares, unidas por conexiones endocárdicas (carina) o epicárdicas en más del 80% de casos7.
Imagen de la aurícula izquierda obtenida mediante segmentación de tomografía computarizada multicorte y navegación no fluoroscópica tras una ablación de fibrilación auricular (aislamiento circunferencial de venas pulmonares). ABL: ablación; CC: catéter circular; OI: orejuela; SC: catéter de seno coronario; VPID: vena pulmonar inferior derecha; VPSI: vena pulmonar inferior izquierda; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha.
La probable utilidad de los catéteres que monitorizan la orientación y grado de contacto de su punta con la aurícula, todavía está por confirmar con estudios aleatorizados8.
La crioablación con balón de segunda generación ofrece una eficacia en torno al 80%9. En nuestro entorno, en el 80% de centros que realizan ablación de FA se hacen menos de 50 procedimientos anuales de este tipo6, por lo cual es especialmente crítico disponer de una técnica simple y con una rápida curva de aprendizaje, características que se han atribuido a la crioablación. A este respecto, un estudio realizado por un centro de este tipo informa sobre datos de eficacia y seguridad aparentemente comparables con las series de crioablación procedentes de centros de alto volumen10.
En relación con la ablación «en fase» con radiofrecuencia mediante catéter multielectrodo, el estudio TTOP-AF11 informa sobre un 44% de recurrencias a 6 meses en pacientes con FA persistente y persistente de larga duración. La formación (asintomática) de trombo en el catéter de ablación y la estenosis de vena pulmonar arrojan dudas sobre esta técnica, al margen del ya conocido daño vascular cerebral silente asociado a esta.
Por último, en pacientes con FA no paroxística la identificación de rotores como guía para la ablación ha mostrado recientemente datos de eficacia al año favorables en comparación con el solo aislamiento de venas pulmonares (82 y 45%, respectivamente)12. Hay que destacar, sin embargo, que los resultados favorables de este tipo de estrategias de ablación adicional, por lo general, no se han replicado en estudios posteriores.
Actualización de las guías de práctica clínicaLas guías de la AHA/ACC/HRS de 201413 consideran indicación clase I (evidencia A) la ablación en pacientes con FA paroxística sintomática refractaria a ≥ 1 fármaco antiarrítmico, y IIa si la FA es persistente. La ablación como primera línea terapéutica se considera razonable (IIb), aunque exclusivamente en pacientes con FA paroxística y sin cardiopatía estructural (tabla 1). No hay recomendaciones específicas sobre la estrategia de ablación a seguir en pacientes con FA no paroxística, más allá de conseguir el aislamiento eléctrico de venas pulmonares.
Indicaciones de la ablación con catéter de fibrilación auricular para mantener el ritmo sinusal13
| Clase I |
| 1. FA paroxística sintomática refractaria o intolerante a, al menos, 1 fármaco antiarrítmico de clase I o III (nivel de evidencia A) |
| Clase IIa |
| 1. FA persistente sintomática refractaria o intolerante a, al menos, 1 fármaco antiarrítmico de clase I o III (nivel de evidencia A) |
| 2. FA paroxística sintomática recurrente antes de iniciar fármacos antiarrítmicos y tras sopesar los riesgos y beneficios del tratamiento farmacológico y de la ablación (nivel de evidencia B) |
| Clase IIb |
| 1. FA persistente de larga duración sintomática refractaria o intolerante a, al menos, 1 fármaco antiarrítmico de clase I o III (nivel de evidencia B) |
| 2. FA persistente sintomática antes de iniciar fármacos antiarrítmicos (nivel de evidencia C) |
| Clase III |
| 1. Pacientes que no pueden ser tratados con anticoagulantes durante y después del procedimiento (nivel de evidencia C) |
| 2. No se debe emplear la ablación de FA con el único objetivo de suspender la anticoagulación (nivel de evidencia C) |
FA: fibrilación auricular.
Adaptado de January et al13 con permiso.
Tras 16 años de experiencia en ablación de FA, los índices de eficacia y complicaciones relacionados con el procedimiento son excelentes, aunque existe margen de mejora. Además de que la aparición de avances técnicos y mejora en la pericia de los operadores puedan tener un impacto adicional, la optimización de estos resultados parece tener más que ver, en el futuro próximo, con la selección del paciente candidato, más allá del tipo de FA, del tamaño auricular y de la presencia de cardiopatía estructural.
A lo largo de este año, 3 nuevas características clínicas relacionadas con el remodelado auricular, la extensión de la fibrosis auricular, la esfericidad auricular (cuantificadas ambas por resonancia magnética) y el síndrome de apnea-hipopnea del sueño, se han confirmado como altamente predictores de recurrencia arrítmica tras ablación (hasta en un 70% de casos)14–16. Unos datos de prevalencia (> 50% de pacientes con FA tienen algún grado de estos 3 procesos) y de recurrencia arrítmica tan elevados sugieren la conveniencia de incluir el análisis de estos factores en el cribado previo a la ablación.
Cierre percutáneo de la orejuela izquierdaOtro de los temas más estudiados a lo largo de este último año ha sido el cierre percutáneo de la orejuela izquierda como tratamiento complementario de la FA (figura 2). La mayoría de estudios con cierre percutáneo, tanto con dispositivo Watchman17,18 como Amplatzer19, han mostrado no inferioridad con la warfarina, con clara mejoría en el porcentaje de éxitos del procedimiento (que se sitúa en el 95-98%) y reducción de las complicaciones (2-4%), tanto en pacientes con contraindicación absoluta para anticoagulación17,18 como sin ella19. Además, esta estrategia ha mostrado un claro beneficio en los estudios de coste-efectividad20.
Finalmente, la estrategia combinada de ablación de FA y cierre percutáneo de la orejuela izquierda emerge como un tratamiento hibrido prometedor y sumamente atractivo en subgrupos de pacientes con FA sintomática en los que es necesario suspender el tratamiento anticoagulante21.
Novedades en el tratamiento farmacológico de la fibrilación auricular: fármacos antiarrítmicos y anticoagulantesCon respecto a la dronedarona, en un estudio que incluye a 4.856 pacientes se subraya que, más allá de su discutida eficacia antiarrítmica, tal vez las alertas por hepatotoxicidad y muerte súbita por proarritmia hayan sido exageradas, con ausencia de muertes por esta doble causa en esta amplia población22.
Según el recientemente publicado registro AFBAR23, un 42% de pacientes con FA sometidos a control de frecuencia cardiaca toma digoxina (sola o en asociación con bloqueadores beta). Pese a evidencias previas, el uso de digoxina no se asoció a un exceso de mortalidad global u hospitalización por cualquier causa, tampoco en el subgrupo de pacientes con insuficiencia cardiaca.
La evaluación y comparaciones de los nuevos anticoagulantes orales para la prevención de las embolias continúa siendo un tema de máxima actualidad.
Durante este año se han presentado los datos de un nuevo fármaco comparado con la warfarina, el edoxabán, que demostró no ser inferior a la warfarina en la prevención de eventos embólicos y con menor número de eventos hemorrágicos mayores (20%) o muertes de causa cardiovascular24. Además han aparecido múltiples registros acerca del uso de los nuevos anticoagulantes orales en el mundo real que muestran una eficacia y unos riesgos de hemorragia similares a los de los estudios clínicos25,26. Los nuevos anticoagulantes orales en otras situaciones clínicas como durante la cardioversión27 con resultados similares a la warfarina. Esto ha facilitado la publicación de una guía específica a este respecto28.
Otro interesante estudio de Winkle et al29, nos ofrece la alternativa de poder retirar la anticoagulación y sustituirla por antiagregación en pacientes con ictus previo a los que se les haya realizado una ablación efectiva de FA (sin recurrencia a los 2 años de la ablación), aunque se debe tomar con cautela este resultado y demostrar la ausencia de FA, porque en otros estudios la retirada de la anticoagulación es un factor independiente de mortalidad.
En relación con los pacientes ancianos con FA, los registros han mostrado previamente la infrautilización del tratamiento anticoagulante en esta población, pero ninguno lo había hecho de forma tan clara como el recientemente realizado en Glasgow30 centrado en pacientes que no solo tenían FA sino que habían presentado previamente un ictus. La tasa de anticoagulación de estos enfermos, de edad media de 78 años, fue tan solo del 34% y la edad se asoció de forma clara a la no prescripción de tratamiento anticoagulante.
AVANCES EN EL TRATAMIENTO DE LAS ARRITMIAS VENTRICULARESAblación de sustrato de taquicardia ventricularEl escaneo de voltaje bipolar es útil para identificar zonas con mayor voltaje en el interior de la cicatriz y es uno de los métodos descritos clásicamente para identificar los canales de conducción lenta, que constituyen istmos críticos de los circuitos de las taquicardias ventriculares y son diana de los procedimientos de ablación31. No obstante, la relación de los canales de conducción lenta identificados mediante este método con los istmos de taquicardia ventricular se ha cuestionado en un estudio reciente en el que se ha mostrado que solo un 30% de los canales de conducción lenta identificados por escaneo de voltaje se relacionaban con el istmo de alguna taquicardia ventricular32. También recientemente, en una serie de pacientes con displasia arritmogénica del ventrículo derecho, solo el 40% de los istmos de las taquicardias ventriculares inducidas se encontraban en canales de conducción lenta identificados por escaneo de voltaje33. En este trabajo, la identificación de canales de conducción lenta mediante el análisis de la secuencia de activación del componente retrasado de los electrogramas fraccionados identificó un mayor número de canales de conducción lenta que el escaneo de voltaje, incluyendo a la mayoría (60%) de los canales de conducción lenta que constituían istmo de taquicardia ventricular, lo que sugiere la necesidad de incorporar este método en la ablación de sustrato de taquicardia ventricular.
La identificación y caracterización del sustrato arrítmico mediante resonancia magnética cardiaca con realce tardío ha demostrado ser de gran utilidad para planificar y guiar los procedimientos de ablación de taquicardia ventricular. En una serie reciente, en la mayoría de las taquicardias ventriculares (96%) se realizaron ablaciones en segmentos con realce tardío, cuya presencia en epicardio identifica el origen epicárdico de la taquicardia ventricular con una sensibilidad del 80% y una especificidad del 89%34. Otros estudios recientes sugieren que la caracterización tridimensional del sustrato de forma, mediante resonancia magnética cardiaca tridimensional integrada en los sistemas de navegación electroanatómica, podría facilitar los procedimientos de ablación de taquicardia ventricular35.
En pacientes con miocardiopatía no isquémica, la caracterización del sustrato puede ser compleja, debido a que normalmente estos pacientes presentan focos aislados de cicatriz a nivel mediomiocárdico septal, que se enmascara durante el mapeo bipolar por el tejido sano circundante. Un estudio reciente ha demostrado que el mapeo durante estimulación desde el septo basal del ventrículo derecho en pacientes con cicatriz septal, pone de manifiesto la existencia de zonas con conducción enlentecida y la presencia de potenciales tardíos que no se habían observado durante el mapeo en ritmo sinusal36.
Recientemente se han propuesto técnicas más selectivas dirigidas al aislamiento del sustrato o a la eliminación de canales de conducción lenta; por ejemplo, la ablación circunferencial con aislamiento eléctrico del sustrato37 o el scar dechanneling mediante la utilización de catéteres multipolo con los que la ablación se dirige selectivamente a potenciales tardíos que muestra precocidad relativa en el componente retrasado38.
Ablación de extrasistolia ventricularLa ablación de extrasistolia ventricular en pacientes con FE deprimida ha mostrado recientemente que, independientemente de la etiología de la disfunción ventricular y de que esta sea inducida o empeorada por la extrasistolia, se asocia a una mejoría progresiva clínica y funcional (incluyendo mejora en la FE). Una carga de extrasistolia ventricular > 13% identificó a los pacientes que se benefician de la ablación39.
Desfibrilador implantable. Prevención de terapias inapropiadas y estratificación de riesgo de muerte súbitaRecientemente se han publicado los resultados del estudio aleatorizado ADVANCE III40, que ha analizado el efecto del alargamiento de los periodos de detección, tanto en pacientes de prevención primaria como secundaria. Dicho incremento de los intervalos de detección a 30-40 (respecto a la configuración nominal de 18-24) se asoció a una reducción de las terapias de desfibrilador automático implantable (DAI) y choques en un 25 y 34%, respectivamente.
La estratificación del riesgo de muerte súbita tras el infarto de miocardio sigue siendo motivo de estudio. Zaman et al41 analizaron la utilidad del estudio electrofisiológico para guiar el implante de DAI en la fase aguda posinfarto en una serie de pacientes sometidos a angioplastia primaria que presentaron una FE<40% en los primeros 4 días posinfarto. Los pacientes con FE<30 o<35% y clase funcional de la New York Heart AssociationII/III en los que el estudio electrofisiológico fue negativo presentaron una supervivencia libre de arritmias ventriculares y una incidencia de muerte súbita similar a los pacientes con FE > 40%, lo que sugiere que el estudio electrofisiológico negativo podría identificar en la fase aguda postinfarto a pacientes con FE muy deprimida que tienen un riesgo bajo de muerte súbita y que no precisarían el implante de DAI. Por otro lado, Izquierdo et al42 analizaron el valor adicional de la determinación mediante resonancia magnética cardiaca del tamaño de infarto en la predicción de eventos arrítmicos en pacientes sometidos a angioplastia primaria, y mostraron que la práctica totalidad de los eventos a lo largo de 2 años aparecieron en pacientes con infartos extensos (> 23,5g/m2) y FE<35%, mientras que los pacientes con FE muy deprimida y tamaño de infarto pequeño no presentaron eventos en el seguimiento.
Estos estudios ponen de manifiesto la baja especificidad de la FE en la predicción de eventos arrítmicos y la necesidad de desarrollar nuevas herramientas que permitan optimizar la selección de pacientes candidatos a implante de DAI en la fase aguda posinfarto.
En relación con novedades tecnológicas, el desarrollo del DAI totalmente subcutáneo (figura 3), cuyos componentes son todos extravasculares, ya disponible para su uso rutinario, abre nuevas posibilidades para esta terapia en algunos subgrupos de pacientes43. A falta de estudios aleatorizados, los resultados del registro prospectivo EFFORTLESS44 en una cohorte de casi 500 pacientes sugieren que el DAI subcutáneo tiene una eficacia y una tasa de eventos similar a la de los DAI convencionales y evita las complicaciones, a veces serias, de los electrodos intracavitarios.
Respecto a los pacientes añosos, la edad media de los pacientes a los que se les implanta un DAI sigue aumentando. En el último Registro Español de DAI45, con datos del 2012, que incluye los implantes en edad pediátrica, la edad media fue de 62 años (rango de 7 a 90 años). Por este motivo resulta relevante el trabajo del grupo italiano ClinicalService46 que, tras analizar más de 6.300 implantes de desfibrilador, mostró la importancia tanto de la edad como de la comorbilidad en el pronóstico vital de estos pacientes. El dato es particularmente importante en ancianos en los que, con frecuencia, la muerte es de origen no cardiaco. En este sentido, este año se ha publicado un documento conjunto de la Sociedad Española de Geriatría y Gerontología, la Sociedad Española de Cuidados Paliativos y la Sección de Cardiología Geriátrica de la Sociedad Española de Cardiología47 respecto al manejo de los DAI en las fases finales de la vida. Cada vez es más frecuente encontrarse ancianos portadores de DAI en fase terminal de una enfermedad avanzada, no solo insuficiencia cardiaca refractaria sino también enfermedades oncológicas, otras insuficiencias orgánicas o enfermedades neurodegenerativas con mal pronóstico a corto plazo. El documento se centra en el proceso de toma de decisiones en la fase final de su vida, incluyendo un algoritmo con los pasos a seguir cuando el paciente solicita el DAI hasta que se realiza la desactivación. Sin embargo, en este sentido, y para establecer recomendaciones aplicables a la práctica clínica, sería necesaria la elaboración de documentos de consenso que incluyeran la visión y perspectiva de todas las subespecialidades que se enfrentan a este contexto clínico y, singularmente, las del ámbito de la electrofisiología y estimulación cardiaca.
Conte et al48 han publicado un interesante trabajo en el que se muestra el pronóstico relativamente benigno del síndrome de Brugada en pacientes ancianos. Tras estudiar a 437 pacientes con este síndrome, 25 de ellos con más de 70 años han mostrado el mejor pronóstico en el subgrupo de pacientes de mayor edad. Es destacable que tras un seguimiento medio de 54±18 meses, ningún paciente > 70 años presentó eventos arrítmicos.
NOVEDADES EN ESTIMULACIÓN CARDIACAMarcapasos sin cables y sistemas biológicosSe han publicado 2 estudios que pueden suponer un cambio paradigmático de la estimulación cardiaca a medio-largo plazo. Reddy et al49 presentan los resultados clínicos y de seguridad de un marcapasos sin cables implantado en 33 pacientes. Se trata de un dispositivo VVIR completamente encapsulado que incluye los circuitos electrónicos, la batería de litio y los electrodos, implantable en el ápex del ventrículo derecho. La tasa de éxito de implante fue del 97%. Un paciente presentó perforación cardiaca y taponamiento y falleció posteriormente de un accidente cerebrovascular. Los valores de onda R, impedancia y umbral de estimulación a los 3 meses fueron estables y similares a los de dispositivos convencionales con electrodos de fijación activa. Por otra parte, el grupo de Hu50 publica los resultados de un estudio realizado en 12 cerdos a los que, tras provocarles un bloqueo auriculoventricular, se los aleatorizó a recibir una inyección percutánea en el ventrículo derecho de proteína verde fluorescente (grupo control) o el gen TBX18. La administración del gen consiguió reprogramar los cardiomiocitos ordinarios y convertirlos en células con las características de las del nodo sinoauricular.
Síndrome de apnea del sueñoSe ha publicado un estudio prospectivo europeo51, que incluyó a 40 pacientes y que comparó el índice apnea-hipopnea evaluado por polisomnografía con el índice de alteración respiratoria evaluado por el algoritmo Sleep Apnea Monitoring, basado en el sensor de impedancia transtorácica que está incluido en algunos modelos de marcapasos. Un valor índice por encima de 20 episodios, identificó con una sensibilidad de 89%, un valor predictivo positivo del 89% y una especificidad del 85% a pacientes portadores de marcapasos con síndrome de apnea-hipopnea grave.
Sistemas de mínima estimulación ventricularEs de destacar la publicación de Botto et al52, que compara, de manera aleatorizada, si la minimización de la estimulación ventricular con el modo AAI(R) o DDD(R) era superior al modo DDD estándar en pacientes sin bloqueo auriculoventricular permanente. Aunque se observó una reducción significativa en la tasa de estimulación ventricular (mínima estimulación ventricular, 5% comparada con DDD, 86%; p<0,0001), no hubo diferencia significativa en el objetivo primario (hospitalización cardiovascular) ni en los objetivos secundarios (FA persistente, FA permanente, combinado de muerte y hospitalización cardiovascular).
Estimulación en sitios alternativosLau et al53 compararon, recientemente, si la estimulación en la orejuela auricular derecha frente al septo interauricular bajo prevenía el desarrollo de FA persistente en pacientes con FA paroxística y disfunción sinusal. Incluyeron a 385 pacientes, y en un seguimiento de 3,1 años no se demostró que la estimulación en septal fuera superior. El segundo trabajo se trata de un estudio prospectivo, aleatorizado, doble ciego y cruzado, que comparó la FE después de la estimulación a largo plazo en el haz de His o para-His con la del septo del ventrículo derecho54. El objetivo primario fue el efecto sobre la FE al año, que resultó significativamente más bajo en el septo que en el haz His, sin cambios significativos en parámetros clínicos ni en la evaluación de la calidad de vida. No hubo diferencia en las complicaciones, pero los umbrales de estimulación fueron significativamente más estables y bajos en el septo.
Monitorización a domicilio en estimulación cardiacaEl HomeGuide Registry55 y los ensayos clínicos REFORM56 y TRUST57 parecen confirmar que la monitorización domiciliaria es segura, permite revisiones presenciales más espaciadas y mejora la adherencia al seguimiento. Un registro reciente de la European Heart Rhythm Association58 describe la situación actual de esta tecnología en Europa.
NOVEDADES EN TERAPIA DE RESINCRONIZACIÓN CARDIACAInsuficiencia cardiaca ligera, complejo QRS estrecho o disfunción ventricular moderadaLos resultados de los seguimientos a largo plazo de los estudios REVERSE59 y MADIT-CRT (Multicenter Automatic Defibrillator Implantation Trial with Cardiac Resynchronization Therapy)60 sugieren que el beneficio en pacientes asintomáticos o con insuficiencia cardiaca ligera se mantiene a los 5 años. Por otro lado, los estudios NARROW-CRT61 y EchoCRT62 mostraron que en pacientes con complejo QRS ≤ 120-130ms, la terapia de resincronización cardiaca no consigue beneficios significativos en pacientes con QRS estrecho.
Sobre la base de estas y otras evidencias, el menor beneficio de la terapia de resincronización cardiaca en pacientes con complejos QRS más estrechos ya se ha recogido en las últimas guías publicadas al respecto (tabla 2)63. Finalmente, un subestudio del REVERSE sugiere que los pacientes con FE entre 30-40% parecen beneficiarse tanto como aquellos con disfunción ventricular más acusada64.
Indicaciones de terapia de resincronización cardiaca en pacientes en ritmo sinusal, insuficiencia cardiaca en grado funcional II, III o IV ambulatorio bajo tratamiento farmacológico óptimo y fracción de eyección ≤ 35%57
| Tipo de trastorno de conducción | Clase de indicación |
|---|---|
| Bloqueo de rama izquierda con QRS > 150 ms | I |
| Bloqueo de rama izquierda con QRS 120-150 ms | I |
| Sin bloqueo de rama izquierda con QRS > 150 ms | IIa |
| Sin bloqueo de rama izquierda con QRS 120-150 ms | IIb |
| QRS<120 ms | III |
Adaptado de Varma et al57 con permiso.
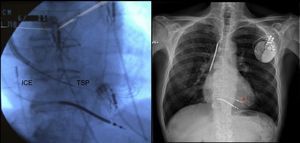
El empleo de criterios adicionales de selección, como ciertos polimorfismos de los receptores betaadrenérgicos65 o la evaluación de disincronía mediante resonancia magnética cardiaca66, podrían ser útiles en la mejora de la respuesta a la terapia de resincronización cardiaca. Además, algunos estudios publicados a lo largo de este año parecen sugerir que la estimulación en las zonas del ventrículo izquierdo con mayor retraso eléctrico67 o mecánico68 se asocian con una mejor respuesta, mientras que la estimulación multisitio ventricular izquierda parece obtener mayor mejoría hemodinámica aguda69. El estudio WiSE-CRT70 analizó la posibilidad de estimulación endocárdica izquierda sin cables basada en ultrasonidos mediante el sistema WiCS®-LV. A su vez se han desarrollado nuevas herramientas para el implante endocárdico de dispositivos de terapia de resincronización cardiaca desde el abordaje subclavio mediante punción transeptal superior71 (figura 4). Finalmente, el sistema de localización electromagnética MediGuide permite reducciones drásticas del tiempo de fluoroscopia72.
CONFLICTO DE INTERESESNinguno.