Los avances tecnológicos que se han producido en las últimas décadas han permitido mejorar el diagnóstico y la monitorización de los pacientes con síndromes coronarios agudos y los pacientes con insuficiencia cardiaca avanzada. Los registros digitales de alta calidad transmitidos de manera inalámbrica a través de redes de telefonía móvil han aumentado el uso prehospitalario de aparatos de electrocardiografía transportables y dispositivos implantables para la monitorización y el tratamiento de la arritmia. No se debe subestimar la importancia de los registros de electrocardiogramas prehospitalarios y su interpretación para pacientes con sospecha de infarto agudo de miocardio. Su empleo permite un acceso más amplio a una terapia de reperfusión rápida, con lo que se reducen el retraso en la aplicación del tratamiento, la morbilidad y la mortalidad. Además, la monitorización continua del electrocardiograma ha mejorado el diagnóstico de la arritmia, y se ha demostrado que la valoración de los cambios dinámicos del segmento ST aporta una información pronóstica importante para los pacientes con infarto de miocardio con elevación aguda del ST. De igual modo, parece que el registro o la monitorización a distancia de las arritmias y las constantes vitales mejora los resultados y reduce la necesidad de nuevos ingresos o contactos asistenciales ambulatorios de los pacientes con insuficiencia cardiaca o arritmias. En el futuro, es de prever que la telemonitorización y el diagnóstico influyan aún más en la práctica de la cardiología y aporten una mejor asistencia para el paciente con enfermedad cardiovascular.
Palabras clave
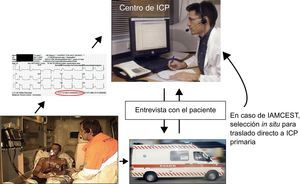
Los pacientes con un infarto agudo de miocardio con elevación del ST (IAMCEST) deben recibir un tratamiento de reperfusión tan pronto como sea posible para reducir la morbimortalidad. Las guías existentes recomiendan la intervención coronaria percutánea (ICP) primaria como estrategia preferida si se puede aplicar rápidamente1,2. Uno de los principales obstáculos para un uso más generalizado de la ICP primaria es la accesibilidad limitada a centros de ICP en funcionamiento ininterrumpido. Así pues, para tratar a pacientes con IAMCEST dentro de los límites de tiempo recomendados, el diagnóstico precoz es esencial para que los pacientes sean trasladados a un centro de ICP en el momento apropiado. Esto ha llevado a un interés creciente por el diagnóstico prehospitalario. La modalidad diagnóstica de elección ha sido el electrocardiograma (ECG). El ECG se registra en el lugar en que se produce el trastorno y lo interpretan los médicos de urgencias, el personal paramédico de las ambulancias o los cardiólogos que reciben el ECG en el hospital a través de una transmisión inalámbrica (fig.). Este método es muy robusto y se ha aplicado con éxito en varios países de todo el mundo3–9. Se ha demostrado que el diagnóstico mediante ECG prehospitalario y la asignación extrahospitalaria de los pacientes directamente a ICP primaria reduce significativamente el retraso en el tratamiento y se asocia a menos mortalidad10,11.
Un ejemplo de organización para el diagnóstico electrocardiográfico prehospitalario. El electrocardiograma se registra en la ambulancia y se envía vía inalámbrica a un centro de intervención coronaria percutánea primaria. El electrocardiograma es interpretado por el cardiólogo de guardia y, tras hablar con el paciente y/o el personal paramédico, se toma la decisión de redirigir al paciente a intervención coronaria percutánea primaria en caso de infarto agudo de miocardio con elevación del ST al paciente al hospital local más próximo para ulteriores diagnóstico e inicio de tratamiento médico. IAMCEST: infarto agudo de miocardio con elevación del ST; ICP: intervención coronaria percutánea.
El uso prehospitalario de supervisión continua del ECG mediante la monitorización del ST ha aportado una importante información pronóstica y podría mejorar aún más la selección adecuada de los pacientes para el uso de métodos de tratamiento individualizados12. Tanto la monitorización del ST como el diagnóstico mediante ECG dependen de que se disponga de un equipamiento óptimo para el registro electrocardiográfico. Con los años se han introducido nuevos aparatos y nuevos algoritmos de análisis que podrían ser útiles para ampliar en mayor medida las indicaciones y el uso del registro de ECG y el diagnóstico prehospitalarios.
REGISTRO PREHOSPITALARIO DEL ELECTROCARDIOGRAMAEn la década de los setenta, Uhley13 presentó sus experiencias con la transmisión telemétrica de una sola derivación desde la ambulancia al hospital para la monitorización de la arritmia de pacientes con sospecha de enfermedad cardiovascular. Sin embargo, durante varios años no fue posible transmitir un ECG de 12 derivaciones de alta calidad, debido a las dificultades técnicas y la inestabilidad de las redes de datos. En 1987, Grim et al14 publicaron un artículo sobre la aplicación satisfactoria de la transmisión del ECG de 12 derivaciones de calidad diagnóstica, utilizando una nueva transmisión digital con corrección de errores, a través de conexiones de telefonía móvil. La nueva tecnología de transmisión fue validada en otros estudios y mostró el posible efecto beneficioso de un diagnóstico temprano y fiable del infarto agudo de miocardio15,16.
A finales de la década de los noventa, se introdujeron los términos IAMCEST e infarto agudo de miocardio sin elevación del ST para asegurar una selección más relevante de los pacientes con infarto agudo de miocardio desde el punto de vista clínico y terapéutico. Esto se basó fundamentalmente en los grandes ensayos sobre trombolisis, que mostraron una mejora de los resultados con el uso inmediato de la terapia lítica en los pacientes con IAMCEST17,18. Con ello, el tratamiento de reperfusión temprano pasó a ser un objetivo importante para el tratamiento óptimo del IAMCEST, y ello condujo a un mayor interés por el diagnóstico precoz y la selección óptima de los pacientes. En 2000 Wall et al19 señalaron que el diagnóstico prehospitalario del infarto agudo de miocardio se asociaba a una aplicación más rápida del tratamiento de reperfusión mediante trombolisis, pero el centro de interés continuaba siendo principalmente el de los tiempos que se empleaban en el diagnóstico en los servicios de urgencias hospitalarios.
Sin embargo, esto cambió cuando varios ensayos aleatorizados y metaanálisis demostraron que la ICP primaria era una estrategia de reperfusión superior en los pacientes con IAMCEST si se utilizaba en un plazo breve20–23. El acceso limitado a centros con disponibilidad de ICP aumentó el interés por un diagnóstico rápido que permitiera que el paciente ingresara directamente o fuera trasladado a un centro con ICP lo antes posible.
En 2005 Terkelsen et al demostraron el beneficio aportado para los pacientes con IAMCEST por el diagnóstico prehospitalario y la selección in situ para el traslado directo a un centro de ICP primaria. Se incluyó en el estudio a 161 pacientes. Se registró el ECG prehospitalario de 106 pacientes, de los que 21 ingresaron directamente en un centro de ICP primaria. Para los pacientes con diagnóstico prehospitalario y selección in situ, el tiempo transcurrido desde el primer contacto médico hasta la aplicación del balón fue una mediana de 81 min menos que para los pacientes diagnosticados en el hospital24. El diagnóstico mediante ECG prehospitalario y la selección in situ no sólo permiten que el paciente evite el paso por el servicio de urgencias de un hospital local sin medios de ICP, sino que reduce también los tiempos intrahospitalarios, puesto que el laboratorio de cateterismo puede prepararse para la inminente llegada del paciente. Sejersten et al6 han puesto de manifiesto aún más claramente este hecho. En su estudio, el tiempo puerta-ICP para los pacientes con diagnóstico prehospitalario se redujo significativamente respecto al de los diagnosticados en el hospital (34 frente a 97 min; p<0,001).
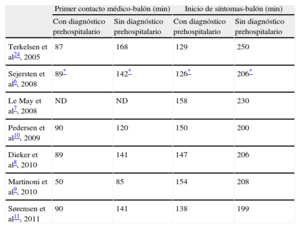
En estudios de muchos países se han reproducido estos resultados a pesar de la diversidad de contextos geográficos, organizaciones de asistencia sanitaria y estructuras logísticas prehospitalarias (tabla 1).
Tiempo entre el primer contacto médico o el inicio de los síntomas y el balón en publicaciones internacionales recientes sobre el diagnóstico y la selección de pacientes por electrocardiograma prehospitalario
| Primer contacto médico-balón (min) | Inicio de síntomas-balón (min) | |||
| Con diagnóstico prehospitalario | Sin diagnóstico prehospitalario | Con diagnóstico prehospitalario | Sin diagnóstico prehospitalario | |
| Terkelsen et al24, 2005 | 87 | 168 | 129 | 250 |
| Sejersten et al6, 2008 | 89* | 142* | 126* | 206* |
| Le May et al7, 2008 | ND | ND | 158 | 230 |
| Pedersen et al10, 2009 | 90 | 120 | 150 | 200 |
| Dieker et al8, 2010 | 89 | 141 | 147 | 206 |
| Martinoni et al9, 2010 | 50 | 85 | 154 | 208 |
| Sørensen et al11, 2011 | 90 | 141 | 138 | 199 |
ND: no disponible.
Recientemente Sørensen et al11 han evaluado el uso ordinario del diagnóstico con ECG preshospitalario y la selección de los pacientes in situ en una región más amplia formada por zonas urbanas y rurales. Los autores observaron que el diagnóstico y la selección prehospitalarios de los pacientes reducen la importancia de la distancia al centro de ICP primaria, por cuanto el tiempo entre el primer contacto médico y el hinchado del balón tenía una diferencia de sólo 9 min entre los pacientes de hospitales urbanos y los de hospitales rurales, con una mediana de distancia al centro de ICP de 10 frente a 40 km (tabla 2). Además, el estudio puso de manifiesto una disminución de la mortalidad entre los pacientes con diagnóstico y selección prehospitalarios. En un reciente estudio holandés se ha hecho hincapié nuevamente en la importancia y la utilidad del diagnóstico prehospitalario para los pacientes que viven en zonas alejadas de un centro de ICP25.
MAPA DE SUPERFICIE CORPORAL PARA ELECTROCARDIOGRAMAUna de las limitaciones del ECG de 12 derivaciones, tanto si se emplea durante la hospitalización como si se usa en la fase prehospitalaria, es la falta de sensibilidad. No todas las partes anatómicas del ventrículo izquierdo quedan igual de bien cubiertas por las derivaciones convencionales. La localización del infarto que con más frecuencia escapa a la detección con el ECG de 12 derivaciones es la del infarto de miocardio de la zona inferoposterior. Hace muchos años se estableció que esta limitación podía superarse empleando derivaciones adicionales, como V7-V926. El mapa de superficie corporal real utiliza a menudo un ECG de 80 derivaciones, que mejora la capacidad de detección del infarto agudo de miocardio y, por lo tanto, aumenta la sensibilidad de la electrocardiografía en series clínicas amplias27. La sensibilidad para la detección del infarto agudo de miocardio confirmado mediante la troponina se aproxima al 80% y el estadístico C mejora en un factor de casi 0,1027. La afección del ventrículo derecho como complicación de un IAMCEST puede detectarse mejor con el ECG de mapa de superficie corporal de 80 derivaciones28. Recientemente, en un ensayo aleatorizado se ha comparado la prevalencia, el patrón de asistencia clínica y los resultados clínicos obtenidos en pacientes con IAMCEST identificados mediante ECG de 80 derivaciones pero no con el ECG de 12 derivaciones (IAMCEST sólo en 80 derivaciones). La variable de valoración primaria del ensayo fue el tiempo puerta-vaina en pacientes con IAMCEST sólo en 80 derivaciones frente a pacientes con IAMCEST identificados con sólo 12 derivaciones (IAMCEST en 12 derivaciones). El ECG de 80 derivaciones aportó un aumento incremental del 27,5% en la detección del IAMCEST en comparación con el de 12 derivaciones. Los pacientes con IAMCEST sólo en 80 derivaciones sufren eventos clínicos adversos de manera similar que los pacientes con IAMCEST en 12 derivaciones, pero son tratados con estrategias invasivas tardías o conservadoras29.
El mapa de superficie corporal para el ECG de 80 derivaciones se ha utilizado también en la fase prehospitalaria, a pesar de que prepararlo requiere más tiempo. Incluso en este contexto, la sensibilidad del método de detección del infarto agudo de miocardio es comparable a lo observado en el contexto intrahospitalario más protegido30. A pesar de estos resultados, el mapa de superficie corporal para la evaluación de los pacientes con dolor torácico no ha alcanzado un uso generalizado. Esta situación podría cambiar con la invención de tecnologías fáciles de aplicar que están empezando a comercializarse.
SISTEMAS NOVEDOSOS DE REGISTRO Y DERIVACIONES ELECTROCARDIOGRÁFICASDado que el contexto prehospitalario a menudo implica el trabajo en circunstancias difíciles, con pacientes en estado clínico muy grave, ha habido cierto interés por desarrollar sistemas de monitorización del ECG que sean sencillos, de aplicación rápida y diseño duradero.
Uno de estos sistemas (el sistema de derivaciones EASI), que utiliza sólo cuatro derivaciones para extraer un ECG «de 12 derivaciones» diagnóstico completo, ha sido comparado con el ECG convencional de 12 derivaciones por Sejersten et al31. Los autores señalan que el sistema EASI de cuatro derivaciones fue igual de eficaz que el ECG estándar de 12 derivaciones para la detección de la isquemia miocárdica aguda. Drew et al investigaron también el uso de un sistema de derivaciones más sencillo en la iniciativa Synthesized Twelve-lead ST Monitoring and Real-time Tele-electrocardiography. El sistema de ECG de cinco derivaciones utilizado en esta serie de estudios ha resultado eficaz en el diagnóstico de la isquemia y ha reducido el tiempo transcurrido hasta el tratamiento en la región en que se realizó el estudio (Norte de California, Estados Unidos)32,33.
TELEASISTENCIA PARA LA MONITORIZACIÓN DE PACIENTES Y DISPOSITIVOSLa combinación de población de edad avanzada y continuos avances del tratamiento moderno en cardiología y medicina interna en general ha llevado a una prevalencia creciente de las enfermedades crónicas, incluida la insuficiencia cardiaca34, y la necesidad de dispositivos implantables35. Este desarrollo ha incrementado la necesidad de un contacto estrecho y continuo entre el paciente y el sistema de asistencia sanitaria para asegurar un tratamiento óptimo. Por consiguiente, el sistema de asistencia sanitaria tiene que hacer frente al reto de una necesidad, en continuo aumento, de profesionales de la salud cualificados y recursos en general, al tiempo que al aumento de los costes. Una de las formas de abordar este reto es empleando la teleasistencia, que permite que el paciente esté en estrecho contacto con el profesional de la salud apropiado e intercambie una información útil y necesaria para el tratamiento de su enfermedad.
La teleasistencia se define como la asistencia sanitaria personal a distancia y consiste en: a) datos aportados por el paciente (p. ej., presión arterial, pulso, peso, información subjetiva sobre la salud); b) transmisión electrónica de datos del paciente al profesional de la salud, y c) retroalimentación personalizada y adaptada a cada paciente individual36. La teleasistencia puede basarse en sistemas en tiempo real (sincrónicos), de almacenamiento (asincrónicos) o híbridos37. La teleasistencia sincrónica exige la disponibilidad de paciente y profesional de la salud al mismo tiempo y el procesamiento en tiempo real de los datos del paciente, mientras que la teleasistencia asincrónica proporciona mayor flexibilidad tanto al paciente como al profesional de la salud.
La tecnología utilizada en la teleasistencia es una combinación de dispositivos de diagnóstico portátiles (p. ej., esfigmomanómetros), ordenador/teléfono inteligente e infraestructura de comunicación inalámbrica, que requiere una red estable de transmisión de datos38. Los datos transmitidos pueden ser almacenados en un puesto de recepción para su procesado y examen inmediatos o posteriores.
Se han propuesto cuatro generaciones de teleasistencia para el manejo de los pacientes a distancia38: a) primera generación, un sistema de obtención y análisis de datos no reactivo, con transmisión asincrónica de los datos a un profesional de la salud, por ejemplo, desde un registrador de eventos; b) segunda generación, un sistema con una estructura analítica o de toma de decisiones no inmediato, con transferencia sincrónica de datos, que permite al profesional de la salud examinar los datos y detectar cambios importantes, aunque puede haber retrasos si el sistema no está activo durante todo el día; c) tercera generación, un sistema de manejo del paciente a distancia que dispone del constante apoyo analítico y de toma de decisiones a cargo de un profesional de la salud, incluso fuera del horario de trabajo regular, y d) cuarta generación, un sistema de manejo a distancia plenamente integrado, en el que los datos procedentes de dispositivos de telemedicina invasivos y no invasivos se conectan en una plataforma de telemedicina y son accesibles tanto al profesional de la salud principal como al centro de telemedicina.
En el ámbito de la cardiología se dispone de una amplia gama de variables invasivas y no invasivas que se puede utilizar en teleasistencia. La mayor parte son las registradas manualmente por los pacientes a través de un dispositivo (p. ej., presión arterial sistólica y diastólica, pulso, ECG de tres derivaciones, variaciones de la frecuencia cardiaca, peso corporal, saturación de oxígeno, glucemia, péptidos natriuréticos). Otras se obtienen con dispositivos invasivos y se registran automáticamente (p. ej., impedancia, incidencia de arritmias, presión pulmonar y auricular izquierda)38.
TELEASISTENCIA EN LA INSUFICIENCIA CARDIACALa insuficiencia cardiaca se asocia con importantes morbilidad, mortalidad y costes de asistencia sanitaria34,39. Con frecuencia los pacientes son objeto de un seguimiento estrecho en clínicas de insuficiencia cardiaca, pero a menudo se hace necesario el ingreso en el servicio de cardiología, y la frecuencia de reingresos en un plazo de 30 días es elevada40. La teleasistencia puede ser una solución, pues aporta una forma de identificar y realizar un seguimiento de la congestión subclínica. La identificación y el tratamiento de la congestión más precoces, junto con la mejora de la coordinación de la asistencia, pueden evitar la necesidad de hospitalización.
Lo ideal es que el contacto entre paciente y profesional de la salud se establezca con una tecnología que permita a ambas partes verse y escucharse a través de un micrófono y una pantalla de ordenador a grandes distancias, con el empleo de una conexión telefónica o por satélite. Se instala un dispositivo en el domicilio del paciente y otro en la clínica de insuficiencia cardiaca. Es preferible que el dispositivo del paciente sea portátil y permita tanto videoconferencias como transmisión de datos y que el profesional de la salud pueda manejarlo con un mando a distancia.
Según las disposiciones individuales que se realicen puede indicarse a los pacientes que registren la presión arterial, el ritmo cardiaco y el peso, proporcionen una descripción subjetiva de los síntomas cada mañana y transmitan luego los datos diariamente, inmediatamente antes del seguimiento a distancia programado o durante este. Entonces se puede examinar los datos justo antes de la videoconferencia con el paciente, de manera que se pueda modificar el tratamiento en caso necesario. Es importante que el profesional de la salud esté capacitado para modificar las pautas de medicación, con objeto de reducir los retrasos y establecer rápidamente el tratamiento correcto.
Se han descrito varias ventajas del uso de teleasistencia en la insuficiencia cardiaca36,41. Los pacientes obtienen un mejor conocimiento de su enfermedad al responsabilizarse de la monitorización y participar en su propio tratamiento, lo cual potencia la educación sanitaria y la capacitación del propio paciente. Esto respalda la adherencia al tratamiento programado, pero asegura al mismo tiempo una asistencia preventiva con detección precoz de las exacerbaciones de la enfermedad y un tratamiento rápido de estas. Los tiempos de desplazamiento y de espera del paciente se reducen o incluso se anulan y la calidad de vida mejora. Además, los pacientes se encuentran en su casa, en un entorno cómodo y seguro, y de todos modos continúan estando en contacto con el hospital. Una de las ventajas para el hospital es que la tecnología libera espacio para nuevos pacientes inestables y se puede evitar los ingresos prolongados.
Sin embargo, no se ha demostrado la efectividad de la teleasistencia en cuanto a la reducción de la morbilidad y la mortalidad de los pacientes con insuficiencia cardiaca, ya que los resultados obtenidos son contradictorios. Así, dos metaanálisis42,43 indican que la teleasistencia redujo la morbilidad y la mortalidad, pero dos ensayos clínicos aleatorizados prospectivos no incluidos en los metaanálisis no respaldaron estos resultados44,45. Una posible explicación de esta diferencia puede ser que los metaanálisis combinaron múltiples estudios pequeños de características poco homogéneas y con pacientes de perfiles de riesgo diversos, con distintos periodos de seguimiento y con diferencias entre los estudios en cuanto a la intervención empleada. En un reciente ensayo prospectivo aleatorizado con 3.230 pacientes con enfermedad pulmonar obstructiva o insuficiencia cardiaca, se observó que la teleasistencia se asoció a menor mortalidad, unas menores tasas de ingresos urgentes y menor duración de las hospitalizaciones46. En un estudio danés actualmente en curso, se asigna aleatoriamente a pacientes con insuficiencia cardiaca crónica al tratamiento tradicional en clínicas ambulatorias o monitorización por teleasistencia. En otra parte del estudio se asigna aleatoriamente a pacientes ingresados por insuficiencia cardiaca aguda al tratamiento tradicional en el hospital o alta temprana y contacto diario con el hospital a través de teleasistencia. La hipótesis es que el tratamiento domiciliario de los pacientes con insuficiencia cardiaca es factible, efectivo y seguro y, por lo tanto, libera recursos para otros grupos de pacientes (comunicación personal).
En los estudios mencionados antes, la teleasistencia se basó en datos no invasivos, pero otros estudios han investigado el manejo de pacientes con insuficiencia cardiaca utilizando datos obtenidos mediante dispositivos implantables. Un aumento de la congestión vascular pulmonar se refleja en una elevación de la impedancia, por lo que la monitorización de la impedancia intratorácica puede ser un instrumento útil en el tratamiento de la insuficiencia cardiaca de pacientes como los portadores de un cardioversor-desfibrilador implantable (CDI)47. Esto está respaldado por un estudio en el que se observó que para la predicción de episodios de agravamiento de la insuficiencia cardiaca la monitorización de la impedancia intratorácica tiene una sensibilidad significativamente mayor que el aumento agudo del peso48. De igual modo, las presiones de llenado del ventrículo izquierdo y las presiones de la arteria pulmonar están correlacionadas con la congestión clínica, la limitación funcional y el mal pronóstico de los pacientes con insuficiencia cardiaca49. Dado que las presiones intracardiacas y arteriales pulmonares aumentan entre varios días y semanas antes del inicio de los síntomas clínicos de congestión, una monitorización estricta puede aportar señales de alarma precoces y facilitar un tratamiento apropiado, incluidos los cambios de medicación. Abraham et al50 utilizaron un sistema inalámbrico de monitorización hemodinámica implantable para determinar la presión arterial pulmonar, y señalaron que el uso del sistema redujo significativamente la duración de las hospitalizaciones y la tasa de ingresos hospitalarios por insuficiencia cardiaca, esta última en un 30%.
En un estudio en el que se utilizó monitorización de la presión auricular izquierda, esta se asoció a una reducción del riesgo de descompensación aguda y muerte51. Serán necesarios nuevos ensayos clínicos aleatorizados, en los que se empleen sistemas de telemedicina de tercera o cuarta generación que combinen variables invasivas y no invasivas con monitorización y tratamiento diarios, para esclarecer plenamente la utilidad de la teleasistencia en cardiología.
TELEASISTENCIA Y DISPOSITIVOS IMPLANTABLESEl número de pacientes con marcapasos y CDI ha aumentado enormemente en los últimos años con la ampliación de las indicaciones para incluir a más grupos de pacientes35. Según lo establecido en las guías, los pacientes portadores de un marcapasos o un CDI requieren seguimiento a los 3-12 meses y a los 3-6 meses, respectivamente52. Generalmente las visitas de seguimiento incluyen tanto una evaluación de la función del dispositivo (incluidos el estado de la pila y los umbrales de captura) como un examen clínico, y ello puede conducir a una reprogramación del dispositivo o cambios en el tratamiento médico. Estas visitas requieren la dedicación de mucho tiempo y pueden ser una carga para el paciente, puesto que con frecuencia implican un largo traslado, tiempo de espera y ausentarse del trabajo. En la clínica ambulatoria, las múltiples visitas requieren espacio y disponibilidad de personal, dada la carga de trabajo asociada a cada visita.
La monitorización y el seguimiento a distancia empleando teleasistencia constituye una estrategia de tratamiento alternativa53. De ser posible, el sistema debe ser capaz de transmitir automáticamente los datos almacenados en el dispositivo al ambulatorio del paciente utilizando la red del sistema general para comunicación móvil inalámbrica o una línea telefónica fija. La transmisión inalámbrica de datos automática requiere un marcapasos o un CDI equipado con una microantena para la comunicación, con un transmisor situado cerca del paciente. Esta disposición reduce la necesidad de cumplimiento por parte del paciente y aumenta la frecuencia de las transmisiones.
Varias compañías comercializan sistemas de transmisión inalámbrica de datos automática21. Pueden transmitirse los datos almacenados en la memoria del dispositivo (p. ej., voltaje de la pila, características de los electrodos, arritmias, alertas). Las alertas pueden basarse en un cambio del funcionamiento del dispositivo (estado de la pila, impedancia del electrodo), en la programación (inactivación del tratamiento de la fibrilación ventricular, márgenes de seguridad insuficientes para la percepción o la captura) o en datos médicos (arritmias, indicios de acumulación de líquido pulmonar). Los episodios que desencadenan una alerta pueden definirse según las características de cada paciente individual. Generalmente los datos se transmiten a una base de datos centralizada, en la que son procesados y se ponen a disposición del médico en una página web segura. La notificación adicional por correo electrónico, SMS, fax o mensajes telefónicos puede ser útil cuando hay datos cruciales disponibles para la consulta53.
Muchos marcapasos y CDI pueden realizar automáticamente pruebas del estado de la pila, las impedancias de los electrodos y los umbrales de percepción y captura, que antes se realizaban manualmente en el ambulatorio53. Puede llevarse a cabo, pues, un seguimiento programado, con transmisión de datos predefinidos, o una monitorización no programada. La monitorización diaria permite la transmisión a un médico de los datos que incluyan cualquier alerta predefinida. Por consiguiente, la monitorización remota puede mejorar la seguridad del paciente y la calidad de la asistencia. Según cuáles sean las necesidades de reprogramación, continuarán siendo necesarios seguimientos clínicos, ya que, por razones de seguridad, no hay todavía ningún sistema que permita la reprogramación a distancia.
La seguridad y los beneficios clínicos que la teleasistencia aporta a los pacientes con dispositivos implantados se han validado en diversos estudios54–56. En el ensayo COMPAS54, la monitorización a distancia a largo plazo de los pacientes portadores de marcapasos constituyó un sustituto seguro de los seguimientos convencionales, redujo el número de visitas ambulatorias y permitió la detección precoz de eventos clínicos adversos importantes y relacionados con el dispositivo. En otro estudio se observó que se podía omitir la mitad de las visitas programadas habitualmente empleando monitorización a distancia sin deterioro de la seguridad para el paciente55. Además, sólo en el 6% de los pacientes se reprograma el dispositivo o se decide la hospitalización durante las visitas clínicas, por lo que el 94% de esas visitas se podría realizar también mediante monitorización a distancia56. La monitorización a distancia podría diagnosticar un 99% de los problemas relacionados con arritmias o con el dispositivo en los pacientes portadores de un CDI si se combina con seguimiento clínico. Además de menos visitas clínicas programadas, también se podría evitar las visitas no programadas tras una descarga del CDI; después de un episodio de este tipo, el paciente puede realizar una carga manual de los datos, transmitirlos al profesional de la salud para una determinación inmediata de si la descarga ha sido apropiada o no, y para establecer si es necesario o no reprogramar el dispositivo o hacer alguna modificación médica57. Por último, varios estudios han demostrado que la monitorización a distancia reduce el tiempo transcurrido hasta la identificación y el diagnóstico del episodio, así como el tiempo desde el episodio hasta la toma de una decisión clínica para el paciente individual58,59.
La monitorización aporta también ventajas para los pacientes con fibrilación auricular paroxística, ya que las alertas podrían identificar el punto de inicio de una fibrilación auricular, lo que conlleva un seguimiento no programado, ya sea en consulta o por teléfono, y las intervenciones apropiadas (p. ej., antiarrítmicos, anticoagulantes o antiagregantes plaquetarios, cardioversión externa, reprogramación del dispositivo)60. En general, el grado de satisfacción es alto y tanto el paciente como los profesionales de la salud prefieren el seguimiento a distancia a las visitas en la clínica61,62.
EL FUTURO DE LA TELEMEDICINA EN CARDIOLOGÍALa telemedicina ha revolucionado la cardiología moderna y brinda la oportunidad de realizar consultas entre médicos situados a grandes distancias, incluso de distintos continentes. En la fase aguda de la enfermedad cardiaca, la telemedicina ayuda a prestar una asistencia óptima más rápidamente, y en la enfermedad crónica la consulta entre médico y paciente reduce la necesidad de visitas ambulatorias. A medida que mejoren estos sistemas, lo mismo ocurrirá con la evolución clínica de los pacientes. En el futuro, es probable que se comercialicen dispositivos implantables más pequeños que aporten a pacientes y médicos información por vía inalámbrica, a través de interfaces que permitan la conexión a través de ordenadores o dispositivos móviles.
CONFLICTO DE INTERESESNinguno.