El implante de un desfibrilador automático implantable (DAI) es el tratamiento de primera línea para los pacientes con síndrome de Brugada (SBr) en la prevención secundaria tras haber sufrido arritmias ventriculares (AV) malignas o un episodio de muerte súbita. Tras el implante del DAI, la incidencia de AV y de descargas de alta energía es elevada1, lo cual tiene repercusiones importantes en la calidad de vida y el pronóstico.
Recientemente se ha acumulado evidencia sobre el uso de la quinidina como tratamiento adyuvante2 para los pacientes portadores de un DAI que tienen episodios frecuentes de AV malignas. La quinidina inhibe la corriente de salida de K transitoria (Ito1), que se cree que da lugar a la homogeneización de la repolarización de las capas epicárdicas al restablecer la cúpula del potencial de acción en donde las corrientes Ito1 son predominantes, como ocurre en el epicardio del tracto de salida ventricular derecho3. A pesar del tratamiento con quinidina, algunos pacientes siguen sufriendo episodios de AV. La presencia de taquicardias ventriculares monomórficas (TVM) en los pacientes con SBr se ha descrito con anterioridad, está ligada a mecanismos diversos y a veces responde a la estimulación antitaquicardia (EAT)4. No se han descrito casos de modificación de una AV maligna para pasar a una TVM susceptible de interrupción con EAT en pacientes que están en tratamiento con quinidina. Se presenta una serie de 3 pacientes que muestran un posible efecto novedoso de la quinidina en el patrón de las AV de pacientes con SBr.
Se revisaron todos los episodios de AV de 29 pacientes con SBr que estaban en tratamiento con quinidina debido a descargas frecuentes del DAI y habían sido incluidos en un registro nacional de España5. Se describe a 3 pacientes de este registro que mostraron una TVM interrumpida mediante EAT (tabla). Las características generales del registro se han descrito en otra publicación5.
Características de los pacientes
| Paciente | Edad (años) | Sexo | SBr familiar o MS | Fibrilación auricular | Forma de presentación clínica | Patrón de ECG | BRDH | EFS | Pruebas genéticas | Razón para la instauración de quinidina | Tiempo DAI-quinidina (meses) | Seguimiento durante el tratamiento con quinidina (meses) | Fármaco | Efectos adversos |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 24 | Varón | No | No | MS | Espontáneo tipo 1 | No | No realizado | No realizado | Síncopes múltiples por TVP NS | 19 | 12 | Hidroxiquinidina 1.000 mg | Sí, diarrea |
| 2 | 64 | Varón | No | No | Síncopes múltiples | Inducido por fármaco, tipo 1 | No | FV inducible | Negativo para SBr y DAVD | Descargas múltiples (4) por TVP | 24 | 50 | Hidroxiquinidina 1.000 mg | No |
| 3 | 41 | Varón | No | No | MS | Espontáneo tipo 1 | Sí | No realizado | Negativo para SBr | Descargas múltiples (9) por FV | 48 | 72 | Bisulfato de quinidina 600 mg | No |
BRDH: bloqueo de rama derecha del haz de His; DAI: desfibrilador automático implantable; DAVD: displasia arritmogénica de ventrículo derecho; ECG: electrocardiograma; EFS: estudio electrofisiológico; FV: fibrilación ventricular; MS: muerte súbita; SBr: síndrome de Brugada; TVP NS: taquicardia ventricular polimórfica no sostenida; TVP: taquicardia ventricular polimórfica.
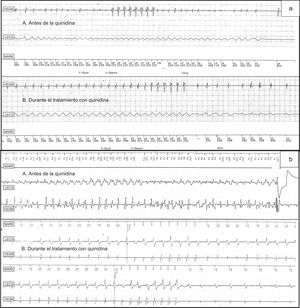
El paciente 1 sufrió muerte súbita a la edad de 24 años. Tenía un patrón de Brugada de tipo 1 espontáneo en las derivaciones V1-V2. Se le implantó un DAI. Al cabo de 19 meses, el paciente sufrió un síncope debido a una taquicardia ventricular polimórfica (TVP) y episodios de casi síncope por TVP no sostenidas. Se inició tratamiento con hidroxiquinidina (1.000 mg/día). El paciente no había sufrido ningún síncope ni TVP desde la instauración del tratamiento con quinidina, pero después de 12 meses de seguimiento tuvo 2 episodios de TVM interrumpidos por descargas de EAT (figura A).
A: antes de la quinidina, TV polimórfica con síncope (duración del ciclo, 230 ms) que degenera a FV, tratada sin éxito con EAT, y se interrumpe espontáneamente; durante el tratamiento con quinidina, TV monomórfica rápida con aceleración respecto al valor inicial de 320 ms llegando a 290 ms, interrumpida con éxito mediante EAT. B: antes de la quinidina, TV polimórfica tratada con una descarga; durante el tratamiento con quinidina, TV monomórfica lenta y ligeramente irregular (duración del ciclo, 390 ms), interrumpida por la primera rampa de EAT después de 3 descargas fallidas de esta (se observa la última descarga fallida antes de la rampa de EAT eficaz). Chrg: carga; Detect V: detección ventricular; Dvrt: tratamiento derivado; EAT: estimulación antitaquicardia; Epsd V: episodio ventricular; FV: fibrilación ventricular; LECG: ECG «sin electrodos»; MARK: marca de canal; MV: marcapasos ventricular; PV: percepción ventricular; TV: taquicardia ventricular; VEGM: electrograma ventricular.
El paciente 2 había sufrido varios episodios de síncope a los 64 años. Presentaba un patrón de Brugada de tipo 2 (tipo 1 después de ajmalina). Se le implantó un DAI. Tras el implante, sufrió 4 episodios de fibrilación ventricular (FV) tratados con descargas, por lo que se inició la administración de hidroxiquinidina (1.000 mg/día). Durante 50 meses de seguimiento, el paciente no tuvo ningún episodio de FV; no obstante, sufrió 62 de TVM, todos interrumpidos por descargas de EAT.
El paciente 3 sufrió una muerte súbita recuperada a los 41 años; el electrocardiograma basal mostró un patrón de Brugada de tipo 1. Cuatro años después del implante del DAI, se inició tratamiento con bisulfato de quinidina (600 mg) debido a 9 episodios de FV tratados con descargas eléctricas. Después de 72 meses de seguimiento y sin haber sufrido ningún episodio de FV, el paciente tuvo 1 episodio de TVM (ciclo de 280 ms), interrumpido por una descarga de EAT (figura B). Los 3 pacientes continúan en tratamiento con quinidina (duración media del tratamiento, 45 meses) sin ningún episodio de TVP ni FV.
La observación de mayor interés en esta serie de casos es la modificación del patrón de AV de estos pacientes con SBr tratados con quinidina, sin reaparición de TVP/FV, pero con una TVM interrumpida mediante EAT sin necesidad de descargas de alta energía.
Estos resultados aportan nuevos datos para el análisis del mecanismo de las AV de los pacientes con SBr y de la interacción de estos mecanismos y el efecto de la quinidina.
Según las teorías más aceptadas, la desviación neta de salida de las corrientes iónicas durante la parte final de la fase 1 del potencial de acción da lugar a una acentuación de la escotadura del potencial de acción, que conduce a la dispersión de la repolarización y crea el sustrato para la reentrada de fase 2 y la AV3. Recientemente se ha propuesto que las modificaciones de la despolarización son los mecanismos que subyacen a las manifestaciones clínicas del SBr; se han observado potenciales tardíos y un electrograma fraccionado en el epicardio del tracto de salida del ventrículo derecho6. Se han descrito anomalías estructurales, como hipertrofia, fibrosis e infiltración grasa en el tracto de salida del ventrículo derecho en relación con una conducción lenta.
La presencia de anomalías estructurales sutiles podría favorecer la aparición de circuitos de reentrada y explicar la observación de una TVM en esos pacientes. En este contexto, la quinidina podría estabilizar la excitabilidad del tracto de salida del ventrículo derecho y facilitar la conversión de una AV maligna en una TVM más estable y regular, que responda a la EAT. La respuesta positiva a la EAT refuerza la idea de un circuito de reentrada con un intervalo excitable; podría ocurrir que el rettaso de la conducción producido por la quinidina facilitara que la descarga de EAT se propagara al circuito, despolarizara el intervalo excitable y condujera a la extinción de la reentrada.
A la vista de esta observación, puede proponerse que los pacientes con SBr tratados con quinidina a causa de las descargas frecuentes del DAI podrían obtener un efecto beneficioso con la introducción de una zona de TV rápida con 1 o 2 descargas de EAT, puesto que esto tiene eficacia demostrada en la interrupción de la TVM y la reducción de las descargas. Serán necesarios más estudios para confirmar este patrón de AV infrecuente en el SBr después del tratamiento con quinidina y para esclarecer su mecanismo.