Las arritmias ventriculares contribuyen de manera importante en la morbilidad y mortalidad de los pacientes con enfermedad coronaria. La fibrilación ventricular es la causa de la mayor parte de las muertes que se producen en la fase aguda de la isquemia, mientras que la taquicardia ventricular monomorfa sostenida, debida a una reentrada generada en el tejido cicatrizal aparece sobre todo en el contexto de un infarto de miocardio cicatrizado, principalmente en pacientes con una fracción de eyección ventricular izquierda más baja. A pesar de los importantes avances que se han producido en la educación sanitaria de la población y en el tratamiento del infarto de miocardio, el riesgo de taquicardia ventricular en la población global con enfermedad coronaria continúa siendo un problema importante en la práctica clínica. La evaluación inicial del paciente que presenta una taquicardia ventricular requiere un electrocardiograma de 12 derivaciones, que puede ser útil para confirmar el diagnóstico, sugerir la presencia de una posible cardiopatía subyacente, e identificar la localización del circuito de taquicardia ventricular. El estudio electrofisiológico invasivo suele ser crucial para determinar el mecanismo de la arritmia una vez inducida, y para guiar la ablación. El abordaje utilizado para la ablación de la taquicardia ventricular depende de varios factores, como la inducibilidad, la sostenibilidad y la tolerancia clínica a la taquicardia ventricular. Este artículo revisa también otras opciones terapéuticas para los pacientes con taquicardia ventricular asociada a la enfermedad coronaria, como el tratamiento farmacológico antiarrítmico, la ablación quirúrgica y las indicaciones actuales de desfibrilador automático implantable.
Palabras clave
Las arritmias ventriculares son de las complicaciones de la enfermedad coronaria (EC) más temidas. La fibrilación ventricular (FV) es la causa de la mayor parte de las muertes que se producen en la fase aguda de un evento isquémico1 y puede ser la primera manifestación de la enfermedad en más de la mitad de los casos. Se ha descrito que la incidencia de FV como complicación de un infarto agudo de miocardio es de alrededor del 4,7%, y se ha mantenido relativamente estable en estudios observacionales a largo plazo2. Se estima que el 90% de los pacientes que sufren una FV fuera del hospital no llegan con vida a este3. En consecuencia, a pesar de los continuos esfuerzos en prevención primaria y educación sanitaria de la población, la gran mayoría de los pacientes con FV no llegan a recibir los beneficios de la asistencia médica. La taquicardia ventricular (TV) monomorfa sostenida se produce sobre todo en el contexto de un infarto de miocardio (IM) cicatrizado, y puede aparecer en la fase subaguda o mucho después de que el paciente haya sufrido la lesión isquémica aguda4. La extensión de la necrosis miocárdica y el grado de disfunción del ventrículo izquierdo (VI) son importantes factores que determinan el riesgo de arritmia tras un IM. La TV monomorfa sostenida suele aparecer en pacientes con un IM más extenso y que tienen también una fracción de eyección del VI (FEVI) más baja4. La incidencia global de la TV sostenida tras el IM se ha establecido clásicamente en alrededor de un 3-5%, pero se ha estimado que en los últimos años se ha reducido al 1% como consecuencia de los importantes avances realizados en el tratamiento del IM, que han conducido a unas cicatrices de infarto más pequeñas4. Sin embargo, el riesgo de TV en la población general se ha mantenido bastante estable y, de hecho, podría estar aumentando como consecuencia de una mejora de la supervivencia tras el IM y de la posibilidad de aparición de TV años después del IM inicial, junto con el envejecimiento progresivo de la población. En este artículo se revisa el conocimiento actualmente disponible sobre la TV asociada a la EC, centrándose sobre todo en los mecanismos, las características electrocardiográficas y electrofisiológicas (EF) y las opciones de tratamiento. Dado que la TV monomorfa recurrente es una situación clínica que plantea especiales dificultades y que cardiólogos y electrofisiólogos se enfrentan a ella cada vez con mayor frecuencia en la práctica clínica, se hace especial hincapié en ese contexto concreto.
Mecanismos de la taquicardia ventricular asociada a enfermedad coronariaLos mecanismos que subyacen al inicio y el mantenimiento de la TV han sido ampliamente estudiados durante varias décadas. Las bases de nuestro conocimiento actual de los mecanismos de la arritmia asociada a la EC proceden de la investigación paralela realizada en animales y laboratorios de EF que se inició hace más de 20 años. La EC engloba una amplia gama de situaciones clínicas, en las que pueden converger todos los mecanismos de arritmia (aumento del automatismo, actividad desencadenada y reentrada). Mientras que la TV asociada a la cicatrización del IM es el paradigma clínico de la reentrada4, la activación focal por un automatismo anormal es el principal mecanismo involucrado en la TV originada en la zona de borde isquémico durante la isquemia aguda5. La descarga focal por sobrecarga de calcio y la actividad desencadenada en forma de posdespolarizaciones tardías o tempranas también son un mecanismo probable de inicio de la TV durante la isquemia, pero hasta el momento no se ha demostrado experimentalmente6.
La isquemia aguda activa los canales de potasio sensibles a adenosina trifosfato, lo que causa un aumento del potasio extracelular, junto con acidosis e hipoxia en el músculo cardiaco. Pequeños incrementos del potasio extracelular despolarizan el potencial de membrana en reposo del miocardiocito, lo cual puede elevar la excitabilidad tisular en las fases tempranas de la isquemia5. Una mayor hiperpotasemia causa un incremento de la despolarización en reposo, disminución de la velocidad de conducción y de la excitabilidad tisular y acortamiento del potencial de acción, pero no del periodo refractario efectivo, que se prolonga como consecuencia de la refractariedad tras la repolarización5. Estos cambios proporcionan sustrato para una corriente de lesión que fluye entre las células isquémicas y las no isquémicas situadas en la zona de borde, lo cual podría fomentar la actividad focal por un automatismo anormal en el tejido normal e iniciar la TV7, que con frecuencia surge en la red de Purkinje subendocárdica8. Se ha descrito también un mecanismo de microrreentrada por gradientes de voltaje transmurales generados durante la isquemia aguda9. En este contexto, la TV polimorfa y la FV se producen cuando un único frente de onda de reentrada se divide en múltiples ondas pequeñas, lo cual es más probable que ocurra en el tejido no isquémico circundante, debido a su menor periodo refractario efectivo10. Si se restablece la perfusión coronaria, una mejoría rápida y heterogénea de la excitabilidad tisular podría producir una activación focal que cause la aparición de las TV con la reperfusión11.
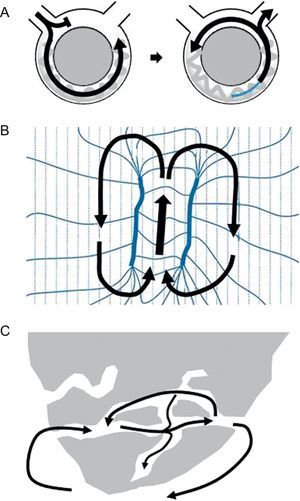
La reentrada es el mecanismo subyacente en la TV asociada al IM cicatrizado o en fase de cicatrización en más del 95% de los casos4. La reentrada es un mecanismo autoperpetuado mediante el cual el frente de onda se propaga repetidamente por la totalidad de un circuito de rotación cerrado y lo suficientemente largo para permitir que el tejido cardiaco esté en un estado excitable cuando llega a él el frente de onda (Figura 1A). Hay dos condiciones esenciales para que se produzca la reentrada: a) un bloqueo unidireccional de la conducción (es decir, una conducción satisfactoria en un solo sentido), y b) un ciclo del circuito de una duración superior a la de cualquiera de los periodos refractarios existentes en su conjunto. La longitud del circuito necesaria para la reentrada depende directamente del periodo refractario tisular, pero también de la velocidad de conducción del frente de onda. El bloqueo unidireccional de la conducción puede ser de causa anatómica, producido por discontinuidades del músculo ventricular12, ramificaciones de conducción lenta13, 14 o una interrupción del tejido debida a anomalías en la unión de hendidura15 en las áreas de cicatriz del IM. También puede ser de carácter funcional, como consecuencia de la dispersión de la refractariedad, un fenómeno que se ha descrito tanto para la TV asociada a un IM cicatrizado como para la TV aparecida como complicación de la isquemia aguda5. Aunque los estudios iniciales realizados con modelos en perros respaldaron el concepto de un circuito de reentrada funcional «en 8» (Figura 1B) en el que, según la descripción original, el componente principal del bloqueo sería una intrusión en la refractariedad causada por la brevedad de los ciclos durante la taquicardia, que se disiparía en presencia de ritmo sinusal (RS), actualmente se acepta que la reentrada en presencia de un IM tiene su origen principalmente en los haces de miocardio supervivientes que se encuentran en el interior de la cicatriz, separados por tejido conjuntivo, fibrosis y alteración del acoplamiento intercelular16 (Figura 1C). La evidencia que respalda esta hipótesis deriva de que puede establecerse un mapa de las áreas fijas de conducción lenta durante el RS en los pacientes con TV y que la ablación de esas zonas puede eliminar de manera efectiva la TV4. El sustrato para la TV se desarrolla gradualmente durante las primeras 2 semanas tras el IM, y una vez establecido persiste indefinidamente. En este contexto, se produce una TV espontánea en presencia de los desencadenantes adecuados, como las elevaciones del tono del sistema autónomo, el desequilibrio electrolítico, la isquemia aguda o la descompensación aguda de la insuficiencia cardiaca4.
Figura 1. Ejemplos de circuitos de reentrada. A: diagrama que representa un solo circuito de reentrada que se inicia con un bloqueo unidireccional; la longitud del circuito debe ser superior al periodo refractario más largo. B: un circuito en forma de 8 en el que, según la idea original, la reentrada se establece a causa de la dispersión de la refractariedad durante la taquicardia (modificado de Lazzara et al 16 con permiso). C: circuito de laberinto anatómico, creado por franjas de miocardio viable en el interior de la cicatriz, con posibilidad de múltiples circuitos de reentrada.
Forma de presentación clínica y estudio diagnóstico no invasivoLa forma de presentación clínica en los pacientes con EC que sufren arritmias ventriculares es diversa. Los pacientes con arritmias ventriculares aparecidas como complicación de la isquemia aguda podrían presentar palpitaciones además de dolor torácico si la arritmia es estable y tolerada clínicamente, pero con más frecuencia sufren síncope y muerte súbita cardiaca como consecuencia de una TV hemodinámicamente inestable o una FV. En el caso de las arritmias ventriculares relacionadas con un IM antiguo, los pacientes podrían estar asintomáticos cuando la arritmia es lenta y estable, pero las palpitaciones, la disnea o la molestia torácica son síntomas frecuentes. La tolerancia clínica a la TV está relacionada con la frecuencia de la taquicardia, la presencia de conducción retrógrada, la función ventricular basal y la integridad de los mecanismos de compensación periféricos. La TV incesante, aun cuando sea hemodinámicamente estable, puede conducir a deterioro hemodinámico e insuficiencia cardiaca17.
Además de la historia clínica y la exploración física, la evaluación general de un paciente con EC en el que se sospecha o se han documentado arritmias ventriculares incluye la realización de un electrocardiograma (ECG) de 12 derivaciones (véase más adelante) y una ecocardiografía. La monitorización Holter puede ser útil en ciertos casos de sospecha de TV. Otras técnicas no invasivas, como la onda T alternante, el ECG de promediación de señal y la determinación de la variabilidad de la frecuencia cardiaca, no aportan confirmación diagnóstica, pero podrían ser útiles para definir el riesgo de arritmia en pacientes con EC17.
Signos electrocardiográficos durante la taquicardia ventricularComo ya se ha comentado, las arritmias ventriculares en la fase aguda de la isquemia suelen ser polimorfas y degenerar rápidamente a FV, que requiere una interrupción eléctrica inmediata. La identificación de la FV no suele ser difícil y no se comenta aquí. Resulta más difícil, en cambio, el diagnóstico de una TV monomorfa, que debe basarse en los signos observados en el ECG de superficie. En la mayoría de los casos, un análisis cuidadoso de un único ECG obtenido durante la taquicardia puede: a) confirmar el diagnóstico de TV y descartar otras posibles causas de taquicardia de complejos anchos (TCA), como la taquicardia supraventricular con conducción aberrante, el bloqueo de rama del haz preexistente o la taquicardia de preexcitación; b) indicar una posible cardiopatía subyacente, y c) identificar el origen de la TV o de qué salida del circuito surge, lo cual es esencial al planificar un estudio electrofisiológico (EEF) para la elaboración del mapa y la ablación.
Diferenciar la taquicardia ventricular de la taquicardia supraventricularEl diagnóstico mediante ECG de una TCA constituye un verdadero reto para el médico clínico, no sólo por la dificultad de reconocer ciertos criterios del ECG, sino también por las circunstancias en que se produce la TCA (que a menudo requieren un diagnóstico rápido) y las consecuencias de una conclusión errónea, que puede causar un perjuicio al paciente. Ante una TCA, es importante recordar que la TV es su causa en el 80% de los casos18. La anamnesis puede respaldar esta etiología si hay antecedentes de enfermedad cardiaca, como un IM previo, angina o insuficiencia cardiaca congestiva18. Diversos trabajos tanto clásicos como recientes han descrito criterios electrocardiográficos específicos, que se han demostrado útiles cuando se dan, pero cuya menor sensibilidad en la mayor parte de los casos ha limitado su utilidad clínica19, 20, 21. En la Tabla 1 se resumen los principales criterios electrocardiográficos propuestos para diferenciar la TV de la taquicardia supraventricular.
Tabla 1. Criterios electrocardiográficos de taquicardia ventricular en el diagnóstico diferencial de la taquicardia de complejos anchos
| 1. Relación auriculoventricular | Disociación AV. Incluye latidos con fusión y con captura | |
| Relación VA>1 | ||
| 2. Duración del QRS | Morfología de tipo BRDH con QRS>140 ms | |
| Morfología de tipo BRIH con QRS>160 ms | ||
| QRS más estrecho que en RS | ||
| 3. Eje del QRS | Eje superior derecho (concordancia negativa en I, II, III) | |
| 4. Patrones específicos del QRS | En derivaciones precordiales:• Concordancia negativa o positiva• Ausencia de RS en todas las derivaciones precordiales• En presencia de complejos de RS, un intervalo entre inicio de R y valor más bajo de S>100 ms | |
| Específicamente en aVR:• Onda R inicial• Fuerzas iniciales con complejo ancho (> 40 ms) o con escotadura• vi / vt < 1 | ||
| Específicamente en V1:• Con morfología de tipo BRDH:– Onda R monofásica– qR o Rs con R ancha (> 30 ms) | • Con morfología de tipo BRIH:– Onda r ancha u onda S profunda– QS con fuerzas iniciales lentas (inicio a valor más bajo>60 ms) | |
| Específicamente en V6:• Con morfología de tipo BRDH:– Onda R monofásica– Onda S profunda (QS o rS)– R/S < 1 | • Con morfología de tipo BRIH:– Ondas Q (QR, QS, QrS) | |
AV: auriculoventricular; BRDH: bloqueo de rama derecha del haz; BRIH: bloqueo de rama izquierda del haz; RS: ritmo sinusal; VA: ventriculoauricular.
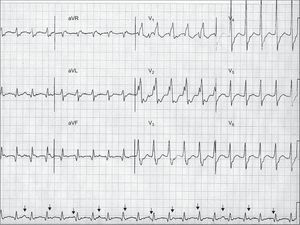
El análisis de la relación auriculoventricular —es decir, la relación entre las ondas P y los complejos QRS— puede aportar información clara. La presencia de una disociación auriculoventricular es un criterio muy específico para la TV. La disociación auriculoventricular indica actividades auricular y ventricular independientes e indica claramente una TV (Figura 2). Sin embargo, solamente se observa en un 20-50% de las TV. La concomitancia con fibrilación auricular es otra limitación de este criterio. La existencia de latidos de captura o de fusión, como consecuencia de una activación completa o parcial de los ventrículos a partir de las aurículas, dentro de la taquicardia, implica una disociación auriculoventricular y, por lo tanto, es diagnóstica de TV. Los requisitos para que se produzcan los latidos de captura y de fusión son frecuencia lenta de la TV, impulsos sinusales en los momentos apropiados, ausencia de conducción ventriculoauricular retrógrada oculta y una conducción auriculoventricular anterógrada excelente.
Figura 2. Un ejemplo de taquicardia de complejos anchos a 130 lpm que muestra una disociación auriculoventricular (las flechas señalan las ondas P), una configuración de tipo bloqueo de rama derecha del haz con un complejo QRS > 140 ms (200 ms), presencia de complejos de RS en las derivaciones precordiales con un intervalo de inicio de onda R-valor más bajo de onda S>100 ms (160 ms), y un vi / vt < 1 en aVR. Todos estos criterios respaldan el diagnóstico de taquicardia ventricular. Aunque no cumple de la forma característica los criterios de taquicardia ventricular, la onda R ancha en V1 y la onda S profunda en V6 apuntan también a una taquicardia ventricular. La relación R/S en V6 es > 1, lo cual puede observarse en hasta un 50% de los casos de taquicardia ventricular con eje inferior. Un análisis más detallado muestra ondas Q en derivaciones inferiores y complejos QRS anchos y mellados, con fuerzas iniciales lentas, que indican una taquicardia ventricular relacionada con una cicatriz, probablemente en el contexto de un infarto de miocardio antiguo.
Hasta un 30% de las TV tienen conducción retrógrada a las aurículas y presentan una relación ventriculoauricular 1:1, lo cual podría llevar a confundirlo con taquicardia supraventricular. Sin embargo, también se puede observar diferentes grados de bloqueo ventriculoauricular que dan lugar a más complejos QRS que ondas P y a una relación ventriculoauricular > 1, otra característica con especificidad del 100% para la TV. En los casos de TV con conducción ventriculoauricular 1:1, el masaje del seno carotídeo puede ser útil para realizar el diagnóstico si se establece el bloqueo ventriculoauricular sin afectar a la taquicardia.
Sin influencia de fármacos antiarrítmicos, los complejos QRS muy anchos generalmente indican TV19 debida a una activación lenta iniciada en los ventrículos. Los complejos QRS más anchos son lo que se observa en casos de TV originadas en la pared lateral del VI, mientras que hay unos complejos QRS comparativamente más estrechos en las TV originadas en el tabique interventricular y en las que afectan rápidamente al sistema de His-Purkinje. En general, se ha descrito que los QRS de anchura > 140 ms en una TCA de tipo bloqueo de rama derecha del haz (positiva en V1) o > 160 ms en una TCA de tipo bloqueo de rama izquierda del haz (negativa en V1) indican claramente una TV. Es importante señalar que se debe analizar todas las derivaciones para buscar los QRS más largos, puesto que algunas TV pueden tener unos complejos QRS aparentemente estrechos en algunas derivaciones y complejos QRS anchos en otras (Figura 2). No obstante, algunos casos de TV pueden mostrar unos complejos QRS relativamente estrechos, como ocurre en las TV originadas en el sistema de His-Purkinje. Por otro lado, la presencia de un QRS más estrecho en la taquicardia que durante el RS indica una secuencia de activación anormal durante la taquicardia, por lo que apunta a una TV.
Los demás criterios electrocardiográficos se refieren al eje y la morfología de los complejos QRS. Como regla general, la taquicardia supraventricular con conducción aberrante debe mostrar siempre unos complejos QRS que sean compatibles con alguna forma de bloqueo de rama del haz o bloqueo fascicular. De lo contrario, el diagnóstico por defecto será el de TV, excepto en los casos de taquicardia con preexcitación, que son poco frecuentes. En este sentido, un QRS con un eje superior derecho, que no puede producirse con ninguna combinación de bloqueo de rama del haz o bloqueo fascicular, indica claramente una TV. Aunque es menos específico, un eje superior desviado hacia la izquierda, en ausencia de un bloqueo fascicular anterior izquierdo, también apunta a una TV.
Las principales características morfológicas específicas que podrían ser útiles para diferenciar la TV de la taquicardia supraventricular se indican en la Tabla 1. Aunque solamente se halla en un 20% de los casos de TV, un patrón de progresión de onda R concordante negativo o positivo (es decir, todas las derivaciones precordiales predominantemente negativas o positivas, respectivamente) tiene una especificidad > 90% para la TV18. La ausencia de RS en todas las derivaciones precordiales, que en la mayoría de los casos muestra una concordancia positiva o negativa, según lo determinado por Brugada et al, tiene una asociación del 100% con la TV20. En nuestra propia revisión de 100 casos (observaciones personales) no se evidenció una ventaja significativa de esta característica respecto a los criterios de morfología de V1-V2 (véase más adelante), pero el «RS ausente precordial» de Brugada tiene una utilidad práctica importante al analizar un ECG. Esos mismos autores describieron que, en presencia de un complejo de RS en una derivación precordial, un intervalo entre el inicio de la onda R y el punto más bajo de la onda S > 100 ms era muy específico para la TV20 (Figura 2). En un trabajo reciente de Vereckei et al21 se ha propuesto un nuevo algoritmo para el diagnóstico diferencial de la TCA con el empleo sólo de la derivación aVR. Según los autores, la presencia de una onda R inicial, una onda r o q inicial de amplitud > 40 ms y una escotadura en la parte de descenso inicial en aVR fueron criterios indicativos de una TV. Si no se daban estas características, un cociente de activación/velocidad ventricular (vi / vt) < 1 era diagnóstico de TV21 (v1 es la desviación de voltaje en los 40 ms iniciales del complejo QRS, mientras que vt es la desviación de voltaje en los últimos 40 ms). Un cociente < 1 indicaría una activación inicial lenta, lo cual concuerda con la TV (Figura 2). Los últimos criterios electrocardiográficos se aplican a las derivaciones V1 y V6 y son diferentes para la TCA de bloqueo de rama derecha del haz y la de bloqueo de rama izquierda del haz. Una TCA de tipo bloqueo de rama derecha del haz probablemente corresponde a una TV si no muestra las características de un bloqueo de rama derecha del haz típico, como una V1 trifásica (rSR’, rsr’, rR’) u ondas S terminales pequeñas en V6. Las características típicas de la TV de bloqueo de rama derecha del haz son las ondas R monofásicas o anchas en V1 y las ondas S profundas con un cociente R/S < 1. Sin embargo, el criterio del cociente R/S se cumple en el 80% de los casos de TV con un eje superior y sólo en un 50% de los casos de TV con eje inferior4. Las TCA de tipo bloqueo de rama izquierda del haz probablemente sean TV si las fuerzas iniciales en V1 son anchas y lentas (indicativas de una conducción lenta procedente del ventrículo) y hay ondas Q en V6.
Analizar la posible existencia de una cardiopatía subyacenteLa existencia de una cardiopatía estructural subyacente se confirma en la mayor parte de los casos mediante la historia clínica. Sin embargo, cuando no se dispone de información, el ECG podría resultar útil para identificar ciertos marcadores de cardiopatía o IM. En el contexto de un IM antiguo, el ECG obtenido durante la TV se ve afectado por el tamaño del infarto, la región afectada por este, la región del interior de la cicatriz en que se sitúa el circuito, la proximidad al sistema de His-Purkinje y la influencia de los agentes farmacológicos concomitantes. A pesar de estas limitaciones, ciertas características del ECG identificables durante la taquicardia podrían señalar la presencia de una cicatriz y, por lo tanto, irían en favor de una TV originada en un IM antiguo. Estas características se enumeran en la Tabla 2.
Tabla 2. Características del electrocardiograma que indican una taquicardia ventricular relacionada con un infarto de miocardio antiguo
| Presencia de ondas Q (qR, QR o Qr) en derivaciones relacionadas |
| Complejos QRS anchos o mellados |
| Voltaje bajo de QRS |
| Múltiples morfologías de taquicardia ventricular |
| Episodios sostenidos paroxísticos |
La presencia de ondas Q durante la taquicardia apunta a un IM antiguo. En general, los pacientes con una TV post-IM mantienen las mismas ondas Q que están presentes en el RS, pero no siempre se dispone de registros de ECG previos en RS. Es importante comprender que una morfología de QS no implica necesariamente una lesión estructural, sino más bien un impulso eléctrico que se aleja del lugar de registro. Por el contrario, las ondas Q traducen un sustrato patológico cuando aparecen con una onda R posterior (qR, QR o Qr) y en dos o más derivaciones relacionadas (Figura 2)4. Otras características del ECG corresponden a la anchura del QRS y las fuerzas iniciales. Como concepto general, en las TV relacionadas con un IM, que es característico que tengan su origen en miocardiocitos viables del interior del tejido cicatrizal, la activación eléctrica se inicia en el tejido patológico con conducción lenta. En el ECG de superficie, esto se manifiesta por unas fuerzas QRS iniciales lentas, con unos complejos QRS característicos de mayor amplitud y mellados. Por el contrario, las TV que se producen en ausencia de una cardiopatía estructural suelen presentar unos complejos QRS comparativamente más estrechos y de perfil menos irregular. Una cicatriz grande —por lo tanto, la presencia de menos tejido miocárdico viable— podría generar unos complejos QRS de bajo voltaje en las TV relacionadas con un IM antiguo, mientras que a menudo se observan complejos QRS de alto voltaje en las TV en un corazón normal. Por último, la presencia de múltiples morfologías de TV monomorfa aparecidas en episodios paroxísticos pero sostenidos apunta a una TV relacionada con una cicatriz, mientras que una morfología única causante de extrasístoles ventriculares aislados, bigeminismo, couplets o salvas, va en favor de una TV en un corazón sano.
Identificar el origen de la taquicardia ventricularEl ECG obtenido durante la TV aporta una información esencial acerca del origen de la arritmia, por lo que es el instrumento más útil para guiar la elaboración de mapas y la ablación en el ulterior estudio de EF invasiva. Sin embargo, es importante señalar que, en la TV relacionada con el IM, el ECG de superficie tiende a localizar la salida del circuito de reentrada (véase más adelante) más que el origen de la TV.
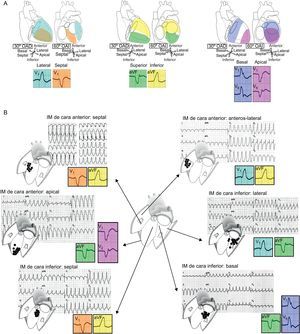
La localización debe definirse en tres ejes (Figura 3): a) septal frente paredes laterales; b) pared superior frente a pared inferior, y c) región apical frente a región basal. El patrón de bloqueo de rama del haz está relacionado con la secuencia de activación ventricular. Las TV originadas en la pared lateral muestran un patrón de bloqueo de rama derecha del haz (positiva en V1), mientras que la mayor parte de las TV septales presentan de manera característica una configuración de tipo de bloqueo de rama izquierda del haz (negativa en V1). Las TV laterales tienen complejos QRS más anchos, debido a la activación secuencial de ambos ventrículos. Por el contrario, las TV septales tienen complejos QRS más estrechos, debido a la participación temprana del sistema de His-Purkinje y la activación paralela de los dos ventrículos. El eje QRS en las derivaciones inferiores indica la secuencia de activación entre las paredes superiores e inferiores. Un IM de cara inferior deja una cicatriz en la parte inferior que es el origen de una TV con eje superior en el 80% de los casos. En cambio, las TV que se producen en un IM de cara anterior pueden tener un eje superior (el 55% de los casos) o inferior (el 45% de los casos)4. Por último, la polaridad predominante de los complejos QRS en las derivaciones precordiales puede ser útil para diferenciar las TV originadas en regiones basales de las originadas en apicales. En las TV iniciadas en el vértice cardiaco, la activación ventricular se aleja de todas las derivaciones precordiales, lo cual se aprecia en el ECG en el patrón de progresión de onda R concordante negativa. Ocurre lo contrario en las TV originadas en regiones basales, que se caracterizan electrocardiográficamente por una concordancia positiva en las derivaciones precordiales.
Figura 3. Localización electrocardiográfica del origen de la taquicardia ventricular. A: la evaluación de la localización debe basarse en tres ejes: septal/lateral, superior/inferior y basal/apical. B: ejemplos de taquicardias ventriculares originadas en diferentes localizaciones de cicatrices de infartos de miocardio de cara anterior o inferior. Aunque una evaluación electrocardiográfica completa requiere un análisis de los tres ejes, solamente se muestran en los cuadrados en color algunas derivaciones representativas esenciales para el diagnóstico en cada caso. IM: infarto de miocardio; OAD: oblicua anterior derecha; OAI: oblicua anterior izquierda. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Son varias las características del ECG descritas como predictoras de origen epicárdico de las TV iniciadas en el ventrículo izquierdo22, 23, 24. Algunos de estos criterios, como el tiempo transcurrido hasta la primera deflexión rápida en las derivaciones precordiales (onda seudodelta) ≥ 34 ms, el intervalo hasta el pico de la onda R (tiempo de deflexión intrinsecoide) en la derivación V2 ≥ 85 ms, la duración mínima del RS ≥ 121 ms y el índice de deflexión máximo ≥ 0,55, son indicadores directos o indirectos de una activación inicial más lenta de los ventrículos cuando el origen es epicárdico22. Otras características morfológicas son la presencia de una onda Q en la derivación I, sin ondas Q en las derivaciones inferiores en las TV originadas en la pared superior, o la presencia de ondas Q en las derivaciones inferiores en las TV inferiores23. Sin embargo, estos estudios se han realizado mayoritariamente en poblaciones sin isquemia. Un estudio reciente ha establecido que estas características del QRS no permiten identificar de manera fiable las TV epicárdicas en la cardiopatía isquémica25, en la que, como se ha comentado, puede haber unas fuerzas iniciales lentas y ondas Q durante la taquicardia en la región de la cicatriz del IM.
Un tipo específico de TV con una morfología del QRS característica es la TV debida a una reentrada de rama del haz. Esto ocurre en los pacientes con una disfunción cardiaca grave y algún tipo de retraso en la conducción o bloqueo de rama del haz en la situación basal. En el contexto de la EC, la TV de reentrada de rama del haz podría producirse en pacientes con un IM de cara anterior grande y un bloqueo de rama derecha del haz con bloqueo fascicular anterior izquierdo o bloqueo fascicular posterior izquierdo. La TV se establece por una reentrada entre las ramas del haz o los fascículos, y es característico que muestre un QRS idéntico al QRS existente en RS.
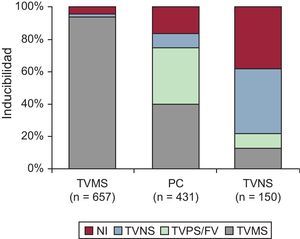
Papel del estudio electrofisiológicoActualmente se recomiendan las pruebas de EF en el contexto de la EC para la evaluación diagnóstica de los pacientes con un IM remoto cuando haya síntomas que indiquen arritmias ventriculares, como palpitaciones, presíncope o síncope (clase I, nivel de evidencia B), para guiar la ablación de la TV una vez identificada y valorar su eficacia (clase I, nivel de evidencia B) y para la evaluación diagnóstica de la TCA de mecanismo no aclarado (clase I, nivel de evidencia C)17. El empleo de pruebas de EF es razonable también para la estratificación del riesgo en pacientes con un IM remoto, TV no sostenida y FEVI ≤ 40% (clase IIa, nivel de evidencia B)17. Para cualquiera de las indicaciones mencionadas, el primer objetivo del EEF es intentar demostrar la inducibilidad de la arritmia con una estimulación eléctrica programada. El tipo de arritmia inducida varía según la forma de presentación clínica (Figura 4). Es importante señalar que los pacientes que han sufrido una TV monomorfa sostenida tienen una probabilidad un 93% superior de inducibilidad para el mismo tipo de taquicardia4.
Figura 4. Inducibilidad de las arritmias durante el estudio electrofisiológico en relación con la forma de presentación clínica. FV: fibrilación ventricular; NI: no inducible; PC: parada cardiaca; TVMS: taquicardia ventricular monomorfa sostenida; TVNS: taquicardia ventricular no sostenida; TVPS: taquicardia ventricular polimorfa sostenida. Modificado de Josephson 4 con permiso.
Si se ha inducido una TV, el EEF es crucial para determinar el mecanismo de la arritmia y una guía esencial para la ablación. Desde la descripción de los primeros EEF hace más de 30 años26, se ha descrito una serie de maniobras para demostrar de manera sencilla diferentes mecanismos de arritmia. Según lo indicado por estos trabajos clásicos, y con el apoyo de los resultados obtenidos en modelos experimentales evaluados en paralelo, sabemos que la TV post-IM tiene su origen en miocardiocitos que han sobrevivido en el interior del área del infarto y que la reentrada es el mecanismo que explica más del 95% de los casos. En consonancia con ello, los registros intracardiacos en el lugar de origen de la TV durante el RS muestran de manera uniforme potenciales multicomponente de baja amplitud, que corresponden a la actividad de los miocitos supervivientes, y una conducción anormalmente lenta y fraccionada en esta área (Figura 5)4. Por otro lado, las siguientes observaciones de EF (Tabla 3) aportan la confirmación de la reentrada como mecanismo causal4, 27, 28, 29, 30:
1. Capacidad de iniciar y finalizar de manera reproducible la arritmia mediante estimulación ventricular programada. La reentrada requiere que se produzca un bloqueo unidireccional, que puede ocurrir cuando un estímulo adicional, en un momento apropiado, encuentra un área de tejido refractario y se establece una conducción por el tejido circundante. La TV se genera luego mediante autoperpetuación del frente de onda, que alcanza el área inicial cuando ya no hay refractariedad y se desplaza indefinidamente por el circuito (Figura 6A). En estas circunstancias, un estímulo adicional en el momento apropiado podría interrumpir la taquicardia al colisionar de modo anterógrado con el tejido refractario y retrógrado con el frente de onda de activación (Figura 6B). La respuesta a la estimulación adicional es específica para la reentrada. Las arritmias causadas por un automatismo normal o anormal no pueden ser iniciadas ni interrumpidas con la estimulación programada, y los ritmos desencadenados causados por posdespolarizaciones tardías suelen inducirse con marcapasos superpuestos y/o infusión de catecolaminas e interrumpirse con maniobras vagales.
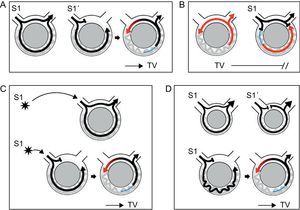
Figura 6. Diagramas en los que se representan diferentes fenómenos asociados a la reentrada. Las flechas negras indican latidos sinusales o estimulados. Los latidos de taquicardia ventricular se representan en rojo. El periodo refractario se muestra en azul. A: inicio e interrupción de la taquicardia ventricular en respuesta a una estimulación adicional: un solo estímulo adicional (S1) entra y sale del circuito que tiene una conducción bidireccional. Un estímulo adicional más prematuro (S1’) es bloqueado en el área de conducción rápida, que continúa siendo refractaria, mientras que se produce una conducción anterógrada a lo largo de la vía lenta del circuito. Cuando la activación llega de forma retrógrada al área de conducción rápida, esta ha dejado de ser refractaria, y se establece la reentrada, con lo que se inicia la taquicardia ventricular. B: durante la taquicardia ventricular, un estímulo adicional que llega en el momento adecuado encuentra el tejido recién despolarizado refractario (indicado en azul); colisiona con el frente de onda retrógrado y detiene el circuito de reentrada, con lo que interrumpe la taquicardia. C: el inicio de la taquicardia ventricular es específico de la localización; en el ejemplo mostrado, un solo estímulo adicional con un intervalo dado inicia la taquicardia ventricular solamente cuando se encuentra a una distancia tal que se establece un bloqueo unidireccional cuando el impulso llega al circuito. D: necesidad de un retraso de conducción crítico para la inducción de la taquicardia ventricular; en el primer ejemplo, la activación se desplaza de forma rápida bidireccionalmente en un circuito en el que hay poco retraso, lo cual se representa mediante un circuito pequeño; incluso la presencia de un bloqueo unidireccional creado por un estímulo adicional podría no ser suficiente para crear una reentrada, ya que el frente de onda que avanza retrógradamente encuentra el tejido todavía en un estado refractario; en el segundo ejemplo, un retraso de conducción significativo facilita la recuperación de la vía retrógrada y la reentrada. TV: taquicardia ventricular. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
2. Especificidad de localización para la inducibilidad y la interrupción. Este criterio responde al mismo principio que el anterior. La especificidad de localización refleja tan sólo la necesidad de que el estímulo adicional entre en el circuito y sea bloqueado de forma unidireccional. Esto puede obtenerse aplicando un estímulo adicional en un momento apropiado o aplicándolo desde cierta distancia, de tal manera que para cuando el impulso llega a entrar en el circuito se haya establecido un bloqueo unidireccional (Figura 6C). El lugar de estimulación no modifica la inducibilidad en las arritmias generadas por otros mecanismos.
3. Relación inversa del intervalo de acoplamiento o la duración del ciclo de marcapasos con la duración del ciclo del primer latido de taquicardia. Cuanto más cortos sean el intervalo S1-S2 o el ciclo de marcapasos, mayor es el tiempo transcurrido hasta el primer latido de taquicardia. Esto se debe a que cuanto más breve es el ciclo o más rápida es la frecuencia del marcapasos, más pronunciada pasa a ser la conducción lenta, que es un requisito para la reentrada (Figura 7A). De hecho, la demostración de que la inducibilidad y el mantenimiento de la TV requieren un grado crítico de conducción lenta prueba la existencia de una reentrada (figs. Figura 6 y Figura 7). Por el contrario, en los ritmos desencadenados, el intervalo de acoplamiento o la duración de ciclo de marcapasos, de tener alguna influencia, están directamente relacionados con la duración del ciclo del primer latido de taquicardia, y es característico que se pueda acelerar con el marcapasos.
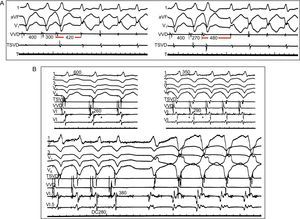
Figura 7. Retraso de la conducción en la taquicardia ventricular de reentrada. A: relación inversa del intervalo de acoplamiento de los estímulos prematuros respecto al intervalo del primer latido de taquicardia; se muestran las derivaciones I, VF y V1, junto con los registros intracardiacos obtenidos en el vértice y en el infundíbulo de salida del ventrículo derecho; se aplican estímulos adicionales ventriculares (300 → 270 ms) en el vértice del ventrículo derecho con una duración del ciclo básico de 400 ms; el retraso de la conducción es más pronunciado (420 → 480 ms) con los intervalos de acoplamiento más cortos. B: requisito de un retraso de la conducción crítico para la inducción de una taquicardia ventricular de reentrada; se presentan las derivaciones I, II, II, V1 y V6 junto con los registros intracardiacos obtenidos en el vértice y el infundíbulo de salida del ventrículo derecho y en dos localizaciones diferentes del ventrículo izquierdo. Con frecuencias de marcapasos más rápida (600 → 350 → 280 ms), la conducción en el ventrículo izquierdo va siendo progresivamente más lenta, lo cual se manifiesta por unos potenciales fraccionados más largos en el canal ventricular izquierdo (260 → 290 → 380 ms) hasta que se alcanza un retraso crítico que puede iniciar la taquicardia ventricular. DC: duración del ciclo; TSVD: tracto de salida ventricular derecho; VI: ventrículo izquierdo; VVD: vértice ventricular derecho. Modificado de Josephson 4 con permiso.
4. Reciclaje durante la taquicardia estable en respuesta a la estimulación programada27, 28. En el EEF, el reciclaje es la interacción de un frente de onda prematuro con una taquicardia, que da lugar a un adelanto o un retraso del latido de taquicardia posterior. En el caso concreto de la reentrada, el frente de onda prematuro (generalmente un estímulo adicional) entra en el circuito de taquicardia, con lo que colisiona retrógradamente con el frente de onda de taquicardia precedente y tiene una conducción anterógrada a través de tejido excitable del circuito, lo que produce un complejo temprano y una pausa inferior a la compensatoria (Figura 7). El ciclo de retorno (CR), definido como el intervalo que va del estímulo adicional al inicio del siguiente latido, corresponde al tiempo necesario para que el impulso estimulado llegue al circuito, sea conducido por todo él y vuelva al lugar de estimulación. En función de la relación existente entre el intervalo de acoplamiento y el CR, se han descrito tres tipos de respuestas de reciclaje:
• Se observa una respuesta plana cuando el CR se mantiene estable a intervalos de acoplamiento decrecientes, en tanto el lugar de estimulación sea el mismo. Una respuesta plana indica que hay un segmento plenamente excitable a lo largo de todo el circuito (no se encuentra tejido refractario en ningún intervalo de acoplamiento).
• Se observa una respuesta creciente cuando el CR aumenta progresivamente a medida que se reduce el intervalo de acoplamiento. Ello indica que el estímulo encuentra tejido refractario en la totalidad o parte del circuito de reentrada, y esto es más pronunciado cuando el intervalo de acoplamiento es más corto.
• Una respuesta mixta se define por la combinación de los dos patrones antes citados (una respuesta plana inicial que aumenta con el intervalo de acoplamiento más corto).
El reciclaje no demuestra reentrada por sí solo. Las arritmias automáticas podrían mostrar reciclaje con una respuesta plana, y los ritmos desencadenados podrían manifestarse por una respuesta de reciclaje plana o decreciente. Las respuestas crecientes o mixtas son específicas de la reentrada e indican la participación de un tejido parcialmente refractario. El reciclaje con fusión (que se observa generalmente en el ECG) (Figura 8) es prácticamente diagnóstico de reentrada e implica que la entrada del estímulo en el circuito y la salida de la taquicardia se producen en lugares separados27, 28. El reciclaje con fusión manifiesta en el ECG se produce en aproximadamente el 50% de las TV de reentrada debidas a EC4.
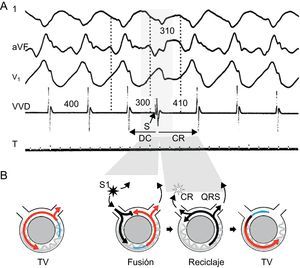
Figura 8. El reciclaje con fusión es diagnóstico de la taquicardia ventricular de reentrada. Se presentan las derivaciones I, aVF y V1 del electrocardiograma de superficie y el registro intracardiaco obtenido en el vértice del ventrículo derecho (A), junto con diagramas representativos del mecanismo (B). Los latidos de taquicardia se indican en rojo; los latidos estimulados, en negro y el periodo refractario, en azul. La duración del ciclo de la taquicardia es de 400 ms. Se aplica un estímulo adicional a los 300 ms a partir de una localización muy alejada de la salida del circuito, con lo que se produce un latido de fusión, una morfología compuesta situada entre los latidos de marcapasos y de taquicardia ventricular. El estímulo adicional penetra en la taquicardia e interacciona con ella generando el siguiente latido de taquicardia. El ciclo de retorno de 410 ms corresponde al tiempo necesario para que el impulso estimulado llegue al circuito, sea conducido por todo él y vuelva al lugar de estimulación. CR: ciclo de retorno; DC: duración del ciclo; TV: taquicardia ventricular; VVD: vértice ventricular derecho. El panel A se ha reproducido de Almendral et al 27 con permiso. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
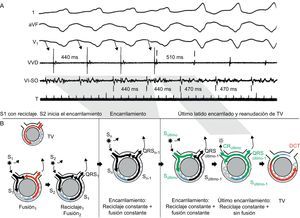
5. Encarrilamiento durante una taquicardia estable en respuesta a la estimulación programada29. El encarrilamiento es la respuesta a un ritmo de marcapasos superpuesto, es decir, un reciclaje continuo por un tren de estímulos (Figura 9), y aporta evidencia concluyente respecto a la presencia de un mecanismo de reentrada. A diferencia del reciclaje, el encarrilamiento examina un circuito en el que ha habido anteriormente un reciclaje (por el primer estímulo adicional del tren de impulsos). Hay encarrilamiento cuando el ritmo de marcapasos aplicado a una frecuencia más rápida que la de la TV acelera todos los complejos QRS de la TV con el mismo patrón de fusión y la interrupción del marcapasos conduce a la reanudación de la misma TV. Los criterios clásicos para identificar el encarrilamiento son los siguientes29:
• Fusión de QRS fija a una duración de ciclo y localización dadas. Excepto por el primer y el último latido de la estimulación, se observa una fusión del QRS fija en los demás latidos estimulados. Una vez que el primer estímulo del tren ha producido el reciclaje de la TV, los estímulos posteriores producen un reciclaje del circuito reciclado, lo que da lugar a un patrón fijo de conducción anterógrada y colisión retrógrada con el frente de onda estimulado anterior. Esto produce una fusión de QRS constante a una duración dada del ciclo del marcapasos.
• Fusión progresiva (que favorece de manera creciente la morfología del marcapasos) con unos ciclos de marcapasos más rápidos.
• Reanudación de la TV con un latido capturado pero no fusionado cuando el marcapasos se detiene.
Figura 9. Encarrilamiento de la taquicardia ventricular. Se presentan las derivaciones I, aVF, y V1 del electrocardiograma de superficie y los registros intracardiacos obtenidos en el vértice ventricular derecho y en el sitio de origen ventricular izquierdo, junto con diagramas esquemáticos que representan el mecanismo (latidos de taquicardia presentados en rojo; latidos estimulados, en negro; último estímulo de marcapasos, en verde; periodo refractario, en azul). La duración del ciclo de la taquicardia es de 470 ms. Durante el marcapasos superpuesto, con un origen en el vértice ventricular derecho a 440 ms, la taquicardia se acelera transitoriamente hasta la frecuencia del marcapasos, y la morfología del QRS corresponde a una fusión entre los latidos de marcapasos y de taquicardia ventricular. Cuando el marcapasos se detiene, la taquicardia ventricular se reanuda con un latido de retorno encarrilado pero no fusionado (que se representa en verde en los diagramas). El ciclo de retorno de este último latido (510 ms) aporta información sobre la distancia entre el lugar de estimulación y el circuito. CR: ciclo de retorno; DCT: duración del ciclo de la taquicardia; SO: sitio de origen; TV: taquicardia ventricular; VI: ventrículo izquierdo; VVD: vértice ventricular derecho. La imagen A se ha reproducido de Almendral et al 29 con permiso. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
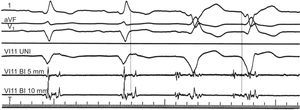
Figura 5. Anomalías del electrograma intracardiaco registrado en ritmo sinusal y durante la taquicardia ventricular. Se muestran las derivaciones I, aVF y V1 del electrocardiograma de superficie con tres registros intracardiacos obtenidos con un catéter colocado en la pared anterior del ventrículo izquierdo. Durante el ritmo sinusal (primeros dos complejos), se registra una señal multicomponente fraccionada en los electrogramas intracardiacos tras el final del complejo QRS en el electrocardiograma, lo cual indica un retraso en la activación endocárdica. Durante la taquicardia ventricular (últimos dos complejos), el electrograma de la misma localización precede al complejo QRS en 90 ms, lo cual indica una relación entre los potenciales multicomponentes anormales y las áreas en que se origina la taquicardia ventricular. BI: bidireccional; UNI: unidireccional; VI: ventrículo izquierdo. Reproducido de Josephson 4 con permiso.
Tabla 3. Características electrofisiológicas que demuestran un mecanismo de reentrada
| 1. Inicio de TV:• Estímulo adicional en el momento adecuado• Especificidad de localización• Relación inversa del intervalo de acoplamiento o la duración del ciclo del marcapasos con la duración del ciclo del primer latido de taquicardia• Requisito de un grado crítico de conducción lenta |
| 2. Durante la TV estable:• Reciclaje con fusión• Reciclaje con respuesta creciente o mixta• Encarrilamiento |
| 3. Interrupción de la TV:• Estímulo adicional en el momento adecuado• Especificidad de localización |
TV: taquicardia ventricular.
Al igual que en el reciclaje, la fusión del QRS es evidente cuando la localización del marcapasos y el lugar de salida de la taquicardia están muy separados. El encarrilamiento con fusión oculta (es decir, sin ningún cambio en la morfología del QRS) hace referencia al encarrilamiento efectuado dentro del propio circuito, en el que los latidos estimulados salen del circuito a través de la salida de la taquicardia y, por lo tanto, tienen exactamente la misma morfología de QRS que los existentes durante la TV. Las técnicas de encarrilamiento son extraordinariamente útiles para los mapas durante las intervenciones de ablación (véase más adelante).
AbordajeEl tratamiento de las arritmias ventriculares asociadas a la EC suele requerir un enfoque combinado, en el que la revascularización y el tratamiento óptimo de la insuficiencia cardiaca tienen como objetivo prevenir el desarrollo de un posible sustrato; los fármacos antiarrítmicos se emplean para suprimir o enlentecer la TV, con lo que mejorará la tolerancia clínica; la ablación quirúrgica o percutánea pretende curar y eliminar el sustrato arrítmico, y el uso de un desfibrilador automático implantable (DAI) es en la mayor parte de los casos el tratamiento de rescate y también el tratamiento definitivo, dada la eficacia limitada de lo anterior.
Tratamiento farmacológicoLa TV es una causa importante de muerte súbita y morbilidad en los pacientes con EC. Varios estudios realizados en los años ochenta y noventa evaluaron de manera empírica diversas opciones farmacológicas para la TV y la prevención de la muerte súbita cardiaca en los pacientes con EC, sobre todo los que ya habían sufrido un IM. Amiodarona mostró unos resultados limitados, con un efecto beneficioso debido a la reducción de las muertes arrítmicas (el 35% en el estudio EMIAT y el 48% en el estudio CAMIAT), pero sin efecto alguno en la mortalidad por todas las causas a los 24 meses31, 32. Sin embargo, en un análisis de subgrupos, los pacientes tratados con bloqueadores y amiodarona presentaron una reducción significativa tanto de la muerte súbita cardiaca como de la mortalidad total31, 32. En un estudio más reciente realizado en pacientes con insuficiencia cardiaca congestiva no se demostró una supervivencia favorable con amiodarona en comparación con placebo33. Los bloqueadores beta utilizados solos se asociaron a una reducción relativa del 19% de la mortalidad total, en comparación con placebo, en un metaanálisis en el que se incluyeron 138 ensayos y 98.000 pacientes con IM34. Ese mismo estudio puso de manifiesto una eficacia limitada de amiodarona, ausencia de eficacia de los bloqueadores del canal del calcio y un aumento del riesgo de mortalidad con los fármacos antiarrítmicos de clase I34. Sotalol mostró tendencia a la reducción de la mortalidad en los pacientes con un IM previo, pero la diferencia no fue estadísticamente significativa35. De hecho, en los pacientes con FEVI baja e insuficiencia cardiaca tras un IM, d-sotalol se asoció a un aumento de las muertes arrítmicas36. Por otro lado, el ensayo DIAMOND no pudo demostrar un efecto beneficioso en cuanto a la supervivencia (mortalidad por todas las causas, mortalidad cardiaca o total de muertes arrítmicas) con dofetilida en pacientes con disfunción del VI grave y un IM reciente37. El tratamiento antiarrítmico guiado por Holter con encainida y flecainida se evaluó en el ensayo CAST. En ese ensayo se evaluó la eficacia de estos fármacos de clase Ic en pacientes con un IM previo, y el estudio se interrumpió prematuramente debido a un exceso de muertes arrítmicas y muertes debidas a shock tras un infarto agudo de miocardio recurrente en ambos grupos de tratamiento antiarrítmico en comparación con placebo38. La inducibilidad en el estudio EEF se utilizó también en varios estudios para ensayo y ajuste de dosis de fármacos antiarrítmicos39, pero este enfoque se ha abandonado en su mayor parte.
La escasa eficacia general de los fármacos antiarrítmicos en la prevención de las arritmias ventriculares post-IM, sus efectos secundarios frecuentes y su potencial de arritmogenicidad en ciertos contextos especiales llevan a considerar otros métodos alternativos. En el ensayo OPTIC se evaluó la eficacia de tres tratamientos farmacológicos (bloqueadores beta solos, bloqueadores beta + amiodarona y sotalol solo) en la prevención de las arritmias ventriculares (y, por lo tanto, de las descargas de DAI) en pacientes portadores de un DAI40. El 80% de los pacientes de los tres grupos de tratamiento tenían antecedentes de un IM previo. Amiodarona+bloqueador beta redujo significativamente el riesgo de descargas en comparación con el bloqueador beta solo (razón de riesgos [HR]=0,27; p<0,001) y con sotalol (HR=0,43; p=0,02). Sotalol tendió a reducir las descargas en comparación con el bloqueador beta solo (HR=0,61; p=0,055).
A la vista de lo indicado por estos y otros ensayos, las guías actuales recomiendan dos opciones: a) bien amiodarona (clase IIa, nivel de evidencia B), bien sotalol (clase IIa, nivel de evidencia C), en combinación con bloqueadores beta si es posible, como tratamiento adyuvante para reducir los síntomas en los pacientes con antecedentes de IM, disfunción del VI y una TV que no responde a los bloqueadores beta solos, y b) amiodarona o sotalol en pacientes con DAI, antecedentes de IM y disfunción del VI que tienen descargas frecuentes del DAI (clase IIa, nivel de evidencia C), y amiodarona en pacientes con antecedentes de IM, disfunción del VI y TV hemodinámicamente estable que no son candidatos a un DAI (clase IIa, nivel de evidencia C)17. No está indicado el tratamiento antiarrítmico profiláctico para reducir la mortalidad, sino solamente para reducir los síntomas de pacientes que cumplen los criterios mencionados1.
Desfibriladores automáticos implantablesDesde su introducción en la práctica clínica a comienzos de los años noventa, los DAI han pasado a ser un elemento determinante en el tratamiento integral de las arritmias ventriculares asociadas a la EC. En comparación con el tratamiento antiarrítmico farmacológico, el empleo de DAI se ha asociado a reducciones de la mortalidad del 23 al 55% según el ensayo, con un beneficio de supervivencia que se debe en su mayor parte a la reducción de la muerte súbita cardiaca17.
El uso de DAI en pacientes que han sufrido ya arritmias con peligro para la vida (es decir, el uso de DAI en prevención secundaria) está fuera de toda duda. Entre 1997 y 2000 se publicaron tres ensayos aleatorizados de prevención secundaria en los que se comparó la eficacia de los DAI con la del tratamiento farmacológico antiarrítmico (Tabla 4)41, 42, 43. Los tres exigían antecedentes de parada cardiaca o arritmias con peligro para la vida documentadas e incluyeron en su mayor parte a pacientes con EC. Aunque solamente fue significativa en el ensayo AVID, probablemente por el mayor tamaño muestral, la reducción de la mortalidad total con los DAI fue similar en los tres estudios (Tabla 4). El análisis de subgrupos posterior de los tres ensayos puso de manifiesto que el efecto beneficioso era máximo en los pacientes con FEVI baja (< 35%), que eran también los que tenían mayor riesgo de arritmias50, 51, 52.
Tabla 4. Principales ensayos del uso de desfibrilador automático implantable en pacientes con enfermedad coronaria
| Ensayo | N | Inclusión | EC (%) | FE (%) | Grupo control | Seguimiento (meses) | Mortalidad grupo control | Mortalidad DAI | FC (DAI) |
| AVID 41 | 1.016 | Supervivientes de PC, TV sostenida con síncope, TV sostenida sintomática (sin síncope) + FE < 40% | 81 | 32 | Amiodarona (85%) o sotalol | 18 | 24 | 15,8 | 0,73 |
| CIDS 42 | 659 | Supervivientes de PC, FV documentada; TV sostenida con síncope; TV sostenida sintomática (sin síncope) o inestable + FE < 35%; síncope + TV inducible | 82,6 | 34 | Amiodarona | 36 | 20,97 a | 14,75 a | 0,70 a |
| CASH 43 | 288 | Supervivientes de PC con FV documentada | 73,3 | 46 | Amiodarona o metoprolol (combinado frente a DAI) b | 57 | 45 | 36 | 0,76 |
| MADIT 44 | 196 | IM previo con FE ≤ 35%; TV no sostenida asintomática; TV inducible, no supresible en el EEF | 100 | 26 | Tratamiento con FAA (amiodarona 74%) | 27 | 39 | 15,8 | 0,46 |
| MUSTT 45 | 704 | EC y FE ≤ 40%; TV no sostenida asintomática; TV inducible en el EEF | 100 | 30 | Sin tratamiento con FAA c | 39 | 28 a | 10 a | 0,55 a |
| CABG-Patch 46 | 900 | Indicación de bypass; FE ≤ 35%; ECG de promediación de señal anormal | 100 | 27 | Sin tratamiento con FAA | 32 | 20,9 | 22,6 | 1,07 |
| MADIT-II 47 | 1.232 | IM previo (> 1 mes); FE ≤ 30% | 100 | 23 | Sin tratamiento con FAA | 20 | 19,8 | 14,2 | 0,69 |
| DINAMIT 48 | 674 | IM previo (en los 6-40 días anteriores); FE ≤ 35%; VFC reducida o media de FC alta en el registro Holter de 24 h | 100 | 28 | Sin tratamiento con FAA | 30 | 17 | 19 | 1,08 |
| SCD-HEFT 33 | 2.521 | ICC de clase II-III de la NYHA; FEVI ≤ 35% | 52 | 25 | Placebo frente a amiodarona frente a DAI además del tratamiento de la IC | 45 | 29 (placebo), 28 (amiodarona) | 22 | 0,77 d |
DAI: desfibrilador automático implantable; EC: enfermedad coronaria; ECG: electrocardiograma; EEF: estudio electrofisiológico; FAA: fármacos antiarrítmicos; FC: frecuencia cardiaca; FE: fracción de eyección; FEVI: fracción de eyección ventricular izquierda; FV: fibrilación ventricular; IC: insuficiencia cardiaca; ICC: insuficiencia cardiaca crónica; IM: infarto de miocardio; NYHA: New York Heart Association; PC: parada cardiaca; TV: taquicardia ventricular; VFC: variabilidad de la frecuencia cardiaca.
Datos de los estudios originales y de Buxton 49 .
a Tasas de mortalidad a los 2 años.
b Un tercer grupo de tratamiento antiarrítmico utilizó propafenona, que se abandonó prematuramente a causa de un exceso de mortalidad.
c Tratamiento estándar de la insuficiencia cardiaca en comparación con tratamiento de la insuficiencia cardiaca + tratamiento antiarrítmico (grupo combinado de fármacos antiarrítmicos y desfibrilador automático implantable).
d Frente a placebo.
Varios ensayos aleatorizados han evaluado también el efecto beneficioso de la implantación de un DAI para la prevención primaria de la muerte súbita cardiaca en el contexto de la EC44, 45, 46, 47, 48. Sus principales características y resultados se resumen en la Tabla 4. Los ensayos MADIT y MUSTT incluyeron a pacientes con EC, FEVI baja y TV no sostenida asintomática que era inducible en el EEF. A pesar de haber algunas diferencias en las características de los pacientes (el MADIT incluyó a un 100% de pacientes con un IM verdadero), el beneficio obtenido con el DAI en cuanto a tasa de eventos y supervivencia fue similar en ambos estudios (hasta un 50% de reducción de la mortalidad relativa con los DAI)44, 45. El posible beneficio aportado por la implantación de DAI más allá de estas indicaciones se evaluó por primera vez por los investigadores del CABG-Patch, que examinaron la hipótesis de que los DAI podían reducir la mortalidad cuando se implantaban al practicar una cirugía de revascularización indicada clínicamente en pacientes con FEVI ≤ 35% y un ECG de promediación de señal anormal46. El estudio no observó ningún efecto beneficioso con el empleo profiláctico de DAI en esa población46. El ensayo MADIT-II se diseñó para evaluar el efecto de los DAI en pacientes con FEVI reducida (≤ 30%) y antecedentes de IM de al menos 1 mes, sin ninguna otra estratificación del riesgo. Aunque con un beneficio relativo inferior al de los ensayos MADIT y MUSTT, se demostró nuevamente que el DAI mejoraba la supervivencia, con una reducción relativa del 31% en la tasa de mortalidad total en el grupo con DAI47. El posible beneficio aportado por los DAI en los pacientes con un IM muy reciente se evaluó en el ensayo DINAMIT, en el que se incluyó a pacientes con FEVI ≤ 35% tras un IM sufrido en los 6-40 días previos a la inclusión y deterioro de la función del sistema autónomo cardiaco. El tratamiento profiláctico con un DAI no redujo la mortalidad total en esta población (el 18,7% en el grupo de DAI frente al 17% en el grupo de tratamiento convencional, con un periodo de seguimiento de 30±13 meses), aunque se asoció a una reducción de la tasa de muertes arrítmicas (grupo de DAI, HR=0,42) que se contrarrestaba por un aumento de la tasa de mortalidad por causas no arrítmicas (grupo de DAI, HR=1,75)48. Por último, el ensayo SCD-HEFT evaluó el beneficio aportado por los DAI en cuanto a la supervivencia total en pacientes con insuficiencia cardiaca crónica de cualquier origen y FEVI ≤ 35%. El estudio puso de manifiesto una disminución del 23% en el riesgo de muerte durante un seguimiento de 45 meses con los DAI en comparación con placebo. Amiodarona no resultó mejor que placebo. El efecto beneficioso del DAI fue similar en las poblaciones isquémicas y no isquémicas33.
A la vista de estos estudios, las recomendaciones actuales para la implantación de un DAI en el contexto de la EC son las siguientes17:
1. El tratamiento con DAI está indicado en pacientes reanimados de una FV cuando la revascularización coronaria no es posible y hay evidencia de un IM previo y una disfunción del VI significativa (clase I, nivel de evidencia A).
2. Se recomienda el empleo de DAI en pacientes con disfunción del VI debida a IM que presentan una TV hemodinámicamente inestable (clase I, nivel de evidencia A).
3. Se recomienda la prevención primaria con DAI en los pacientes con disfunción del VI debida a un IM previo tras el que han transcurrido al menos 40 días y con FEVI ≤ 30-40% y clase II-III de la New York Heart Association (clase I, nivel de evidencia A).
4. La prevención primaria con DAI es razonable en pacientes con disfunción del VI debida a un IM previo tras el que han transcurrido al menos 40 días y con FEVI ≤ 30-35% y clase I de la New York Heart Association (clase IIa, nivel de evidencia B).
5. La implantación de DAI es razonable en pacientes con función del VI normal tras un IM que sufren TV recurrente (clase IIa, nivel de evidencia C).
Todas las recomendaciones mencionadas parten del supuesto de que los pacientes reciben tratamiento médico óptimo y tienen una esperanza de supervivencia razonable (> 1 año). Las medidas para tratar de forma agresiva la insuficiencia cardiaca y la isquemia miocárdica constituyen también indicaciones de clase I para tratar las arritmias ventriculares en el contexto de la EC17.
AblaciónEn los pacientes con anomalías estructurales extensas, sobre todo los que ya han sufrido un IM, podrían producirse múltiples morfologías de la TV. En consecuencia, la ablación de una sola morfología de TV no elimina la necesidad de DAI o tratamiento antiarrítmico. En el seguimiento podrían producirse episodios de TV en hasta un 40-60% de los pacientes a los que se ha implantado un DAI para la prevención secundaria y en un 2,5-12% de los pacientes con DAI implantados con fines de prevención primaria53. Dado que el tratamiento farmacológico antiarrítmico tiene una eficacia sólo moderada (ya comentado), la ablación percutánea pasa a ser la opción más atractiva para reducir la frecuencia de los episodios de TV en pacientes con EC, incluidos los que presentan una TV incesante17. La ablación suele estar indicada en los casos de TV monomorfa recurrente originados en un sustrato específico que se puede abordar con técnicas de cartografía. El abordaje por mapas y ablación depende del tipo de TV y su mecanismo (Tabla 5). Dado que la reentrada es el mecanismo principal de las TV relacionadas con IM, en este apartado se analizan las técnicas cartografía y ablación para este tipo concreto de TV.
Tabla 5. Utilidad de las técnicas de cartografía según el mecanismo de la taquicardia ventricular
| Técnica cartográfica | Mecanismo de la TV | ||
| TV automática | TV desencadenada | TV de reentrada | |
| En RS | |||
| Mapa de RS de electrogramas anormales | – | – | ++ |
| Mapa-marcapasos | +++ | +++ | +/– |
| Durante la TV | |||
| Mapa de activación de lugar inicial | +++ | +++ | ++ |
| Mapa de encarrilamiento | – | – | +++ |
RS: ritmo sinusal; TV: taquicardia ventricular.
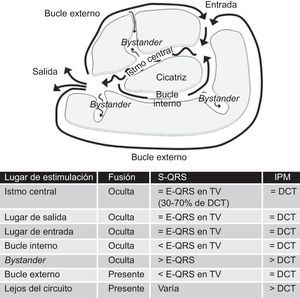
El circuito de reentrada suele ser complejo, con múltiples trayectos definidos por áreas de bloqueo funcional (la mayor parte de las veces a causa de una refractariedad) o bloqueos anatómicos fijos (tejido cicatrizal)54, 55. La separación de los miocitos por áreas de fibrosis da lugar a una conducción lenta, que es un factor determinante de la reentrada y la generación de la TV. Los principales componentes del circuito de reentrada según el modelo anatómico son los que se indican en la Figura 10. El istmo central es la vía común del circuito y la región esencial para la reentrada. Se despolariza durante la diástole, y su actividad no puede apreciarse en el ECG de superficie, pero puede detectarse mediante registros intracardiacos, que habitualmente muestran potenciales multicomponentes como reflejo de la conducción lenta. Un solo istmo central puede participar en más de una TV clínica o inducible54. El inicio del QRS se produce después de que el frente de onda emerja del istmo en un lugar de salida y la activación difunda por todos los ventrículos. Los bucles externos son láminas de miocardio que circundan la cicatriz y conducen el impulso haciendo que vuelva al circuito a través del lugar de entrada. Los circuitos complejos tienen también bucles internos, contenidos en el interior de la cicatriz, y lugares bystander es decir, lugares de conducción lenta dentro de la cicatriz que no participan en el circuito.
Figura 10. Modelo anatómico de circuito de reentrada para explicar la taquicardia ventricular tras el infarto de miocardio. Las características de los mapas de encarrilamiento según la localización del marcapasos se resumen en la tabla. DCT: duración del ciclo de la taquicardia; E-QRS: intervalo de electrograma a QRS; TV: taquicardia ventricular.
Aunque el ECG de superficie puede aportar una información importante acerca de la localización de la arritmia, los mapas intracardiacos son esenciales para definir el circuito, identificar las partes críticas y servir de guía para la ablación. El fundamento de todas las técnicas de cartografía actuales es una extensión de los estudios iniciales que definieron el sustrato fisiopatológico de la TV en la EC4, 29.
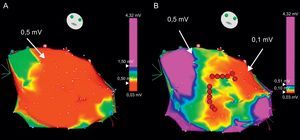
Mientras el paciente se encuentra en RS, a veces es útil definir el circuito de arritmia mediante un mapa de voltaje, una reconstrucción electroanatómica tridimensional del ventrículo que se obtiene mediante la representación gráfica de las amplitudes de electrograma obtenidas en diferentes lugares del mapa55, 56. Las áreas de cicatriz se definen por un voltaje < 1,5 mV. El empleo de unos criterios de voltaje más estrictos, como un valor de corte de 0,5 mV, facilita una mejor definición de la cicatriz y la identificación de los istmos (Figura 11)56. Los registros intracardiacos en RS en las localizaciones de interés pueden mostrar señales amplias con múltiples componentes (electrogramas fraccionados) o potenciales inmediatamente después del complejo QRS (potenciales tardíos) en áreas con una conducción anormal, que suelen asociarse a reentrada. El ritmo de marcapasos procedente del catéter de cartografía durante el RS (denominado mapa-marcapasos) puede reproducir la morfología del QRS de la taquicardia si el catéter está situado cerca de la salida del circuito de reentrada, aunque esta técnica puede llevar a confusión en la TV de reentrada, a diferencia de lo que ocurre en la TV focal. De hecho, es improbable que se produzca la misma morfología del QRS que en la TV mediante la estimulación en el istmo del circuito, que produciría una activación simultánea antidrómica y ortodrómica de los ventrículos, a diferencia de la TV, en la que la activación es solamente ortodrómica a lo largo del istmo. El marcapasos puede ser útil también para definir las áreas de cicatriz eléctricamente inexcitable, en las que el umbral del marcapasos es > 10 mA55. Los gráficos tridimensionales de áreas no excitables permiten delimitar cicatrices e istmos entre ellas y facilitan la identificación de posibles lugares para la ablación. El ritmo de marcapasos originado en localizaciones de interés muestra generalmente una conducción lenta, que se manifiesta por un retraso < 40 ms entre el estímulo y el inicio el QRS en las 12 derivaciones del ECG55. Las reconstrucciones electroanatómicas tridimensionales durante el RS y el ritmo de marcapasos para la caracterización de la cicatriz (a lo que se denomina mapa de sustrato) facilitan la ablación en caso de TV múltiples, TV pleomórficas o TV en las que no pueda establecerse el mapa por ser hemodinámicamente inestables o no inducibles durante la estimulación eléctrica programada57. Incluso para la TV estable, los mapas de sustrato pueden ser útiles para limitar los mapas de encarrilamiento a la región de interés57.
Figura 11. Mapa electroanatómico de voltaje para identificar áreas de cicatriz. A: se obtiene una enorme cicatriz ventricular izquierda cuando se establece el valor de corte en < 0,5 mV (área en rojo). Al modificar la escala de color (B), se puede identificar diferentes áreas en el interior de la cicatriz: áreas de voltaje muy bajo (< 0,1mV) correspondientes a cicatriz verdadera y pasillos entre ellas con un voltaje ligeramente superior (en verde y amarillo), que constituyen los istmos que serán el objetivo de la ablación (manchas rojas). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Durante la TV estable y tolerada, la evaluación de las señales intracardiacas y la respuesta a las maniobras de marcapasos durante la taquicardia son extraordinariamente útiles para el éxito de la ablación. Los electrogramas en la TV relacionada con una cicatriz podrían mostrar una actividad presistólica y diastólica en forma de potenciales de baja amplitud. La activación presistólica se encuentra en la salida del circuito, con una actividad que precede al inicio del QRS en 50 ms o más, a diferencia de lo que ocurre en las TV focales, en las que la actividad presistólica suele encontrarse a –15 ms. Es importante señalar que, en la TV de reentrada, la actividad diastólica no es específica para la localización del istmo; puede observarse también en lugares bystander58. Podría haber actividad continua.
Para cartografía y ablación es más determinante la respuesta de la TV al encarrilamiento. Almendral et al4, 29 describieron los mecanismos en un contexto temporal y posteriormente Stevenson et al59 los describieron en un modelo anatómico. Se debe analizar los siguientes parámetros:
1. Fusión de QRS. Como ya se ha comentado, la fusión del QRS durante el encarrilamiento se debe a la activación simultánea de los ventrículos por el marcapasos y la TV. El encarrilamiento sin un cambio apreciable de la morfología del QRS se denomina encarrilamiento con fusión oculta, e indica que el estímulo se está aplicando a partir de algún lugar de la cicatriz y genera un frente de activación que utiliza la misma salida del circuito que la TV. Esto podría deberse a un estímulo originado en el istmo o en un lugar bystander conectado con este.
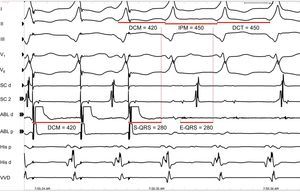
2. El intervalo de estímulo a QRS (S-QRS) es un indicador del tiempo de conducción desde el lugar de origen del marcapasos hasta la salida del circuito. El S-QRS más corto es el correspondiente a la salida del circuito, y va siendo progresivamente más largo desde el lugar de la salida hacia las partes distal, central y proximal del istmo, y finalmente el lugar de entrada, ya que en esas áreas el estímulo se enfrenta a un área de conducción lenta progresivamente más larga antes de salir del circuito. Se ha establecido que el intervalo S-QRS en el istmo es de entre un 30 y un 70% de la duración del ciclo de la taquicardia59. El intervalo S-QRS es igual al intervalo electrograma-QRS (E-QRS) durante la TV si el estímulo se aplica a partir de algún lugar del circuito y produce solamente una activación ortodrómica, ya que en ese caso el estímulo del marcapasos sigue exactamente el mismo camino que la TV. Cuando el marcapasos se aplica en bucles internos o externos, el estímulo puede transmitirse de forma bidireccional (ortodrómica y antidrómica) y producir un S-QRS más corto que el E-QRS durante la TV, en la que solamente hay una conducción ortodrómica. En cambio, el marcapasos aplicado en lugares bystander obtiene un intervalo S-QRS más largo que el E-QRS durante la TV (Figura 10).
3. Intervalo posmarcapasos, o CR, en relación con la duración del ciclo de taquicardia. El intervalo posmarcapasos se mide desde el último estímulo con encarrilamiento de la TV hasta la siguiente despolarización en el lugar de aplicación del marcapasos (Figura 9)60. Como se ha mencionado antes, el CR en un circuito de reentrada corresponde al tiempo necesario para que el impulso se desplace del lugar de marcapasos al circuito, pase por todo él y vuelva al lugar de marcapasos. En consecuencia, el intervalo posmarcapasos debe ser igual a la duración del ciclo de taquicardia (en un margen de 30 ms) si el marcapasos se aplica en cualquier lugar del circuito de reentrada. El marcapasos originado en lugares alejados del circuito o en lugares bystander situados dentro de la cicatriz daría lugar a intervalos posmarcapasos más largos, que superarían la duración del ciclo de taquicardia en más de 30 ms60. Es aconsejable aplicar ritmos de marcapasos a unas frecuencias sólo ligeramente más rápidas que la duración del ciclo de taquicardia, con objeto de evitar una falsa prolongación del intervalo posmarcapasos a causa de una reducción de la rapidez de conducción generada por un ritmo de marcapasos muy rápido. Los electrogramas de campos lejanos podría ser una fuente de error importante al medir el intervalo posmarcapasos. Dichos electrogramas están presentes también durante la aplicación de marcapasos, lo cual indica que son el resultado de un tejido despolarizado que está alejado del catéter, mientras que no se puede identificar el potencial local durante la aplicación del marcapasos.
Un buen lugar de ablación se caracteriza por un encarrilamiento oculto en el que el intervalo S-QRS sea igual al E-QRS y el intervalo posmarcapasos sea igual a la duración del ciclo de taquicardia (Figura 12). La interrupción reproducible de la TV mediante estímulos de marcapasos que capturan pero no son capaces de producir un complejo QRS indica también que la localización probablemente sea un istmo.
Figura 12. Encarrilamiento para identificar los posibles lugares de ablación. Se muestran las derivaciones I, II, II, V1 y V6 del electrocardiograma de superficie, junto con los registros intracardiacos obtenidos con catéter en el seno coronario, la ablación, el haz de His y el vértice ventricular derecho. La figura muestra una posible localización adecuada para la ablación, ya que hay una fusión oculta durante el encarrilamiento de la taquicardia ventricular, con un estímulo a intervalo QRS = intervalo de electrograma a QRS y un intervalo posmarcapasos = duración del ciclo de la taquicardia. ABL: ablación; DCM: duración de ciclo de marcapasos; DCT: duración del ciclo de la taquicardia; E-QRS: intervalo de electrograma a QRS; IPM: intervalo posmarcapasos; SC: seno coronario; S-QRS: estímulo a intervalo QRS; VVD: vértice ventricular derecho.
Los objetivos de la ablación en pacientes con TV post-IM son los siguientes: a) que no se pueda inducir TV clínica; b) que varíe la duración del ciclo de la TV inducida, y c) que no se pueda inducir ninguna TV57. En general, la ablación es eficaz de forma aguda, y produce la abolición de una o varias TV monomorfas relacionadas con la cicatriz en un 77-95% de los pacientes con TV post-IM61. Sin embargo, puede producirse una recurrencia de la TV de la misma morfología, o con más frecuencia de una morfología diferente, en un 12-50% de los pacientes, y pueden ser necesarias nuevas intervenciones de ablación en el seguimiento. La ablación epicárdica, a través de un acceso percutáneo del espacio pericárdico guiado por fluoroscopia e inyección de contraste, suele ser necesaria en un 10-30% de las TV post-IM62.
CirugíaLa cirugía, que se desarrolló inicialmente a finales de los años setenta, fue desplazada posteriormente por otros tratamientos (sobre todo los DAI) debido a la complejidad de las intervenciones y la tasa de mortalidad operatoria relativamente elevada (10-15%)4. Actualmente la ablación quirúrgica directa o la resección del sustrato arritmógeno continúan siendo una opción en centros experimentados. En el contexto de la EC, los pacientes candidatos a cirugía suelen ser los que tienen antecedentes de IM previo, ya tratados con un DAI, y presentan una TV recurrente refractaria a los fármacos y la ablación percutánea. La operación requiere cartografía intraoperatoria de precisión, y se han descrito técnicas de ablación guiada por mapa (resección subendocárdica, crioablación focal) o por sustrato (aneurismectomía, crioablación por cerclaje, ventriculotomía endocárdica por cerclaje), con unos porcentajes de éxito de entre el 60 y el 100%4.
Conflicto de interesesLa Dra. Benito no tiene conflictos de intereses que declarar. El Dr. Josephson es consultor de Medtronic y recibe honorarios por labores de formación de Medtronic y Biotronik.
Recibido 5 Marzo 2012
Aceptado 9 Marzo 2012
Autor para correspondencia: Cardiology Division, Harvard Medical School, 185 Pilgrim Road, Baker 4, Boston, MA 02215, Estados Unidos. mjoseph2@bidmc.harvard.edu