Se trató de determinar la asociación de los cambios recíprocos en el segmento ST con el daño miocardio evaluado mediante imagen con resonancia magnética cardiaca (RMC) en pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) que recibieron intervención coronaria percutánea (ICP).
MétodosSe realizó estudio de imagen con RMC a 244 pacientes tratados con ICP primaria durante el primer IAMCEST. El estudio con RMC se realizó de media 3 días después de la ICP primaria. Se analizó el primer electrocardiograma y los pacientes se estratificaron de acuerdo a la presencia de cambios recíprocos. El objetivo primario fue el tamaño del infarto medido por RMC y los secundarios el área en riesgo y el índice de miocardio rescatado.
ResultadosLos pacientes con cambios recíprocos (133 pacientes, 54,5%) tuvieron una menor incidencia de infarto de miocardio anterior (27,8 frente al 71,2%; p < 0,001) y un tiempo más corto desde el inicio de los síntomas hasta la restauración del flujo coronario (221,5±169,8 frente a 289,7±337,3min; p=0,042). Usando un modelo de regresión lineal múltiple, se encontró que los pacientes con cambios recíprocos tuvieron una mayor área en riesgo (p=0,002) y un mayor índice de miocardio rescatado (p=0,04) comparado con los pacientes sin cambios recíprocos. Consecuentemente, el tamaño del infarto de miocardio no fue significantemente diferente entre los 2 grupos (p=0,14). La tasa de eventos adversos cardiovasculares mayores, incluyendo muerte por todas las causas, infarto de miocardio, y nueva revascularización coronaria, fue similar entre los 2 grupos después de 2 años de seguimiento (p=0,92).
ConclusionesLos cambios recíprocos del segmento ST se asociaron a una mayor extensión de miocardio isquémico en riesgo y a un mayor índice de miocardio rescatado, pero no a un mayor tamaño del infarto o eventos clínicos adversos en pacientes con IAMCEST tratados con ICP primaria.
Palabras clave
El infarto agudo de miocardio transmural induce una elevación del segmento ST, un aumento de la onda R y un ensanchamiento del complejo QRS en las derivaciones del electrocardiograma (ECG) que están directamente relacionadas con la región isquémica1,2. Además, las derivaciones no relacionadas con el área isquémica pueden mostrar al mismo tiempo una descenso recíproco del segmento ST3,4. Se han realizado numerosos estudios destinados a determinar las consecuencias clínicas del cambio recíproco en el ECG. Sin embargo, la trascendencia clínica que tiene el cambio recíproco en el ECG, como un descenso del segmento ST a distancia de la zona del infarto, sigue siendo objeto de controversia en cuanto a si refleja un mayor tamaño del infarto o es un fenómeno especular benigno4–8. La resonancia magnética cardiaca (RMC) permite describir con exactitud el cambio en la cicatriz miocárdica y el área en riesgo (AR) en el infarto agudo de miocardio. Esta técnica de imagen puede utilizarse también para estimar el índice de miocardio salvado (IMS), un parámetro de evaluación del resultado evaluable en la RMC que indica el infarto de miocardio agudo reperfundido9,10. Así pues, el objetivo de nuestro estudio fue investigar si el cambio recíproco en el segmento ST está relacionado con los marcadores de la lesión miocárdica, evaluados mediante RMC, y con los resultados clínicos en los pacientes sometidos a una intervención coronaria percutánea (ICP) primaria por un infarto agudo de miocardio con elevación del segmento ST (IAMCEST).
MÉTODOSPoblación del estudio, datos clínicos y seguimientoSe consideró aptos para el estudio a los pacientes con IAMCEST que acudieron a nuestro centro, un hospital terciario de referencia, entre enero de 2008 y septiembre de 2013 si cumplían las siguientes características: a) tener una elevación del segmento ST en 2 o más derivaciones contiguas en el ECG como definición estándar, y b) haber pasado por una ICP primaria exitosa y una exploración por RMC. Se excluyó a los pacientes que presentaban las siguientes características: ingreso más de 12 h después del inicio de los síntomas, infarto de miocardio previo o revascularización coronaria previa (cirugía de revascularización aortoconaria o ICP). Los coordinadores de la investigación registraron prospectivamente los datos clínicos basales procedentes del registro específico, incluidos los antecedentes patológicos, la presencia de factores de riesgo, las medicaciones, los datos angiográficos y de la intervención y los resultados clínicos. Este estudio fue aprobado por el comité local de ética de investigación del centro, que lo eximió de la exigencia de consentimiento informado.
La intervención coronaria percutánea se llevó a cabo con técnicas de intervención estándares11. La decisión de aplicar un tratamiento invasivo, así como la elección de la vía de acceso, el tipo de stent, la ecografía intravascular y el uso de inhibidores del receptor de la glucoproteína IIb/IIIa se dejó al criterio del médico. Se evaluó el grado de opacificación (blush) del miocardio mediante una angiografía final, según lo descrito con anterioridad12. Todas las intervenciones y los métodos de anticoagulación utilizados en ellas se ciñeron a lo indicado en las guías vigentes13.
La variable de valoración principal fue el tamaño del infarto de miocardio (% de la masa del ventrículo izquierdo [VI]), medido en la RMC. Las variables de valoración secundarias fueron el AR (% de la masa del VI) el IMS (%), la obstrucción microvascular y el infarto hemorrágico. Los eventos adversos cardiovasculares mayores se definieron como la combinación de muerte por cualquier causa, infarto de miocardio y nueva revascularización coronaria.
Definición del análisis del electrocardiogramaSe estableció el diagnóstico de IAMCEST cuando los cambios observados en el ECG correspondían a la definición estándar de una elevación del segmento ST de nueva aparición en el punto J en un mínimo de 2 derivaciones contiguas, ≥ 2 mm (0,2 mV) en los varones o ≥ 1,5 mm (0,15 mV) en las mujeres, en las derivaciones V2-V3 y/o ≥ 1 mm (0,1 mV) en otras derivaciones precordiales contiguas o en las derivaciones de las extremidades más 1 de los 2 criterios siguientes: duración del dolor torácico > 30 min o elevación de los marcadores enzimáticos cardiacos en suero14. El cambio recíproco se definió como un descenso de 0,1 mV 80 ms después del punto J en 2 o más derivaciones adyacentes alejadas de las derivaciones que mostraban la elevación del segmento ST15. Se estratificó a los pacientes según la presencia o ausencia de cambios recíprocos en el ECG.
Adquisición y análisis de las imágenes de resonancia magnética cardiacaLa RMC se realizó con un escáner de 1,5 T (Achieva, Philips Medical Systems; Best, Países Bajos) con una espiral cardiaca SENSE según el protocolo de nuestro laboratorio16. Para la adquisición de las imágenes, se empleó sincronización electrocardiográfica y apnea espiratoria. El protocolo de RMC incluyó imágenes de cine, imágenes con ponderación T2, perfusión de primer paso e imágenes con realce tardío de gadolinio. Las imágenes de cine se basaron en secuencias de precesión libre en fase estacionaria (balanced steady-state free precession sequences), a lo largo del eje largo y el eje corto desde el vértice hasta la base del VI. A continuación se captaron las imágenes de T2W en la dirección del eje cardiaco corto, utilizando la secuencia de eco de espín rápido de inversión-recuperación T2W de sangre oscura. Se obtuvieron imágenes de perfusión de primer paso con la secuencia dinámica con ponderación T1 (eco de campo turbo con SENSE, tiempo de repetición/tiempo de eco = 2,6/1,3 ms) después de la infusión intravenosa de gadolinio-ácido dietilentriaminopentaacético (Gd-DTPA, Magnevist, Bayer Schering Pharma; Berlín, Alemania; total, 0,15 mmol/kg de peso a 3 ml/s). El grosor de corte se fijó en 6 mm con un campo de visión de 40 × 40 cm y una matriz de imagen de 128 × 128. Se adquirieron imágenes de 4 localizaciones en cada 2 latidos cardiacos, durante 40 fases.
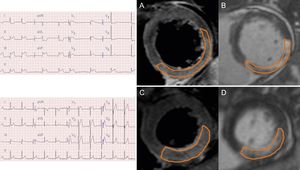
Mediante un programa informático validado (ARGUS, Siemens Medical System; Erlangen, Alemania) 2 radiólogos con experiencia, a los que se ocultó la información clínica, analizaron las imágenes de RMC en nuestro laboratorio central de resonancia magnética. Tras la adquisición de las imágenes de eje corto al final de la diástole y al final de la sístole, se trazaron manualmente los bordes del endocardio. Se calcularon los volúmenes telediastólico y telesistólico del ventrículo izquierdo y la fracción de eyección mediante la regla de Simpson. Se cuantificó el volumen de infarto mediante la suma del área con realce tardío de gadolinio dentro de cada segmento de las imágenes de eje corto, multiplicado por el grosor de los cortes, hasta cubrir la totalidad del VI17. Se dibujó el área de infarto mediante la detección visual del borde, con un método de trazado manual con un software comercial de análisis. La obstrucción microvascular se definió y planimetró manualmente como un núcleo hipointenso dentro del miocardio infartado en las imágenes con realce tardío de gadolinio. La masa del AR se definió a partir de las imágenes de T2W mediante la masa miocárdica con una intensidad de señal ≥ 2 desviaciones estándares por encima de las zonas distantes. A continuación, se normalizó la masa del AR respecto a la masa de miocardio del VI, con objeto de estimar el porcentaje de AR. Se identificó la hemorragia intramiocárdica y se planimetró manualmente como un núcleo hipointenso dentro del AR en las imágenes de T2W. El miocardio salvado se calculó mediante (masa de AR – masa de infarto), y se calculó el IMS mediante (masa de miocardio salvado / masa de AR) y se expresó como porcentaje9,18. En la figura 1 se muestra una imagen de RMC representativa de un IAMCEST de cara no anterior reperfundido, con o sin cambio recíproco del segmento ST.
Imágenes de resonancia magnética cardiaca representativas de un estudio del infarto agudo de miocardio con elevación del segmento ST de cara no anterior, con o sin cambios recíprocos en el ECG. A: corte de eje corto de una imagen con ponderación T2, con cambio recíproco en el ECG. B: corte de eje corto de una imagen con realce tardío de gadolinio, con cambio recíproco en el ECG. C: corte de eje corto de una imagen con ponderación T2, sin cambio recíproco en el ECG. D: corte de eje corto de una imagen con realce tardío de gadolinio, sin cambio recíproco en el ECG. ECG: electrocardiograma.
Las variables continuas se compararon con la prueba de t de Student o con la prueba de suma de orden de Wilcoxon, según procediera, y los resultados se presentan en forma de media±desviación estándar o mediana [intervalo intercuartílico]. Las variables discretas se evaluaron con la prueba exacta de Fisher o la prueba de la χ2, según procediera. Las covariables que se consideraron relevantes por tener valores de p < 0,2 en el análisis univariable o que tenían interés clínico por otros motivos se incluyeron en nuestro modelo de ajuste de factores de riesgo, un modelo de regresión lineal múltiple. Con objeto de equilibrar las características demográficas y clínicas subyacentes, se aplicó también el método de puntuación de propensión. Estas se estimaron mediante un modelo de regresión logística múltiple que incluía todas las variables presentadas en la tabla 1. El equilibrio de las covariables se evaluó comparando las diferencias estandarizadas absolutas en las covariables entre los 2 grupos (tabla del material suplementario). En los pacientes emparejados por puntuación de propensión, las variables continuas como la variable de valoración principal y las variables secundarias de la RMC se compararon con una prueba de la t para datos emparejados o con la prueba de orden con signo de Wilcoxon. Las variables discretas se compararon con las pruebas de simetría de McNemar o de Bowker, según procediera. Se verificaron detalladamente los gráficos de residuos, incluida la distancia de Cook y los gráficos de probabilidad normal, y se confirmó que fueran satisfactorios antes de adoptar ningún resultado en el modelo final.
Características clínicas y angiográficas en la situación inicial
| Variables | Con cambio recíproco | Sin cambio recíproco | p |
|---|---|---|---|
| n=133 | n=111 | ||
| Edad (años) | 59,5±11,9 | 58,4±11,6 | 0,5 |
| Varones | 101 (75,9) | 92 (82,9) | 0,21 |
| Estatura (cm) | 165,4±8,1 | 166,1±7,9 | 0,47 |
| Peso (kg) | 68,8±13,3 | 67,6±11,3 | 0,49 |
| Índice de masa corporal | 25,0±3,6 | 24,4±3,2 | 0,19 |
| Área de superficie corporal (m2) | 1,77±0,20 | 1,76±0,18 | 0,71 |
| Presión arterial sistólica (mmHg) | 129,7±26,8 | 139,4±27,5 | 0,09 |
| Presión arterial diastólica (mmHg) | 81,9±18,0 | 89,7±19,1 | 0,006 |
| Frecuencia cardiaca inicial (lpm) | 77,0±22,4 | 81,4±18,3 | 0,001 |
| Signos electrocardiográficos | |||
| Infarto de cara anterior | 37 (27,8) | 79 (71,2) | < 0,001 |
| Resolución del cambio del ST después de 30 min | 94 (70,7) | 76 (68,5) | 0,78 |
| Resolución del cambio del ST después de 60 min | 102 (76,7) | 83 (74,8) | 0,77 |
| Longitud total de la elevación del ST | 8,1±6,3 | 7,4±5,1 | 0,31 |
| Antecedentes patológicos | |||
| Tabaquismo | 0,58 | ||
| Fumador actual | 64 (48,1) | 55 (49,5) | |
| Exfumador | 20 (15,0) | 21 (18,9) | |
| Diabetes mellitus | 37 (27,8) | 18 (16,2) | 0,032 |
| Hipertensión | 68 (51,1) | 43 (38,7) | 0,07 |
| Dislipemia | 26 (19,55) | 14 (12,60) | 0,17 |
| Ictus previo | 5 (3,8) | 2 (1,8) | 0,46 |
| Medicación | |||
| Antagonistas del calcio | 19 (14,3) | 11 (9,9) | 0,33 |
| Bloqueadores beta | 7 (5,3) | 8 (7,2) | 0,6 |
| Inhibidores de la enzima de conversión de la angiotensina | 0 (0,0) | 2 (1,8) | 0,21 |
| Antagonistas del receptor de la angiotensina II | 13 (9,8) | 11 (9,9) | 1 |
| Diuréticos | 6 (4,5) | 3 (2,7) | 0,52 |
| Tiempo de síntoma a balón (min) | 221,5±169,8 | 289,7±337,3 | 0,042 |
| Tiempo de síntoma a puerta (min) | 147,9±139,3 | 179,7±176,0 | 0,12 |
| Troponina I | 114,68±113,93 | 90,61±117,79 | 0,11 |
| Clase de Killip | 0,34 | ||
| 1 | 116 (87,2) | 102 (91,9) | |
| 2 | 2 (1,5) | 3 (2,7) | |
| 3 | 5 (3,8) | 1 (0,9) | |
| 4 | 10 (7,5) | 5 (4,5) | |
| Arteria relacionada con el infarto | < 0,001 | ||
| Tronco coronario izquierdo | 2 (1,5) | 0 (0,0) | |
| Arteria descendente anterior izquierda | 36 (27,1) | 78 (70,3) | |
| Arteria circunfleja | 20 (15,0) | 12 (14,6) | |
| Arteria coronaria derecha | 75 (56,4) | 21 (18,9) | |
| Oclusión proximal de la arteria relacionada con el infarto | 84 (63,2) | 66 (59,5) | 0,60 |
| Extensión de la enfermedad coronaria | 0,51 | ||
| Enfermedad de 1 vaso | 68 (51,1) | 65 (58,6) | |
| Enfermedad de 2 vasos | 45 (33,8) | 33 (29,7) | |
| Enfermedad de 3 vasos | 20 (15,0) | 13 (11,7) | |
| Flujo TIMI (inicial) | 0,06 | ||
| 0 | 107 (80,5) | 74 (66,7) | |
| 1 | 9 (6,8) | 8 (7,2) | |
| 2 | 9 (6,8) | 13(11,7) | |
| 3 | 8 (6,0) | 16 (14,4) | |
| Flujo TIMI (final) | 1 | ||
| 2 | 6 (4,5) | 5 (4,5) | |
| 3 | 127 (95,5) | 106 (95,5) | |
| Grado Rentrop | 0,99 | ||
| 0 | 61 (45,9) | 50 (45,0) | |
| 1 | 51 (38,3) | 44 (39,6) | |
| 2 | 20 (15,0) | 16 (14,4) | |
| 3 | 1 (0,8) | 1 (0,9) | |
| Grado de opacificación del miocardio | 0,38 | ||
| 1 | 0 (0,0) | 1 (0,9) | |
| 2 | 11 (8,3) | 6 (5,4) | |
| 3 | 122 (91,7) | 104 (93,7) | |
| Aspiración del trombo | 95 (74,1) | 60 (54,1) | 0,007 |
| Implante de stent | 128 (96,2) | 106 (95,5) | 1 |
| Uso de glucoproteína IIb/IIIa | 28 (21,15) | 16 (14,45) | 0,19 |
| Ausencia de fenómeno de reflujo | 13 (9,8) | 2 (1,8) | 0,014 |
| Oclusión de rama lateral | 2 (1,50) | 4 (3,65) | 0,42 |
TIMI: Thrombolysis In Myocardial Infarction.
Los valores expresan media ±desviación estándar o n (%).
Todas las pruebas fueron bilaterales y se consideró estadísticamente significativo un valor de p < 0,05. Todos los análisis se realizaron con el Statistical Analysis Software (SAS versión 9.2, SAS Institute; Cary, Carolina del Norte, Estados Unidos).
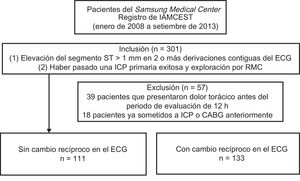
RESULTADOSCaracterísticas basales de los pacientesDe los 301 pacientes registrados, se excluyó del análisis a 39 que habían sufrido dolor torácico antes del periodo de evaluación de 12 h y a 18 que ya habían pasado anteriormente por una ICP o cirugía de revascularización aortoconaria. Un total de 244 pacientes cumplían los criterios de inclusión de haber pasado por una ICP primaria y RMC. Se dividió a estos pacientes en 2 grupos: pacientes con un cambio recíproco (n = 133) y sin un cambio recíproco (n = 111) (figura 2).
En la tabla 1 se resumen las características clínicas y angiográficas basales de los 2 grupos de pacientes. Los pacientes con un cambio recíproco presentaron mayores prevalencias de diabetes mellitus (el 27,8 frente al 16,2%; p = 0,032) e infarto de miocardio de cara no anterior (el 72,2 frente al 28,8%; p < 0,001) que con los pacientes sin ese cambio. El tiempo desde el inicio del dolor hasta el balón fue más corto en los pacientes con un cambio recíproco (221,5±169,8 frente a 289,7±337,3min; p = 0,042). En los pacientes con un cambio recíproco hubo mayores incidencias de flujo Thrombolysis In Myocardial Infarction 0 en la situación inicial, de aspiración del trombo y de ausencia de reflujo durante la ICP que en los pacientes sin un cambio recíproco. En la coronariografía se observó una distribución similar de la enfermedad contralateral en los 2 grupos (el 38,3 frente al 35,1%; p = 0,69). En la tabla 2 se muestran las características clínicas y angiográficas basales de los pacientes emparejados por puntuación de propensión.
Características clínicas y angiográficas basales de los pacientes emparejados por puntuación de propensión
| Variables | Con cambio recíproco | Sin cambio recíproco | p |
|---|---|---|---|
| n=65 | n=65 | ||
| Edad (años) | 59,6±11,4 | 59,4±12,7 | 0,94 |
| Varones | 53 (81,5) | 51 (78,5) | 0,83 |
| Estatura (cm) | 166,3±7,8 | 165,1±9,3 | 0,43 |
| Peso (kg) | 69,8±11,9 | 67,9±12,8 | 0,34 |
| Índice de masa corporal | 25,1±3,1 | 24,8±3,6 | 0,49 |
| Área de superficie corporal (m2) | 1,79±0,18 | 1,76±0,20 | 0,32 |
| Presión arterial sistólica (mmHg) | 135,3±24,3 | 137,4±27,9 | 0,64 |
| Presión arterial diastólica (mmHg) | 85,8±16,8 | 88,0±19,9 | 0,46 |
| Frecuencia cardiaca inicial (lpm) | 82,8±22,0 | 82,1±19,5 | 0,86 |
| Signos electrocardiográficos | |||
| Infarto de cara anterior | 34 (52,3) | 36 (55,4) | 0,86 |
| Resolución del cambio del ST después de 30 min | 49 (75,4) | 43 (66,2) | 0,21 |
| Resolución del cambio del ST después de 60 min | 52 (80,0) | 48 (73,8) | 0,045 |
| Longitud total de la elevación del ST | 9,4±7,7 | 6,1±3,7 | 0,004 |
| Antecedentes patológicos | |||
| Tabaquismo | 0,89 | ||
| Fumador actual | 31 (47,7) | 29 (44,6) | |
| Exfumador | 12 (18,5) | 11 (16,9) | |
| Diabetes mellitus | 17 (26,2) | 12 (18,5) | 0,4 |
| Hipertensión | 29 (44,9) | 30 (46,2) | 1 |
| Dislipemia | 11 (16,9) | 9 (13,8) | 0,81 |
| Ictus previo | 0 (0,0) | 1 (1,5) | 1 |
| Medicación | |||
| Antagonistas del calcio | 6 (9,2) | 9 (13,8) | 0,58 |
| Bloqueadores beta | 3 (4,6) | 6 (9,2) | 0,49 |
| Inhibidores de la enzima de conversión de la angiotensina | 0 | 2 (3,1) | 0,50 |
| Antagonistas del receptor de la angiotensina II | 6 (9,2) | 9 (13,8) | 0,58 |
| Diuréticos | 3 (4,6) | 3 (4,6) | 1 |
| Tiempo de síntoma a balón (min) | 242,8±196,1 | 242,3±160,4 | 0,99 |
| Tiempo de puerta a balón (min) | 83,5±140,1 | 76,2±32,8 | 0,68 |
| Tiempo de síntoma a puerta (min) | 159,3±143,3 | 166,2±159,8 | 0,79 |
| Clase de Killip | 1 | ||
| 1 | 58 (89,2) | 59 (90,8) | |
| 2 | 2 (3,1) | 1 (1,5) | |
| 3 | 1 (1,5) | 1 (1,5) | |
| 4 | 4 (6,2) | 4 (6,2) | |
| Arteria relacionada con el infarto | 0,34 | ||
| Tronco coronario izquierdo | 2 (3,1) | 0 (0,0) | |
| Arteria descendente anterior | 30 (46,2) | 36 (55,4) | |
| Arteria circunfleja | 8 (12,3) | 10 (15,4) | |
| Arteria coronaria derecha | 23 (35,4) | 19 (29,2) | |
| Extensión de la enfermedad coronaria | 0,79 | ||
| Enfermedad de 1 vaso | 34 (52,3) | 33 (50,8) | |
| Enfermedad de 2 vasos | 23 (35,4) | 21 (32,3) | |
| Enfermedad de 3 vasos | 8 (12,3) | 11 (16,9) | |
| Flujo TIMI (inicial) | 1 | ||
| 0 | 50 (76,9) | 49 (75,4) | |
| 1 | 3 (4,6) | 4 (6,2) | |
| 2 | 7 (10,8) | 6 (9,2) | |
| 3 | 5 (7,7) | 6 (9,2) | |
| Flujo TIMI (final) grado 3 | 63 (96,9) | 62 (95,4) | 1 |
| Grado Rentrop | 0,82 | ||
| 0 | 33 (50,8) | 29 (44,6) | |
| 1 | 22 (33,8) | 27 (41,5) | |
| 2 | 9 (13,8) | 8 (12,3) | |
| 3 | 1 (1,5) | 1 (1,5) | |
| Grado de opacificación del miocardio | 0,21 | ||
| 1 | 0 (0,0) | 1 (1,5) | |
| 2 | 8 (12,3) | 3 (4,6) | |
| 3 | 57 (87,7) | 61 (93,8) | |
| Aspiración del trombo | 39 (60,0) | 39 (60,0) | 1 |
| Implante de stent | 62 (95,4) | 60 (92,3) | 0,72 |
| Uso de glucoproteína IIb/IIIa | 12 (18,5) | 10 (15,4) | 0,82 |
| Ausencia de fenómeno de reflujo | 1 (1,5) | 2 (3,1) | 1 |
| Oclusión de rama lateral | 1 (1,5) | 2 (3,1) | 1 |
TIMI: Thrombolysis In Myocardial Infarction.
Los valores expresan media ± desviación estándar o n (%).
Se realizó una RMC una mediana de 3 [3-5] días tras la ICP primaria, sin diferencias significativas entre los 2 grupos (4,9±5,7 frente a 5,0±5,5 días; p = 0,93). El tamaño del infarto, que fue el parámetro de valoración principal, no mostró diferencias significativas entre los pacientes sin cambio recíproco o con él (mediana, 18,33% [12,34-27,65] frente a 17,95% [11,44-25,49]; p = 0,35). Aunque los pacientes con cambios recíprocos presentaron un AR significativamente mayor que los pacientes sin esos cambios (el 37,24 [27,83-46,82] frente al 33,28% [20,07-44,27]; p = 0,05), el IMS no mostró diferencias significativas entre los 2 grupos (el 48,57 [34,65-58,69] frente al 44,63% [33,15-56,88]; p = 0,27). Los demás parámetros de la RMC, incluidos la fracción de eyección del VI (p = 0,46), el volumen telediastólico del VI (p = 0,89), el volumen telesistólico del VI (p = 0,83), el volumen de eyección del VI (p = 0,46), el gasto cardiaco del VI (p = 0,56), la masa del VI (p = 0,66), la presencia de obstrucción microvascular (p = 0,15) e infarto hemorrágico (p = 0,12), no mostraron diferencias significativas entre los 2 grupos (tabla 3). En un análisis de los datos del subgrupo con emparejamiento por puntuación de propensión, los parámetros de resultados de la RMC no mostraron diferencias significativas (tabla 4).
Parámetros de las imágenes de resonancia magnética cardiaca
| Variables | Con cambio recíproco | Sin cambio recíproco | p |
|---|---|---|---|
| n=133 | n=111 | ||
| VTDVI (ml) | 142,70 [121,71-164,48] | 143,04 [123,02-163,04] | 0,89 |
| VTSVI (ml) | 66,55 [50,04-82,18] | 67,96 [49,43-82,62] | 0,83 |
| Fracción de eyección del VI (%) | 53,80 [45,05-60,61] | 53,81 [46,93-60,92] | 0,46 |
| Volumen de eyección del VI (ml) | 72,67 [63,28-85,49] | 75,62 [64,2-85,79] | 0,87 |
| Gasto cardiaco del VI (l/min) | 4,93 [4,26-5,61] | 5,13 [4,55-5,88] | 0,56 |
| Masa del VI (g) | 100,70 [84,33-118,61] | 100,45 [78,81-116,45] | 0,66 |
| Tamaño del infarto/VI (% de masa VI) | 18,33 [12,34-27,65] | 17,95 [11,44-25,49] | 0,35 |
| Área en riesgo/VI (% de masa VI) | 37,24 [27,83-46,82] | 33,28 [20,07-44,27] | 0,05 |
| Índice de miocardio salvado (%) | 48,57 [34,65-58,69] | 44,63 [33,15-56,88] | 0,27 |
| Presencia de obstrucción microvascular | 84 (63,2) | 60 (54,1) | 0,15 |
| Presencia de infarto hemorrágico | 65 (48,9) | 43 (38,7) | 0,12 |
| Variables | Estimación de la pendiente* | Error estándar* | p* |
|---|---|---|---|
| Tamaño del infarto/VI (% de masa VI) | 2,11 | 1,43 | 0,14 |
| Área en riesgo/VI (% de masa VI) | 6,97 | 2,20 | 0,002 |
| Índice de miocardio salvado (%) | 5,47 | 2,66 | 0,041 |
VI: ventrículo izquierdo; VTDVI: volumen telediastólico del VI; VTSVI: volumen telesistólico del VI.
Salvo otra indicación, los valores expresan mediana [intervalo intercuartílico] o n (%).
Los resultados se basan en un modelo de regresión lineal múltiple que incluye la puntuación de propensión y las covariables cambio recíproco, sexo, índice de masa corporal, presión arterial sistólica, presión arterial diastólica, tiempo entre síntoma y balón (min), ictus previo, clase de Killip, arteria relacionada con el infarto, grado Rentrop y aspiración del trombo para el ajuste de posibles factores de confusión.
Parámetros de las imágenes de resonancia magnética cardiaca como resultados en los datos del subconjunto emparejado por puntuación de propensión
| Variables | Con cambio recíproco | Sin cambio recíproco | p* |
|---|---|---|---|
| n=65 | n=65 | ||
| Tamaño del infarto/VI (% de masa del VI) | 18,34 [10,61-26,92] | 17,99 [12,31-25,97] | 0,65 |
| Área en riesgo/VI (% de masa del VI) | 37,62 [25,85-50,71] | 33,60 [20,56-42,52] | 0,06 |
| Índice de miocardio salvado (%) | 46,86 [38,18-56,47] | 40,18 [32,51-54,00] | 0,12 |
VI: ventrículo izquierdo.
Los valores expresan mediana [intervalo intercuartílico].
Después de realizar las regresiones lineales múltiples, que incluyeron las puntuaciones de propensión y otros ajustes para los factores de confusión, los pacientes con un cambio recíproco presentaron una mayor extensión del AR (estimación de la pendiente=6,97, error estándar [EE]=2,20, p = 0,002), y un IMS superior (estimación de la pendiente=5,47, EE=2,64, p = 0,04) en comparación con los pacientes sin ese cambio. Por consiguiente, el tamaño del infarto de miocardio no mostró diferencias significativas entre los 2 grupos (estimación de la pendiente=2,11, EE=1,43, p = 0,14).
El cambio recíproco total en el descenso del segmento ST mostró una asociación con el tamaño del infarto (estimación de la pendiente=0,57, EE=0,25, p = 0,021) y con el AR (estimación de la pendiente=1,02, EE=0,35, p = 0,004), según nuestro análisis.
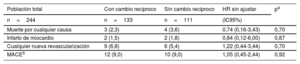
Resultados clínicosLos resultados clínicos acumulados de los pacientes del estudio se resumen en la tabla 5. La mediana de duración del seguimiento fue de 26,7 [12,8-40,9] meses y no mostró diferencias significativas entre los pacientes sin (28,2 [11,1-42,8] meses) y con cambios recíprocos (25,9 [13,3-38,9] meses; p = 0,54).
Resultados clínicos en el grupo con cambio recíproco en comparación con el grupo sin cambio recíproco durante el periodo de seguimiento
| Población total | Con cambio recíproco | Sin cambio recíproco | HR sin ajustar | pa |
|---|---|---|---|---|
| n=244 | n=133 | n=111 | (IC95%) | |
| Muerte por cualquier causa | 3 (2,3) | 4 (3,6) | 0,74 (0,16-3,43) | 0,70 |
| Infarto de miocardio | 2 (1,5) | 2 (1,8) | 0,84 (0,12-6,00) | 0,87 |
| Cualquier nueva revascularización | 9 (6,8) | 6 (5,4) | 1,22 (0,44-3,44) | 0,70 |
| MACEb | 12 (9,0) | 10 (9,0) | 1,05 (0,45-2,44) | 0,92 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores.
Salvo otra indicación, los valores expresan n (%).
El log-rank test indicó que entre los 2 grupos no había diferencias significativas en los tiempos hasta los eventos de valoración clínicos (tabla 5). Se produjeron eventos adversos cardiovasculares mayores en un 9% de los pacientes con y sin cambios recíprocos, sin diferencias significativas (HR = 1,05; IC95%, 0,45-2,44; p = 0,92) (tabla 5).
DISCUSIÓNSe compararon los resultados de las exploraciones de RMC y los resultados clínicos de los pacientes con y sin cambios recíprocos en el ECG en el contexto de un IAMCEST. Los principales resultados de nuestro estudio son los siguientes: a) los pacientes con un cambio recíproco presentaron mayor prevalencia de infartos de cara no anterior y menos tiempo de isquemia total que los pacientes sin ese cambio; b) el cambio recíproco en el segmento ST se asoció con una mayor extensión de miocardio isquémico en riesgo, pero también con mayor cantidad de miocardio salvado; el tamaño final del infarto, evaluado mediante las imágenes de RMC, no mostró asociación con la presencia de un cambio recíproco en el segmento ST, y c) no hubo diferencias significativas en cuanto a la supervivencia sin eventos cardiovasculares adversos mayores en función de la presencia o ausencia de un cambio recíproco en el ECG.
El mecanismo subyacente al descenso simultáneo del segmento ST en los pacientes con IAMCEST es una cuestión muy controvertida. En estudios previos se ha observado que el cambio recíproco de descenso del segmento ST fue el principal signo electrocardiográfico en una amplia variedad de pacientes por lo que respecta al tamaño del infarto de miocardio, la gravedad de la enfermedad coronaria y la cantidad de miocardio en riesgo19–21. En consecuencia, son necesarias mejores evaluaciones que permitan establecer una gradación más exacta del riesgo. Otros investigadores han planteado las hipótesis de que el descenso recíproco del segmento ST pueda reflejar un infarto más extenso5,22,23, una isquemia adicional más allá de la zona de infarto6,23,24 o una enfermedad coronaria más difusa25,26 o pueden corresponder simplemente a una proyección especular benigna de la elevación del segmento ST, que no tenga relevancia clínica8,27. En la mayoría de los estudios previos mencionados se investigó la asociación entre el cambio recíproco y la lesión miocárdica evaluada mediante la determinación de las enzimas cardiacas, la tomografía por emisión de positrones o la ventriculografía 7,28–30. Sin embargo, continúa sin estar claro el mecanismo patológico que subyace a esta asociación. Las exploraciones de RMC permiten estimar con exactitud la extensión de la lesión miocárdica y del miocardio salvado y, por ello, un mejor conocimiento del descenso recíproco del segmento ST en los pacientes con IAMCEST. En consecuencia, se evaluó la relación entre el cambio recíproco en el ECG y la lesión miocárdica determinada mediante RMC en pacientes con IAMCEST a los que se había practicado una ICP primaria.
En este estudio, el cambio recíproco en el segmento ST se asoció con mayor extensión del miocardio en riesgo isquémico y también una mayor cantidad de miocardio salvado, según lo indicado por la evaluación de las imágenes de RMC. Los resultados de este estudio coinciden con los de uno previo en el que se observó que 35 pacientes con IAMCEST y cambios recíprocos en el ECG de ingreso tenían una masa de AR y una extensión de miocardio salvado mayores que las de los pacientes sin esos cambios, según lo indicado por la RMC31. En estos 2 estudios, no se observó relación alguna entre el cambio recíproco y el tamaño del infarto de miocardio. Sin embargo, en estudios previos no se ha podido explicar por qué los pacientes con un cambio recíproco presentaron un AR mayor con un tamaño de infarto similar en comparación con los pacientes sin ese cambio.
Se evaluaron las repercusiones del cambio recíproco en el ECG en los resultados clínicos comparando los 2 grupos de estudio, y no se observaron diferencias significativas por lo que respecta a los eventos adversos cardiovasculares mayores. Teniendo en cuenta que el tamaño del infarto es el factor pronóstico más importante en los pacientes con un IAMCEST y que el cambio recíproco no predijo la disfunción ventricular izquierda ni los resultados clínicos adversos, no parece que el cambio recíproco sea un marcador de isquemia fiable15,32. En estudios previos30,33,34, el cambio recíproco en el ECG se asoció con un mayor tamaño del infarto. El aumento del AR en los pacientes con cambios recíprocos en el ECG, pero no el del tamaño del infarto, indica una mayor masa isquémica expuesta en el momento de realizar el ECG en la era de la ICP primaria. El AR observada en las imágenes con ponderación T2, como el miocardio que sufrirá un infarto antes de la apertura de la arteria relacionada con el infarto, podría ser viable si no hay una necrosis completa. En nuestro estudio se observó que, en comparación con los pacientes sin cambios recíprocos en el ECG, los que sí presentaban estos cambios mostraban más miocardio isquémico en riesgo y menos tiempo de isquemia total. Además, el cambio recíproco en el ECG se asoció con una mayor cantidad de miocardio salvado, pero con un tamaño de infarto similar tras la ICP primaria. En consecuencia, los cambios recíprocos en el ECG podrían ser un indicador de una mayor cantidad de miocardio isquémico en riesgo con posibilidad de que sea viable en la fase inicial del IAMCEST, e indicarían que es posible mejorar la salvación de miocardio con el oportuno tratamiento de reperfusión aplicado inmediatamente.
Sin embargo, al comparar los resultados en los diversos pacientes con cambios recíprocos, se observó que el grado de suma total de descenso del segmento ST con un cambio recíproco se asociaba de manera significativa con una mayor AR (estimación de la pendiente =1,02, EE=0,35; p = 0,004). El valor inicial de la suma total de descenso del segmento ST se asoció también con un mayor tamaño del infarto (estimación de la pendiente =0,57, EE=0,25; p = 0,021). Por consiguiente, esto no tuvo un efecto decisivo en las intervenciones destinadas a salvar miocardio. Serán necesarios futuros estudios prospectivos para determinar si estos subgrupos de pacientes con cambios recíprocos permitirían predecir los resultados de otras intervenciones terapéuticas adicionales.
LimitacionesEste estudio tiene varias limitaciones. Fue un estudio observacional no aleatorizado, y nuestros resultados pueden estar influidos de manera significativa por factores de confusión. Se incluyeron datos de un único centro y el número de pacientes es pequeño, aunque se trata del estudio de RMC más amplio realizado hasta la fecha en el que se han determinado los valores de AR, el tamaño del infarto, la salvación de miocardio y el IMS. Teniendo en cuenta los criterios de inclusión y exclusión de este estudio unicéntrico y los protocolos de tratamiento empleados en los hospitales especializados con gran volumen de casos, es posible que nuestros resultados no sean generalizables a otras poblaciones con IAMCEST, como las de pacientes que acuden tardíamente tras sufrir un IAMCEST (> 12h). Además, el predominio de los varones en la población del estudio limita la posibilidad de generalizar los resultados. La inclusión de los pacientes tuvo lugar en un periodo relativamente largo, durante el cual podrían haberse producido cambios en los tratamientos y las guías que pudieran haber influido en los resultados.
Además, los 2 grupos eran bastante distintos cualitativamente y, por consiguiente, la pérdida de participantes fue notable cuando se intentó emparejar los grupos. El número de emparejamientos fue muy pequeño. En consecuencia, el análisis con emparejamiento se utilizó para comparar los resultados con los de los casos iniciales sin emparejar. Si el número de casos no emparejados hubiera sido bajo, se habría intentado identificar los motivos clínicos de que no se los emparejara.
Ha habido una notable controversia respecto a si el AR real se delimita con exactitud en la RMC con ponderación T235,36. De hecho, los datos experimentales recientes apuntan a que la ponderación T2 puede indicar el tamaño del infarto real más que el AR real37, o que puede verse influida por el tiempo transcurrido entre el evento agudo y la adquisición de las imágenes38. Podría ocurrir que las áreas de hiperintensidad en las secuencias con ponderación T2 no reflejaran el AR real y que, por consiguiente, proporcionaran unas estimaciones sesgadas del miocardio salvado y unos ajustes inexactos en los modelos estadísticos. Recientemente se ha señalado que el edema podría ser un proceso dinámico y, por lo tanto, inestable durante la primera semana después de un infarto de miocardio. A diferencia de la evaluación únicamente inicial, podría ser crucial realizar la RMC sistemáticamente dentro de una estrecha ventana temporal. Para medir el miocardio salvado, consideramos que la evaluación inicial del AR es crucial, ya que el edema del miocardio es máximo y constante durante la primera semana después del infarto y se reduce después39,40. A pesar de la ausencia de diferencias entre los grupos en el tiempo transcurrido entre la ICP primaria y la RMC (4,9±5,7 frente a 5,0±5,5 días; p = 0,93), el tamaño del AR puede variar de manera significativa si se mide entre 1 y 40 días después de la ICP primaria, y no se examinó a los pacientes en esta estrecha ventana temporal de manera uniforme.
No se puede descartar por completo una posible sobrestimación del tamaño del infarto causada por la presencia de edema en la RMC en los primeros 5 días. Sin embargo, esto no habría afectado a los resultados de nuestro estudio, ya que no hubo entre los grupos una diferencia significativa en el tiempo desde la ICP primaria hasta la RMC.
La baja tasa de eventos en la población de nuestro estudio y los intervalos de confianza amplios no aportan evidencia convincente de un peor resultado. Además, la baja incidencia de eventos podría haberse debido a un sesgo de reclutamiento, con la inclusión de pacientes con infartos de miocardio no graves en este registro de RMC, ya que se observó una incidencia mayor que la esperada de la clase I de Killip (el 87,2 y el 91,9% de los pacientes con y sin cambios recíprocos). Aunque los eventos adversos clínicos no fueron objeto de adjudicación centralizada en nuestros registros, todos los eventos fueron identificados por los médicos de los pacientes y confirmados por el investigador principal del hospital.
CONCLUSIONESEl cambio recíproco en el ECG no se asoció con un mayor tamaño del infarto de miocardio, pero sí con una mayor extensión de miocardio isquémico y más miocardio salvado, según la evaluación realizada mediante RMC en pacientes con IAMCEST tratados con una ICP primaria. La presencia de un cambio recíproco en el ECG podría facilitar el diagnóstico temprano y la reperfusión rápida del IAMCEST, lo cual podría aumentar, a su vez, la cantidad de miocardio salvado.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Se han realizado numerosos estudios destinados a determinar las consecuencias clínicas del cambio recíproco en el ECG. Sin embargo, la trascendencia clínica que tiene el cambio recíproco en el ECG, como un descenso del segmento ST a distancia de la zona del infarto, sigue siendo objeto de controversia en cuanto a si refleja un mayor tamaño del infarto o es un fenómeno especular benigno. La RMC permite describir con exactitud el cambio en la cicatriz miocárdica y el AR en el infarto agudo de miocardio. También puede utilizarse para estimar el IMS, un parámetro de evaluación del resultado evaluable en la RMC que indica el infarto de miocardio agudo reperfundido.
- –
Los pacientes con un cambio recíproco presentaron mayor frecuencia de infartos de cara no anterior y menos tiempo de isquemia total que los pacientes sin ese cambio.
- –
El cambio recíproco en el segmento ST se asoció con una mayor extensión de miocardio isquémico en riesgo, pero también con más miocardio salvado. El tamaño final del infarto, evaluado mediante las imágenes de RMC, no mostró asociación con la presencia de un cambio recíproco en el segmento ST.
- –
No hubo diferencias significativas en cuanto a la supervivencia sin eventos cardiovasculares adversos mayores en función de la presencia o ausencia de un cambio recíproco en el ECG.
- –
La presencia de un cambio recíproco en el ECG podría facilitar el diagnóstico temprano y la reperfusión rápida del IAMCEST, lo cual podría aumentar la cantidad de miocardio salvado.