Los nuevos stents farmacoactivos (SFA), diseñados para solventar las limitaciones de los existentes, han de someterse inicialmente al análisis preclínico. El objetivo es analizar la eficacia y la seguridad de nuevos SFA con polímero biodegradable en comparación con stents convencionales (SC) y SFA comercializados en el modelo de arteria coronaria sana porcina.
MétodosSe implantaron aleatoriamente 101 stents (SC y stents liberadores de sirolimus con polímero biodegradable: 3 formulaciones test [BD1, BD2 y BD3], Orsiro, Biomime y Biomatrix) en las arterias coronarias de 34 cerdos domésticos. Se completó estudio angiográfico e histomorfométrico al mes (n = 83) y a los 3 meses (n = 18).
ResultadosLos stents se implantaron en proporción stent/arteria de 1,31 ± 0,21, sin diferencias entre grupos. Al mes, los nuevos stents (BD1, BD2 y BD3) mostraron menos pérdida tardía y reestenosis angiográfica, así como menor área neointimal y reestenosis histológica (p < 0,0005) que los SC. No se observaron diferencias significativas entre los nuevos stents y los SC en endotelización, daño vascular o inflamación; solo se encontró mayor persistencia de fibrina en los nuevos (p = 0,0006). A los 3 meses, todas estas diferencias desaparecieron, excepto una menor área neointimal con el nuevo stent BD1 (p = 0,027). No hubo diferencias en ningún parámetro al mes ni a los 3 meses entre los nuevos stents y los comercializados.
ConclusionesEn este modelo preclínico, los nuevos SFA con polímero biodegradable estudiados presentan menos reestenosis que los SC, sin diferencias significativas en seguridad y eficacia respecto a SFA comercializados.
Palabras clave
Los stents farmacoactivos (SFA) han demostrado de manera consistente menores tasas de revascularización que los stents convencionales (SC) en un amplio abanico de situaciones clínicas1 y así se ha extendido su uso, superándose con creces al número de SC en España2. El riesgo de trombosis tardía de los SFA de primera generación constituyó un serio motivo de preocupación3. Este fenómeno se ha relacionado con el efecto deletéreo del fármaco, el polímero transportador, la plataforma del stent o con una combinación de ellos en la pared del vaso; lo cual conduce a endotelización incompleta y reacciones de hipersensibilidad e inflamatorias persistentes4–8.
Los SFA de nueva generación han demostrado una tasa mucho menor de trombosis tardía9,10, probablemente relacionada con la mejora en los polímeros empleados. La aplicación de polímeros biodegradables ha demostrado su excelente perfil de seguridad en estudios preclínicos11,12 y clínicos13–15. Aunque estos avances han sido muy relevantes, aún persisten fenómenos indeseables, como la aparición de neoateroesclerosis16, que estimulan el desarrollo de nuevos dispositivos que permitan eliminar todas las limitaciones.
Los modelos preclínicos se han mostrado de gran utilidad a la hora de analizar diferencias entre nuevos dispositivos; puesto que la secuencia de los eventos biológicos asociados con la reparación arterial es similar a la de los seres humanos17. El modelo porcino de arteria coronaria sana se recomienda por consenso para evaluar las respuestas biológicas tras el uso de dispositivos coronarios18–21.
El propósito de este estudio es evaluar la seguridad y la eficacia de 3 nuevos diseños de stents de polímero biodegradable liberadores de sirolimus en el modelo preclínico porcino.
MÉTODOSModelo animalEn este estudio experimental aleatorizado, controlado y con análisis final ciego, se han usado 34 cerdos domésticos Large White de 2-3 meses de edad. Todos los procedimientos se realizaron de acuerdo con la regulación legal nacional (Real Decreto 53/2013, del 1 de febrero, sobre estándares básicos para la protección de animales de experimentación) y la Directiva Europea 2010/63/EC. El comité ético local aprobó el estudio antes de su inicio. El método de aleatorización fue el de asignación estratificada por arterias coronarias mayores, de modo que se implantase cada tipo de stent en igual número de arterias. Los plazos de seguimiento predeterminados fueron de 1 mes (n = 28) y 3 meses (n = 6).
Se administró ácido acetilsalicílico (325mg) y clopidogrel (300mg) 24h antes del procedimiento. El protocolo anestésico y la preparación quirúrgica se han descrito previamente18,19. Se administró tratamiento anticoagulante con 5.000 UI de heparina no fraccionada. Para implantar los dispositivos con una relación stent/arteria > 1,2, se seleccionó la mejor localización dentro de las 3 arterias coronarias epicárdicas tras administrar nitroglicerina intracoronaria.
Dispositivos analizadosEn este estudio se utilizaron los siguientes dispositivos:
- •
SC control (n = 27): stent metálico convencional (iVascular), de aleación de cromo-cobalto L605 y grosor de strut de 80μm. La estructura del stent está formada por 8 coronas unidas por 3 filas de conectores no concatenados que forman una estructura sinusoidal discontinua; lo que permite una mejor distribución del fármaco.
- •
SFA1, BD1 (n = 32): basado en el SC, recubierto abluminalmente de polímero biodegradable poli(D,L)-láctico-co-glicólico, con espesor de 4-5μm y cargado con 1,0μg/mm2 de sirolimus con un sistema de liberación que permite que más del 60% del fármaco se libere en 30 días (figura 1).
- •
SFA2, BD2 (n = 6): una variante de SFA1 con 1,4μg/mm2 de sirolimus.
- •
SFA3, BD3 (n = 3): una variante de SFA1 con perfil de liberación más lento, más del 40% del fármaco se libera en 30 días.
- •
SFA4 (n = 5): SFA comercial con polímero biodegradable Biomatrix (Biosensors Interventional Technologies, Singapur) con un grosor de strut de 120μm y cargado con 15,6μg/mm de biolimus en una matriz abluminal de 10μm degradable de poli(D,L)-lactato.
- •
SFA5 (n = 16): SFA comercial con polímero biodegradable Biomime (Meril Life Sciences, India) con un grosor de strut de 65μm y cargado con 1,25μg/mm2 de sirolimus con una matriz circunferencial degradable de 2μm de poli(L)-lactato y poli(L)-glicolato.
- •
SFA6 (n = 8): SFA comercial con polímero biodegradable Orsiro (Biotronik, Alemania) con un grosor de strut de 61μm y cargado con 1,4μg/mm2 de sirolimus con una matriz circunferencial degradable de 7,5μm de poli(L)-lactato.
Todo el material lo proporcionó iVascular, incluidos los SFA 1, 2 y 3 que aún no están disponibles en el mercado. El diseño del estudio se realizó de forma conjunta con iVascular; el análisis e interpretación de los resultados se hizo de forma independiente de la compañía. El cálculo del tamaño muestral y el número de stents incluidos en el estudio se ha realizado según lo recomendado en los documentos de consenso de análisis preclínico de stents20.
Análisis angiográficoTras implantar los stents, se repitió la coronariografía para determinar el diámetro luminal mínimo (DLM) intra-stent. Al mes (en todos los animales, n = 34) y a los 3 meses (en los programados para ese seguimiento, n = 6), se realizó nueva coronariografía de control para evaluar el DLM durante el seguimiento. Tanto los DLM como los diámetros de referencia (diámetro medio de los segmentos localizados en los 5mm proximales y distales del stent) se calcularon con el software de análisis cuantitativo coronario automatizado Medis QCA-CMS, versión 6.1. Se calcularon los siguientes parámetros de reestenosis angiográfica:
- •
Pérdida tardía (late loss) = DLM inicial – DLM en seguimiento.
- •
Porcentaje de reestenosis angiográfica = (1 – [DLM inicial/diámetro de referencia]) × 100.
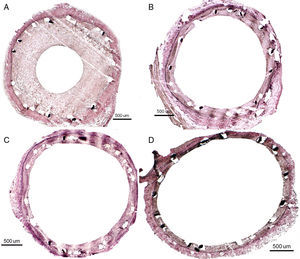
Tras completar el seguimiento, los animales se sacrificaron (n = 28 al mes; n = 6 a los 3 meses) y se realizó el análisis histológico tal como se ha descrito previamente19. Se analizaron las arterias histomorfométricamente con microscopio digital Olympus PRovis AX70W (Tokio, Japón) con cámara digital Nikon DXM 1200W incorporada y el software ImageJ-NIH Image 1.4 (National Institutes of Health, Estados Unidos). Se utilizó la planimetría para determinar el área luminal y el área de membrana elástica interna y calcular así las variables de reestenosis por histología:
- •
Área neointimal = área de elástica interna – área luminal.
- •
Porcentaje de estenosis por histología = (1 – [área luminal/área de elástica interna]) × 100.
El análisis histológico de seguridad se basa en el análisis semicuantitativo de 4 parámetros18 (tabla 1): el grado de daño vascular (injury score), la intensidad de la inflamación, el depósito persistente de fibrina y el grado de reendotelización calculado como el porcentaje aproximado de superficie luminal cubierta por células endoteliales. En función de la cantidad de superficie cubierta por células endoteliales al mes tras el implante, se define un parámetro adicional —la endotelización completa— como al menos el 95% de la superficie luminal cubierta por dichas células8. Los stents con injury score > 2 se excluyeron del análisis final; dado que pueden mostrar respuestas inespecíficas en la histología.
Parámetros histológicos de evaluación de seguridad
| Grado 0 | Grado 1 | Grado 2 | Grado 3 | |
|---|---|---|---|---|
| Daño vascular (injury score) | Sin deformación de LEI ni de capa media | LEI lacerada, capa media comprimida | LEI y capa media laceradas; LEE sin rotura | Rotura de todas las capas; adventicia dañada |
| Grado de inflamación | Ausente | Infiltrado linfohistiocitario ligero que rodea el stent | Acumulación ≥ moderada de células inflamatorias alrededor del stent de forma no circunferencial | Acumulación significativa de células inflamatorias alrededor del stent de forma circunferencial |
| Acumulación de fibrina | Ausente | Acumulación moderada alrededor del stent, < 1/4 circunferencia arterial | Acumulación moderada alrededor del stent, > 1/4 circunferencia arterial o acumulación intensa alrededor o fuera del stent, < 1/4 circunferencia arterial | Acumulación intensa, > 1/4 circunferencia arterial |
| Grado de reendotelización | Porcentaje (aproximado) de superficie luminal cubierta por células endoteliales Endotelización completa: al menos el 95% de la superficie luminal cubierta por dichas células | |||
LEE: lámina elástica externa; LEI: lámina elástica interna.
Publicado con permiso de Pérez de Prado et al.18.
Los valores se presentan como proporciones y como media ± desviación estándar dependiendo del tipo de variable. Las variables semicuantitativas, como las puntuaciones de seguridad en el análisis histopatológico, se describen como media ± desviación estándar (la forma más común de presentarse en publicaciones previas) y como porcentajes (recomendado por consenso de análisis preclínico de stents20).
Se analizaron las diferencias entre la media de los grupos mediante el test de la t de Student y el análisis de la varianza. Para las comparaciones múltiples, se realizaron análisis post-hoc mediante el método de Dunnett para la comparación con un control y mediante el método de Tukey para la comparación con todos los grupos. Las variables semicuantitativas se analizaron mediante el test de la χ2 o el método exacto de Fisher. Para evaluar la posible influencia de diferentes variables (relación stent/arteria, arteria tratada, tipo de stent e injury score) en los resultados finales de estenosis angiográfica e histológica, se llevó a cabo un análisis de regresión lineal multivariable en el que se incluyó, además de las citadas variables, el tipo de stent (SC o SFA). Las variables se introdujeron en el modelo en bloque con una p de entrada de 0,05 y una p de salida de 0,1. Para los análisis se empleó el software estadístico JMP v10 (SAS Institute Inc.; Cary, North Carolina, Estados Unidos) y se consideró significativo un valor de p < 0,05.
RESULTADOSSe implantaron 101 de los 102 stents planeados (1 SC no se implantó por no disponer del dispositivo en el momento), sobredistendidos a una relación media stent/arteria de 1,31 ± 0,21, sin diferencias entre los stents. Los animales completaron los seguimientos planeados y los controles angiográficos se realizaron sin incidencias, excepto en un animal que presentó parada cardiaca tras la inducción anestésica. Los análisis histológicos se realizaron sin incidencias. Todos los segmentos tratados estaban permeables. Se excluyó del análisis final por presentar un injury score > 2 un total de 8 stents (2 SC, 2 BD1, 2 BD2, 1 BD3 y 1 Biomatrix). No se pudo realizar el análisis angiográfico de 6 stents por presencia de ramas superpuestas en el segmento en 1 caso (Orsiro), por inadecuada opacificación en 2 casos (BD1 y Biomime) y en los 3 stents del citado animal que falleció.
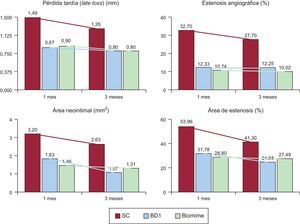
Análisis de eficacia antiproliferativaLos resultados angiográficos al mes se muestran en la tabla 2. Se observa una reducción significativa tanto en la pérdida tardía (late loss) como en la estenosis para todos los SFA en comparación con el SC de control (p < 0,0001 para ambas variables). Los nuevos SFA (BD1, 2 y 3) mostraron valores de pérdida tardía (p = 0,0004) y estenosis angiográfica (p < 0,0001) menores que el SC y sin diferencias con los SFA comerciales. A los 3 meses se repitió la angiografía en los 6 animales programados y se observó la desaparición de las diferencias entre los SFA (BD1, BD3, Biomime) y el SC de control, con reducción de la estenosis frente a los resultados del mes, muy notable en los SC (–15,3%), pero también evidente en Biomime (–6,7%) y BD1 (–0,6%).
Resultados angiográficos al mes
| SC (n = 12) | BD1 (n = 29) | BD2 (n = 4) | BD3 (n = 6) | Biomatrix (n = 4) | Biomime (n = 14) | Orsiro (n = 7) | p* | |
|---|---|---|---|---|---|---|---|---|
| Pérdida tardía (mm) | 1,49 ± 0,70 | 0,87 ± 0,44 | 0,79 ± 0,35 | 1,00 ± 0,53 | 0,67 ± 0,57 | 0,90 ± 0,34 | 1,04 ± 0,42 | < 0,0001 |
| Estenosis (%) | 32,70 ± 19,04 | 12,33 ± 13,86 | 11,29 ± 11,99 | 18,80 ± 22,65 | 9,35 ± 6,24 | 10,74 ± 10,26 | 4,20 ± 5,45 | < 0,0001 |
SC: stent convencional; SFA: stent farmacoactivo.
Los datos expresan media ± desviación estándar.
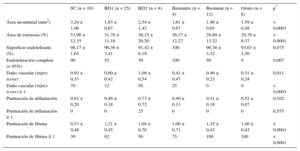
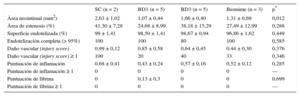
El análisis histológico al mes se representa en la figura 2 y en la tabla 3. Todos los SFA presentaron menor área neointimal y de estenosis que el SC (p < 0,0001 para ambas variables). Los nuevos SFA mostraron valores de área neointimal (p = 0,0004) y área de estenosis (p < 0,0001) menores que el SC y sin diferencias con los SFA comerciales. Los resultados histológicos de reestenosis a los 3 meses (figura 3 y tabla 4) mostraron valores inferiores a los observados en los seguimientos de 1 mes. Los SFA mostraron menor área neointimal que los SC (p = 0,012), especialmente reseñable entre BD1 y SC (1,07 ± 0,44mm2 frente a 2,63 ± 1,02mm2; p = 0,027). Sin embargo, los resultados de BD3 fueron peores que los de BD1 (1,07 ± 0,44mm2 frente a 1,66 ± 0,40mm2; p = 0,059). En la misma línea están los resultados en términos de estenosis (41,30 ± 7,28% frente a 24,68 ± 8,99%; p = 0,070).
Resultados histológicos al mes
| SC (n = 10) | BD1 (n = 25) | BD2 (n = 4) | Biomatrix (n = 4) | Biomime (n = 12) | Orsiro (n = 8) | p* | |
|---|---|---|---|---|---|---|---|
| Área neointimal (mm2) | 3,20 ± 1,06 | 1,83 ± 0,67 | 2,54 ± 1,42 | 1,61 ± 0,67 | 1,46 ± 0,65 | 1,59 ± 0,48 | < 0,0001 |
| Área de estenosis (%) | 53,96 ± 12,35 | 31,78 ± 11,16 | 36,15 ± 20,20 | 26,37 ± 12,27 | 28,80 ± 13,32 | 29,78 ± 8,37 | < 0,0001 |
| Superficie endotelizada (%) | 98,17 ± 1,63 | 96,36 ± 3,41 | 91,42 ± 8,18 | 100 | 96,38 ± 3,32 | 93,63 ± 1,30 | 0,075 |
| Endotelización completa (> 95%) | 90 | 52 | 50 | 100 | 50 | 0 | 0,007 |
| Daño vascular (injury score) | 0,93 ± 0,33 | 0,60 ± 0,42 | 1,09 ± 0,54 | 0,41 ± 0,47 | 0,46 ± 0,23 | 0,51 ± 0,24 | 0,011 |
| Daño vascular (injury score) ≥ 1 | 70 | 12 | 50 | 25 | 0 | 0 | < 0,0001 |
| Puntuación de inflamación | 0,61 ± 0,20 | 0,46 ± 0,18 | 0,73 ± 0,72 | 0,40 ± 0,13 | 0,41 ± 0,18 | 0,52 ± 0,07 | 0,102 |
| Puntuación de inflamación ≥ 1 | 0 | 0 | 25 | 0 | 0 | 0 | 0,555 |
| Puntuación de fibrina | 0,53 ± 0,48 | 1,21 ± 0,45 | 1,04 ± 0,70 | 1,00 ± 0,71 | 1,35 ± 0,43 | 1,46 ± 0,43 | < 0,0001 |
| Puntuación de fibrina ≥ 1 | 30 | 92 | 50 | 75 | 100 | 100 | < 0,0001 |
SC: stent convencional; SFA: stent farmacoactivo.
Los datos expresan porcentaje o media ± desviación estándar.
Resultados histológicos a 3 meses
| SC (n = 2) | BD1 (n = 5) | BD3 (n = 5) | Biomime (n = 3) | p* | |
|---|---|---|---|---|---|
| Área neointimal (mm2) | 2,63 ± 1,02 | 1,07 ± 0,44 | 1,66 ± 0,40 | 1,31 ± 0,69 | 0,012 |
| Área de estenosis (%) | 41,30 ± 7,28 | 24,68 ± 8,99 | 38,18 ± 15,29 | 27,49 ± 12,99 | 0,288 |
| Superficie endotelizada (%) | 99 ± 1,41 | 98,50 ± 1,41 | 98,67 ± 0,94 | 96,86 ± 1,62 | 0,449 |
| Endotelización completa (> 95%) | 100 | 100 | 80 | 100 | 0,585 |
| Daño vascular (injury score) | 0,99 ± 0,12 | 0,85 ± 0,58 | 0,64 ± 0,45 | 0,44 ± 0,30 | 0,376 |
| Daño vascular (injury score) ≥ 1 | 100 | 20 | 40 | 33 | 0,346 |
| Puntuación de inflamación | 0,68 ± 0,41 | 0,43 ± 0,24 | 0,57 ± 0,16 | 0,52 ± 0,12 | 0,285 |
| Puntuación de inflamación ≥ 1 | 0 | 0 | 0 | 0 | — |
| Puntuación de fibrina | 0 | 0,13 ± 0,3 | 0 | 0 | 0,699 |
| Puntuación de fibrina ≥ 1 | 0 | 0 | 0 | 0 | — |
SC: stent convencional; SFA: stent farmacoactivo.
Los datos expresan porcentaje o media ± desviación estándar.
Se realizó análisis multivariable y el modelo de mayor capacidad de predicción mostró una asociación independiente de la estenosis con mayor injury score (B = 18,43; intervalo de confianza del 95%, 12,02-24,84; p < 0,0001) y menor estenosis en SFA (B = –16,84; intervalo de confianza del 95%, –23,55 a –10,13; p < 0,0001).
Análisis de seguridadLas variables de seguridad al mes se muestran en la tabla 3. Los SC mostraron mayor grado de endotelización que los SFA (p = 0,075 en el análisis cuantitativo, p = 0,007 en el análisis semicuantitativo). En cuanto al injury score, la diferencia era inversa: con menor valor cuantitativo (p = 0,011) y menor número de stents con injury score ≥ 1 (p < 0,0001) en los SFA que en los SC. El grado de inflamación fue globalmente bajo, con casi todos los stents por debajo de grado 1. Se encontró menor depósito de fibrina en el grupo de SC que en los SFA testados (p < 0,0001). En el análisis individual del stent BD1 frente al SC se observaron diferencias significativas favorables a BD1 en injury score y en el grado de inflamación (p < 0,036 en ambos casos).
A los 3 meses desaparecen todas las diferencias (tabla 4). Los valores de daño vascular e inflamación son muy similares a los observados al mes: desaparece la deposición de fibrina y presenta endotelización virtualmente completa.
DISCUSIÓNEste estudio analiza la seguridad y eficacia de unos nuevos modelos de stents liberadores de sirolimus y con polímero biodegradable, en comparación con SC y con 3 SFA actualmente comercializados. Se demuestra que los nuevos dispositivos, en el modelo preclínico, disminuyen el grado de reestenosis de forma sostenida hasta los 3 meses (fundamentalmente BD1) en comparación con el SC control y con unos parámetros de seguridad equivalentes a los SFA comercializados y, en ciertos aspectos (inflamación, daño vascular), potencialmente superiores a los SC.
Eficacia anti-reestenóticaEn general, los nuevos SFA mostraron mayor eficacia en la prevención de la reestenosis que el SC de control. En estudios previos ya se ha demostrado que distintos SFA con sirolimus liberado desde polímero biodegradable disminuyen significativamente la pérdida tardía y la revascularización del vaso tratado en comparación con los SC15 y resultados similares a SFA con polímero estable13–15. De forma individual, los stents BD1 y BD2 presentaron parámetros de reestenosis muy similares y significativamente mejores que los SC; sin embargo, BD3 presentó peores valores, especialmente durante el seguimiento a los 3 meses, por lo que se discontinuó su uso en las siguientes fases de estudio.
El modelo experimental de coronarias sanas se basa en la inducción de daño vascular por sobreexpansión de los stents y, como se ha descrito previamente22, un mayor grado de daño representa un mayor estímulo para la proliferación neointimal. Aunque en este estudio la razón stent/arteria es superior a la recomendada20, es reseñable que no se asociara con un excesivo injury score que puede inducir respuestas vasculares inespecíficas: menos de un 8% de los stents presentaron un valor ≥ 2, sin diferencias según el tipo de los stents. Ante la posible repercusión que la eliminación de estos datos pudiera tener en los resultados globales, se repitieron los análisis incluyéndolos y no se observó ninguna variación relevante. En el análisis multivariable, el uso de SFA se asoció de forma independiente con menor grado de estenosis; lo cual confirma que el efecto es real y no está exclusivamente relacionado con el daño producido en la arteria.
Seguridad de los nuevos stentsEl grado de endotelización es peor en los SFA que en el SC control; lo que se explica por el efecto del sirolimus, un potente inhibidor de la proliferación endotelial mediante la desactivación de la vía de la cinasa p70 S6: un paso fundamental para la progresión del ciclo celular en respuesta a factores de crecimiento23. Las diferencias entre SC y BD1 son menores que con el grupo global de SFA y no alcanzan la significación estadística (p = 0,121 en el análisis cuantitativo, p = 0,055 en el análisis semicuantitativo).
Todos los stents analizados presentaban valores bajos de injury score, con una media < 1 a pesar de la elevada relación stent/arteria. Se aprecia una diferencia significativa entre los SFA y los SC, con menor grado de daño vascular en los SFA. Aunque la relación stent/arteria fue similar en ambos grupos (1,34 ± 0,19 frente a 1,30 ± 0,22; p = 0,535), no se puede descartar que alguna variable no controlada influyera en esta diferencia. De cualquier modo, este hallazgo también refleja el alto grado de biocompatibilidad del material probado.
En la misma línea, la inflamación mostró una tendencia (p = 0,102) a ser menor en los SFA que en los SC. Y en el caso concreto de los stents BD1, tanto el grado de inflamación como el de daño vascular fueron significativamente menores (p < 0,036) que con los SC. Varios factores podrían explicar este hallazgo: el efecto antiinflamatorio del fármaco, el diseño optimizado del stent para la mejor liberación del fármaco y la contribución del polímero biodegradable. Los valores de inflamación observados son notablemente inferiores a los observados en un estudio previo con SFA con polímero estable19. Aunque no es posible realizar comparaciones directas, estos hallazgos ya se han descrito en otras series11,12.
El depósito de fibrina alrededor de los stents fue mayor en el grupo de SFA, lo cual indica el efecto del fármaco18,19. Como se discute posteriormente, su desaparición a los 3 meses supone un interesante hallazgo.
Del mismo modo que se apreciaron diferencias entre BD1 y BD3, BD2 mostró valores significativamente superiores de injury score e inflamación y peores datos de endotelización que BD1. Consecuentemente, también se prescindió del uso de BD2 en las últimas fases del estudio.
Evolución a medio plazo (3 meses)Los parámetros histológicos de reestenosis muestran una reducción del área neointimal y el área de estenosis en comparación con los observados al mes en todos los stents. Este fenómeno ya se ha descrito previamente24, aunque no siempre aparece en todos los SFA: de hecho, los SFA liberadores de paclitaxel tienden a presentar una mayor pérdida tardía25. Este fenómeno tiene su explicación en la sustitución del colágeno tipo III por colágeno tipo I, que condiciona retracción de la neoíntima, como sucede en la cicatrización de cualquier herida, y una reducción de la densidad de células musculares lisas26.
Las variables de seguridad a los 3 meses muestran una evolución muy favorable, sin presencia de mayor inflamación o daño vascular tardíos y con una endotelización completa. La desaparición de la fibrina puede reflejar la rápida liberación del fármaco en ese periodo, así como la biocompatibilidad del polímero.
LimitacionesComo todos los modelos preclínicos, este estudio tiene limitaciones intrínsecas: ningún modelo animal puede reproducir con total fidelidad las complejas características de la enfermedad coronaria humana20. Los modelos de animales enfermos pueden mostrar algunas de ellas, pero su validez aún no está contrastada. Aunque la respuesta proliferativa obtenida permite evaluar la actividad del fármaco y el comportamiento del stent, se desconoce si este efecto sería el mismo en las arterias con gran contenido aterosclerótico, en las que la fragmentación de la lámina elástica interna aparece espontáneamente como parte del proceso inflamatorio general, especialmente en las placas vulnerables, en el que otros mediadores participan en el proceso de reparación vascular. A pesar de ello, el modelo de arteria coronaria porcina sigue siendo el recomendado por los documentos de consenso para la evaluación de dispositivos. La evaluación histológica utilizando variables semicuantitativas también limita la exactitud; sin embargo, se han seguido los estándares de análisis postulados por consenso de expertos20. El SC empleado es una variante no comercial del stent Architect sin información específica de seguridad/eficacia, empleado por ser la estructura básica de los SFA analizados. El tamaño muestral es limitado, aunque se seleccionó siguiendo los estándares marcados por los citados documentos de consenso. En este sentido, si bien la potencia para detectar diferencias con los SC es adecuada, la potencia para detectar diferencias entre SFA es menor; por lo que estas comparaciones deben interpretarse con cautela.
CONCLUSIONESEn el modelo experimental de arteria coronaria porcina sana con implante de stents sobredimensionados, los nuevos stents con polímero biodegradable liberadores de sirolimus probados han mostrado una reducción significativa de la reestenosis en comparación con el SC y esta se mantiene a los 3 meses. Su perfil de seguridad es superponible a los SC a los 3 meses. Además, no se han encontrado diferencias relevantes con los SFA con polímero biodegradable actualmente disponibles en el mercado.
FINANCIACIÓNLVD Biotech/iVascular aportó todos los stents del estudio y proporcionó ayuda económica para la realización de los procedimientos experimentales y análisis histológicos.
CONFLICTO DE INTERESESA. Pérez de Prado y F. Fernández Vázquez han sido consultores y recibido apoyo para este y otros proyectos de investigación por parte de LVD Biotech/iVascular. M. Molina Crisol, M. Amorós Aguilar, I. Pérez Serranos, A. Vidal Parreu, A. Benavides Montegordo y L. Duocastella Codina son empleados de LVD Biotech/iVascular. L. Duocastella Codina es CEO (Chief Executive Officer) y posee acciones de LVD Biotech/iVascular.
- –
Aunque los SFA de nueva generación solucionan muchos de los problemas de los SFA más antiguos, aún queda margen de mejora en aspectos como el desarrollo de neoateroesclerosis. La evolución en los polímeros transportadores podría ayudar en esta tarea. Antes de realizar comparativas clínicas, los nuevos desarrollos deben probarse en modelos preclínicos: el de arterias coronarias sanas porcinas es el más aceptado para valorar la eficacia y la seguridad.
- –
El análisis de estos nuevos stents liberadores de sirolimus con polímero biodegradable demuestra su eficacia sostenida en el tiempo (hasta 3 meses) en forma de menor reestenosis (angiográfica e histológica) que los stents metálicos convencionales y similar a la de otros SFA comercializados. Por otra parte, su seguridad en términos de daño vascular, inflamación y depósitos de fibrina persistentes, y reendotelización es comparable a la de los SFA comercializados al mes y similar a la de los SC a los 3 meses.