En el proceso de mejora de los polímeros, las plataformas y los sistemas de liberación de fármacos en los nuevos diseños de stents farmacoactivos, el análisis preclínico inicial es obligatorio. El objetivo es analizar la eficacia y la seguridad de nuevos modelos de stents farmacoactivos en comparación con un stent convencional y stents farmacoactivos comercializados en el modelo experimental de arteria coronaria sana porcina.
MétodosSe implantaron aleatoriamente 60 stents (stent convencional, nuevos stents liberadores de sirolimus: stents liberadores de fármaco 1, 2 y 3; Cypher® y Xience®) en las arterias coronarias de 20 cerdos domésticos raza Large White. Se realizó estudio angiográfico e histomorfométrico a los 28 días.
ResultadosLos stents se implantaron en proporción stent/arteria de 1,34 ± 0,15, sin diferencias significativas entre grupos. Los nuevos stents mostraron menos pérdida tardía y restenosis angiográfica que los convencionales (p=0,006 y p<0,001 respectivamente). Todas las nuevas plataformas presentaron menos área neointimal y restenosis histológica que los stents convencionales (p<0,001 para cada variable), sin diferencias con los farmacoactivos comercializados. En cuanto a la seguridad, todos los stents farmacoactivos mostraron menos endotelización que los convencionales, salvo el stent liberador de fármaco 3 (p=0,084). Asimismo, la inflamación observada fue menor con el stent liberador de fármaco 3 que con los demás.
ConclusionesLas nuevas plataformas de stents farmacoactivos estudiadas se asocian con menos restenosis que los convencionales, sin diferencias significativas en seguridad y eficacia respecto a los stents farmacoactivos comercializados.
Palabras clave
Los stents liberadores de fármaco (SLF) han supuesto uno de los mayores avances en el tratamiento percutáneo de la enfermedad coronaria. Con estos dispositivos se han mostrado de manera consistente menores tasas de revascularización del vaso tratado que con los stents convencionales (SC) en un amplio abanico de situaciones clínicas1–4. Sin embargo, el riesgo de trombosis tardía y muy tardía de estos stents es todavía hoy motivo de preocupación5,6. Este fenómeno se ha relacionado con el efecto deletéreo del fármaco, el polímero, la plataforma del stent o con una combinación de ellos en la pared del vaso, lo cual conduce a endotelización incompleta, reacciones inflamatorias persistentes y desarrollo de neoaterosclerosis7–11.
Para superar estas limitaciones, se han realizado innovaciones en el diseño de las plataformas, la liberación del fármaco, el desarrollo de polímeros más biocompatibles o reabsorbibles e incluso se ha diseñado un SLF completamente reabsorbible12–14. Los modelos preclínicos se han mostrado de gran utilidad a la hora de analizar diferencias entre nuevos dispositivos, puesto que la secuencia de los eventos biológicos asociados con la reparación arterial, como el daño producido por el stent, depósito de fibrina, inflamación y proliferación celular, es similar que en seres humanos15–17. El modelo porcino de arteria coronaria sana se ha mostrado como un modelo adecuado para evaluar las respuestas biológicas tras el implante de SC, SLF o balones liberadores de fármacos18–20.
El propósito de este estudio es evaluar la seguridad y la eficacia en relación con la respuesta vascular de tres nuevos diseños de stents de polímero permanente liberadores de sirolimus en el modelo preclínico porcino.
MÉTODOSModelo animalEn este estudio experimental aleatorizado, controlado y con análisis final ciego, hemos usado 20 cerdos domésticos Large White de 2-3 meses de edad y media de peso de 25±3kg. Todos los procedimientos se realizaron de acuerdo con la regulación local (RD 53/2013, del 1 de febrero, que hace referencia a los estándares básicos para la protección de animales de experimentación y otros propósitos científicos, incluida la enseñanza) y la Directiva Europea 2010/63/EC. El comité ético local aprobó el estudio antes del inicio de cualquier procedimiento.
El método de aleatorización fue el de asignación estratificada por arterias coronarias mayores, de modo que se implantase cada tipo de stent en igual número de arterias.
Se administró a todos los animales tratamiento antiplaquetario con ácido acetilsalicílico (325mg) y clopidogrel (300mg) 24h antes del procedimiento. El protocolo antestésico y la preparación quirúrgica ya se han descrito21,22. Se anestesió a los animales y se les administró tratamiento anticoagulante con 5.000 UI de heparina no fraccionada. La angiografía coronaria se realizó a través de un acceso carotídeo izquierdo, previa administración intracoronaria de nitroglicerina.
Procedimiento de angioplastiaPara implantar los dispositivos con la idea de obtener una relación stent/arteria > 1,1, se seleccionaba la mejor localización dentro de las tres arterias coronarias epicárdicas. Tras avanzar una guía intracoronaria, los diferentes tipos de stents se implantaban en la zona seleccionada de cada arteria.
Dispositivos analizadosEn este estudio se utilizaron los siguientes dispositivos (números entre paréntesis):
- 1.
SC de control (n=11): stent de aleación de cromo-cobalto L605, Architect® (iVascular). La estructura del stent está formada por seis coronas unidas por tres filas de conectores concatenados, con lo que se forma una estructura sinusoidal continua (figura 1A).
Figura 1.Diseño del stent convencional de cromo-cobalto Architect®, la plataforma metálica del control, stent liberador de fármaco 1 y stent liberador de fármaco 2 (A); la nueva plataforma metálica, estructural del stent liberador de fármaco 3, tiene mayor número de coronas por segmento y conectores no concatenados para permitir una liberación del fármaco más uniforme (B). Imágenes de alta definición obtenidas con el sistema QSix® (Barcelona, España).
(0.12MB). - 2.
SLF 1 (n=17): basado en el stent metálico Architect®, recubierto de un polímero permanente de la familia de los poliacrilatos y cargado con 1,4μg/mm2 de sirolimus con un sistema de liberación lento (con una capa externa polimérica adicional para controlar la liberación del fármaco).
- 3.
SLF 2 (n=10): basado en el stent metálico Architect®, recubierto de un polímero permanente de la familia de los poliacrilatos y cargado con 1,4μg/mm2 de sirolimus (sin barrera polimérica externa).
- 4.
SLF 3 (n=12): es el nuevo SLF de iVascular llamado Angiolite®. La plataforma está compuesta de la aleación de cromo-cobalto L605 con grosor de strut de 85μm. La estructura del stent está formada por ocho coronas unidas por tres filas de conectores no concatenados que forman una estructura sinusoidal discontinua (figura 1B). Este diseño supone un leve incremento de la razón metal/arteria y permite una mejor distribución del fármaco en la pared arterial. El polímero es permanente y de la familia de los poliacrilatos. El fármaco liberado es sirolimus a dosis de 1,4μg/mm2, y más del 80% del fármaco se libera en 60 días.
- 5.
SLF 4 (n=5): SLF comercial de primera generación Cypher® (J&J Cordis; Miami Lakes, Florida, Estados Unidos) con un grosor de strut de 140μm y cargado con 1,4μg/mm2 de sirolimus con una matriz permanente de copolímero.
- 6.
SLF 5 (n=5): SLF de segunda generación Xience® (Abbott Vascular; Santa Clara, California, Estados Unidos). Este stent libera everolimus a dosis de 1μg/mm2 a través de su copolímero fluorado permanente. La plataforma metálica es el stent Multi-Link, que está formado por aleación de cromo-cobalto con un grosor de strut de 81μm.
Todo el material fue proporcionado por iVascular, incluidos los SLF 1, 2 y 3, que aún no están disponibles en el mercado.
El cálculo del tamaño muestral y el número de stents incluidos en el estudio se ha realizado según lo recomendado en los documentos de consenso de análisis preclínico de stents20.
Análisis angiográficoTras completar en cada arteria los procedimientos mencionados, se repitió la coronariografía (previa administración intracoronaria de nitroglicerina) para determinar el diámetro luminal mínimo (DLM) dentro del stent. A los 28 días, se realizó una nueva coronariografía de control para evaluar el DLM en el seguimiento. Tanto los DLM tras el procedimiento y en el seguimiento como los diámetros de referencia de las arterias (diámetro medio de los segmentos arteriales localizados en los 5mm proximales y distales del stent) se calcularon con el software de análisis cuantitativo coronario automatizado Medis QCA-CMS, versión 6.1. Se calcularon los siguientes parámetros de restenosis angiográfica:
- •
Pérdida tardía (late loss)=DLM inicial – DLM en seguimiento.
- •
Porcentaje de restenosis angiográfica=[1-(DML inicial/diámetro de referencia)]×100.
Se consideró un criterio de exclusión del análisis angiográfico la presencia de ramas superpuestas que impidiesen una correcta medición del diámetro del vaso.
Análisis histológicoTras completar el seguimiento angiográfico, los animales fueron sacrificados y se les realizó un análisis histológico completo. Se explantaron los corazones y se fijaron las arterias coronarias mediante presión-perfusión, inicialmente con salino tamponado con fosfato y posteriormente mediante paraformaldehído al 4%. Se disecaron los segmentos tratados conservando los 5mm distales y proximales a la zona tratada. Las muestras se incluyeron en resinas plásticas para obtener secciones circunferenciales representativas de las zonas proximal, media y distal y calcular los valores medios de cada segmento estudiado. Tras desplastificar las secciones, se realizaron sistemáticamente tinciones con hematoxilina-eosina y elastina de Van Gieson.
Se analizaron las arterias histomorfométricamente con microscopio digital Olympus PRovis AX70W (Tokyo, Japan) con cámara digital Nikon DXM 1200W incorporada y el software ImageJ-NIH Image 1.4 (National Institutes of Health, Estados Unidos). Se utilizó la planimetría para determinar el área luminal y el área de membrana elástica interna y calcular así las variables de restenosis definidas mediante histología:
- •
Área neointimal=área de elástica interna – área luminal.
- •
Porcentaje de estenosis por histología=[1 – (área luminal / área de elástica interna)]×100.
El análisis histológico de seguridad se basa en el análisis semicuantitativo de cuatro parámetros: el grado de daño vascular (injury score), definido por Schwartz et al23; la intensidad de la inflamación, definida por Kornowski et al24; el depósito persistente de fibrina según Suzuki et al25, y el grado de reendotelización calculado como el porcentaje aproximado de superficie luminal cubierta por células endoteliales. En función de la cantidad de superficie cubierta por células endoteliales 28 días tras el implante, se define un parámetro adicional: la endotelización completa, como al menos el 95% de la superficie luminal cubierta por dichas células26. Los stents con injury score > 2 se excluyeron del análisis final, dado que pueden mostrar respuestas inespecíficas en la histología de la pared arterial.
Método estadísticoLos valores se presentan como proporciones y como media±desviación estándar dependiendo del tipo de variable. Las variables semicuantitativas, como las puntuaciones de seguridad en el análisis histopatológico, se describen como media±desviación estándar (que es la forma más común de presentarlo en las publicaciones previas) y como porcentajes (lo recomendado por los documentos de consenso de análisis preclínico de stents20,27).
Se analizaron las diferencias entre la media de los grupos mediante el test de la t de Student y el análisis de la varianza. Para las comparaciones múltiples, se realizaron análisis post-hoc mediante el método de Dunnett para la comparación con un control y mediante el de Tukey para la comparación con todos los grupos. Las variables semicuantitativas se analizaron mediante el test de la χ2 o el método exacto de Fisher. Para evaluar la posible influencia de diferentes variables (razón stent/arteria, arteria tratada, tipo de stent e injury score) en los resultados finales de estenosis angiográfica e histológica, se llevó a cabo un análisis de regresión lineal multivariable en el que se incluyó, además de las citadas variables, el tipo de stent (SC o SLF). Las variables se introdujeron en el modelo en bloque con una p de entrada de 0,05 y una p de salida de 0,1. Para los análisis se consideró significativo un valor de p<0,05.
RESULTADOSEn este estudio, finalmente se implantaron en las arterias coronarias porcinas 59 de los 60 stents planeados (un SC no se pudo implantar correctamente en la coronaria derecha) y sobredistendidos a una tasa media stent/arteria de 1,34±0,15, sin diferencias significativas entre los stents. Los animales completaron el seguimiento planeado y los controles angiográficos y los análisis histológicos se realizaron sin incidencias. Todos los segmentos tratados estaban permeables en el análisis angiográfico final. Dos SC, 2 SLF-1 y 1 SLF-3 se excluyeron del análisis final por presentar un injury score > 2. El análisis angiográfico de 2 stents no se pudo realizar debido a la presencia de ramas superpuestas en el segmento del stent en un caso (SLF-1 en arteria circunfleja) y por una inadecuada opacificación del stent en el otro (SLF-3 en coronaria derecha).
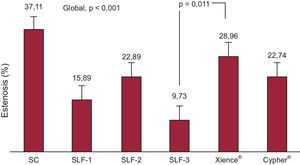
Análisis de eficacia antirrestenóticaLos resultados en cuanto a las propiedades antirrestenóticas se muestran en las tablas 1 y 2. Se observa en general una reducción significativa de la pérdida tardía (late loss) para todos los SLF en comparación con el SC de control (p=0,006). SLF-1 y SLF-3 mostraron valores de esta variable menores que el SC (p=0,025 y p=0,004 respectivamente). Asimismo, SLF-3 mostró valores de esta variable menores que el stent Xience®, hecho de significación estadística límite (p=0,049). La restenosis angiográfica también fue menor en el grupo de SLF que en el del SC de control (p<0,001); sin embargo, este hecho solo se cumple con los nuevos prototipos testados (p<0,001 para el SLF-1; p=0,047 para el SLF-2; p<0,001 para el SLF-3). El SLF-3 mostró menor restenosis que el Xience® (p=0,011) (figura 2).
Resultados angiográficos a 28 días
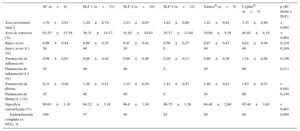
| SC (n=8) | SLF-1 (n=14) | SLF-2 (n=10) | SLF-3 (n=11) | Xience® (n=5) | Cypher® (n=5) | p (SC frente a SLF) | |
|---|---|---|---|---|---|---|---|
| Late loss (mm) | 1,54±0,40 | 1,03±0,55 | 1,26±0,30 | 0,87±0,30 | 1,52±0,37 | 1,19±0,30 | 0,006 |
| Estenosis (%) | 37,11±12,73 | 15,89±10,59 | 22,89±7,92 | 9,73±6,09 | 28,96±9,86 | 22,74±14,14 | < 0,001 |
SC: stent convencional; SLF: stent liberador de fármaco.
Los datos se presentan como media±desviación estándar.
Resultados histológicos a 28 días
| SC (n=8) | SLF-1 (n=15) | SLF-2 (n=10) | SLF-3 (n=12) | Xience® (n=5) | Cypher® (n=5) | p (SC frente a SLF) | |
|---|---|---|---|---|---|---|---|
| Área neointimal (mm2) | 3,70±0,91 | 2,20±0,74 | 2,43±0,65 | 1,84±0,60 | 1,93±0,84 | 3,35±0,88 | < 0,001 |
| Área de estenosis (%) | 63,55±15,39 | 36,31±14,17 | 41,02±10,83 | 35,17±11,04 | 29,60±9,58 | 46,92±8,19 | < 0,001 |
| Injury score | 0,96±0,44 | 0,89±0,55 | 0,87±0,42 | 0,56±0,27 | 0,87±0,47 | 0,81±0,48 | 0,318 |
| Injury score ≥ 1 (%) | 38 | 40 | 30 | 0 | 40 | 40 | 0,249 |
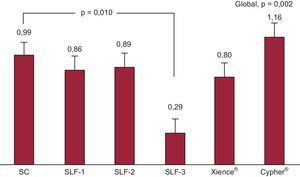
| Puntuación de inflamación | 0,99±0,63 | 0,86±0,44 | 0,89±0,46 | 0,29±0,12 | 0,80±0,38 | 1,16±0,46 | 0,198 |
| Puntuación de inflamación ≥ 1 (%) | 25 | 40 | 40 | 0 | 20 | 60 | 0,111 |
| Puntuación de fibrina | 0,33±0,40 | 1,36±0,51 | 1,25±0,54 | 1,41±0,47 | 1,40±0,43 | 1,67±0,53 | < 0,001 |
| Puntuación de fibrina ≥ 1 (%) | 25 | 40 | 40 | 0 | 20 | 60 | 0,249 |
| Superficie endotelizada (%) | 99,63±1,10 | 94,22±3,18 | 96,0±1,10 | 96,75±1,26 | 94,40±2,60 | 95,40±3,65 | < 0,001 |
| Endotelización completa (> 95%), % | 100 | 47 | 50 | 83 | 20 | 40 | 0,005 |
SC: stent convencional; SLF: stent liberador de fármaco.
Salvo otra indicación, los datos se presentan como media±desviación estándar.
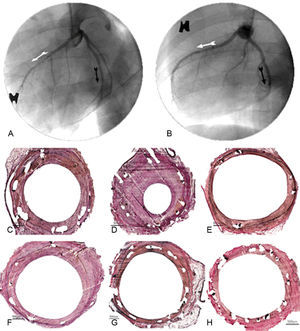
En cuanto al análisis histológico, los nuevos SLF de sirolimus presentaron menor área neointimal y menor restenosis histológica que el SC (p<0,001 para ambas variables). Los nuevos dispositivos mostraron significativamente menor área neointimal que el SC y el Cypher®, pero no se evidenciaron diferencias con respecto al Xience®. Asimismo, se objetivó menor restenosis histológica en comparación con SC, pero no con Xience® o Cypher®. La figura 3 muestra la comparación entre los efectos de los diferentes stents, tanto en la angiografía como en la histología.
Eficacia antiproliferativa: comparación angiográfica e histológica a los 28 días. Resultados angiográficos del stent convencional de control (A: descendente anterior, flecha blanca), stent liberador de fármaco 3 (A: circunfleja, flecha negra), stent liberador de fármaco 2 (B: descendente anterior, flecha blanca) y stent liberador de fármaco 1 (B: circunfleja, flecha negra). Resultados histológicos del stent Cypher® (C), stent convencional (D), Xience® (E), stent liberador de fármaco 1 (F), stent liberador de fármaco 2 (G) y stent liberador de fármaco 3 (H).
Se realizó un análisis multivariable para evaluar la influencia de diferentes variables en los valores de restenosis histológica. Se encontró una asociación independiente con mayor grado de restenosis a mayor injury score (B=13,38; intervalo de confianza del 95%, 5,68-21,08; p<0,001) y menores valores en caso de SLF frente a control (B=–26,73; intervalo de confianza del 95%, –35,95 a 17,51; p<0,001).
Análisis de seguridadLas variables de seguridad se muestran en la tabla 2. En general, los SC mostraron mayor grado de endotelización a los 28 días que los SLF analizados (p<0,001). Esta diferencia no alcanzó la significación estadística en el caso del SLF-3 (p=0,084). No se observaron diferencias entre los SLF analizados. En cuanto al injury score, no se objetivaron diferencias significativas entre los dispositivos. El grado de inflamación fue menor en el SLF-3, incluso con valores menores que el SC (p=0,010) (figura 4). Finalmente, se encontró menor depósito de fibrina en el grupo de SC que en los SLF testados (p<0,001).
DISCUSIÓNEste estudio pretende comprobar la seguridad y eficacia de unos nuevos modelos de stent liberadores de sirolimus y con polímero permanente, en comparación con SC y con dos SLF actualmente comercializados. Se ha demostrado que los nuevos dispositivos, en el modelo preclínico, disminuyen el grado de restenosis (fundamentalmente SLF-1 y SLF-3) en comparación con el SC control y con similares parámetros de seguridad que los SLF actualmente comercializados.
El análisis preclínico en el modelo animal es una parte fundamental de los procesos de aprobación y un determinante esencial para comprobar la seguridad y la eficacia de nuevos dispositivos coronarios. Asimismo, es el método más eficaz para evaluar la respuesta de la pared vascular en relación con los nuevos materiales terapéuticos.
Los nuevos SLF mostraron en general mayor eficacia en la prevención de la restenosis que el SC de control. Este hallazgo era esperable, puesto que estudios previos han demostrado que distintos modelos de stents liberadores de sirolimus disminuyen significativamente el late loss y la revascularización del vaso tratado en comparación con los SC1,2,25,28–30. Además, es de destacar que en el presente estudio estudio el SLF-3 parece ser el de mayor eficacia en general, incluso cuando se compara los SLF comercializados. Este hecho es de relevancia, puesto que el stent Xience® ha sido el dispositivo con mejor balance de eficacia/seguridad en metanálisis recientes31,32. Aunque pueden existir varios factores que expliquen este hallazgo, se conoce por publicaciones previas que el diseño y el recubrimiento del stent pueden afectar significativamente a la hiperplasia neointimal y el depósito trombótico33–36. Es probable que el nuevo diseño de esta plataforma, con una distribución mejorada del fármaco en la pared arterial, pueda ser el motivo de estos efectos. A pesar de estos resultados prometedores, se debe asumir que el modelo coronario porcino es limitado a la hora de valorar la respuesta de la pared arterial a los stents y que no existe un modelo animal que reproduzca con total exactitud las características de la enfermedad vascular en humanos20,27. Es por ello que es necesario ser cautos a la hora de interpretar este hallazgo positivo. Sin embargo, estudios experimentales indican que existen importantes similitudes entre la inflamación, el daño vascular y el crecimiento neointimal entre estos modelos y las arterias coronarias nativas humanas, aunque el daño vascular causado en el modelo animal difiere de aquel que se produce en arterias humanas ateroscleróticas37,38. El daño vascular representa el evento fundamental que puede llevar a encontrar diferencias entre los stents estudiados en el modelo porcino. El presente grupo ha publicado previamente que un mayor grado de daño vascular producido por la sobredilatación de los stents implantados representa un potente estímulo para la proliferación neointimal. Por lo tanto, cuanto mayor sea el daño vascular, mayor será la eficacia de los SLF en prevenir la respuesta neointimal22. Este hecho está presente en este estudio, en el que la razón stent/arteria es superior a lo recomendado20, lo que permite observar las diferencias entre los dispositivos. Además, es relevante que esta sobredilatación no se asociara con un excesivo injury score, lo cual podría alterar los resultados del estudio al inducir respuestas vasculares inespecíficas. Esto se confirmaría al no encontrar asociación significativa entre esta variable y el grado de estenosis angiográfica o histológica. En el presente análisis multivariable, el uso de SLF se asoció de forma independiente con menor grado de estenosis, lo cual confirma que el efecto es real y no está relacionado con el daño producido en la arteria.
En cuanto a los datos de seguridad, el grado de endotelización es peor en cualquier SLF que en el SC control, lo que se explica por el efecto del sirolimus, un potente inhibidor de la proliferación endotelial mediante la desactivación de la vía de la cinasa p70 S6, un paso fundamental para la progresión del ciclo celular en respuesta a factores de crecimiento28,39,40. Es interesante señalar que el SLF-3 no mostró diferencias significativas con respecto al SC, lo cual confirma la seguridad de este dispositivo testado. Asimismo, el depósito de fibrina alrededor de los stents fue mayor en el grupo de SLF, lo cual indica el efecto del fármaco41. Es interesante señalar que todos los stents analizados presentaban bajos valores de injury score, con una media<1 a pesar de una tasa stent/arteria ≥ 1,3. Es probable que este hallazgo refleje el alto grado de biocompatibilidad del material testado. Finalmente, merece la pena señalar que el SLF-3 presentaba menor respuesta inflamatoria que el SC control. A pesar de que existen varios factores que podrían explicar este hallazgo, es posible que este nuevo diseño, con su patrón de liberación de sirolimus mejorado, pueda estar asociado a un mayor efecto antiinflamatorio del fármaco42 que podría equilibrar el efecto proinflamatorio del polímero permanente43.
LimitacionesEste estudio, como todos los modelos preclínicos, tiene limitaciones inherentes, puesto que ningún modelo animal puede reproducir con total fidelidad las complejas características de la enfermedad coronaria humana. Los modelos de animales enfermos pueden mostrar algunas de ellas, pero su interpretación exacta no está completamente aclarada. Aunque la respuesta proliferativa obtenida permite evaluar la actividad del fármaco y el comportamiento del stent, se desconoce si este efecto sería el mismo en las arterias con gran contenido aterosclerótico, en las que la fragmentación de la lámina elástica interna aparece espontáneamente como parte del proceso inflamatorio general, especialmente en las placas vulnerables, en el que otros mediadores participan en el proceso de reparación vascular. Además, los pacientes con aterosclerosis presentan otros factores moleculares y genéticos que pueden interferir directamente en el proceso. A pesar de ello, el modelo de arteria coronaria porcina sigue siendo el recomendado por los consensos para evaluación de dispositivos. La evaluación histológica utilizando variables semicuantitativas también limita la exactitud; sin embargo, se han seguido los estándares de análisis postulados por los consensos de expertos20,27. El tamaño muestral se seleccionó siguiendo los estándares marcados por los documentos de consenso de estudios preclínicos de stents coronarios. En este sentido, si bien la potencia para detectar diferencias con los SC es adecuada, la potencia para detectar diferencias entre SLF es menor, por lo que estas comparaciones deben ser tomadas con cautela.
CONCLUSIONESEn el modelo experimental de arteria coronaria porcina sana con implante de stents sobredimensionados, los nuevos stents de sirolimus testados han mostrado una reducción significativa de la restenosis en comparación con el SC de control. Además, no se han encontrado diferencias relevantes con los SLF de primera y segunda generación disponibles actualmente en el mercado.
FINANCIACIÓNEste estudio se ha desarrollado con el apoyo del CDTI (Centro para el Desarrollo Tecnológico Industrial) del Ministerio de Economía y Competitividad (IDI-20111025).
CONFLICTO DE INTERESESA. Pérez de Prado y F. Fernández-Vázquez son consultores y reciben apoyo para diversos proyectos de investigación por parte de LVD Biotech/iVascular. M. Molina y L. Duocastella son empleados de LVD Biotech/iVascular. L. Duocastella es el CEO (Chief Executive Officer) y posee acciones de LVD Biotech/iVascular.