La incorporación de los nuevos antiagregantes (NAA) prasugrel y ticagrelor a la práctica clínica está siendo errática. Los datos del mundo real todavía son escasos. Se analizó la tendencia temporal de uso de NAA, su seguridad y eficacia clínica frente a clopidogrel en una cohorte actual de pacientes con síndrome coronario agudo (SCA).
MétodosEstudio multicéntrico observacional retrospectivo de pacientes con SCA ingresados en unidades coronarias incluidos de forma prospectiva en el registro ARIAM-Andalucía entre 2013 y 2015. Se analizaron las tasas de eventos cardiovasculares mayores y hemorragias intrahospitalarias mediante modelos de propensión y regresión multivariante.
ResultadosSe incluyó a 2.906 pacientes: el 55% recibió clopidogrel y el 45% NAA. Un 60% presentó SCA con elevación del segmento ST. El uso de NAA se incrementó de forma significativa a lo largo del estudio. El grupo de clopidogrel presentó mayor edad y comorbilidad. La tasa de mortalidad total, el ictus isquémico y la trombosis del stent fue menor con NAA (2 frente a 9%, p < 0,0001; 0,1 frente a 0,5%, p = 0,025; 0,07 frente a 0,5%, p = 0,025, respectivamente). No hubo diferencias en la tasa de hemorragias totales (3 frente a 4%; p = NS). Tras el análisis de propensión, se mantuvo la reducción de mortalidad con NAA (OR = 0,37; IC95%, 0,13-0,60; p< 0,0001) sin incremento en las hemorragias totales (OR = 1,07; IC95%, 0,18-2,37; p = 0,094).
ConclusionesEn el mundo real, los NAA se usan de forma selectiva en sujetos más jóvenes y con menor comorbilidad. Su uso se asocia con una reducción de eventos cardiacos mayores, incluida mortalidad, sin aumentar las hemorragias en comparación con clopidogrel.
Palabras clave
La combinación de ácido acetilsalicílico y un inhibidor del receptor plaquetario P2Y12 (antiP2Y12) supone el pilar fundamental del tratamiento antitrombótico del síndrome coronario agudo (SCA) con y sin elevación del segmento ST1,2. Las actuales guías de práctica clínica recomiendan los nuevos antiagregantes (NAA) prasugrel y ticagrelor frente a clopidogrel cuando el riesgo hemorrágico no es prohibitivo, insistiendo en el balance riesgo-beneficio1,2. Esta recomendación se basa en ensayos clínicos realizados sobre una población diferente a la que se encuentra en la práctica clínica diaria.
La realización de estudios tras la comercialización resulta fundamental para trasladar los resultados de los ensayos clínicos a la práctica diaria. Los datos sobre el uso de estos NAA en el mundo real todavía son escasos3–13 y solo algunos estudios han recopilado datos con los 3 antiP2Y12 disponibles9,12. De forma general, estos estudios observacionales muestran una infrautilización de los NAA y un uso selectivo en pacientes más jóvenes y con menor comorbilidad; hecho que podría explicar el beneficio clínico neto encontrado frente al empleo de clopidogrel3–6,8–12. Se ha cuestionado la reducción en la mortalidad a corto plazo con los NAA14 y recientemente se han llevado a cabo estudios que todavía dejan dudas sin resolver en este sentido9,12,15.
En España, a pesar de la existencia de propuestas de protocolos de utilización de NAA16, no hay registros multicéntricos recientes que evalúen en el mundo real los eventos clínicos con ambos NAA (ticagrelor y prasugrel)10,11,17; incluso habiéndose comunicado factores limitantes, además de los económicos, para su incorporación en la práctica diaria17.
El objetivo de este estudio es conocer la tendencia temporal de uso de los NAA, así como su seguridad y eficacia clínica en comparación con clopidogrel en una cohorte actual de pacientes con SCA.
MÉTODOSPoblación de estudioSe trata de un estudio multicéntrico observacional, con análisis retrospectivo, de pacientes con diagnóstico de SCA que recibieron ácido acetilsalicílico y un antiP2Y12 (clopidogrel, prasugrel o ticagrelor) en el momento del alta hospitalaria y que se incluyeron de forma prospectiva en el registro ARIAM-Andalucía entre 2013 y 2015. Las características de este registro se han descrito previamente18–21. En resumen, recoge de forma continuada y en plataforma electrónica datos demográficos, variables clínicas, analíticas, tratamientos, procedimientos, tiempos de demora de reperfusión y eventos cardiacos y cerebrovasculares mayores (así como hemorragias durante el curso intrahospitalario) de todos los pacientes con SCA que ingresan en unidades coronarias de hospitales andaluces. Para llevar a cabo este estudio se eligieron los 4 centros de tercer nivel con mayor volumen de casos recogidos y con menor número de valores perdidos de las variables de estudio. El sistema de recopilación y verificación de los datos introducidos en la plataforma on-line se somete a auditorías de calidad por parte de la Escuela Andaluza de Salud Pública18,21.
Variables clínicasLa prescripción de antiplaquetarios se realizó a criterio del clínico responsable, según la práctica clínica habitual en cada centro. El infarto se definió de acuerdo con la tercera definición universal. El ictus isquémico se definió como cualquier déficit neurológico establecido más allá de 24h y la ausencia de hemorragia se comprobó con pruebas de neuroimagen. La trombosis del stent se definió según la clasificación del Academic Research Consortium22. Todos los eventos clínicos se definieron previamente en la hoja de recogida de datos y se adjudicaron con el consenso de los investigadores de cada centro19–21. La variable principal de eficacia fue la mortalidad total y las secundarias el infarto de miocardio y el ictus isquémico no fatales, así como la trombosis del stent probable/definitiva. La variable de seguridad principal fueron las hemorragias totales según escala TIMI (Thrombolysis in Myocardial Infarction)23.
Análisis estadísticoTodos los análisis se segmentaron según el tipo de antiP2Y12 en el momento del alta hospitalaria, NAA (prasugrel y ticagrelor agrupados) frente a clopidogrel. Las variables continuas se expresaron como media ± desviación estándar o mediana [intervalo intercuartílico], expresado como percentil 25-percentil 75, según su distribución y se compararon con el test de la t de Student o de la U de Mann-Whitney. Las variables cualitativas se expresaron como número y porcentaje y se compararon con el test de la χ2 o el test exacto de Fischer.
Para ajustar las diferencias entre las características basales de ambos grupos y atenuar posibles variables de confusión, se calcularon las puntuaciones de propensión (propensity score [PS]) para recibir NAA24 recurriendo a un modelo de regresión multivariada que incluyó las siguientes variables: edad, sexo, peso corporal, tabaquismo, diabetes mellitus, hipertensión, infarto previo, ictus previo, historia de hemorragia, isquemia vascular periférica, antecedentes de fibrilación auricular y tratamiento previo con anticoagulantes orales, SCA con elevación del segmento ST, intervención coronaria percutánea o cirugía de revascularización durante el ingreso, año de ingreso, afección coronaria de 3 vasos/enfermedad de tronco, uso de anti IIb-IIIa, insuficiencia cardiaca, insuficiencia renal y tiempo total de isquemia (medido desde el inicio de los síntomas a la reperfusión). El emparejamiento se realizó mediante un protocolo voraz (greedy) de 1:1 (cáliper de 0,05) sin reemplazamiento y se asumió una bondad de ajuste adecuada si las diferencias estandarizadas eran < 10%24,25. Para analizar la robustez de los resultados, se realizó análisis adicional mediante regresión ponderada por IPTW (inverse probability of treatment weight) o análisis de regresión ponderado por el inverso de la probabilidad de tratamiento con restricción muestral para puntuaciones de propensión extremas26. La contribución de cada sujeto o ponderación en el grupo de NAA se calculó como la inversa del PS (1/PS) y como (1/1-PS) en el grupo de clopidogrel. Este tipo de análisis asegura que la contribución de las diferentes variables introducidas para construir el modelo de propensión no difiera entre los sujetos de cada grupo. Las diferencias en las características basales de ambos grupos de estudio en la muestra emparejada se analizaron con el test de McNemar (variables cuantitativas) y la prueba de la t de Student para datos emparejados (variables cuantitativas). Las diferencias en la aparición de los eventos clínicos entre ambos grupos de tratamiento en la muestra emparejada se analizaron mediante modelos de regresión multivariante condicional y se expresaron como odds ratio (OR) y sus intervalos de confianza del 95% (IC95%). Como análisis de sensibilidad para validación interna de los resultados se analizó la mortalidad y las hemorragias totales en distintos subgrupos: según las puntuaciones de riesgo GRACE y CRUSADE, edad ≥ 75 años, tipo de SCA y año de ingreso. El poder discriminativo y la calibración de los modelos de regresión se realizaron con el estadístico C y el test de Hosmer-Lemeshow, respectivamente. Se consideró significativo un valor bilateral de p < 0,05. Se usaron los paquetes estadísticos SPSS 19 (IBM Corporation; Somers, Nueva York, Estados Unidos) y STATA 13.1 IC (STATA Corp.; College Station, Texas, Estados Unidos)
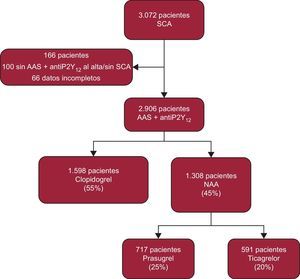
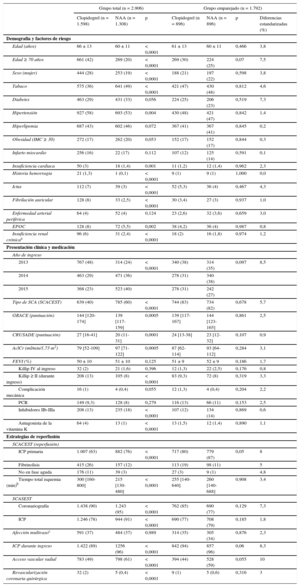
RESULTADOSDurante el periodo de estudio se evaluó a un total de 3.072 pacientes. De ellos, 2.906 se incluyeron en el análisis final (figura 1). De estos, 1.598 (55%) recibieron clopidogrel y 1.308 (45%) NAA (717 prasugrel y 591 ticagrelor). Del total de casos, un 60% fueron SCA con elevación del segmento ST. En general, los pacientes tratados con clopidogrel presentaron puntuaciones de riesgo isquémico (GRACE) y hemorrágico (CRUSADE) más elevadas, mayor edad, superior comorbilidad y mayor incidencia de insuficiencia cardiaca durante el ingreso; así como menor realización de intervención coronaria percutánea y tiempo total de isquemia más prolongado (tabla 1). No hubo diferencias en la prevalencia de diabetes e infarto de miocardio previo, en el valor de la fracción de eyección ni en el porcentaje de shock cardiogénico o parada cardiaca documentada al ingreso.
Características basales en la población total y emparejada
| Grupo total (n = 2.906) | Grupo emparejado (n = 1.792) | ||||||
|---|---|---|---|---|---|---|---|
| Clopidogrel (n = 1.598) | NAA (n = 1.308) | p | Clopidogrel (n = 896) | NAA (n = 896) | p | Diferencias estandarizadas (%) | |
| Demografía y factores de riesgo | |||||||
| Edad (años) | 66 ± 13 | 60 ± 11 | < 0,0001 | 61 ± 13 | 60 ± 11 | 0,466 | 3,8 |
| Edad ≥ 70 años | 661 (42) | 269 (20) | < 0,0001 | 269 (30) | 224 (25) | 0,07 | 7,5 |
| Sexo (mujer) | 444 (28) | 253 (19) | < 0,0001 | 188 (21) | 197 (22) | 0,598 | 3,8 |
| Tabaco | 575 (36) | 641 (49) | < 0,0001 | 421 (47) | 430 (48) | 0,812 | 4,6 |
| Diabetes | 463 (29) | 431 (33) | 0,056 | 224 (25) | 206 (23) | 0,519 | 7,3 |
| Hipertensión | 927 (58) | 693 (53) | 0,004 | 430 (48) | 421 (47) | 0,842 | 1,4 |
| Hiperlipemia | 687 (43) | 602 (46) | 0,072 | 367 (41) | 367 (41) | 0,845 | 0,2 |
| Obesidad (IMC ≥ 30) | 272 (17) | 262 (20) | 0,053 | 152 (17) | 152 (17) | 0,844 | 0,3 |
| Infarto miocardio | 256 (16) | 22 (17) | 0,112 | 107 (12) | 125 (14) | 0,591 | 0,1 |
| Insuficiencia cardiaca | 50 (3) | 18 (1,4) | 0,001 | 11 (1,2) | 12 (1,4) | 0,962 | 2,3 |
| Historia hemorragia | 21 (1,3) | 1 (0,1) | < 0,0001 | 9 (1) | 9 (1) | 1,000 | 0,0 |
| Ictus | 112 (7) | 39 (3) | < 0,0001 | 52 (5,3) | 36 (4) | 0,467 | 4,3 |
| Fibrilación auricular | 128 (8) | 33 (2,5) | < 0,0001 | 30 (3,4) | 27 (3) | 0,937 | 1,0 |
| Enfermedad arterial periférica | 64 (4) | 52 (4) | 0,124 | 23 (2,6) | 32 (3,6) | 0,659 | 3,0 |
| EPOC | 128 (8) | 72 (5,5) | 0,002 | 38 (4,2) | 36 (4) | 0,987 | 0,8 |
| Insuficiencia renal crónicaa | 96 (6) | 31 (2,4) | < 0,0001 | 18 (2) | 16 (1,8) | 0,974 | 1,2 |
| Presentación clínica y medicación | |||||||
| Año de ingreso | |||||||
| 2013 | 767 (48) | 314 (24) | < 0,0001 | 340 (38) | 314 (35) | 0,097 | 8,5 |
| 2014 | 463 (29) | 471 (36) | 278 (31) | 340 (38) | |||
| 2015 | 368 (23) | 523 (40) | 278 (31) | 242 (27) | |||
| Tipo de SCA (SCACEST) | 639 (40) | 785 (60) | < 0,0001 | 744 (83) | 734 (82) | 0,678 | 5,7 |
| GRACE (puntuación) | 144 [120-174] | 139 [117-159] | 0,0005 | 139 [117-167] | 144 [123-165] | 0,861 | 2,5 |
| CRUSADE (puntuación) | 27 [16-41] | 20 (11-31] | 0,0001 | 24 [13-38] | 23 [12-32] | 0,107 | 0,9 |
| AclCr (ml/min/1,73 m2) | 79 [52-109] | 97 [71-122] | 0,0005 | 87 [62-114] | 93 [64-112] | 0,284 | 3,1 |
| FEVI (%) | 50 ± 10 | 51 ± 10 | 0,125 | 51 ± 9 | 52 ± 9 | 0,186 | 1,7 |
| Killip IV al ingreso | 32 (2) | 21 (1,6) | 0,396 | 12 (1,3) | 22 (2,5) | 0,176 | 0,8 |
| Killip ≥ II (durante ingreso) | 208 (13) | 105 (8) | < 0,0001 | 83 (9,3) | 72 (8) | 0,319 | 3,3 |
| Complicación mecánica | 16 (1) | 4 (0,4) | 0,055 | 12 (1,3) | 4 (0,4) | 0,204 | 2,2 |
| PCR | 149 (9,3) | 128 (8) | 0,279 | 116 (13) | 66 (11) | 0,153 | 2,5 |
| Inhibidores IIb-IIIa | 208 (13) | 235 (18) | < 0,0001 | 107 (12) | 134 (14) | 0,869 | 0,6 |
| Antagonista de la vitamina K | 64 (4) | 13 (1) | < 0,0001 | 13 (1,5) | 12 (1,4) | 0,890 | 1,1 |
| Estrategias de reperfusión | |||||||
| SCACEST (reperfusión) | |||||||
| ICP primaria | 1.007 (63) | 882 (76) | < 0,0001 | 717 (80) | 779 (87) | 0,05 | 8 |
| Fibrinolisis | 415 (26) | 157 (12) | 113 (19) | 98 (11) | 5 | ||
| No en fase aguda | 176 (11) | 39 (3) | 27 (3) | 9 (1) | 4,8 | ||
| Tiempo total isquemia (min)b | 300 [160-800] | 215 [130-480] | < 0,0001 | 255 [140-640] | 260 [140-688] | 0,908 | 3,4 |
| SCASEST | |||||||
| Coronariografía | 1.438 (90) | 1.243 (95) | < 0,0001 | 762 (85) | 690 (77) | 0,129 | 7,3 |
| ICP | 1.246 (78) | 944 (91) | < 0,0001 | 690 (77) | 708 (79) | 0,185 | 1,8 |
| Afección multivasoc | 591 (37) | 484 (37) | 0,989 | 314 (35) | 305 (34) | 0,876 | 2,3 |
| ICP durante ingreso | 1.422 (89) | 1256 (96) | < 0,0001 | 842 (94) | 857 (96) | 0,06 | 8,3 |
| Acceso vascular radial | 783 (49) | 798 (61) | < 0,0001 | 394 (44) | 528 (59) | 0,055 | 10 |
| Revascularización coronaria quirúrgica | 32 (2) | 5 (0,4) | < 0,0001 | 9 (1) | 5 (0,6) | 0,316 | 3 |
AclCr: aclaramiento de creatinina (Cockcroft-Gault); EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; NAA: nuevos antiagregantes; PCR: parada cardiorrespiratoria; SCA: síndrome coronario agudo; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico], expresado como percentil 25-percentil 75.
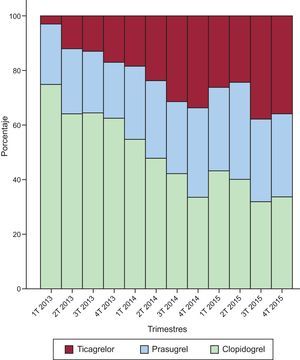
A lo largo del estudio, el uso de NAA se incrementó respecto al de clopidogrel de forma significativa (p < 0,001) —31% en 2013, 53% en 2014 y 63% en 2015—, sobre todo a costa de un incremento en el uso de ticagrelor a partir del año 2014 (figura 2).
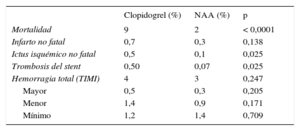
Eventos clínicosLos pacientes que recibieron NAA presentaron menores tasas crudas de mortalidad total (2 frente a 9%; p < 0,0001) (tabla 2). La tasa del resto de eventos trombóticos fue baja y se observó una reducción en la tasa de ictus isquémico (0,1 frente a 0,5%; p = 0,025) y trombosis del stent (0,07 frente a 0,5%; p = 0,025) a favor del grupo de NAA, sin evidenciarse diferencias en la tasa de infarto no fatal. Cuando se analizó la mortalidad con los NAA no se observaron diferencias significativas entre prasugrel y ticagrelor (1,8 frente a 1,4%; p = 0,701).
Eventos clínicos según grupos de tratamiento. Población total
| Clopidogrel (%) | NAA (%) | p | |
|---|---|---|---|
| Mortalidad | 9 | 2 | < 0,0001 |
| Infarto no fatal | 0,7 | 0,3 | 0,138 |
| Ictus isquémico no fatal | 0,5 | 0,1 | 0,025 |
| Trombosis del stent | 0,50 | 0,07 | 0,025 |
| Hemorragia total (TIMI) | 4 | 3 | 0,247 |
| Mayor | 0,5 | 0,3 | 0,205 |
| Menor | 1,4 | 0,9 | 0,171 |
| Mínimo | 1,2 | 1,4 | 0,709 |
NAA: nuevos antiagregantes; TIMI: Thrombolysis in Myocardial Infarction.
En cuanto al objetivo de seguridad, la tasa cruda de hemorragias totales y por grados de gravedad no difirió entre ambos grupos de tratamiento (tabla 2). De igual forma, tampoco se encontraron diferencias en la tasa de hemorragias entre prasugrel y ticagrelor (3,1 frente a 4,5%; p = 0,409).
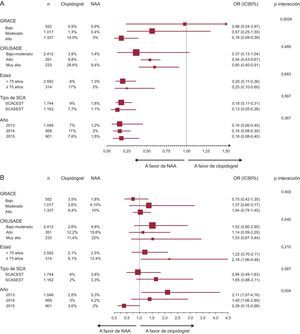
Al analizar la tasa de mortalidad por subgrupos, los resultados fueron acordes a los de la muestra global, aunque cabe destacar que los pacientes con mayor riesgo isquémico fueron los que obtuvieron mayor beneficio con los NAA (puntuación GRACE > 140: 3% frente a 14,5%; p interacción = 0,0026) (figura 3A, ). Además, esta tendencia se mantuvo en el grupo emparejado tras ajustar las diferencias en las características basales (). La reducción de la mortalidad con NAA también se evidenció incluso en los subgrupos de mayor riesgo hemorrágico (puntuación CRUSADE > 50: 9,4% frente a 29%; p = 0,047), aunque en este caso sin evidenciarse interacción (p = 0,485) (figura 3A, ). La reducción absoluta de la mortalidad en el grupo emparejado en quienes coincidió un alto riesgo isquémico y un alto o muy alto riesgo hemorrágico fue de un 12% a favor de NAA ().
Diagrama de árbol (forest plot) de eventos clínicos por subgrupos. A: mortalidad total. B: hemorragias totales. IC95%: intervalo de confianza del 95%; NAA: nuevos antiplaquetarios; OR: odds ratio; SCA: síndrome coronario agudo; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
Se constató una tendencia no significativa a presentar mayores tasas de hemorragia total con NAA en todos los subgrupos, especialmente en los mayores de 75 años, aunque sin mostrar interacción (figura 3B), que también se mantuvieron en la muestra emparejada por propensión.
Análisis ajustadoEl análisis de propensión permitió emparejar a 896 sujetos de cada grupo de tratamiento y ambos grupos estaban bien equilibrados en cuanto a diferencias estandarizadas (tabla 1). El análisis multivariado ajustado tras emparejamiento mostró una reducción significativa en la mortalidad total con los NAA frente a clopidogrel (OR = 0,37; IC95%, 0,13-0,60; p< 0,0001), con una tendencia no significativa en el grupo de NAA a presentar mayores tasas de hemorragia (OR = 1,07; IC95%, 0,18-2,37; p = 0,094), por lo que se deriva un beneficio clínico neto (tabla 3). El análisis mediante IPTW confirmó los mismos resultados en reducción de mortalidad con un incremento no significativo en las hemorragias totales con NAA (tabla 3). Ambos modelos predictivos mostraron excelentes poderes de discriminación y calibración. Cabe destacar que, tras realizar los 2 análisis ajustados, la reducción en la mortalidad con NAA se mantuvo; mientras que las menores tasas de hemorragia total con NAA observadas en la muestra no emparejada (OR = 0,80; IC95%, 0,54-1,20) se trasformaron en tendencias opuestas en la muestra emparejada por propensión (datos más plausibles dada la mayor potencia de los NAA), lo que refuerza la validez y robustez del ajuste del modelo.
Análisis multivariado de eficacia y seguridad
| Modelo no ajustadoa (n = 2.906) | Modelo ajustado Puntuación de propensión emparejadab (n = 1.792) | Modelo ajustado IPTWc (n = 2.565) | ||||
|---|---|---|---|---|---|---|
| NAA frente a clopidogrel | OR (IC95%) | p | ORa (IC95%) | p | ORa (IC95%) | p |
| Mortalidad | 0,27 (0,16-0,48) | < 0,0001 | 0,37 (0,13-0,60) | < 0,0001 | 0,59 (0,42-0,77) | < 0,0001 |
| Hemorragia total | 0,80 (0,54-1,20) | 0,287 | 1,07 (0,18-2,37) | 0,094 | 2,15 (0,12-3,73) | 0,758 |
AIT: accidente isquémico transitorio; antiP2Y12: inhibidores del receptor plaquetario P2Y12; EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza del 95%; IPTW: inverse probability of treatment weight; NAA: nuevos antiagregantes; OR: odds ratio; ORa: OR ajustada; SCACEST: síndrome coronario agudo con elevación del segmento ST.
Covariables incluidas en modelos de regresión: a) mortalidad: edad, sexo, diabetes, insuficiencia renal previa, ictus/AIT previo, infarto de miocardio previo, EPOC previa, enfermedad arterial periférica, tipo de reperfusión en SCACEST, tiempo total de isquemia, clase Killip, parada cardiaca, afección coronaria de 3 vasos/enfermedad de tronco y el tipo de antiP2Y12, y b) hemorragia: edad, sexo, historia de hemorragia, escala CRUSADE, uso de anti IIb/IIIa, vía de acceso arterial, peso corporal, historia de insuficiencia renal, ictus/AIT previo y el tipo de antiP2Y12.
Los resultados de este registro multicéntrico describen el uso contemporáneo de NAA en el mundo real y demuestran una incorporación progresiva aunque selectiva en la práctica diaria, que se traduce en un beneficio clínico neto frente a clopidogrel, consistente en una reducción significativa de la mortalidad intrahospitalaria sin un incremento significativo en las hemorragias durante el curso hospitalario. Los datos exploratorios no mostraron diferencias en cuanto a reducción de mortalidad y hemorragias entre prasugrel y ticagrelor.
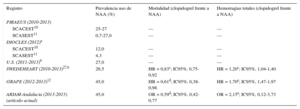
Estos datos ofrecen una tendencia esperanzadora en el uso de NAA frente a clopidogrel en España, ajustándose a las recomendaciones de las guías. Hasta la fecha, este estudio es el primero a nivel nacional que recoge datos multicéntricos recientes sobre el uso en pacientes del mundo real tanto de ticagrelor como de prasugrel. Los datos más actuales provienen de estudios observacionales muy diversos, en los que no siempre se incluyen ambos NAA3,4,6–13,27 (tabla 4). En este sentido cabe destacar la creciente utilización de ticagrelor en este estudio, sobre todo a partir de 2014, al igual que en otros trabajos5,7,8,12,13.
Comparativas registros observacionales con nuevos antiplaquetarios
| Registro | Prevalencia uso de NAA (%) | Mortalidad (clopidogrel frente a NAA) | Hemorragias totales (clopidogrel frente a NAA) |
|---|---|---|---|
| PIRAEUS (2010-2013) | |||
| SCACEST10 | 25-27 | — | — |
| SCASEST11 | 0,7-27,0 | — | — |
| DIOCLES (2012)a | |||
| SCACEST10 | 12,0 | — | — |
| SCASEST11 | 4,3 | — | — |
| U.S. (2011-2013)9 | 27,0 | — | — |
| SWEDEHEART (2010-2013)27,b | 26,5 | HR = 0,83c; IC95%, 0,75-0,92 | HR = 1,20c; IC95%, 1,04-1,40 |
| GRAPE (2012-2013)12 | 45,0 | HR = 0,61d; IC95%, 0,38-0,98 | HR = 1,70e; IC95%, 1,47-1,97 |
| ARIAM-Andalucía (2013-2015) (artículo actual) | 45,0 | OR = 0,59d; IC95%, 0,42-0,77 | OR = 2,15e; IC95%, 0,12-3,73 |
BARC: Bleeding Academic Research Consortium; GRAPE: GReek AntiPlatElet Registry; HR: hazard ratio; IPTW: inverse probability of treatment weight; NAA: nuevos antiagregantes; OR: odds ratio; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TIMI: Thrombolysis in Myocardial Infarction.
Entre los factores que podrían haber influido en el creciente uso de NAA, en este estudio se encuentra la implementación de protocolos de uso de NAA desde la atención extrahospitalaria dentro de la implantación del código infarto en SCA con elevación del segmento ST28. La explicación para la infrautilización de los NAA en el mundo real es variada y probablemente influyan aspectos más allá de la inercia clínica y las consideraciones económicas17, contribuyendo en buena medida la consideración del riesgo hemorrágico por encima del riesgo isquémico al usar antiplaquetarios más potentes. Enlazando con el potencial riesgo de hemorragia de los NAA, en la muestra se usaron preferentemente en población con un perfil de riesgo isquémico y hemorrágico más favorable (tabla 1). Esta tendencia también se ha evidenciado en la mayoría de los registros publicados del mundo real3–13; lo que se ha venido a denominar la paradoja riesgo-tratamiento, por la cual existe una tendencia a tratar a los pacientes de mayor riesgo con tratamientos menos agresivos y con menor beneficio clínico29,30 que, en el caso de los antiP2Y12, conduce a usar clopidogrel en los pacientes que presentan mayor comorbilidad en un intento de minimizar las hemorragias. En este estudio, al igual que se ha comunicado en otros registros del mundo real, la reducción en la tasa de eventos trombóticos (incluida la mortalidad) podría verse explicada por esta paradoja. Sin embargo tras realizar modelos de ajuste que incluían más de 20 variables de confusión, demostramos un descenso de mortalidad y eventos isquémicos con NAA frente al clopidogrel, en la misma línea de estudios recientes9,12 (tabla 4). Los resultados respecto a las tasas de hemorragia han sido más diversos y podrían justificarse, más que por la superioridad de un agente sobre el otro9,12, por las distintas definiciones de hemorragias usadas en cada trabajo; así como por las diferencias en las características basales de cada grupo de tratamiento (tabla 4). En este sentido, cabe destacar que la población del estudio fueron principalmente pacientes con SCA con elevación del segmento ST con un riesgo hemorrágico bajo (puntuación CRUSADE mediana, 23).
Existen aún pocos trabajos que evalúen el papel de ticagrelor en el mundo real, por ser el último NAA incorporado a la práctica clínica7–9,12,13,27. Destacan los resultados del registro SWEDEHEART, que comunica una reducción de eventos cardiacos mayores junto a un incremento en las tasas de hemorragia con ticagrelor respecto a clopidogrel, trasladando los resultados del ensayo PLATO a la práctica clínica diaria27. Como en el presente registro, los pacientes asignados a ticagrelor en el registro sueco tenían un menor riesgo isquémico y hemorrágico que el grupo de clopidogrel, pero en comparación con nuestros datos del grupo NAA, el grupo de ticagrelor sueco presentó un perfil de riesgo isquémico (puntuación GRACE mediana 99 frente a 139) y hemorrágico (riesgo CRUSADE alto o muy alto 10 frente al 13,2%) más favorable.
Recientemente, Matteau et al.31 han analizado en un subanálisis a nivel de paciente el equilibrio entre el riesgo isquémico y hemorrágico sobre datos de ensayos clínicos con stent farmacoactivos en un seguimiento de hasta 4 años. Demuestran que el riesgo isquémico y hemorrágico suelen superponerse. No obstante, el riesgo isquémico superaba al hemorrágico en el 97% de los sujetos estudiados; de igual forma que ocurrió en nuestro estudio, en el que un 46% de los sujetos presentaban riesgo GRACE alto (puntuación > 140) frente a un 17% de sujetos con riesgo de hemorragia CRUSADE alto o muy alto (puntuación > 40). Estas recientes evidencias unidas a los datos exploratorios del presente estudio —que muestran una mayor reducción de la mortalidad con NAA, sin aumentar las hemorragias graves en los grupos de mayor riesgo isquémico incluso hemorrágico ()— refuerzan aún más la necesidad de individualizar la asignación de antiP2Y12 y cuestionan el poder predictivo de las escalas de riesgo hemorrágico actuales, así como su utilidad para individualizar el tratamiento antiplaquetario en la práctica clínica; sobre todo en la población con mayor comorbilidad32.
El presente estudio demuestra la superioridad y la seguridad clínica de los NAA frente a clopidogrel en el mundo real; se muestra como una alternativa con beneficio clínico neto, en línea con los resultados de los ensayos pivotales, y refuerza la necesidad de unificar criterios y protocolos que ayuden a que los ya no tan “nuevos antiplaquetarios” se establezcan definitivamente en la práctica clínica diaria1,2,16.
LimitacionesEste trabajo presenta las limitaciones propias de los estudios observacionales basados en registros y en consecuencia los resultados no se deben interpretar como causales.
La muestra está extraída de unidades coronarias y recoge solo eventos intrahospitalarios no extendidos a los 12 meses de recibir un tratamiento de doble antiagregación recomendado en el contexto de un SCA, por lo que la extrapolación de resultados a otras poblaciones se debe realizar con cautela. Las diferentes características basales y de procedimientos entre los 2 grupos de tratamiento reflejan la práctica clínica diaria y, aunque se han realizado distintos tipos de ajuste, no se puede excluir la posible participación de variables de confusión no incluidas en los modelos de propensión, o no recogidas en el estudio, que pudieran influir en los resultados. Como en otros registros, la adjudicación de eventos no se realizó de forma centralizada ni ciega. No obstante, en el registro ARIAM-Andalucía los eventos se encuentran predefinidos y se someten a auditorias periódicas externas que aseguran la fiabilidad de su adjudicación. Los resultados en subgrupos se deben considerar solo como exploratorios. La asignación del antiplaquetario se realizó en el momento del alta hospitalaria, por lo que es posible que los cruces entre antiplaquetarios pudieran haber influido en los resultados finales. La naturaleza retrospectiva de este análisis, junto a la ausencia de una variable predefinida para el cruce entre antiplaquetarios, no permite estimar su influencia sobre los resultados. En este sentido, un registro multicéntrico prospectivo en marcha (registro CREA [CRuce Entre Antiplaquetarios] ClinicalTrials.gov: NCT02500290) se centrará en este aspecto de forma específica.
CONCLUSIONESLa incorporación de los NAA prasugrel y ticagrelor a la práctica clínica diaria se ha visto incrementada y se utilizan de manera selectiva en pacientes con menor riesgo isquémico y hemorrágico. Tanto prasugrel como ticagrelor se asocian a una reducción de mortalidad y eventos mayores sin incrementar de forma significativa las hemorragias frente a clopidogrel, trasladando los resultados de los ensayos clínicos pivotales al mundo real.
CONFLICTO DE INTERESESNinguno.
- –
Los antiplaquetarios de última generación prasugrel y ticagrelor se consideran de elección frente a clopidogrel en el tratamiento de los SCA.
- –
Su implantación en la práctica clínica diaria está siendo muy errática.
- –
Son escasos los datos del mundo real sobre su prevalencia de uso, así como de su efectividad y eficacia clínica en nuestro medio.
- –
Se ha evidenciado un incremento gradual en el uso tanto de prasugrel como de ticagrelor en la práctica diaria, principalmente en pacientes con un perfil clínico más favorable.
- –
Tanto prasugrel como ticagrelor se asociaron a una disminución de la mortalidad y de los eventos trombóticos, sin incrementar de forma significativa las hemorragias en comparación con clopidogrel.
- –
Los grupos de mayor riesgo isquémico presentaron un mayor beneficio clínico neto con los NAA.
- –
Los resultados refuerzan las recomendaciones de las guías basadas en resultados de ensayos clínicos y podrán servir para realizar una selección adecuada de los antiP2Y12 en la práctica diaria.
A todos los investigadores locales del registro ARIAM-Andalucía (