El interés por el potencial trombogénico de la orejuela izquierda (OI) se remonta a 1949, cuando Madden llevó a cabo la primera escisión quirúrgica de esta estructura anatómica1. Un conjunto creciente de publicaciones en la última mitad de siglo, junto con el desarrollo durante las 2 últimas décadas de estrategias percutáneas para el cierre de la OI han contribuido a un uso extendido de esta técnica para la prevención del ictus en pacientes con fibrilación auricular (FA) no valvular, en particular en aquellos con alto riesgo hemorrágico2. A pesar de las continuas mejoras en los resultados de las intervenciones fruto de una mayor experiencia de los operadores e innovaciones tecnológicas3, existen muy pocos datos sobre los resultados a largo plazo tras el cierre percutáneo de la OI4,5.
En un reciente artículo publicado en Revista Española de Cardiología, López-Mínguez et al.6 analizan los resultados a largo plazo del Registro Ibérico II en pacientes con contraindicación para la anticoagulación sometidos a cierre de OI. El estudio incluyó 167 pacientes del Registro Ibérico I7 y otros 431 pacientes incluidos posteriormente, con una población final a estudio de 598 pacientes (mediana de edad: 75 años, mediana de la escala CHA2DS2-VASc: 4, mediana de la escala HAS-BLED: 3). De estos, 487 (81%) se sometieron a cierre de OI con el dispositivo Amplatzer Cardiac Plug/Amulet (Abbott Vascular, Santa Clara, CA, Estados Unidos) y 111 (19%) recibieron el dispositivo WATCHMAN (Boston Scientific, Natick, MA, Estados Unidos). Las tasas de éxito de cierre de OI y de complicaciones mayores fueron del 95,8 y del 5,0%, respectivamente. Tras un seguimiento medio de ∼2 años, las tasas de muerte, ictus isquémico y hemorragia grave fueron de 7,0, 1,6 y 3,9% pacientes-año, respectivamente; lo que representó una reducción del 81% y del 39% con respecto a la incidencia esperada de ictus isquémico y hemorragia grave, según las escalas de riesgo tromboembólico y hemorrágico, respectivamente. Cabe destacar que 29% de los pacientes tuvieron seguimiento a muy largo plazo (> 2 años, media de ∼ 4 años), con resultados similares respecto a la reducción de ictus, aunque con una reducción considerablemente mayor (de hasta ∼ el 60%) de los eventos hemorrágicos graves. La incidencia de trombosis asociada a dispositivo evaluada por ecocardiografía transesofágica (ETE) durante los 6 meses posteriores a la intervención, fue del 4,7%, asociándose a un mayor riesgo de ictus durante el seguimiento. La edad, la hemorragia intracraneal y el ictus se asociaron con una mayor mortalidad durante el seguimiento.
La naturaleza prospectiva y de «vida real» de este amplio registro, con un seguimiento medio de ∼4 años en más de una cuarta parte de los pacientes, representa sin lugar a dudas la principal fortaleza del trabajo de López-Mínguez. Sin embargo, existen algunas limitaciones que merecen ser mencionadas. En primer lugar, aunque los estudios observacionales multicéntricos en la práctica cotidiana se hallan generalmente sujetos a variabilidad entre centros, se desconoce el número y periodicidad de visitas durante el seguimiento, así como el porcentaje de datos perdidos o las pérdidas de seguimiento. Segundo, se carece de información detallada sobre el tratamiento antitrombótico posterior a la intervención, asumiéndose doble antiagregación durante 3 a 6 meses en todos los pacientes seguido de ácido acetilsalicílico durante un 6 a 12 meses. No obstante, los mismos autores informaron de que> 10% de los pacientes incluidos en el Registro Ibérico I habían recibido un tratamiento antitrombótico distinto de la doble antiagregación (lo que representó el 28% de los pacientes incluidos en el presente estudio). Tercero, aunque se describe un riguroso (a la vez que admirable) seguimiento por imagen durante los 6 meses poscierre de OI, una vigilancia mediante ETE del 100% es poco probable y no se especificó el porcentaje real de pacientes a los que se practicó un ETE en los meses posteriores a la intervención. Además, no se documentaron las fugas residuales y no pudo realizarse una evaluación centralizada de las imágenes de ETE. Por último, la ausencia de monitorización y adjudicación independiente de eventos, si bien representan limitaciones inherentes a este tipo de registros, pueden conllevar una infraestimación de la incidencia real de los eventos clínicos.
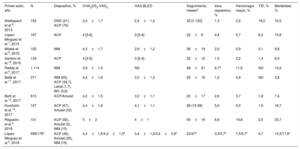
Varios estudios han evaluado la seguridad y eficacia a largo plazo de los dispositivos de cierre de OI más comúnmente utilizados (tabla 1)4–13. Sin embargo, los estudios con más de 4 o 5 años de seguimiento han sido muy escasos4,5. La mortalidad a largo plazo tras el cierre de OI ha oscilado entre el 3,8% y el 33,7%, con una amplia variabilidad en función de la duración del seguimiento (entre 20 y 50 meses)4–13. La mayoría de los pacientes que se someten actualmente a cierre de OI son de edad avanzada, con contraindicación a los anticoagulantes y múltiples comorbilidades, estando por ello expuestos a un alto riesgo de mortalidad. La mortalidad global observada en el Registro Ibérico II es ligeramente superior a la observada en la mayor parte de los estudios observacionales con un seguimiento similar4,7–12, pero inferior a la proporcionada por Korsholm et al.13 y Regueiro et al.5. Es preciso mencionar que el trabajo de Regueiro incluyó a la población con mayor perfil de riesgo y seguimiento (hasta 8 años) hasta la fecha5, lo que explicaría en parte estas diferencias. Sin embargo, se requieren estudios que incluyan mayor número de pacientes para evaluar adecuadamente los factores de riesgo asociados con una mayor mortalidad tras el cierre de OI e identificar a los pacientes a los que un tratamiento preventivo como el cierre de OI pueda resultar fútil.
Estudios sobre el seguimiento a largo plazo tras el cierre percutáneo de orejuela izquierda
| Primer autor, año | N | Dispositivo, % | CHA2DS2-VASC | HAS-BLED | Seguimiento, mesesa | Ictus isquémico, % | Hemorragia mayor, % | TID, % | Mortalidad, % |
|---|---|---|---|---|---|---|---|---|---|
| Nietlispach et al.8, 2013 | 152 | DND (21), ACP (79) | 3,4±1,7 | 2,4±1,2 | 32 [1-120] | 1,3 | 2,6 | 16,0 | 10,5 |
| López-Mínguez et al.7, 2015 | 167 | ACP | 4 [3-6] | 3 [3-4] | 22±8 | 4,4 | 5,7 | 8,2 | 10,8 |
| Wiebe et al.9, 2015 | 102 | WM | 4,3±1,7 | 2,9±1,2 | 36±19 | 2,0 | 5,9 | 2,1 | 9,8 |
| Santoro et al.10, 2016 | 134 | ACP | 4 [3-5] | 3 [2-4] | 22±12 | 1,5 | 2,2 | 1,4 | 6,0 |
| Reddy et al.4, 2017 | 1.114 | WM | 3,9±1,5 | ND | 48±21 | 6,1b | 11,6 | ND | 14,5 |
| Betts et al.11, 2017 | 371 | WM (63), ACP (34,7), Lariat (1,7), WC (0,6) | 4,2±1,6 | 3,3±1,2 | 25±16 | 1,2 | 0,9 | ND | 3,8 |
| Berti et al.12, 2017 | 613 | ACP/Amulet | 4,2±1,5 | 3,2±1,1 | 20±17 | 2,6 | 3,7 | 1,8 | 7,4 |
| Korsholm et al.13, 2017 | 107 | ACP (67), Amulet (33) | 4,4±1,6 | 4,1±1,1 | 28 (19-38) | 5,6 | 9,3 | 1,9 | 18,7 |
| Regueiro et al.5, 2018 | 101 | ACP (82), Amulet (3), WM (15) | 5±2 | 4±1 | 50±16 | 6,9 | 19,8 | 2,5 | 33,7 |
| López-Mínguez et al.6, 2018 | 598/176c | ACP (46), Amulet (35), WM (19) | 4,4±1,5/4,3±1,5c | 3,4±1,2/3,4±0,9c | 23/47c | 3,0/5,7c | 7,5/9,7c | 4,7 | 13,3/17,6c |
ACP, Amplatzer Cardiac Plug; CHA2DS2-VASc, insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, antecedentes de ictus, enfermedad vascular, sexo; TAD, trombosis asociada al dispositivo; HAS-BLED, hipertensión, función hepática/renal alterada, antecedentes de ictus, antecedentes de hemorragia o predisposición a la misma, INR lábil, edad avanzada, fármacos/alcohol de manera concomitante); ND, no disponible; DND, dispositivos no dedicados; WC, WaveCrest; WM, WATCHMAN.
Uno de los hallazgos más notables del Registro Ibérico II fue el beneficio sostenido en la prevención tromboembólica (comparado con el riesgo estimado según las puntuaciones de riesgo tromboembólico de cohortes históricas), que constituye la razón de ser del cierre de OI. La baja incidencia de ictus observada en este registro se compara favorablemente con la observada en la mayor parte de estudios previos4,5,7,12,13. Asimismo, la incidencia anual de ictus del 1,5% (incidencia acumulada, 5,7%) en el subgrupo de pacientes con más de 2 años de seguimiento fue similar a la observada en el análisis combinado a 5 años de los estudios PROTECT AF (Left Atrial Appendage System for Embolic Protection in Patients With Atrial Fibrillation) y PREVAIL (Prospective Randomized Evaluation of the WATCHMAN LAAC Device in Patients With AF Versus Long-Term Warfarin Therapy)4 y en el trabajo de Regueiro, también con un seguimiento medio de ∼ 4 años5. El estudio en curso ASAP-TOO (NCT02928497) aleatorizará a unos 900 pacientes con FA no valvular no aptos para la anticoagulación, a cierre de OI con el dispositivo WATCHMAN o a tratamiento médico (antiagregación simple o nada) en un diseño 2:1, y proporcionará evidencia definitiva sobre la eficacia a largo plazo del cierre de OI en esta población.
La tasa de hemorragia mayor fue del 7,5% en el conjunto de la población, frente a 9,7% en aquellos pacientes con un seguimiento> 2 años (incidencia anual de sangrado del 3,9 y el 2,6%, respectivamente), con una clara tendencia a la reducción de los episodios hemorrágicos en aquellos pacientes con un seguimiento más largo. No obstante, esto representa una incidencia mucho mayor que la del ictus isquémico, y la mayor parte de sangrados son de origen gastrointestinal. Cabe destacar que la incidencia de hemorragia intracraneal a los 2 años del cierre de OI fue similar a la esperada según las escalas de riesgo hemorrágico (0,8 frente a 0,9 por 100 pacientes-año, respectivamente), lo que sugiere un posible efecto deletéreo de la doble antiagregación administrada en los meses posteriores a la intervención. De hecho, la hemorragia intracraneal se asoció con una mayor mortalidad durante el seguimiento. La incidencia de eventos hemorrágicos observada entre los pacientes con un seguimiento medio de 4 años fue similar a la observada en el análisis a 5 años de los estudios PROTECT AF y PREVAIL, si bien dichos estudios incluyeron a una población de menor riesgo (apta para la anticoagulación). La reducción progresiva del riesgo hemorrágico a lo largo del tiempo observada en el Registro Ibérico II es de gran importancia, particularmente si se considera el alto perfil de riesgo de la población a estudio (mediana de la escala HAS-BLED de 3, con un 70% de los pacientes con antecedentes de hemorragia), lo que sugiere que el incremento del riesgo de complicaciones hemorrágicas precoces podría estar en parte en relación con el tratamiento antiagregante recibido tras el cierre de OI. Se precisan más estudios aleatorizados para esclarecer cuál es el tratamiento antitrombótico óptimo para reducir el riesgo isquémico sin aumentar significativamente el riesgo de hemorragia tras el cierre de OI.
La trombosis asociada al dispositivo de cierre de OI sigue siendo una preocupación mayor, con incidencias que varían entre el 1 y el 17%3. La incidencia de trombosis de dispositivo en el estudio de López-Mínguez et al.6 fue del 4,7%, según evaluación mediante ETE entre 3 y 6 meses tras el implante, siendo más frecuente con el dispositivo Amplatzer Cardiac Plug (7,6%) que con los dispositivos Amulet (2,4%) o WATCHMAN (0,9%). Estos hallazgos concuerdan con observaciones anteriores que sugieren mayores tasas de trombosis con el dispositivo Amplatzer Cardiac Plug debido a una mayor trombogenicidad de su tornillo proximal más prominente14. No obstante, lo contrario fue observado en un registro reciente que mostró una incidencia de trombosis mucho mayor en aquellos pacientes tratados con el dispositivo Amulet15. Hay que destacar que la trombosis asociada al dispositivo se asoció con un mayor riesgo de ictus isquémico durante el seguimiento (11,1 y frente a 2,6%; p=0,041), resultados similares a los obtenidos en dos recientes estudios a gran escala15,16. No obstante, en el trabajo de López-Mínguez et al. no se especificó el tratamiento antitrombótico en el momento de la trombosis de dispositivo, y la heterogeneidad en el seguimiento mediante ETE tras la intervención junto con la ausencia de una adjudicación independiente para las trombosis atenúa parcialmente el valor de dichas observaciones. Así, mientras que hay varios estudios evaluando el tratamiento antitrombótico óptimo tras el cierre de OI, son precisos estudios prospectivos que evalúen la asociación entre la trombosis asociada a dispositivo y el ictus posterior, así como la eficacia y la duración de la anticoagulación oral para la resolución de dichas trombosis.
El objetivo final del cierre de OI en pacientes con FA no valvular no aptos para el tratamiento anticoagulante es prevenir las complicaciones tromboembólicas, minimizando al mismo tiempo el riesgo hemorrágico. Los resultados presentados por López-Mínguez et al. añaden información valiosa en relación con la eficacia y seguridad del cierre de OI a largo plazo, a la evidencia previamente disponible en pacientes del mundo real. No obstante, hacen falta nuevos estudios con mayor número de pacientes y seguimientos más largos, además de estudios aleatorizados comparando los distintos dispositivos comercializados y emergentes, así como una mejor comprensión del impacto clínico a largo plazo de la trombosis asociada a dispositivo y de las fugas residuales. También será importante obtener datos basados en la evidencia en relación al tratamiento antitrombótico posterior al cierre de OI. Por último, los resultados de los estudios en marcha proporcionarán en los próximos años una respuesta definitiva sobre el papel del cierre de OI como alternativa no farmacológica para la prevención tromboembólica en pacientes de alto riesgo.
CONFLICTO DE INTERESESJ. Rodés-Cabau ha recibido subvenciones institucionales para proyectos de investigación de Boston Scientific. L. Asmarats no ha notificado ningún posible conflicto de interés con respecto al contenido de este artículo.
L. Asmarats contó con una subvención de la Fundación Alfonso Martín Escudero, Madrid, España. J. Rodés-Cabau ocupa la cátedra de investigación canadiense Fondation Famille Jacques Larivière para el desarrollo de intervenciones para cardiopatías estructurales.