La resonancia magnética se ha erigido en la técnica de elección para el diagnóstico y manejo de múltiples enfermedades. En el campo cardiaco permite alcanzar una precisión muy alta en la cuantificación y la caracterización tisular gracias a su elevada resolución espacial y temporal a la vez que permite una muy buena caracterización tisular. Por ello, su aplicación a la investigación traslacional resulta clave en la valoración de muchos de los resultados. En este original se revisan las aplicaciones de la técnica en distintos modelos animales, desde los más pequeños hasta el más empleado en la investigación cardiovascular traslacional, el porcino. Se analizan los distintos medios de contraste empleados y se sistematizan los estudios cardiacos para la obtención de los mejores resultados anatómicos y funcionales.
Palabras clave
La resonancia magnética cardiaca (RMC) es la técnica de primera elección para el estudio de muchos procesos morbosos1, dado que tiene una elevada resolución espacial y una adecuada resolución temporal y además permite una caracterización tisular inalcanzable por otras técnicas1,2. Gracias a estas características la RMC se ha convertido en el estándar de referencia para evaluar la anatomía y la función cardiaca al tratarse de la técnica más exacta y reproducible3.
Para conseguir que la RMC sea el estándar de referencia, han sido fundamentales todos los estudios con modelos animales, y actualmente la resonancia magnética (RM) es una técnica indispensable en la investigación cardiovascular con estos modelos.
Los campos de investigación en modelos animales sobre RM son muy extensos e iremos describiéndolos más adelante en función de las principales especies usadas que, fundamentalmente, son la rata (distintas especies del genero Rattus), el hurón (Mustela putoriuos furo), el perro (Canis lupus familiaris) y, por supuesto, el cerdo (Sus scrofa domestica).
Historia de la Resonancia Magnética Cardiaca en MamíferosEn pequeños animalesUno de los modelos animales fundamentales en RMC ha sido la rata. En 1971, Damadian consiguió la primera imagen por resonancia magnética (IRM) de un ser vivo (rata). La primera descripción anatómica del corazón de la rata mediante RM fue en 1986, cuando llegaron a evidenciar incluso las arterias coronarias4. Tan solo 3 años después se describió la técnica de visualización del infarto de miocardio mediante la aplicación de medios de contraste específicos, derivados del gadolinio5.
El modelo animal de rata hoy se usa en el desarrollo y el estudio de distintos medios de contraste en isquemia miocárdica, el desarrollo y la validación de nuevos métodos de cuantificación de RMC automáticos y el desarrollo de terapias celulares. Hay que tener en cuenta que se ha demostrado una muy buena correlación entre el tamaño del área de realce tardío y el área de infarto en histología6 al validar los estudios de realce tardío para los estudios por RMC en resonancias desde 0,2 hasta 7 T7.
También se han validado los sistemas de cuantificación funcional del corazón demostrando que los sistemas manuales son más exactos, aunque tienden a sobrestimar la fracción de eyección en corazones infartados. Los sistemas semiautomáticos son un 70% más rápidos que los manuales, pero tienden a subestimar la fracción de eyección en corazones sanos. Las diferencias encontradas entre ambos métodos son similares a las diferencias intraobservador e interobservador, y ninguna de estas diferencias es significativa8. Las últimas publicaciones sobre RMC en ratas están orientadas a pruebas de eficacia de terapias celulares en el tratamiento del infarto de miocardio.
En el modelo animal de hurón, los principales estudios se han basado en investigar la actividad y la seguridad del medio de contraste gadolinio con ácido dietilentriaminopentaacético (Gd-DTPA-BMA); en esta especie, vieron que la administración del contraste no causaba alteraciones hemodinámicas9.
El modelo animal canino ha tenido una especial importancia en estudios cardiovasculares, ya que durante varios años fue un modelo animal casi ideal, pero las implicaciones éticas y morales de la experimentación en caninos y la alta capacidad de revascularización de las zonas infartadas han conseguido que se utilicen cada vez menos.
Los avances realizados con este modelo canino han sido muy importantes; se demostró que los tiempos de relajación espín-espín (T2) en la zona infartada son significativamente diferentes de los del miocardio sano10, los daños miocárdicos se pueden visualizar 30 min después de la lesión11 y el área isquémica tiene una intensidad de señal un 66% mayor que en el miocardio sano en potenciaciones T212.
También se hicieron los primeros estudios sobre mediciones de volumen del ventrículo izquierdo (VI)13. Se demostró que la RMC es muy precisa para medir la masa del VI en corazones infartados14 y se aplicaron las secuencias de enrejado (tagging) para la cuantificación de la funcionalidad regional del VI en corazones infartados15.
En cánidos se probaron por primera vez los efectos de los contrastes derivados del óxido de hierro y su eficacia en primer paso para evaluar el flujo sanguíneo miocárdico y los defectos de la perfusión miocárdica16. Actualmente se evalúa en perros y cerdos la seguridad de los implantes electrónicos internos17.
El cerdo como modelo animal en RMCEstá claro que, si existe un modelo animal importante en investigación preclínica cardiovascular, es el porcino, dadas sus similitudes anatómicas y fisiológicas. Por ello es también un modelo fundamental en el estudio de los protocolos de RMC, que empezó ya en 198318, cuando se demostró la posibilidad de visualizar el corazón porcino y se indicó la utilidad de la RM para evaluar la anatomía y la función cardiacas18; en 1991 se demostró que con RMC se evalúa la anatomía cardiaca y se proponen protocolos semiautomáticos de cuantificación ventricular partiendo de ejes cortos cardiacos19, técnica que después se generalizaría como método de cuantificación. También se determinó que la mejor manera de cuantificar la masa de VI es realizando mediciones en eje corto, pero correlacionándolos con un eje largo para identificar estas dos regiones y realizando pequeñas correcciones manuales a la selección automática de bordes20, que es el sistema usado hoy.
En 2001 se demostró que la RMC es válida para evaluar los volúmenes ventriculares en cortes de eje corto y que no hay variabilidad intraobservador ni interobservador (alta reproducibilidad)21. Con la mejora en secuencias de RMC y los avances en nuevos sistemas de detección automática de bordes, se consigue bajar el tiempo de posproceso a una sexta parte y se ha demostrado que no existen diferencias significativas entre la cuantificación manual, la semiautomática y la automática22.
En 2008 se vio que la precisión de los medios automáticos para detección de músculos papilares es muy alta y que las mediciones más precisas de masa de VI se obtienen cuando se incluyen los músculos papilares dentro de la masa ventricular; en cambio, las mediciones de volúmenes son más exactas cuando no se incluyen los músculos papilares dentro de la masa ventricular23.
La RMC puede identificar las arterias coronarias y evaluar su composición histológica con buena correlación histológica24. También se ha demostrado que la RMC es válida para la caracterización no invasiva de la placa aterosclerótica y evaluar su composición24–26. En 2005 se demostró que la evaluación por RM tiene una precisión similar a la angiografía cuando se evalúan estenosis localizadas27.
Hay que tener en cuenta que el modelo animal porcino se ha utilizado, en los últimos 10 años, para la evaluación de la seguridad de distintos dispositivos e implantes a la hora de realizar estudios de resonancia, o de utilizar la RM para realizar cateterismos. Se ha demostrado que los stents metálicos no se ven afectados por la RM, no se produce desplazamiento (en 1,5 T) y el artefacto metálico que producen es variable en función del material28,29. También se ha evaluado la seguridad de los dispositivos de cierre de defectos septales auriculares30–32, las válvulas percutáneas33, agujas transeptales34, catéteres y guías29,35–37, y se ha demostrado su fiabilidad y su seguridad dentro de un campo magnético.
Como ya se ha mencionado sobre el modelo animal canino, en el porcino también se evaluó la seguridad de dispositivos como marcapasos y desfibriladores internos17 o externos38.
Uno de los temas sobre los que más se ha investigado en los últimos 10 años es los cateterismos guiados por RM. La verdadera importancia de los cateterismos por RM consiste no solo en la posibilidad de realizarlos sin necesidad de exponer al paciente y el equipo sanitario a radiaciones ionizantes, sino en la posibilidad de evaluar el efecto del tratamiento instantáneamente, por ejemplo con mediciones de flujo dentro del stent, mediciones de perfusión o evaluación de la lesión creada en los procedimientos de ablación por radiofrecuencia.
Para realizar los cateterismos, se han utilizado métodos muy diferentes; en principio se utilizaron guías y catéteres convencionales para realizar el cateterismo, y se utilizaba el artefacto que estos causan en la IRM para asegurar su correcta posición. Posteriormente se desarrollaron catéteres compatibles con RM que se puede visualizar directamente en la IRM y se utilizan de forma similar a los catéteres convencionales. Los últimos avances en este campo consisten en el diseño de guías y catéteres específicos con pequeñas antenas de RM, que permiten no solo visualizarlos y posicionarlos mejor, sino también la posibilidad de realizar imágenes desde ellos evaluando estructuras cercanas, de un modo similar a la ultrasonografía intravascular (IVUS).
Utilizando cateterismo guiado únicamente por RM, se consiguió posicionar varios stents coronarios utilizando únicamente secuencia de RM en tiempo real29. Posteriormente se utilizó la RM para posicionar un catéter de inyección percutánea con secuencias en tiempo real y un muy buen posicionamiento en los lugares deseados35, al igual que para el posicionamiento de catéteres de ablación por radiofrecuencia39, dispositivos de cierre percutáneo de defectos septales auriculares30–32 y válvulas percutáneas por vía intravascular33. En 2010 se describió la utilidad de realizar valvuloplastias utilizando como referencia únicamente secuencias de RM, posicionando correctamente un marcapasos externo en el ventrículo derecho y el balón en la válvula y comprobando la estabilidad de esta durante el procedimiento de valvuloplastia38.
También se ha utilizado este modelo para evaluar la seguridad y la utilidad de los medios de contraste. Desde el principio, en la investigación se ha tenido mucho interés en conseguir identificar las zonas de infarto; para ello ya se evaluaron los efectos de medios de contraste derivados del gadolinio (Gd-DTPA) en el miocardio sano, y en 1988 ya se describía la captación de contraste por el miocardio sano y que la señal de este aumentaba durante unos 50 min40.
Wikström et al41,42 realizaron en 1992 el primer estudio de contraste en animales infartados; compararon dos medios de contraste basados en gadolinio y disprosio, y observaron que con ambos medios de contraste se puede identificar el área infartada, pero que la mejor manera de realzar el infarto es utilizando ambos medios de contraste a la vez.
Otra parte de la investigación de contrastes fue intentar el seguimiento in vivo de las terapias celulares y su distribución. Con este fin se desarrollaron medios de contraste a base de óxido de hierro, y en 2003 se publicaron los primeros estudios sobre la eficacia de la RMC para el seguimiento fiable de células marcadas con óxido de hierro43,44.
Lo más novedoso en medios de contraste en RMC son los contrastes específicos. Entre estos se incluyen los medios de contraste puramente intravasculares y los selectivos de tejidos. Uno de los medios de contraste más interesantes en RMC es el BMS-753951, un medio de contraste específico de elastina que permite evaluar la composición de las paredes vasculares. Se ha demostrado que permite detectar y cuantificar el remodelado de la pared de los vasos coronarios en pacientes con sospecha de enfermedad coronaria45.
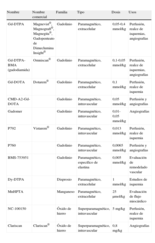
Medios de Contraste en Resonancia Magnética CardiacaLos medios de contraste en RMC son una parte fundamental para el estudio de diferentes procesos patológicos. Existen múltiples clasificaciones, pero en este apartado los vamos a clasificar en función de su composición, ya que la mayoría son derivados o familias a partir de un componente base, y por ello presentan similares características bioquímicas. Según este criterio, los medios de contraste se clasifican básicamente en paramagnéticos (basados en gadolinio y manganeso) y superparamagnéticos (basados en óxido de hierro).
Los medios paramagnéticos producen hiperintensidad en imágenes potenciadas en T1, pero a altas concentraciones se produce hipointensidad de la señal en potenciaciones T2*. En cambio, los superparamagnéticos causan hipointensidad en potenciaciones T2 y DP, pero a altas concentraciones producen hiperintensidad en T1.
En la tabla 1 se puede ver las especificaciones de cada uno de los medios de contraste utilizados en modelos animales para estudios de RMC, nombre comercial, dosis, familia a la que pertenecen o de la que derivan, tipo de contraste y sus principales usos. Los medios de contraste más utilizados en RMC son los paramagnéticos extracelulares, ya que permiten realizar diferentes tipos de estudios, y el más utilizado de ellos es el Gd-DTPA, en una primera administración para determinar la perfusión miocárdica y después realizar las imágenes de realce tardío evaluando la marcación que produce en el área de infarto, aunque también se puede utilizar para estudios de primer paso46.
Medios de contraste para resonancia magnética.
| Nombre | Nombre comercial | Familia | Tipo | Dosis | Usos |
| Gd-DTPA | Magnevist®, Magnograft®, Magnegita®, Gadopenteato de Dimeclumina Insight® | Gadolinio | Paramagnético, extracelular | 0,05-0,4mmol/kg | Perfusión, realce de isquemias, angiografías |
| Gd-DTPA-BMA (gadodiamida) | Omniscan® | Gadolinio | Paramagnético, extracelular | 0,1-0,05mmol/kg | Perfusión, realce de isquemias, angiografías |
| Gd-DOTA | Dotarem® | Gadolinio | Paramagnético, extracelular | 0,1mmol/kg | Perfusión, realce de isquemia |
| CMD-A2-Gd-DOTA | Gadolinio | Paramagnético, intravascular | 0,05mmol/kg | Perfusión y angiografías | |
| Gadomer | Gadolinio | Paramagnético, intravascular | 0,01-0,05mmol/kg | Angiografías | |
| P792 | Vistarem® | Gadolinio | Paramagnético, intravascular | 0,013mmol/kg | Perfusión, realce de isquemia |
| P760 | Gadolinio | Paramagnético, intravascular | 0,0065mmol/kg | Perfusión y angiografías | |
| BMS-753951 | Gadolinio | Paramagnético, específico de elastina | 0,005mmol/kg | Evaluación de remodelado vascular | |
| Dy-DTPA | Disprosio | Paramagnético, extracelular | 1mmol/kg | Estudios de isquemia | |
| MnHPTA | Manganeso | Paramagnético, extracelular | 25 μmol/kg | Evaluación de flujo miocárdico | |
| NC-100150 | Óxido de hierro | Superparamagnético, intravascular | 5mg/kg | Perfusión, realce de isquemia | |
| Clariscan | Clariscan® | Óxido de hierro | Superparamagnético, intravascular | 0,8mg/kg | Angiografías |
Este medio de contraste en potenciaciones T1 da un aumento de señal del miocardio infartado y más aún en la periferia del infarto41. Está demostrado que este medio se acumula 5 veces más en miocardio isquémico que en miocardio sano47, captación que se produce en unos 10 min tras la administración y se prolonga hasta 2 h en zonas de infarto reperfundidas48, pero puede tardar hasta 1 h en realzar el miocardio isquémico no reperfundido49.
En cuanto a la precisión del Gd-DTPA para cuantificación de áreas infartadas, se ha demostrado que es totalmente válido en comparación con histología, aunque tiende a producir una sobrestimación del área infartada50,51. En un principio se pensó que esta sobrestimación se debía a la posibilidad de captación de contraste por la zona de edema alrededor del infarto, pero Li et al52 determinaron en 2005 que el área de edema miocárdico presenta similares concentraciones de contraste que el miocardio sano, con lo que se descartó el edema como contribuyente a esta sobrestimación.
Los demás medios de contraste derivados del gadolinio con comportamiento extracelular presentan unas características muy similares al Gd-DTPA. En cambio, los de carácter intravascular presentan características específicas.
P760, CMD-A2-Gd-DOTA, gadomer y todos los derivados de óxidos de hierro (NC100150 y Clariscan) son medios de contraste intravasculares que tienen escasa distribución al espacio intersticial, con lo que perduran en el torrente sanguíneo y son ideales para realizar angiografías y secuencias de perfusión miocárdica53–57. Con ellos se puede determinar el área isquémica que no muestra perfusión sanguínea, pero, por contra, no causan el efecto de realce tardío, con lo que mediante esta técnica no se puede cuantificar la escara ni evaluar los infartos reperfundidos.
Existe un medio de contraste derivado del gadolinio, el P792, con características intermedias entre extracelular e intravascular. Este medio de contraste permanece en el espacio intravascular durante unos 30 min, tiempo suficiente para realizar estudios angiográficos y secuencias de perfusión (con buena correlación con la histomorfometría58), pero que también produce realce tardío de la zona isquémica, y se ha demostrado que no tiene diferencias significativas con las mediciones con Gd-DTPA o la histología59,60.
Los medios de contraste derivados de disprosio en potenciaciones T2 producen una disminución de la señal del miocardio sano, pero no del infartado, aunque la concentración de medio de contraste es 3 veces mayor en la zona del infarto que en el miocardio sano41,61. Esto se debe a la rotura de la membrana celular de los cardiomiocitos en la zona del infarto, que resulta en una distribución homogénea del medio de contraste intracelular y extracelular62. La falta de pérdida de señal en la zona del infarto, aunque hay más medio de contraste, indica ausencia de susceptibilidad del infarto a los efectos del medio de contraste63.
Existen varios estudios que defienden la adición de un medio de contraste extracelular como el Gd-DTPA junto con un derivado del disprosio para mejorar la visualización en potenciaciones T2 del área infartada, aunque no mejora la señal en potenciaciones T1 respecto a Gd-DTPA solo o disprosio solo41,61,62,64.
Realización de Estudios de Resonancia Magnética Cardiaca en el Modelo Animal PorcinoPara la realización de un estudio de RMC en el modelo animal porcino, es necesario anestesiar al animal. El protocolo anestésico que se utilice va a variar los valores de funcionalidad cardiaca y la forma de realizar la RMC. Lo ideal es utilizar un mantenimiento anestésico inhalatorio para poder realizar apneas espiratorias durante las series.
La segunda parte necesaria para la correcta realización de un estudio de RMC es obtener una buena sincronización cardiaca, ya que las imágenes convencionales de RM se forman por un número de repeticiones de una secuencia en un órgano inmóvil; en el caso de un órgano móvil como el corazón, estas secuencias requieren la sincronización entre la obtención de la imagen y el movimiento del órgano65.
Existen muchos métodos distintos para realizar la sincronización cardiaca, como el pletismograma o los detectores de pulso carotídeo, pero el más utilizado es el electrocardiograma (ECG), dado que hay relación directa entre las actividades eléctrica y mecánica del corazón65.
Los electrodos de ECG se deben colocar cuidadosamente para obtener intervalos QRS amplios con ondas R picudas y ondas T de baja amplitud, ya que la adquisición de las imágenes de RMC se basa en la correcta identificación de las ondas R (trigger)66. El campo magnético puede producir artefactos en el ECG, y para evitarlos se ha desarrollado un sistema que modifica el ECG y consiste en medir los vectores eléctricos cardiacos representándolos en un vectocardiograma (VCG)67.
Debido a que la señal que se origina en el corazón es débil, además de la correcta colocación de los electrodos, hay que rasurar la zona y secarla convenientemente absteniéndose de utilizar alcohol, ya que este elimina electrolitos de la piel y eso reduce la conductividad de los impulsos67. En este modelo animal, la posición de los electrodos que permite obtener el mejor registro ECG es la lineal paramedial izquierda, colocando el electrodo caudal en el espacio entre la apófisis xifoides y la última costilla y los otros tres electrodos siguiendo una línea paraesternal izquierda, alternando en los espacios intercostales anteriores.
La comprobación de la señal de ECG se debe realizar tanto fuera como dentro del imán, ya que en esta última posición la señal puede sufrir modificaciones por la interacción entre el campo magnético y los fluidos en movimiento que causa el llamado artefacto hidroparamagnético. Este artefacto, sobre todo, crea un pico de ECG periódico que se repite después de la onda T y suele ser más bajo pero más ancho que R y de la misma polaridad, lo que puede inducir confusión con la onda R y crear un fallo en la sincronización del ECG2,67. Para solventar este problema del efecto hidroparamagnético, se introduce al paciente en el equipo con los pies por delante, con lo que el artefacto del ECG se invierte y se diferencia de la onda R2,67.
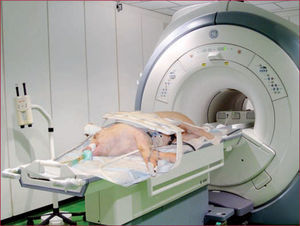
La elección de la colocación ideal del paciente se ha visto condicionada por varios factores, fundamentalmente minimizar los artefactos producidos en el ECG y maximizar el contacto con la antena. En la mayoría de los estudios de IRM realizados en el modelo animal porcino, se aplica el posicionamiento descrito para humanos colocando al animal en decúbito supino. Si observamos la estructura de la antena, podemos evidenciar que esta posición es muy buena en humanos, dado que su tórax está aplanado dorsoventralmente y permite el máximo contacto entre el paciente y las antenas, mientras que en el cerdo el tórax está aplanado laterolateralmente y, en decúbito supino o dorsal, el contacto con la antena es mínimo. Dada esta diferencia anatómica, el posicionamiento ideal en el modelo animal porcino para estudios de RMC utilizando antenas de superficie multicanal diseñadas para humanos es el decúbito lateral (derecho o izquierdo) y en dirección de entrada en el equipo caudocraneal (los pies primero) (fig. 1). Esta posición también permite introducir en el equipo de RM animales de mayor tamaño, ya que normalmente el diámetro vertical del pórtico es menor que el horizontal debido a la superposición de la mesa y las dos partes de la antena.
En el caso de los modelos animales, la nomenclatura de los planos anatómicos difiere de la humana por no encontrarse en bipedestación como los humanos. Los planos ortogonales puros en el caso de la especie porcina reciben los siguientes nombres68:
- •
Plano transverso: el que divide al animal en una porción craneal y una caudal.
- •
Plano sagital: el que divide el cuerpo del animal en una parte derecha y una izquierda.
- •
Plano dorsal o frontal: el que divide el cuerpo del animal en una porción dorsal y una ventral.
Estos planos transverso, dorsal y sagital se corresponden con los planos axial, coronal y sagital utilizados en medicina humana. A partir de los planos ortogonales puros, se estudia la anatomía cardiaca, especialmente cuando existen anomalías estructurales, y desde las IRM en planos cardiacos específicos se realizan todas las cuantificaciones cardiacas, desde evaluaciones funcionales, estudios de perfusión, viabilidad, etc. Estos planos son los recomendados por la American Heart Association (AHA), el American College of Cardiology (ACC) y la Sociedad de Medicina Nuclear69.
Los planos utilizados para el estudio del corazón se dividen en eje corto cardiaco y ejes largos cardiacos. El eje corto cardiaco se corresponde con cortes axiales o transversales al corazón; en este corte, a nivel basal, se puede distinguir ambas válvulas auriculoventriculares; en un nivel medio, se diferencian ambos ventrículos y, normalmente, los músculos papilares en el ventrículo izquierdo; a nivel apical, solo se evidencia ventrículo izquierdo. Los ejes largos utilizados en RMC se dividen en horizontales, verticales y una variante de uno de ellos conocido como de tres cámaras.
Adquisición de planos en RMC porcinaEl mejor sistema para realizar una correcta adquisición de los planos cardiacos en este modelo animal debe seguir los siguientes pasos, siempre en orden, para conseguir imágenes sin oblicuidades que alteren el resultado del estudio.
Localización del corazón y planos cardiacosPara la localización cardiaca dentro del tórax, se emplean los planos transverso, dorsal y sagital estrictos.
Localización ortogonalInicialmente, para localizar el corazón se emplean secuencias eco de gradiente unifásicas, de obtención rápida de imágenes con adquisición de estado estacionario (fast imaging employing steady state acquisition [FIESTA en GE]). En este tipo de secuencia, la resolución espacial se sacrifica para obtener imágenes rápidamente.
Los localizadores iniciales se obtienen con un protocolo multiplanar multicorte (una imagen por intervalo R-R) en los planos ortogonales estrictos (transverso, dorsal y sagital). Normalmente se hacen cinco cortes en los tres planos ortogonales puros. Es conveniente adquirir estos localizadores multiplanares en apnea tras espiración, ya que la posición del corazón es más reproducible.
Sobre los localizadores multiplanares, se planifican los localizadores cardiacos específicos. Desde el punto de vista de localización espacial, es la imagen sagital pura que suele mostrar un corte oblicuo del VI, parte de la aurícula izquierda y, en algunas ocasiones, el tracto de salida de la aorta. Sobre esta imagen se programa el siguiente localizador (seudoeje corto).
Los planos de adquisición deben adaptarse a la orientación de cada corazón estudiado. Aunque la anatomía cardiaca es similar en todos los sujetos, pequeñas oblicuidades en la adquisición de los planos pueden suponer variaciones significativas en las imágenes resultantes y su posterior cuantificación.
Localizador seudoeje cortoPara programar el localizador seudoeje corto se programan sobre el corte sagital puro cortes perpendiculares al sagital que sean paralelos al plano valvular mitral, donde nos interesa principalmente el corte en que se evidencia el tracto de salida de la aorta. Desde este plano, se programan los localizadores seudoejes largos.
Localizadores seudoejes largosPara programar el plano similar al de dos cámaras (2C) a partir de un corte seudoeje corto a nivel medio ventricular, se traza un plano paralelo a los puntos de unión del ventrículo derecho (VD) que corte por la mitad el VI; a su vez, este corte se inclina en el corte sagital puro para que pase por el ápex cardiaco.
Para programar el plano similar al de tres cámaras (3C) a partir de un corte seudoeje corto a nivel basal donde se evidencie el tracto de salida de la aorta, se traza un plano que corte la aorta y el VI por la mitad y se inclina en el plano seudo-2C para que pase por el ápex.
Por último, para programar el plano similar al de cuatro cámaras (4C) se programa igual que el seudo-3C, pero hay que asegurarse de no cortar la aorta, sino solamente los ventrículos, para lo cual lo más adecuado es lateralizar el corte evitando la arteria aorta por su lado izquierdo y asegurarse entonces de cortar ambas aurículas. Este plano seudo-4C es a partir del cual se programa el eje corto.
Planos de estudioHay que asegurarse de que los planos de estudio tengan las angulaciones adecuadas para que sean cortes puros del corazón. Se describen en el orden en que deben realizarse; en el caso de nuestro protocolo y teniendo en cuenta el tamaño cardiaco porcino, se ha estandarizado un grosor de corte de 8mm para las secuencias funcionales y de contractilidad segmentaria y 15mm en las secuencias de perfusión, edema y viabilidad miocárdica. Los planos necesarios para un estudio completo cardiaco en el modelo animal porcino son:
- •
Plano de eje corto. Para realizar los planos de eje corto, partimos de los localizadores seudo-4C y seudo-2C. En el primero, se programan los cortes que sean paralelos al plano del anillo valvular mitral y perpendiculares al septo interventricular y se corrige el ángulo en el plano seudo-2C para que sean paralelos al plano valvular. Siempre hay que hacer cortes que abarquen todo el volumen del VI, poniendo el primer corte por encima del anillo mitral y el último por debajo del ápex cardiaco. Con la finalidad de facilitar el posterior estudio de vasos pulmonares, conviene ampliar la zona de estudio abarcando toda la anatomía cardiaca. El eje corto cardiaco se corresponde con cortes dorsales o axiales al corazón, donde se ve una sección de ambos ventrículos. En el plano de eje corto, se evalúan los grosores miocárdicos tanto de VI como de VD, se observan en secuencias multifásicas la contractilidad cardiaca segmentaria y se calculan volúmenes ventriculares, diámetros ventriculares, fracciones de eyección y de acortamiento y los distintos índices cardiacos.
- •
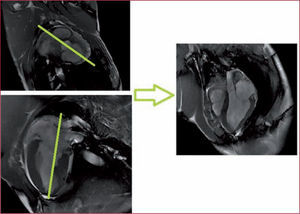
Plano de tres cámaras o tracto de salida del VI. Para realizar este corte, se parte de los planos de eje corto puro y el localizador seudo-2C. Seleccionamos un corte (eje corto) donde se diferencie el VI y el tracto de salida de la aorta, se programa la secuencia de manera que corte tanto aorta como VI por la mitad y se corrige la angulación con el plano localizador seudo-2C para asegurar que el plano de corte pasa por el ápex (fig. 2). En el plano 3C permite evaluar la función y la anatomía de la válvula aórtica, el diámetro de la raíz de la aorta, el diámetro de la aorta ascendente, el diámetro de la unión sinotubular y el diámetro y la longitud de los senos de Valsalva.
- •
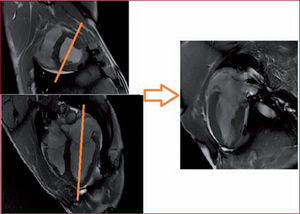
Plano de dos cámaras. A la hora de programar este corte se parte de los planos de eje corto puro y 3C puro. En el eje corto se traza un eje paralelo al tabique interventricular o paralelo a los puntos de unión interventricular anterior e inferior y que pase por el centro del VI, se corrige el ángulo de corte en el plano 3C para asegurar que pasa por el ápex y el centro de la válvula mitral (fig. 3). En el eje 2C se puede cuantificar la funcionalidad de la válvula mitral, los diámetros de la aurícula izquierda y el diámetro del anillo valvular mitral.
- •
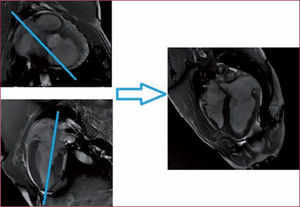
Plano de cuatro cámaras. En la programación de este corte se parte de los planos de eje corto puro y 2C puro. Se elige un corte (eje corto) donde se vea el VI y el tracto de salida de la aorta y se traza una línea que corte VD y VI sin cortar el tracto de salida de la aorta, se corrige la angulación en el corte 2C asegurando que el plano de corte pasa por el ápex y la mitad de las válvulas mitral y tricúspide (fig. 4). En el eje 4C se puede medir los diámetros y las longitudes de ambos ventrículos y aurículas, el área auricular, la funcionalidad y los diámetros de las válvulas auriculoventriculares y actualmente se empieza a utilizar para valorar la funcionalidad del ventrículo derecho.
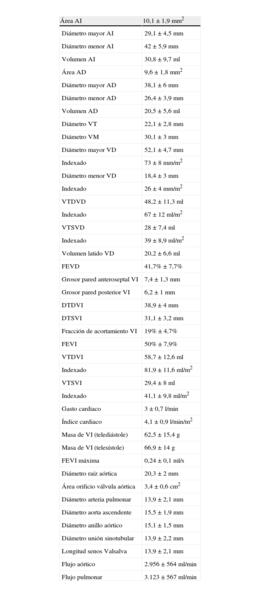
La cuantificación de las secuencias de resonancia en el modelo animal porcino se realiza de manera idéntica a la cuantificación en humanos. En animales de menos de 50kg es recomendable utilizar el sistema de cuantificación pediátrico para realizar mediciones más exactas y reproducibles. Los valores medios obtenidos para la raza Large White en animales de unos 2 meses de edad y entre 20 y 25kg se exponen en la tabla 2.
Valores medios cardiacos en animal Large White (20–25kg).
| Área AI | 10,1 ± 1,9mm2 |
| Diámetro mayor AI | 29,1 ± 4,5mm |
| Diámetro menor AI | 42 ± 5,9mm |
| Volumen AI | 30,8 ± 9,7ml |
| Área AD | 9,6 ± 1,8mm2 |
| Diámetro mayor AD | 38,1 ± 6mm |
| Diámetro menor AD | 26,4 ± 3,9mm |
| Volumen AD | 20,5 ± 5,6ml |
| Diámetro VT | 22,1 ± 2,8mm |
| Diámetro VM | 30,1 ± 3mm |
| Diámetro mayor VD | 52,1 ± 4,7mm |
| Indexado | 73 ± 8mm/m2 |
| Diámetro menor VD | 18,4 ± 3mm |
| Indexado | 26 ± 4mm/m2 |
| VTDVD | 48,2 ± 11,3ml |
| Indexado | 67 ± 12ml/m2 |
| VTSVD | 28 ± 7,4ml |
| Indexado | 39 ± 8,9ml/m2 |
| Volumen latido VD | 20,2 ± 6,6ml |
| FEVD | 41,7% ± 7,7% |
| Grosor pared anteroseptal VI | 7,4 ± 1,3mm |
| Grosor pared posterior VI | 6,2 ± 1mm |
| DTDVI | 38,9 ± 4mm |
| DTSVI | 31,1 ± 3,2mm |
| Fracción de acortamiento VI | 19% ± 4,7% |
| FEVI | 50% ± 7,9% |
| VTDVI | 58,7 ± 12,6ml |
| Indexado | 81,9 ± 11,6ml/m2 |
| VTSVI | 29,4 ± 8ml |
| Indexado | 41,1 ± 9,8ml/m2 |
| Gasto cardiaco | 3 ± 0,7 l/min |
| Índice cardiaco | 4,1 ± 0,9 l/min/m2 |
| Masa de VI (telediástole) | 62,5 ± 15,4 g |
| Masa de VI (telesístole) | 66,9 ± 14 g |
| FEVI máxima | 0,24 ± 0,1ml/s |
| Diámetro raíz aórtica | 20,3 ± 2mm |
| Área orificio válvula aórtica | 3,4 ± 0,6cm2 |
| Diámetro arteria pulmonar | 13,9 ± 2,1mm |
| Diámetro aorta ascendente | 15,5 ± 1,9mm |
| Diámetro anillo aórtico | 15,1 ± 1,5mm |
| Diámetro unión sinotubular | 13,9 ± 2,2mm |
| Longitud senos Valsalva | 13,9 ± 2,1mm |
| Flujo aórtico | 2.956 ± 564ml/min |
| Flujo pulmonar | 3.123 ± 567ml/min |
AD: aurícula derecha; AI: aurícula izquierda; DTDVI: diámetro telediastólico del VI; DTSVI: diámetro telesistólico del VI; FAVI: fracción de acortamiento del VI; FEVD: fracción de eyección del VD; FEVI: fracción de eyección del VI; VD: ventrículo derecho; VI: ventrículo izquierdo; VM: válvula mitral; VT: válvula tricúspide; VTDVD: volumen telediastólico del VD; VTDVI: volumen telediastólico del VI; VTSVD: volumen telesistólico del VD; VTSVI: volumen telesistólico del VI.
Ninguno.