El presente artículo presenta las características y resultados del trasplante cardiaco en España desde que empezó su actividad en mayo de 1984.
MétodosSe realiza un análisis descriptivo de las características de los receptores, los donantes, el procedimiento quirúrgico y los resultados de los trasplantes cardiacos realizados en España hasta el 31 de diciembre de 2013.
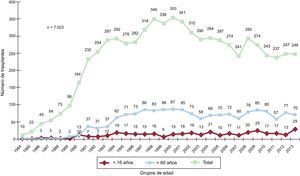
ResultadosDurante 2013 se han realizado 248 procedimientos, con lo que la serie histórica consta de 7.023 trasplantes. El análisis temporal confirma un empeoramiento significativo del perfil clínico de los receptores (mayor porcentaje de pacientes añosos, insuficiencia renal grave, diabetes mellitus insulinodependiente, cirugía cardiaca previa, ventilación mecánica), los donantes (mayor porcentaje de donantes añosos y mayor discordancia de peso) y el procedimiento (mayor porcentaje de trasplante urgente, que en 2013 alcanzó el 49%, y con tiempos de isquemia > 240 min). Hay un incremento notable del uso previo al trasplante de dispositivos de asistencia circulatoria, que en 2013ha llegado al 25,2% del total de pacientes. Las supervivencias a 1, 5, 10 y 15 años son del 76, el 65, el 52 y el 37% respectivamente, y permanecen estables desde 1995.
ConclusionesLa actividad de trasplante cardiaco en España permanece estable en los últimos años, con alrededor de 250 procedimientos al año. A pesar del claro empeoramiento en las características de los donantes, los receptores y los tiempos quirúrgicos, se mantienen unos resultados de mortalidad comparables a los de los países vecinos y se confirma un uso creciente de los dispositivos de asistencia circulatoria antes del trasplante.
Palabras clave
Desde 1991, el Registro Español de Trasplante Cardiaco (RETC) viene publicando la descripción de las características clínicas y quirúrgicas y los resultados generales de los procedimientos de trasplante cardiaco que se realizan en España1–24 (anexo). El presente artículo describe los datos referentes a la población trasplantada hasta el 31 de diciembre de 2013. Como ya es conocido, la mayor fortaleza del RETC reside en la inclusión y la actualización exhaustivas de todos los procedimientos de trasplante cardiaco realizados en todos los hospitales de España desde mayo de 1984, independientemente de sus características y resultados. Además, la recogida de datos se realiza prospectivamente en una base de datos común consensuada y actualizada por todos los grupos.
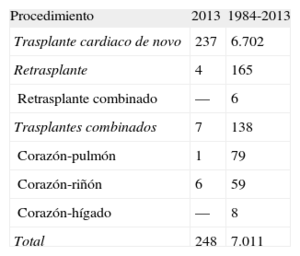
MÉTODOSPacientes y centrosDe los 19 centros que han aportado datos al RETC, actualmente permanecen activos 18 (tabla 1). El número de procedimientos realizados anualmente se resume en la figura 1. El total de la serie consta de 7.023 procedimientos. En 12 casos se ha producido una pérdida de datos, incluida información sobre el seguimiento. Estos no se incluyen en los análisis, y el tamaño muestral queda finalmente formado por 7.011 casos. De los 248 procedimientos realizados, 29 casos (11,7%) se realizaron en pacientes pediátricos (edad < 16 años). Los tipos de procedimientos realizados en 2013 y en la serie total se resumen en la tabla 2.
Centros participantes (por orden de realización del primer trasplante) en el Registro Español de Trasplante Cardiaco (1984-2013)
| 1. | Hospital de la Santa Creu i Sant Pau, Barcelona |
| 2. | Clínica Universitaria de Navarra, Pamplona |
| 3. | Clínica Puerta de Hierro, Majadahonda, Madrid |
| 4. | Hospital Marqués de Valdecilla, Santander |
| 5. | Hospital Reina Sofía (adulto y pediátrico), Córdoba |
| 6. | Hospital Universitario y Politécnico La Fe, Valencia |
| 7. | Hospital Gregorio Marañón (adulto y pediátrico), Madrid |
| 8. | Fundación Jiménez Díaz, Madrid (1989-1994) |
| 9. | Hospital Virgen del Rocío, Sevilla |
| 10. | Hospital 12 de Octubre, Madrid |
| 11. | Hospital Universitario de A Coruña (adulto y pediátrico), A Coruña |
| 12. | Hospital Bellvitge, L’Hospitalet de Llobregat, Barcelona |
| 13. | Hospital La Paz (pediátrico), Madrid |
| 14. | Hospital Central de Asturias, Oviedo |
| 15. | Hospital Clínic, Barcelona |
| 16. | Hospital Virgen de la Arrixaca, El Palmar, Murcia |
| 17. | Hospital Miguel Servet, Zaragoza |
| 18. | Hospital Clínico, Valladolid |
| 19. | Hospital Vall d’Hebron (pediátrico), Barcelona |
La base de datos consta de 175 variables clínicas, preestablecidas de manera consensuada por todos los grupos, que recogen datos del receptor, el donante, las técnicas quirúrgica y de inmunosupresión y el seguimiento. Desde el año 2013 los datos se introducen y actualizan en formato electrónico en tiempo real mediante una aplicación disponible en internet, específicamente diseñada para tal propósito. El soporte de la base de datos es un archivo de Microsoft Excel. Este procedimiento sustituye al anterior, en el que cada centro enviaba los datos al director del registro en formato de Microsoft Access mediante correo electrónico. El mantenimiento de la base de datos, el control de calidad y el análisis estadístico los realiza una CRO (contract research organization) externa: actualmente ODDS, S.L.
La aprobación por el comité ético, la auditoría y el registro en el Ministerio de Sanidad se ha realizado según lo dispuesto en la Ley Orgánica de Protección de Datos 15/1999.
EstadísticaLas variables se presentan como media ± desviación estándar en caso de variables cuantitativas continuas y como porcentaje las variables categóricas. Los resultados se categorizan por el año del trasplante, dividiendo la muestra total en seis grupos quinquenales (1984-1988; 1989-1993; 1994-1998; 1999-2003; 2004-2008; 2009-2013). Las diferencias entre grupos se analizan mediante un test no paramétrico para la tendencia temporal (tau de Kendall). Las curvas de supervivencia se han calculado mediante el test de Kaplan-Meier y la comparación entre ellas, con el método de log rank test. Se consideró diferencia significativa un valor de p < 0,05 en la comparación.
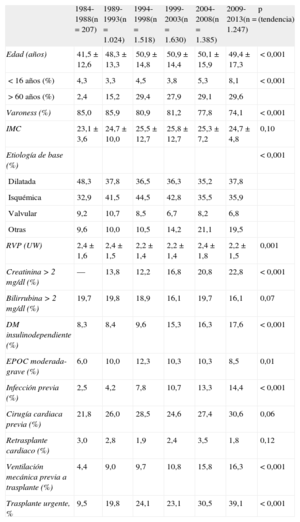
RESULTADOSCaracterísticas de los receptoresEn 2013, los receptores tenían una media de edad de 47 ± 19 (intervalo, 0-70) años; el 71% eran varones, con diagnósticos basales mayoritarios de miocardiopatía isquémica (33,6%), miocardiopatía dilatada idiopática (37,2%), miocardiopatía de origen valvular (8,1%) y otras etiologías (21,1%). Las características de los pacientes trasplantados por periodo de trasplante se resumen en la tabla 3. En el último periodo destaca que un 30% de los receptores eran > 60 años y que las mujeres superaban el 25%. Se constata asimismo un incremento en condiciones de riesgo como disfunción renal, diabetes mellitus, infección en los 15 días previos al trasplante y la necesidad de ventilación mecánica. Se observa, en cambio, una tendencia significativa a la disminución del retrasplante en el periodo más reciente, en el que apenas llega al 2% de todos los trasplantes, con un promedio anual histórico del 2,4%.
Características del receptor en el Registro Español de Trasplante Cardiaco (1984-2013)
| 1984-1988(n = 207) | 1989-1993(n = 1.024) | 1994-1998(n = 1.518) | 1999-2003(n = 1.630) | 2004-2008(n = 1.385) | 2009-2013(n = 1.247) | p (tendencia) | |
| Edad (años) | 41,5 ± 12,6 | 48,3 ± 13,3 | 50,9 ± 14,8 | 50,9 ± 14,4 | 50,1 ± 15,9 | 49,4 ± 17,3 | < 0,001 |
| < 16 años (%) | 4,3 | 3,3 | 4,5 | 3,8 | 5,3 | 8,1 | < 0,001 |
| > 60 años (%) | 2,4 | 15,2 | 29,4 | 27,9 | 29,1 | 29,6 | |
| Varoness (%) | 85,0 | 85,9 | 80,9 | 81,2 | 77,8 | 74,1 | < 0,001 |
| IMC | 23,1 ± 3,6 | 24,7 ± 10,0 | 25,5 ± 12,7 | 25,8 ± 12,7 | 25,3 ± 7,2 | 24,7 ± 4,8 | 0,10 |
| Etiología de base (%) | < 0,001 | ||||||
| Dilatada | 48,3 | 37,8 | 36,5 | 36,3 | 35,2 | 37,8 | |
| Isquémica | 32,9 | 41,5 | 44,5 | 42,8 | 35,5 | 35,9 | |
| Valvular | 9,2 | 10,7 | 8,5 | 6,7 | 8,2 | 6,8 | |
| Otras | 9,6 | 10,0 | 10,5 | 14,2 | 21,1 | 19,5 | |
| RVP (UW) | 2,4 ± 1,6 | 2,4 ± 1,5 | 2,2 ± 1,4 | 2,2 ± 1,4 | 2,4 ± 1,8 | 2,2 ± 1,5 | 0,001 |
| Creatinina > 2 mg/dl (%) | — | 13,8 | 12,2 | 16,8 | 20,8 | 22,8 | < 0,001 |
| Bilirrubina > 2 mg/dl (%) | 19,7 | 19,8 | 18,9 | 16,1 | 19,7 | 16,1 | 0,07 |
| DM insulinodependiente (%) | 8,3 | 8,4 | 9,6 | 15,3 | 16,3 | 17,6 | < 0,001 |
| EPOC moderada-grave (%) | 6,0 | 10,0 | 12,3 | 10,3 | 10,3 | 8,5 | 0,01 |
| Infección previa (%) | 2,5 | 4,2 | 7,8 | 10,7 | 13,3 | 14,4 | < 0,001 |
| Cirugía cardiaca previa (%) | 21,8 | 26,0 | 28,5 | 24,6 | 27,4 | 30,6 | 0,06 |
| Retrasplante cardiaco (%) | 3,0 | 2,8 | 1,9 | 2,4 | 3,5 | 1,8 | 0,12 |
| Ventilación mecánica previa a trasplante (%) | 4,4 | 9,0 | 9,7 | 10,8 | 15,8 | 16,3 | < 0,001 |
| Trasplante urgente, % | 9,5 | 19,8 | 24,1 | 23,1 | 30,5 | 39,1 | < 0,001 |
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; RVP: resistencias vasculares pulmonares; UW: unidades Wood.
Salvo otra indicación, los datos expresan media ± desviación estándar.
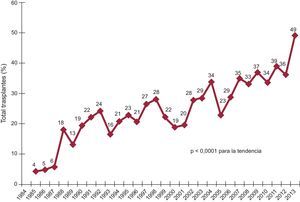
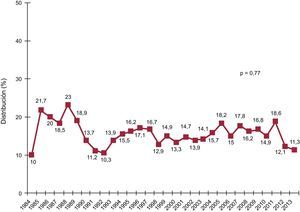
El porcentaje de procedimientos urgentes ha ido creciendo progresivamente y de manera muy significativa (p < 0,0001) en la serie histórica (figura 2) hasta llegar al 39% en el periodo más reciente (tabla 3). Es llamativo que en 2013 prácticamente la mitad de los procedimientos se realizaron con carácter urgente (figura 2).
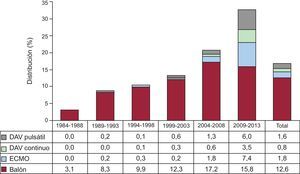
En 2013, se ha utilizado oxigenador de membrana extracorpóreo en el 11,7%, dispositivos de asistencia ventricular continua en el 6,0% y dispositivos de asistencia ventricular pulsátil en el 5,2%. Por lo tanto, en este último año, el uso de estos dispositivos (22,9%) prácticamente duplica el de la utilización de balón de contrapulsación como método único de asistencia (13,3%) antes del trasplante. Desde 2004 se aprecia un aumento constante en la utilización de soporte circulatorio mecánico más allá del tradicional balón de contrapulsación intraaórtico. La distribución de los procedimientos de asistencia ventricular por periodos se muestra en la figura 3.
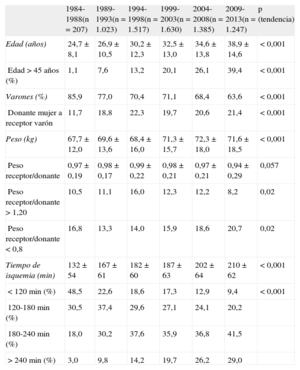
Características de los donantes y tiempo de isquemiaEn 2013, la media de edad de los donantes era 40,2 ± 16,1 años (el 44% eran > 45 años) y el 53,8% eran varones. En el 25% de los casos, el peso del donante fue un 20% mayor que el del receptor, mientras que sucedió lo contrario en el 10,1%. En el 27,8% de los casos, se injertó de donante mujer a receptor varón.
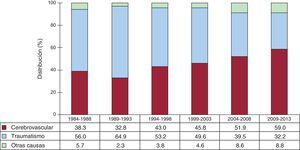
Las características de los donantes según el periodo se resumen en la tabla 4. Las causas de muerte del donante por periodo se resumen en la figura 4. A lo largo de los periodos descritos se aprecia un incremento de los accidentes cerebrovasculares como principal causa de muerte, en contraposición a los traumatismos craneoencefálicos.
Características del donante y tiempo de isquemia en el Registro Español de Trasplante Cardiaco (1984-2013)
| 1984-1988(n = 207) | 1989-1993(n = 1.023) | 1994-1998(n = 1.517) | 1999-2003(n = 1.630) | 2004-2008(n = 1.385) | 2009-2013(n = 1.247) | p (tendencia) | |
| Edad (años) | 24,7 ± 8,1 | 26,9 ± 10,5 | 30,2 ± 12,3 | 32,5 ± 13,0 | 34,6 ± 13,8 | 38,9 ± 14,6 | < 0,001 |
| Edad > 45 años (%) | 1,1 | 7,6 | 13,2 | 20,1 | 26,1 | 39,4 | < 0,001 |
| Varones (%) | 85,9 | 77,0 | 70,4 | 71,1 | 68,4 | 63,6 | < 0,001 |
| Donante mujer a receptor varón | 11,7 | 18,8 | 22,3 | 19,7 | 20,6 | 21,4 | < 0,001 |
| Peso (kg) | 67,7 ± 12,0 | 69,6 ± 13,6 | 68,4 ± 16,0 | 71,3 ± 15,7 | 72,3 ± 18,0 | 71,6 ± 18,5 | < 0,001 |
| Peso receptor/donante | 0,97 ± 0,19 | 0,98 ± 0,17 | 0,99 ± 0,22 | 0,98 ± 0,21 | 0,97 ± 0,21 | 0,94 ± 0,29 | 0,057 |
| Peso receptor/donante > 1,20 | 10,5 | 11,1 | 16,0 | 12,3 | 12,2 | 8,2 | 0,02 |
| Peso receptor/donante < 0,8 | 16,8 | 13,3 | 14,0 | 15,9 | 18,6 | 20,7 | 0,02 |
| Tiempo de isquemia (min) | 132 ± 54 | 167 ± 61 | 182 ± 60 | 187 ± 63 | 202 ± 64 | 210 ± 62 | < 0,001 |
| < 120 min (%) | 48,5 | 22,6 | 18,6 | 17,3 | 12,9 | 9,4 | < 0,001 |
| 120-180 min (%) | 30,5 | 37,4 | 29,6 | 27,1 | 24,1 | 20,2 | |
| 180-240 min (%) | 18,0 | 30,2 | 37,6 | 35,9 | 36,8 | 41,5 | |
| > 240 min (%) | 3,0 | 9,8 | 14,2 | 19,7 | 26,2 | 29,0 |
Salvo otra indicación, los datos expresan media ± desviación estándar.
El tiempo de isquemia ha venido incrementándose a lo largo de la serie temporal, de tal manera que en el periodo 2009-2013 este es casi 1,5 h mayor que el del periodo inicial 1984-1988. En el periodo más reciente, casi el 30% de los procedimientos tienen tiempo de isquemia > 4 h (tabla 4). En 2013, el tiempo de isquemia fue de 209,1 ± 59,6 min, con un 27,9% de los casos con tiempos de isquemia > 4 h.
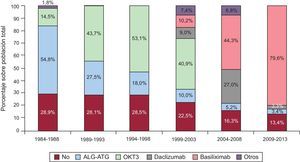
InmunosupresiónEn 2013, el 87,1% de los receptores recibieron algún tratamiento inmunosupresor de inducción, en su inmensa mayoría basiliximab (85,1%). En la figura 5 se aprecia que la inducción se ha incrementado progresivamente hasta su uso mayoritario actual. En el periodo 2009-2013, se indujo al 80% de los pacientes con inhibidores de la interleucina 2 (basiliximab o daclizumab, fundamentalmente el primero), sustituyendo el uso mayoritario del OKT3 de los periodos anteriores.
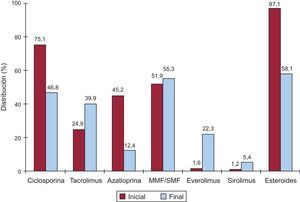
La inmunosupresión de inicio en 2013 se realizó mayoritariamente con tacrolimus (81,8%) como inhibidor de la calcineurina, micofenolato mofetilo (97,1%) como antiproliferativo y esteroides (97,9%). En la figura 6 se resumen los fármacos usados en la inmunosupresión inicial y al final del seguimiento en la serie total. Tras un seguimiento promedio de 6,8 años, el 58,1% de los pacientes continuaban en tratamiento con corticoides. Como se puede apreciar, tacrolimus tiende a igualarse con la ciclosporina en la inmunosupresión al final del seguimiento, a pesar del predominio de la segunda en las pautas de inmunosupresión al inicio del trasplante. La azatioprina mantiene un uso apenas testimonial y, llamativamente, el 27,7% de los pacientes está en tratamiento con inhibidores de la m-TOR (everolimus o sirolimus) en el último seguimiento.
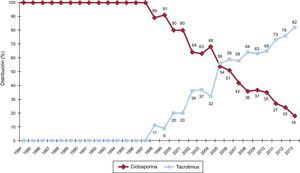
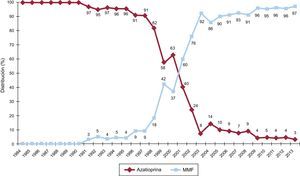
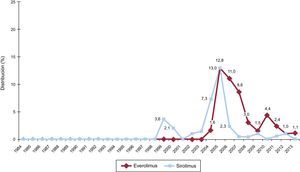
La evolución anual del uso de los distintos inhibidores de la calcineurina y antimicóticos se muestra en las figuras 7 y 8 respectivamente. El uso de tacrolimus igualó al uso de ciclosporina en 2005, y desde entonces mantiene una tendencia ascendente para convertirse en el inhibidor de calcineurina predominante en la inmunosupresión de inicio. Similar tendencia se observa entre el micofenolato mofetilo y azatioprina, cuyo uso se igualó entre 1999 y 2001; el micofenolato pasó a ser el antimicótico predominante en la inmunosupresión de inicio, relegando a la azatioprina a un uso mínimo a partir de 2009. La evolución anual del uso de inhibidores de m-TOR (sirolimus, everolimus) en la inmunosupresión de inicio se muestra en la figura 9. Estos fármacos se usaron inicialmente en un porcentaje apreciable en 2005-2007, pero después el uso decayó hasta un porcentaje mínimo.
En la figura 10 se resume la evolución anual de la mortalidad quirúrgica (primeros 30 días tras la cirugía). En 2013 fue del 11,3%, ligeramente inferior a la de la cohorte histórica, con un promedio del 15% anual.
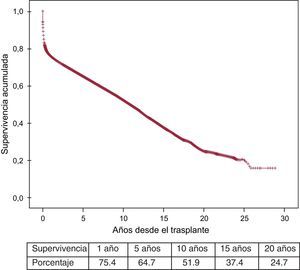
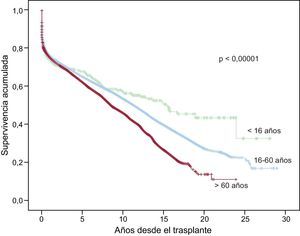
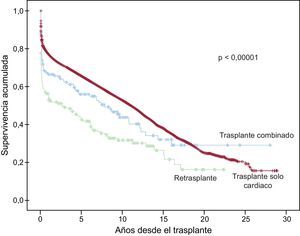
A la última actualización el 31 de diciembre de 2013, las supervivencias actuariales en el conjunto de la serie a 1, 5, 10, 15 y 20 años se resumen en la figura 11. Esto supone una mortalidad promedio de un 2-3%/año aproximadamente, con una mediana de supervivencia de 10,8 años. Hubo diferencias significativas según la edad del receptor en el momento del trasplante y por el tipo de procedimiento. La supervivencia de los pacientes < 16 años fue significativamente mejor que la de los pacientes de 16-60 años, y la de estos respecto a los pacientes > 60 años (figura 12). Igualmente hubo diferencias muy significativas entre los trasplantes solo cardiacos, los trasplantes cardiacos combinados con trasplante renal, hepático o pulmonar y los retrasplantes (figura 13).
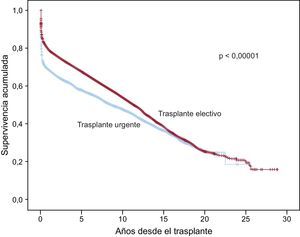
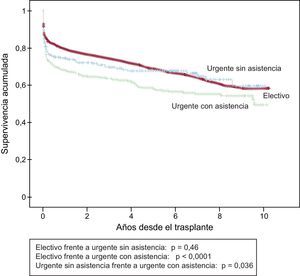
En la serie total, se observan diferencias de supervivencia muy significativas entre los trasplantes electivos y los urgentes (figura 14). Analizando el periodo 2004-2013, en el cual el uso de dispositivos de asistencia mecánica se ha incrementado de manera apreciable, la supervivencia del trasplante electivo no resulta significativamente diferente del de urgencia con el apoyo único de fármacos inotrópicos o, en la mayoría de los casos, con balón de contrapulsación intraaórtico (p = 0,46), pero sí significativamente mejor que la del trasplante urgente con asistencia mecánica (p < 0,0001) (figura 15). Asimismo, el trasplante urgente con balón de contrapulsación muestra una supervivencia significativamente mejor (p = 0,036) que el trasplante urgente realizado tras dispositivos de asistencia ventricular (figura 15).
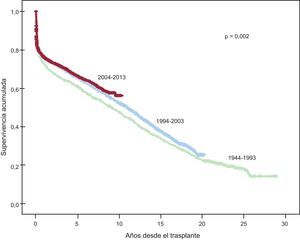
Después de la primera década (1984-1993), se evidencia una significativa mejora en la supervivencia a medio y largo plazo, mediada fundamentalmente por la menor mortalidad en etapas precoces tras el trasplante (figura 16). En la última década (2004-2013), respecto a la década inmediatamente anterior (1994-2003), se observa una tendencia no significativa a mejora de la supervivencia a partir del quinto año tras el trasplante (figura 16).
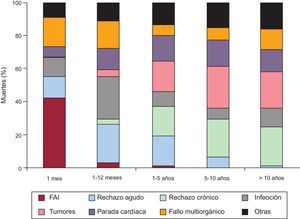
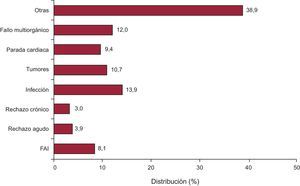
Causas de fallecimientoLas causas de fallecimiento cambian según el tiempo tras el trasplante que se considere (figura 17). En el primer mes tras el trasplante, casi el 50% de los fallecimientos se producen por fallo primario del injerto. Después del primer mes y hasta cumplir el primer año, el rechazo agudo y sobre todo las infecciones son la principal causa de muerte. Después del primer año, la causa mayoritaria son los tumores y las distintas manifestaciones de la enfermedad vascular del injerto (rechazo crónico, muerte súbita). En la figura 18 se resumen las causas de muerte principales para la serie total. En general, las causas de muerte principales son la infección (13,9%), las manifestaciones achacables mayormente a la enfermedad vascular del injerto (rechazo crónico, muerte súbita) (12,4%), el fallo multiorgánico (12%) y los tumores (9,4%). El rechazo agudo solo supone el 3,9% del total de los fallecimientos.
El trasplante cardiaco actualmente es una terapia bien establecida para los pacientes con cardiopatías en estadio avanzado que no tienen otra alternativa terapéutica razonable. Este año se cumplen 30 años desde la realización del primer trasplante cardiaco viable en España. Por su parte, el RETC cuenta ya 25 años de actividad, que se inició en 1989 y publicó su primer informe en 19911. El esfuerzo colaborativo de todos los grupos de trasplante cardiaco españoles asegurando el carácter exhaustivo del RETC, con la inclusión de todos los pacientes trasplantados en España y con pérdidas de seguimiento prácticamente inexistentes, permite una visión en perspectiva y consistente de este procedimiento en la población desde el inicio de la actividad trasplantadora en España. La recolección prospectiva y estandarizada, y con una adaptación dinámica a la evolución histórica del procedimiento, resulta un instrumento de investigación y sobre todo de uso clínico de primera magnitud. Esto es particularmente cierto en casos como el del trasplante cardiaco en España, un procedimiento de implantación dispersa (actualmente hay programas en 18 centros) y, en consecuencia, con bajo volumen por centro. Parece obvio que solo el análisis conjunto de los datos puede garantizar un mínimo de consistencia en los hallazgos. No obstante, un análisis profundo explicativo de las tendencias históricas del trasplante cardiaco en España no siempre es posible a partir del RETC, debido a que este carece de algunos datos importantes, como el número de pacientes incluidos en la lista de espera o el tiempo en lista de espera antes del trasplante.
En 2013 se han realizado 248 trasplantes, un número similar que en años previos, lo que confirma el descenso del número de procedimientos que se evidencia después de las cifras máximas de finales de los años noventa, un fenómeno común al ámbito europeo25. Como dato diferenciador, este año se ha producido un incremento significativo de los trasplantes pediátricos, lo cual puede reflejar la maduración y la revitalización progresiva de los programas de trasplante pediátrico en España.
Las características de los procedimientos realizados en 2013 confirman las tendencias ya observadas en años previos24 y reflejan en gran medida un cambio en el paradigma del tratamiento de la insuficiencia cardiaca avanzada. En primer lugar, estos datos muestran un progresivo empeoramiento del perfil clínico del receptor. En los últimos 5-10 años, se ha aumentado el porcentaje de pacientes añosos, con peor función renal, con más diabetes mellitus insulinodependiente y ventilación mecánica, todos ellos factores de reconocida incidencia en el pronóstico a corto y largo plazo25. En segundo lugar, es posible detectar una progresiva ampliación de los criterios de donación, como parece derivarse del significativo aumento de la media de edad de los donantes y el porcentaje de donantes añosos (> 45 años), así como de los donantes fallecidos por accidente cerebrovascular, con frecuencia asociado a mayor incidencia de arteriosclerosis. En tercer lugar, hay un llamativo incremento en el número de trasplantes realizados con carácter de urgencia y, sobre todo, con dispositivos de asistencia circulatoria (oxigenador de membrana extracorpóreo, asistencia ventricular mecánica), que suponen ya la mitad de los trasplantes urgentes e igualan a los realizados con balón de contrapulsación. Sin duda esto es posible debido a la disponibilidad creciente de dichos dispositivos para las unidades de insuficiencia cardiaca avanzada encargadas de la realización del trasplante y se enmarca en la tendencia general observada en países desarrollados26. Estos dispositivos permiten la optimización del paciente para el trasplante en situaciones agudas de máxima urgencia (infarto agudo de miocardio masivo, shock cardiogénico, shock tras cardiotomía) y la estabilización del paciente de larga evolución con deterioro terminal muy grave e irreversible27. Tal como se preveía en el informe del RETC publicado en 2013, la expansión del uso de dispositivos de asistencia circulatoria ha originado una reordenación de los criterios para inclusión en lista de espera urgente en España, cuya efectividad habrá de valorarse en años próximos. Finalmente, este nuevo escenario clínico justifica el incremento significativo en los tiempos de isquemia, otro factor con marcado impacto pronóstico en el trasplante cardiaco, y muy probablemente es secundario a la aceptación de injertos en referencias lejanas y a un procedimiento quirúrgico más complejo y ocasionalmente menos predecible.
Los cambios históricos de la inmunosupresión son igualmente llamativos. Se ha generalizado el tratamiento de inducción con anticuerpos, particularmente inhibidores de la interleucina 2, que permiten una introducción retardada de los inhibidores de la calcineurina en situaciones más frecuentes de insuficiencia renal perioperatoria y tienen una tolerabilidad clínica muy superior a la de fármacos ya obsoletos como el OKT3. En la época contemporánea, la inmunosupresión de inicio sigue descansando en la triple terapia tradicional, si bien se observa un cambio definitivo en los inhibidores de la calcineurina hacia el tacrolimus y en los antiproliferativos hacia el micofenolato mofetilo, en detrimento de la ciclosporina y la azatioprina respectivamente. Las expectativas generadas por la introducción de los inhibidores de la m-TOR (sirolimus y everolimus) indujeron un uso apreciable de estos fármacos como terapia inicial alrededor de 2005. Este uso decayó poco después tras confirmarse la complejidad de su uso en el trasplante cardiaco de novo. No obstante, constituyen una opción terapéutica establecida en la fase crónica del trasplante, como demuestra que, un promedio de 7 años después del trasplante, más del 25% de los pacientes tengan estos fármacos incluidos en su tratamiento inmunosupresor.
A pesar de la progresiva complicación del escenario clínico en que se realiza el trasplante cardiaco actualmente, los resultados en mortalidad han permanecido estables los últimos 20 años. Estos resultados son comparables a los publicados en el registro de la International Society for Heart and Lung Transplantation25. Después del periodo inicial (1984-1993), se produjo una mejora significativa de la supervivencia a expensas principalmente de la reducción de la mortalidad en el primer año tras el trasplante, y después las curvas a largo plazo se han mantenido paralelas. Después de 1994, la supervivencia precoz ha permanecido estable, si bien se aprecia una tendencia a la mejora de la supervivencia a partir del quinto año en el periodo 2004-2013 respecto al periodo 1994-2003. Una observación más prolongada permitirá confirmar si esta mejora es significativa y traduce, tal vez, un mejor manejo de los pacientes a largo plazo, en gran parte mediado por los refinamientos en los tratamientos inmunosupresores. Es destacable que en 2013, a pesar del importante aumento de procedimientos urgentes, se ha confirmado una disminución de la mortalidad precoz (primeros 30 días), ya iniciada en 2012. La expansión de la utilización de dispositivos de asistencia circulatoria en estos casos podría ser una de las causas de este hallazgo27, que habrá que confirmar en años próximos.
Analizando las causas de muerte en la serie total, parece evidente que el rechazo agudo, cuyo riesgo no desaparece a lo largo de la toda la evolución del paciente, hoy es una entidad clínicamente controlada. En cambio, predominan como causas de fallecimiento entidades como infecciones, tumores, fallo multiorgánico (en gran parte mediado por la incidencia de insuficiencia renal crónica) y manifestaciones propias de la enfermedad vascular del injerto. Estas entidades están relacionadas etiopatogénicamente con los efectos de la medicación inmunosupresora. Los cambios recientemente producidos en la inmunosupresión, que permiten minimizarla y hasta cierto punto individualizarla, podrían tener una marcada incidencia en el pronóstico a largo plazo de estos pacientes.
CONCLUSIONESEn 30 años de experiencia con el trasplante cardiaco en España, este se ha convertido en un procedimiento maduro y con indicación bien establecida para el tratamiento de la insuficiencia cardiaca avanzada. A pesar del empeoramiento y las complicaciones del contexto clínico actual, los grupos españoles han conseguido estabilidad en los resultados y hay fundadas razones para esperar una mejora de estos en relación con el refinamiento en el uso de los dispositivos de asistencia circulatoria y los regímenes inmunosupresores.
FINANCIACIÓNEl RETC está parcialmente financiado por una beca no condicionada de Novartis.
CONFLICTO DE INTERESESF. González-Vílchez recibe remuneración por participar en comité de control y análisis estadístico de Roche y Astellas y por ponencias, presentaciones educativas y gastos de viaje de Roche, Astellas y Novartis. M.G. Crespo-Leiro recibe remuneración por ponencias, presentaciones educativas y gastos de viaje de Roche, Astellas y Novartis.
Agradecemos el apoyo estadístico realizado por ODDS, SL.
| Clínica Universitaria Puerta de Hierro, Majadahonda, Madrid | Javier Segovia-Cubero, Inés Sayado y Luis Alonso-Pulpón |
| Hospital Universitario y Politécnico La Fe, Valencia | Luis Martínez-Dolz, Ignacio Sánchez-Lázaro y Mónica Cebrián |
| Hospital Universitario de A Coruña, A Coruña | Maria J. Paniagua-Martin, Raquel Marzoa-Rivas y Eduardo Barge-Caballero |
| Hospital Universitario Reina Sofía, Córdoba | Amador Lopez-Granados y Juan Carlos Castillo-Dieguez |
| Hospital Universitario Marqués de Valdecilla, Santander | Miguel Llano-Cardenal y Jose A. Vázquez de Prada |
| Hospital Gregorio Marañón (adultos), Madrid | Adolfo Villa, Juan Fernández-Yáñez, Iago Sousa y Pablo Díez |
| Hospital Universitario 12 de Octubre, Madrid | Maria J. Ruiz, Pilar Escribano, Miguel A. Gómez y Marta Paradina |
| Hospital de la Santa Creu i Sant Pau, Barcelona | Vicenç Brosa, Sonia Mirabet, Laura López y Josep Padró |
| Hospital Universitario Virgen del Rocío, Sevilla | Jose Manuel Sobrino y Alejandro Adsuar |
| Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat, Barcelona | Josep Roca-Elías, José González-Costello y Joel Salazar-Mendiguchía |
| Clínica Universitaria de Navarra, Pamplona | Beltrán Levy y Rafael Hernández |
| Hospital Clínic Universitari, Barcelona | Marta Farrero y M. Ángeles Castel |
| Hospital Universitario Central de Asturias, Oviedo | Beatriz Díez de Molina |
| Hospital Universitario Gregorio Marañón (niños), Madrid | Constancio Medrano |
| Hospital Universitario Virgen de la Arrixaca, El Palmar, Murcia | Iris Garrido |
| Hospital Universitario Miguel Servet, Zaragoza | María L. Sanz-Julvé |
| Hospital Clínico Universitario, Valladolid | Javier López-Díaz y Amada Recio |
| Hospital Universitario La Paz, Madrid | Daniel Borches, Luz Polo, Carlos Labrandero y Lucía Deiros |
| Hospital Universitario Vall d’Hebron, Barcelona | Ferrán Gran y Raúl Abella |