Muchos pacientes con fibrilación auricular no valvular tienen contraindicados los anticoagulantes orales. El objetivo es estimar la incidencia de eventos tromboembólicos y hemorrágicos en pacientes con fibrilación auricular no valvular y cierre de la orejuela izquierda con seguimiento a largo plazo, y determinar los factores asociados con mayor mortalidad a largo plazo.
MétodosCohorte prospectiva de pacientes reclutados desde 2009 a 2015. Se compararon los eventos tromboembólicos y hemorrágicos con los esperados según las escalas CHA2DS2-VASc y HAS-BLED. Se realizó un análisis multivariable para determinar las variables asociadas con la mortalidad.
ResultadosSe reclutó a 598 pacientes (1.093 pacientes-año) con contraindicación de anticoagulantes (mediana de edad, 75,4 años). La tasa de éxito del cierre de la orejuela izquierda fue del 95,8%; 30 pacientes (5%) presentaron complicaciones. Las tasas de eventos (cada 100 pacientes-año) durante el seguimiento (media, 22,9 meses; mediana, 16,1 meses) fueron: muerte, 7,0%; ictus isquémico, 1,6% (frente al 8,5% esperado según CHA2DS2-VASc; p < 0,001); hemorragia intracraneal, 0,8%; hemorragia gastrointestinal, 3,2%, y hemorragia grave, 3,9% (frente al 6,3% esperado por HAS-BLED; p = 0,002). Estos resultados incluso mejoraron en el subgrupo de 176 pacientes con seguimiento > 24 meses (media, 46,6 meses; 683 pacientes-año) para las hemorragias graves, el 2,6% (frente al 6,3% esperado por HAS-BLED; p < 0,033). La edad (HR = 1,1), las hemorragias intracraneales (HR = 6,8) y el ictus (HR = 2,7) se asociaron con mayor mortalidad.
ConclusionesEl cierre de la orejuela izquierda redujo significativamente las incidencias de ictus y de eventos hemorrágicos graves y el beneficio se mantuvo. La edad, las hemorragias intracraneales y el ictus se asociaron con mayor mortalidad.
Palabras clave
La fibrilación auricular no valvular (FANV) es un importante problema de salud, especialmente de la población anciana1. La principal ventaja de los nuevos anticoagulantes orales (NACO) es que ahora tienen tratamiento más pacientes con riesgo de ictus2. No obstante, este aumento se ha producido lentamente, incluso con mayor lentitud de lo esperado en algunos registros3,4. Hay un considerable número de pacientes que, por riesgo hemorrágico alto, antecedentes de hemorragia durante el tratamiento con NACO o falta de adherencia al tratamiento, se habrían quedado sin protección anticoagulante5,6. En el estudio GARFIELD-AF5, a pesar de que las poblaciones participantes presentaran una puntuación media de 1 en la escala HAS-BLED (hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la INR, edad> 65 años y toma concomitante de fármacos o alcohol), al menos un 30% de los pacientes que debían estar medicados con NACO no los recibieron. Estos porcentajes se incrementaban a medida que la puntuación de la escala HAS-BLED aumentaba, lo cual quizá refleje la reticencia tanto de los médicos como de los pacientes a usar estos medicamentos en pacientes con antecedentes de hemorragia o puntuaciones de riesgo hemorrágico altas.
El cierre de la orejuela izquierda (OI) es una estrategia terapéutica que resulta útil en el tratamiento de esta clase de pacientes7. Tanto los estudios aleatorizados en pacientes que recibieron anticoagulantes orales (ACO) como los registros de pacientes con contraindicación a anticoagulantes han demostrado una disminución de la mortalidad y de las complicaciones hemorrágicas y tromboembólicas con el cierre de la OI8-11. Aunque las guías de práctica clínica clasifiquen el cierre de la OI dentro de la indicación de clase IIb en este contexto, no comparten esta recomendación otros investigadores por lo que se refiere a pacientes con contraindicación a los ACO ni, en la práctica clínica, los médicos que tratan a pacientes con contraindicaciones para los ACO de distinta naturaleza12-14.
En el momento que se cuente con un seguimiento más amplio de los pacientes a los que se ha implantado un dispositivo de cierre de la OI, se logrará una mejor comprensión de su evolución natural. El propósito de este estudio es, por lo tanto, evaluar la incidencia de complicaciones hemorrágicas y tromboembólicas en el seguimiento a largo plazo de 2 años (o> 2 años en un subgrupo de pacientes), así como determinar los principales predictores de mortalidad a largo plazo.
MÉTODOSDiseño, pacientes y procedimientosSe analiza prospectivamente a 598 pacientes de 13 hospitales terciarios de referencia de toda la península Ibérica (10 de España y 3 de Portugal) que recibieron un cierre de la OI entre el 2 de marzo de 2009 y el 18 de diciembre de 2015. Estos pacientes conformaban la cohorte prospectiva del Registro Ibérico, a quienes se da continuidad en el seguimiento a largo plazo15, junto con los nuevos pacientes incorporados sucesivamente hasta la fecha límite fijada como final de la inclusión. Los dispositivos utilizados fueron Amplatzer Cardiac Plug, Amplatzer Amulet y Watchman. El seguimiento se llevó a cabo mediante la valoración de las ecocardiografías de control programadas y de las consultas externas o llamadas telefónicas realizadas tras el periodo inicial.
Las complicaciones hemorrágicas y tromboembólicas se compararon con las esperadas a partir de las puntuaciones de las escalas CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años [doble], diabetes mellitus, ictus [doble], enfermedad vascular, edad 65-74 años y sexo [mujer]) y HAS-BLED, tanto en el conjunto de la muestra como en el subgrupo de pacientes en seguimiento> 24 meses.
Todos los pacientes firmaron el consentimiento informado para la intervención y el seguimiento. El comité de ética del hospital aprobó el protocolo del estudio.
Para descartar la presencia de trombo en la OI, se realizó a todos los pacientes una ecocardiografía transesofágica (ETE) en las 24-48 h previas a la intervención o al menos en la semana anterior. El tratamiento antitrombótico posterior consistió en una dosis de carga de clopidogrel (600 mg) tras el implante y ácido acetilsalicílico (AAS) en una dosis inicial de 300 mg el primer día y diaria de 100 mg a continuación. Se mantuvieron el clopidogrel de 3 a 6 meses, salvo que se presentaran complicaciones hemorrágicas, y el AAS de 6 a 12 meses como mínimo.
El seguimiento clínico fue muy estricto, mediante la valoración con ETE realizada en al menos 2 momentos (entre 1-3 meses y entre 3-6 meses). En caso de trombo, se pautó además enoxaparina subcutánea a dosis terapéuticas durante 2 semanas, a cuyo término se repitió la ETE para comprobar su desaparición. Ante un trombo persistente, se valoró si procedía prolongar el tratamiento 1 semana más o se ingresaba al paciente para iniciar el tratamiento con heparina intravenosa.
Variables y definicionesComplicaciones tromboembólicasSe define el ictus como un episodio agudo de disfunción neurológica focal o total inducida por un daño cerebrovascular, medular o retiniano secundario a hemorragia o infarto. Se distingue el accidente isquémico transitorio del ictus isquémico conforme a los signos neurológicos focales que persisten menos de 24 h y la ausencia de infarto cerebral agudo confirmado por técnicas de imagen. La embolia sistémica se define como insuficiencia vascular aguda u oclusión de las extremidades o de cualquier otro órgano fuera del sistema nervioso central, asociada a oclusión arterial clínica o establecida por evidencia distinta.
Complicaciones hemorrágicasSe define hemorragia mayor como una hemorragia establecida clínicamente, asociada con cualquiera de los siguientes factores: desenlace de muerte; afección de un lugar anatómico crítico (intracraneal, medular, ocular, pericárdico, artral, retroperitoneal o intramuscular con síndrome compartimental); descenso de los valores de hemoglobina> 3g/dl; transfusión> 2 unidades de sangre completa o de concentrado de eritrocitos, y necesidad de ingreso hospitalario.
Estimación del riesgoEl perfil de riesgo embólico basal se calculó mediante las escalas CHADS2 (insuficiencia cardiaca, hipertensión, edad, diabetes, ictus [doble]) y CHA2DS2-VASc, efectuando análisis independientes mediante las series de Lip et al.16 y Friberg et al.17. El riesgo hemorrágico se estimó mediante la escala HAS-BLED. Los eventos clínicos (en especial, la mortalidad cardiaca y total) y los hemorrágicos y trombóticos que requieren ingreso hospitalario se evaluaron en cada visita. La incidencia de complicaciones observada se calculó por paciente y año de seguimiento (número de pacientes al comienzo del periodo de seguimiento multiplicado por la duración media de seguimiento del paciente expresado en años). Se computó la incidencia de complicaciones esperada en la muestra como la media del riesgo individual de cada paciente.
Se registraron en la ETE la presencia de trombo en el dispositivo, la dehiscencia periprotésica, la presencia de comunicación interauricular residual y la confirmación de que el dispositivo permanecía en la posición correcta. Se define trombo como la presencia de una densidad ecocardiográfica visible en más de 1 plano, que aparece pediculado o no se corresponde con la reactivación laminar habitual de reendotelización del recubrimiento del dispositivo. La identificación se realizó por consenso entre 2 cardiólogos expertos en ecocardiografía. No se consideró complicación la presencia de trombo en el dispositivo, a menos que derivara en ulteriores eventos tromboembólicos clínicos. La dehiscencia se interpreta como la persistencia de flujo> 1 mm por el borde del dispositivo con filtración en la OI.
Análisis estadísticoLas variables cuantitativas se expresan como la media±desviación estándar o la mediana [intervalo intercuartílico]. Las variables categóricas muestran la frecuencia absoluta y el porcentaje. Se compararon las variables categóricas utilizando la prueba de la χ2 o la prueba exacta de Fisher y las variables cuantitativas mediante la prueba de la t de Student o la de Wilcoxon. Se evaluaron mediante pruebas binomiales las comparaciones entre las tasas de complicaciones observadas y esperadas. El análisis de supervivencia libre de complicaciones se realizó con el método de Kaplan-Meier y el modelo de regresión de Cox. El análisis multivariable se efectúa para determinar qué eventos clínicos durante el seguimiento se asocian con mayor mortalidad. La significación estadística se fijó en p <0,05. Todos los análisis se llevaron a cabo con el paquete estadístico SPSS, version 19.0.
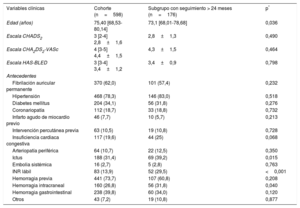
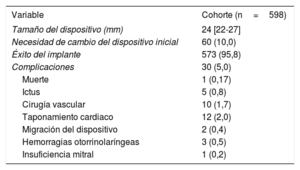
RESULTADOSLas características basales del conjunto de la población y el subgrupo con seguimiento más largo se muestran en la tabla 1 (los valores de p indican la diferencia respecto al grupo asignado a seguimiento <24 meses). La mediana de edad de los pacientes era 75,4 años. Se observó fibrilación auricular permanente en el 62% de los pacientes y fibrilación auricular paroxística en el 38%; el 31,4% de ellos tenían antecedentes de ictus y el 73,7%, de hemorragia mayor. Las puntuaciones de las escalas CHA2DS2-VASc y HAS-BLED fueron de 4,4±1,5 y 3,4±1,2 respectivamente. Los dispositivos usados para el cierre de la OI fueron Amplatzer Cardiac Plug (n=278; 46,5%), Amplatzer Amulet (n=209; 34,9%) y Watchman (n=111; 18,6%). El implante tuvo éxito en el 95,8% de los pacientes: un 93,9% en el caso de Amplatzer Cardiac Plug, un 98,1% con Amplatzer Amulet y un 96,4% con Watchman.
Variables basales de la población
| Variables clínicas | Cohorte (n=598) | Subgrupo con seguimiento > 24 meses (n=176) | p* |
|---|---|---|---|
| Edad (años) | 75,40 [68,53-80,14] | 73,1 [68,01-78,68] | 0,036 |
| Escala CHADS2 | 3 [2-4] 2,8±1,6 | 2,8±1,3 | 0,490 |
| Escala CHA2DS2-VASc | 4 [3-5] 4,4±1,5 | 4,3±1,5 | 0,464 |
| Escala HAS-BLED | 3 [3-4] 3,4±1,2 | 3,4±0,9 | 0,798 |
| Antecedentes | |||
| Fibrilación auricular permanente | 370 (62,0) | 101 (57,4) | 0,232 |
| Hipertensión | 468 (78,3) | 146 (83,0) | 0,518 |
| Diabetes mellitus | 204 (34,1) | 56 (31,8) | 0,276 |
| Coronariopatía | 112 (18,7) | 33 (18,8) | 0,732 |
| Infarto agudo de miocardio previo | 46 (7,7) | 10 (5,7) | 0,213 |
| Intervención percutánea previa | 63 (10,5) | 19 (10,8) | 0,728 |
| Insuficiencia cardiaca congestiva | 117 (19,6) | 44 (25) | 0,068 |
| Arteriopatía periférica | 64 (10,7) | 22 (12,5) | 0,350 |
| Ictus | 188 (31,4) | 69 (39,2) | 0,015 |
| Embolia sistémica | 16 (2,7) | 5 (2,8) | 0,763 |
| INR lábil | 83 (13,9) | 52 (29,5) | <0,001 |
| Hemorragia previa | 441 (73,7) | 107 (60,8) | 0,208 |
| Hemorragia intracraneal | 160 (26,8) | 56 (31,8) | 0,040 |
| Hemorragia gastrointestinal | 238 (39,8) | 60 (34,0) | 0,120 |
| Otros | 43 (7,2) | 19 (10,8) | 0,877 |
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
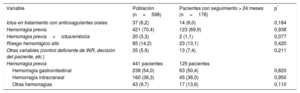
Las indicaciones para la intervención se muestran en la tabla 2. Los datos de los pacientes con un seguimiento> 24 meses se ilustran en la tabla 1. Cabe destacar el gran porcentaje de pacientes con antecedentes de hemorragia, en concreto, gastrointestinal.
Indicaciones para el procedimiento
| Variable | Población (n=598) | Pacientes con seguimiento > 24 meses (n=176) | p* |
|---|---|---|---|
| Ictus en tratamiento con anticoagulantes orales | 37 (6,2) | 14 (8,0) | 0,184 |
| Hemorragia previa | 421 (70,4) | 123 (69,9) | 0,938 |
| Hemorragia previa+ictus/embolia | 20 (3,3) | 2 (1,1) | 0,077 |
| Riesgo hemorrágico alto | 85 (14,2) | 23 (13,1) | 0,420 |
| Otras variables (control deficiente de INR, decisión del paciente, etc.) | 35 (5,9) | 13 (7,4) | 0,211 |
| Hemorragia previa | 441 pacientes | 125 pacientes | |
| Hemorragia gastrointestinal | 238 (54,0) | 63 (50,4) | 0,820 |
| Hemorragia intracraneal | 160 (36,3) | 45 (36,0) | 0,950 |
| Otras hemorragias | 43 (9,7) | 17 (13,6) | 0,110 |
Salvo otra indicación, los valores expresan n (%).
Las complicaciones principales se exponen en la tabla 3. Sufrieron complicaciones periprotésicas 30 pacientes (5%), de las que 10 requirieron cirugía vascular (4 fístulas arteriovenosas, 4 seudoaneurismas y 2 hemorragias con hematoma).
Variables del procedimiento
| Variable | Cohorte (n=598) |
|---|---|
| Tamaño del dispositivo (mm) | 24 [22-27] |
| Necesidad de cambio del dispositivo inicial | 60 (10,0) |
| Éxito del implante | 573 (95,8) |
| Complicaciones | 30 (5,0) |
| Muerte | 1 (0,17) |
| Ictus | 5 (0,8) |
| Cirugía vascular | 10 (1,7) |
| Taponamiento cardiaco | 12 (2,0) |
| Migración del dispositivo | 2 (0,4) |
| Hemorragias otorrinolaríngeas | 3 (0,5) |
| Insuficiencia mitral | 1 (0,2) |
Los valores expresan n (%) o mediana [intervalo intercuartílico].
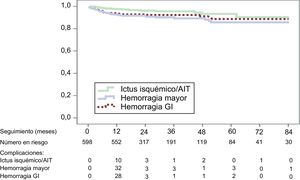
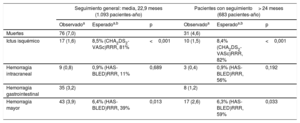
La tabla 4 ilustra las principales complicaciones durante el seguimiento en el conjunto del grupo (con éxito en el implante del dispositivo de cierre de la OI; media de seguimiento, 22,9 meses; mediana, 16,1 meses) y el subgrupo con seguimiento> 24 meses.
Eventos ocurridos a los pacientes con éxito del implante en general y a los pacientes con seguimiento> 24 meses
| Seguimiento general: media, 22,9 meses (1.093 pacientes-año) | Pacientes con seguimiento> 24 meses (683 pacientes-año) | |||||
|---|---|---|---|---|---|---|
| Observadoa | Esperadoa,b | p | Observadoa | Esperadoa,b | p | |
| Muertes | 76 (7,0) | 31 (4,6) | ||||
| Ictus isquémico | 17 (1,6) | 8,5% (CHA2DS2-VASc)RRR, 81% | <0,001 | 10 (1,5) | 8,4% (CHA2DS2-VASc)RRR, 82% | <0,001 |
| Hemorragia intracraneal | 9 (0,8) | 0,9% (HAS-BLED)RRR, 11% | 0,689 | 3 (0,4) | 0,9% (HAS-BLED)RRR, 56% | 0,192 |
| Hemorragia gastrointestinal | 35 (3,2) | 8 (1,2) | ||||
| Hemorragia mayor | 43 (3,9) | 6,4% (HAS-BLED)RRR, 39% | 0,013 | 17 (2,6) | 6,3% (HAS-BLED)RRR, 59% | 0,033 |
RRR: reducción del riesgo relativo.
Salvo otra indicación, los valores expresan n (%).
Tasa anual esperada de ictus/accidente isquémico transitorio sin ajustar por la variable de uso de ácido acetilsalicílico (reducción del riesgo estimada del 20% debido al uso de ácido acetilsalicílico); tasa anual de complicaciones hemorrágicas esperada en el caso de pacientes que reciben anticoagulantes orales.
Los resultados, expresados en pacientes-año, del conjunto de la muestra y del subgrupo de pacientes con seguimiento> 24 meses fueron, respectivamente: muertes, el 7,0 y el 4,6% (p <0,001); ictus isquémico, el 1,6 y el 1,5% (esperado conforme a la puntuación de la escala, el 8,5%); hemorragia intracraneal (HIC), el 0,8 y el 0,4% (p=0,297); hemorragia gastrointestinal, el 3,2 y el 1,2% (p <0,030), y hemorragia mayor, el 3,9 y el 2,6% (p <0,006) (esperada, el 6,3%). Las curvas de supervivencia libre de esos eventos clínicos se muestran en la figura. El número de pacientes seguidos en cada punto de la secuencia temporal se indica junto con la reducción de complicaciones después del primer año.
En el análisis multivariable (modelo de regresión de Cox), la HIC (hazard ratio [HR]=6,8; intervalo de confianza del 95% [IC95%], 2,1-22,0; p=0,001), la edad (HR=1,1; IC95%, 1,0-1,1; p <0,001) y el ictus durante el seguimiento (HR=2,7; IC95%, 1,3-5,7; p=0,009), pero no la hemorragia gastrointestinal, se asociaron con mayor mortalidad.
Se identificó trombo en el dispositivo de 27 pacientes (4,7%). Estos tuvieron mayor incidencia de accidente cerebrovascular (el 11,1 frente al 2,6%; p=0,041). La incidencia de trombo fue significativamente superior con el dispositivo Amplatzer Cardiac Plug (7,6%) que con el Amulet (2,4%; p=0,019) o el Watchman (0,9%; p=0,013). No se apreciaron diferencias significativas entre los dispositivos Amulet y Watchman (p=1,000).
DISCUSIÓNLas series del estudio incluyen a 573 pacientes con contraindicaciones para el tratamiento con NACO, y la mayoría de ellos, además, con antecedentes de hemorragia mayor y sometidos con éxito al implante de un dispositivo de cierre de la OI, con una media de seguimiento de 22,9 meses (1.093 pacientes-año). De esos pacientes, 176 tuvieron un seguimiento> 24 meses, con una media de 46,6 meses (683 pacientes-año de seguimiento).
De este modo, la principal contribución del presente estudio es explorar el seguimiento a medio y largo plazo de las complicaciones (tromboembólicas y hemorrágicas) de la serie completa, con un seguimiento medio de casi 2 años, y un subgrupo con seguimiento> 24 meses. La mayoría de los grandes registros hasta la fecha han podido comparar tan solo a pacientes con seguimientos medios de casi 1 año. Tras el análisis multivariable, surgen 3 variables como factores pronósticos de mortalidad a largo plazo: la HIC, el ictus y la edad.
El primer hallazgo digno de mención es que, al igual que las poblaciones de estudio aleatorizadas a tratamiento con ACO muestran tasas de hemorragia mayor entre 3 y 4 cada 100 pacientes/año18, los pacientes de la práctica clínica de este estudio que precisaban un cierre de la OI y tenían puntuaciones altas en la escala HAS-BLED además de contraindicación a los ACO obtuvieron tasas de hemorragia mayor del 3,9% cada 100 pacientes-año, lo cual se debió, en particular, a las hemorragias gastrointestinales. Es preciso mencionar que la puntuación de la escala HAS-BLED se basa en el riesgo hemorrágico de los pacientes que usan ACO. Es reseñable que los antecedentes de hemorragia gastrointestinal constituyeran el predictor principal de recurrencia de este tipo de hemorragia durante el seguimiento (HR=4,27; IC95%, 1,87-9,73; p=0,001), un hallazgo publicado anteriormente por Witt et al.19.
El efecto del cierre de la OI en la reducción de las hemorragias es especialmente significativo a medida que se dispone de seguimientos más largos, de modo que solo un 2,6% de los pacientes de este estudio con seguimiento> 24 meses tuvieron una hemorragia mayor, a pesar del alto riesgo de esta población. Las puntuaciones de la escala HAS-BLED se redujeron aún más lo esperado, en un 59% en el caso del subgrupo de pacientes con seguimiento> 24 meses y en un 39% en la serie completa. Este hallazgo resulta de particular interés, puesto que la tasa de hemorragias por pacientes-año de los estudios que han evaluado los ACO/NACO han permanecido constantes durante años18,20. Así, el estudio RELY-ABLE fue una ampliación del RELY, en el que solo se incluyó al 48% de los pacientes que recibieron dabigatrán en el estudio original, que fueron precisamente los pacientes que tenían menos hemorragias previas y un riesgo hemorrágico menor. A pesar de estos factores de bajo riesgo, la tasa de hemorragia mayor del grupo de seguimiento> 2 años fue del 3,74%20.
Los resultados del presente estudio concuerdan en este extremo con los del Registro Multicéntrico, aunque el nuestro dispone de un seguimiento más largo11. El Registro Multicéntrico analizó a pacientes tratados con AAS en monoterapia o no tratados, y los comparó según el seguimiento fuera mayor o menor que 1 año. Ambos grupos obtuvieron una puntuación de 3,2 en la escala HAS-BLED y una media de riesgo hemorrágico esperado de 5,64. En el grupo de seguimiento> 1 año (media, 22,8 [15,5-30,4] meses), la tasa de hemorragia mayor fue del 1,2 frente al 4,1% en el grupo de seguimiento <1 año (media, 6,3 [4,2-8,8] meses) (p <0,05), y la de reducción superior a lo esperado por la escala HAS-BLED, del 90,1 frente al –36,2% (p <0,001) respectivamente. Por lo tanto, el periodo de 6 meses a 1 año es especialmente crítico, y tras él las hemorragias se reducen de manera significativa.
Este hecho concierne también a los pacientes que podían recibir ACO, conforme a un metanálisis de estudios aleatorizados que evaluaron el dispositivo Watchman y la warfarina con un seguimiento medio de 3,1 años. Se observa en el presente estudio una tasa similar de hemorragia mayor: 3,5 frente a 3,6/100 pacientes-año. Sin embargo, cuando se descartó la hemorragia relacionada con el procedimiento en los primeros 7 días, las tasas de hemorragia fueron de 1,8 frente a 3,6 eventos/100 pacientes-año a favor del cierre de la OI (razón de tasas [RT]=0,49; p=0,001), con una notable diferencia que se mantenía sobre todo a partir de los 6 meses siguientes a la reducción del tratamiento antitrombótico (1,0 frente a 3,5 eventos/100 pacientes-año; RT=0,28; p <0,001). Este fue el caso en todos los subgrupos de pacientes en riesgo, con independencia de su puntuación en la escala HAS-BLED21.
Se mantuvieron muy significativas las reducciones de ictus isquémico precozmente desde el primer año, y cobra importancia que este efecto continuara reflejándose en los resultados a más largo plazo (el 1,6 y el 1,5% entre ambas poblaciones frente al 8,4% esperado, lo cual representa reducciones del 81 y el 82%, respectivamente, en la serie completa y en las poblaciones con seguimiento> 2 años). La concordancia de estos hallazgos con los distintos registros de este tipo de pacientes ratifica la fiabilidad de estos resultados8-11. En este sentido, en el Registro Multicéntrico, las tasas de ictus de los pacientes con seguimiento <1 año frente a> 1 año fueron del 3,77 frente al 1,03%, con las reducciones esperadas (5,62%) en la escala CHA2DS2-VASc del 33 frente al 81%11.
En el estudio aleatorizado PROTECT-AF, con seguimiento a largo plazo, se observó una reducción de la mortalidad de los pacientes asignados al cierre de la OI frente al tratamiento con warfarina22, aunque no se ofrecieron datos sobre los predictores de mortalidad. El análisis multivariable del presente estudio identificó la HIC durante el seguimiento (HR=6,8; IC95%, 2,1-22,0; p=0,001), la edad (HR=1,1; IC95%, 1,0-1,1; p <0,001) y el ictus isquémico durante el seguimiento (HR=2,7; IC95%, 1,3-5,7; p=0,009) como factores de riesgo asociados con mayor mortalidad. El principal predictor de HIC e ictus en el análisis multivariable ajustado por la variable de edad fue, en cada caso, haber presentado el evento antes del procedimiento (para HIC, odds ratio [OR]=5,03; IC95%, 0,92-27,5; p=0,062; para ictus recurrente, OR=9,97; IC95%, 2,28-43,47; p=0,002), lo cual con frecuencia era la principal indicación para el cierre de la OI de estos pacientes.
Las tasas de HIC fueron de 0,87/100 pacientes-año en el conjunto de la población frente a 0,4/100 pacientes-año con seguimiento> 24 meses, lo cual representa, en el caso de este subgrupo, una reducción 4 veces superior y una disminución del 56% según lo esperado para la escala (0,9/100 pacientes-año).
La HIC entre los pacientes con FANV y prescripción de NACO se ha demostrado también predictora de mortalidad en los estudios de varios registros. Dos registros publicados recientemente que incluyeron a pacientes con FANV y prescripción de NACO afirmaban que estos pacientes tienen mayor riesgo de ictus y mortalidad tras una HIC23,24. Así, en el registro estadounidense con 2.084.735 pacientes con fibrilación auricular y seguimiento de 3,2 años, 50.468 (2,4%) tuvieron una HIC y 89.594 (4,3%), un ictus, mientras que la tasa anual acumulada de accidentes cerebrovasculares era del 8,1% después de una HIC, del 3,9% después de una hemorragia subdural y del 2% en ausencia de ICH previa23. Estos resultados son muy semejantes a los del registro danés, que analizó a 58.815 pacientes con FANV. El grupo que había presentado una HIC tuvo mayor riesgo de ictus durante el seguimiento, con OR=3,67 y OR=5,55 en relación con el riesgo de mortalidad. La RT de complicaciones antes y después de una HIC relacionadas con la administración de warfarina fue del 0,28, lo que pudo afectar a los resultados24.
Un análisis de pacientes con HIC del Registro Europeo ha demostrado resultados mejores que lo esperado para estos pacientes tras el cierre de la OI según las puntuaciones de las escalas25. Así, en el caso de 198 pacientes con seguimiento medio de 1,3 años, la tasa observada de ictus/accidente isquémico transitorio fue del 1,4%, mientras que el riesgo se redujo en un 75% por encima de lo esperado teniendo en cuenta la escala CHA2DS2-VASc. Asimismo, Cruz-González et al.26 demostraron que el cierre percutáneo de la OI era seguro y eficaz en los pacientes con indicación de anticoagulación a largo plazo por FANV y antecedentes de HIC.
Por último, el mejor predictor del ictus durante el seguimiento fue haberlo tenido ya. Sin embargo, y en consonancia con un metanálisis publicado recientemente, también la aparición de un trombo en el dispositivo durante el seguimiento se asoció con una mayor predisposición a presentar otro ictus27. No obstante, esta cuestión aún suscita controversia, pues los estudios ofrecen resultados dispares28.
Por desgracia, debido a la falta de armonización de la práctica hospitalaria en el seguimiento con ETE, no se pudo determinar con exactitud la fecha de aparición de los hallazgos ecocardiográficos en correspondencia con las complicaciones tromboembólicas. No obstante, los hospitales con seguimientos más largos parecen coincidir en que su aparición se concentra al máximo entre el tercer y el sexto mes29. En relación con el tratamiento antitrombótico, su actuación es meramente indicativa, pues la orientación terapéutica se ajusta al perfil de riesgo del paciente, aunque la mayoría siguió un tratamiento de antiagregación plaquetaria doble de 3 a 6 meses y AAS a partir de ese momento.
LimitacionesLas limitaciones del presente estudio son las inherentes al análisis de un registro, aunque la mayoría de los hospitales participantes y de los investigadores incluyeron a pacientes en riesgo que presentaban indicaciones similares y resultados comparables que reflejaran el estado actual de la técnica. El número de estudios de seguimiento mediante ETE difería según el protocolo de cada hospital, pero en la mayoría se realizaron al menos 2 valoraciones (entre 1-3 meses y entre 3-6 meses). Por último, los tratamientos antitrombóticos tras el implante eran semejantes, aunque con variaciones, hecho que refleja en parte la ausencia de indicaciones claras al respecto y que el tratamiento se ajusta en función del perfil de riesgo del paciente.
CONCLUSIONESEl cierre de la OI se practica a pacientes con muy alto riesgo en comparación con los incluidos en los estudios sobre los NACO, cuyos resultados apuntan a mayores tasas de hemorragia por pacientes-año durante el primer y el segundo año. A pesar de dicho resultado, las series del presente estudio, que cuenta con un grupo de pacientes más numeroso en seguimiento tanto a largo como a muy largo plazo (> 24 meses), muestran menores tasas de hemorragia, inferiores incluso que las publicadas en los estudios aleatorizados que evalúan los NACO en pacientes con menos riesgo hemorrágico. La reducción de las tasas de accidente cerebrovascular es significativa desde el primer año y mantiene su beneficio con seguimientos> 24 meses. Los principales predictores de la mortalidad son la edad, una HIC previa y tener un ictus durante el seguimiento. Esta última complicación puede mejorarse aplicando estrategias terapéuticas que reduzcan la aparición de trombos en el dispositivo.
CONFLICTO DE INTERESESJ.R. López-Mínguez, D. Arzamendi-Aizpurua y V. De Gama Ribeiro son supervisores de St. Jude Medical/Abbot para el cierre de la OI con el dispositivo Amplatzer Cardiac Plug/Amplatzer Amulet; E. Infante De Oliveira y R. Ruiz-Salmerón son supervisores de Boston Scientific Corporation para el cierre con el dispositivo Watchman.
- –
El cierre de la OI es una opción terapéutica para pacientes con fibrilación auricular no valvular y contraindicación a los anticoagulantes. Los estudios aleatorizados han demostrado una reducción de la mortalidad y de las complicaciones hemorrágicas y tromboembólicas mediante el cierre de la OI. A pesar de que las guías de práctica clínica asignen el cierre de la OI a una indicación de clase IIb en este contexto, dicha recomendación no es compartida por ciertos investigadores cuando se aplica a pacientes con contraindicación a los ACO ni, en la práctica clínica, por los médicos que tratan a pacientes con distintos tipos de contraindicaciones para los ACO. Así pues, es fundamental contar con un análisis de resultados provenientes de la práctica clínica real.
- –
En esta población el cierre de la OI redujo significativamente la incidencia de accidentes cerebrovasculares desde el primer año tras el implante. En el caso de las complicaciones hemorrágicas, la reducción se tornó significativa al contar con un seguimiento más largo, hecho que se debió principalmente a la elevada incidencia de hemorragia gastrointestinal durante el primer año. La hemorragia intracraneal, la edad y el ictus durante el seguimiento se asocian con mayor mortalidad.