Palabras clave
INTRODUCCIÓN
Diferentes estudios durante los últimos años han demostrado que la infusión intracoronaria de células mononucleadas de la médula ósea (CMNMO) en pacientes con infarto agudo de miocardio mejora, en mayor o menor grado, la función ventricular1-12. Aunque se desconoce aún el mecanismo, existen hipótesis de transdiferenciación y anidamiento frente a un supuesto efecto paracrino de las propias células infundidas. Lo cierto es que en numerosos estudios clínicos se observa un remodelado ventricular favorable y una mejoría de la fracción de eyección (FE). Los factores que inciden en el grado de recuperación funcional tampoco son bien conocidos, aunque sí hay datos que indican que es mayor cuando se infunde un mayor número de células durante los primeros 7 días tras el infarto8,11,12, o mayor aún cuando se hace después del día 611, y su efecto beneficioso es más detectable en infartos extensos6,8.
En el infarto crónico, el escenario es completamente distinto. El remodelado adverso generalmente ya está consumado y en los extensos resulta casi inevitable la insuficiencia cardiaca. Aunque la evolución de este tipo de enfermos depende del tratamiento médico y de la posible revascularización, el pronóstico a largo plazo resulta complicado.
La terapia celular podría tener un papel beneficioso para este tipo de pacientes, aunque tampoco hay, en el momento de su aplicación, reclamos quimiotácticos conocidos que favorezcan un posible anidamiento13. Diferentes estudios clínicos, con distintas estrategias y vías de administración, así como con diversos tipos de células, han mostrado un efecto favorable14-20, aunque se precisa más información. En relación con la infusión intracoronaria de CMNMO autóloga, hay poca información sobre pacientes con infarto de miocardio crónico que padecen depresión severa de la función ventricular e insuficiencia cardiaca17,18.
El presente ensayo clínico analiza la evolución de 19 pacientes con infarto anterior extenso crónico e insuficiencia cardiaca tratados con infusión intracoronaria de CMNMO.
MÉTODOS
Selección de pacientes y protocolo de estudio
Desde junio de 2005 hasta enero de 2008, se seleccionó para el estudio a 19 pacientes consecutivos por cumplir los siguientes criterios de inclusión: a) pacientes con infarto de miocardio crónico (más de 1 mes desde el episodio agudo) de localización anterior, en ritmo sinusal estable; b) tener revascularizada la arteria coronaria descendente anterior u otros territorios isquémicos, si los hubiera; c) tener una función ventricular deprimida FE < 40%) tras el infarto antiguo; d) tener síntomas de insuficiencia cardiaca, a pesar de estar sometidos a un tratamiento médico óptimo, y e) aceptar el protocolo de estudio. Como criterios de exclusión, figuraban: a) edad > 80 años; b) enfermedad hemática u oncológica concomitante; c) embarazo; d) haber participado en otro estudio, y e) tener pobres expectativas de vida. Dicho protocolo había sido aceptado por el comité de ensayos clínicos de nuestro hospital y por el correspondiente autonómico. Inicialmente se realizó a todos ellos estudios clínicos y ecocardiográficos, siendo así preseleccionados para estudio. Ya entonces, se aseguraba en cada caso un tratamiento médico óptimo de su insuficiencia cardiaca. Tras la preselección, a todos los pacientes se les efectuó un cateterismo cardiaco en el que se estudiaba la función ventricular y se comprobaba la persistencia de una revascularización completa. Tras registrarse en el estudio y firmar el consentimiento informado, se programó a todos los pacientes para terapia celular.
Las células de la médula ósea autóloga se obtuvieron sin estimulación previa y no fueron cultivadas. Bajo anestesia local, se efectuaron punciones y aspiraciones repetidas sobre una de las crestas iliacas hasta alcanzar un volumen total de médula entre 100 y 150 ml. Las células mononucleadas se aislaron mediante centrifugación en gradiente de densidad sobre Ficoll-Hypaque (densidad, 1.077) en un procesador de células semiautomático COBE 2991. Tras ser sometidas a tres lavados, las CMNMO fueron filtradas y resuspendidas en 10 ml de ClNa al 0,9% con el 0,1% de heparina e infundidas al paciente por vía intracoronaria, no más de 3 h tras la punción.
Para efectuar la infusión intracoronaria se ocluía transitoriamente la arteria descendente anterior para crear distalmente un flujo estancado que pudiera favorecer la difusión del caldo celular en el lecho capilar. Tras la infusión, el paciente pasaba a la planta, donde se lo monitorizaba por electrocardiografía para detectar posibles cambios o arritmias tras la infusión celular. También se efectuaban determinaciones enzimáticas seriadas en 24 h. Finalmente, se daba de alta al paciente con tratamiento médico y se lo seguía estrechamente mediante frecuentes llamadas telefónicas. A los 6 meses, el paciente ingresaba para un estudio clínico idéntico al realizado en condiciones basales, así como un ulterior estudio hemodinámico al seguimiento, en el que se repetían los estudios funcionales con idéntica metodología. Al año de seguimiento, se repetía ambulatoriamente el estudio clínico y ecocardiográfico. Los pacientes supervivientes continúan seguimiento clínico indefinido.
Estudios funcionales
Estudios ecocardiográficos de función ventricular
En todas las condiciones, se efectuaba un estudio ecocardiográfico completo con adquisición digital de imágenes bidimensionales del ventrículo izquierdo de, al menos, 3 ciclos cardiacos en las proyecciones apical de 4 y 2 cámaras, así como paraesternal, a nivel basal, medio y apical. En todos los casos, se optimizaban el sector de exploración y la profundidad del campo para obtener una frecuencia de, al menos, 60 imágenes por segundo. Las imágenes grabadas se enviaban a una estación de trabajo para su posterior análisis. Dos expertos ecocardiografistas, que desconocían la condición de estudio, midieron los volúmenes ventriculares y la FE, utilizando el método de Simpson biplanar. En caso de ventana ecográfica inadecuada, se utilizaron ecopotenciadores para conseguir una adecuada visualización del borde endocárdico.
Estudios angiográficos de función ventricular
En cada condición de estudio se efectuó un estudio hemodinámico izquierdo completo para registrar la presión sistémica y la telediastólica y, al menos, una ventriculografía izquierda en proyección oblicuo-anterior derecha 30°. Durante cada ventriculograma de estudio, se intentó obtener un latido sinusal y otro postextrasistólico para análisis, con vistas a estudiar la reserva contráctil del ventrículo izquierdo. Los latidos postextrasistólicos se obtuvieron mediante la inducción de latidos prematuros con el propio catéter, una vez obtenido un ciclo cardiaco sinusal bien opacificado. En todas las ocasiones, se registraron y midieron el intervalo R-R' del latido prematuro inducido y el R'-R de la pausa postextrasistólica.
Los cálculos y medidas de la función ventricular se efectuaron en nuestro propio laboratorio. Dos expertos angiografistas, desconocedores de las características del estudio, dibujaron las siluetas telediastólica y telesistólica mediante el sistema CASS. Se obtuvieron volúmenes y FE y se analizó la motilidad regional. Se utilizó el método de Sheehan21 para el estudio de asinergia, dividiendo las siluetas superimpuestas en 100 radios de acortamiento sistólico de la pared, desde telediástole a telesístole. El segmento de contracción anormal (SCA) se definió como el porcentaje de radios que mostraran acinesia o discinesia. Las áreas de la pared anterior afectada por el infarto antiguo incluyeron el SCA junto a las cuerdas hipocinéticas que rodeaban a dicho segmento. Por lo tanto, el comportamiento funcional de la zona infartada del miocardio tras el tratamiento se observó de forma seriada en idénticas condiciones, lo que favoreció la evaluación de la posible recuperación. La evolución seriada de la reserva contráctil se valoró mediante el análisis de la potenciación postextrasistólica.
Velocidad de flujos y reserva coronaria
Se utilizó el sistema FloMap® (Cardiometrics, Mountain View, California). Los estudios basales de reserva coronaria (RC) sobre la descendente anterior se realizaron siempre antes de la infusión intracoronaria de células y a los 6 meses de seguimiento. Se introducía una guía Doppler de 0,014" cuya punta se ubicaba distal al segmento tratado de la DA, registrándose velocidades de flujo de forma continua. El pico medio de velocidad se obtuvo basalmente y tras la administración de un bolo intracoronario de 60 μg de adenosina. Se calculó la RC como la relación entre la máxima velocidad de flujo durante el efecto pico de la adenosina y la velocidad de flujo basal.
Estudio biológico
Se obtuvieron alícuotas de la suspensión de CMNMO infundida para determinación del inmunofenotipo celular mediante citometría de flujo con tres colores. Las células se marcaron con anticuerpos monoclonales unidos a ficoeritrina-cianina-5 (PE-Cy5) o peridina-clorofil-proteína (Per-CP) frente a CD34 humano (BD Biosciences, San José, Estados Unidos), y los siguientes anticuerpos monoclonales marcados con fluoresceína isotiocianato o ficoeritrina: CD38, CXCR4, CD31, CD146, CD45 (BD Pharmingen, San Diego, Estados Unidos), CD133 (Miltenyi Biotec, Auburn, Estados Unidos), CD90, VEGFR2 (R&D Systems, Minneapolis, Estados Unidos), HLA-DR y CD117 (BD Biosciences) en un citómetro de flujo FACSCanto con doble láser mediante el Cell-Quest software (Becton Dickinson, San José, Estados Unidos). Al menos 2.000 eventos se analizan por cada marcador.
Para el cultivo in vitro de células progenitoras endoteliales las células se resuspendieron en medio EBM-2 (Cambrex Bio Science, Walkersville, Estados Unidos) con el 20% de suero bovino fetal a una concentración de 1 × 106 células/ml y se cultivaron en placas pretratadas con fibronectina (BD Biosciences Labware, Bedfor, Estados Unidos) con cambio de medio cada 48 h durante 2 semanas, transcurridas las cuales las colonias formadas por las células progenitoras endoteliales se cuantificaron mediante recuento en microscopio invertido.
El análisis funcional de la capacidad quimiotáctica de las células infundidas se practicó en una cámara de Boyden modificada (BD Biosciences Labware) de la siguiente forma: la cámara superior de una placa de 24 pocillos Transwell con membrana de Matrigel de 6,5 mm de diámetro y poros de 8 μmol se cargó con 5 × 104 CMNMO y la parte inferior de la cámara, con EBM-2 + stromal derived growth factor-1 (SDF-1, 100 ng/ml, R&D Systems), o con EBM-2 + vascular endothelial growth factor (VEGF, 100 ng/ml, R&D Systems) o con medio solo. Las placas se incubaron a 37 °C, con el 95% de humedad y el 5% de CO2 durante 24 h, una vez transcurridas y tras observación bajo un microscopio invertido con sistema de recuento automático por campos, se calculó el porcentaje de células migradas.
Estudio estadístico
Los datos se expresan como media ± desviación estándar. Para la comparación de medias se utilizaron tests no paramétricos (Wilcoxon para datos apareados y Mann-Whitney para datos independientes). Las diferencias entre las tres condiciones del estudio ecocardiográfico del mismo paciente se analizaron mediante un test no paramétrico para muestras relacionadas (test de Friedman). La correlación lineal entre variables cuantitativas se analizó con el test de Pearson, con lo que se obtuvo el índice de correlación r y su significación estadística. Se consideraron estadísticamente significativos los valores de p < 0,05.
RESULTADOS
Evolución clínica
Los 19 pacientes seleccionados tenían una media de edad de 56 ± 8 años; 17 eran varones y 2, mujeres. La media de tiempo transcurrido desde el infarto hasta el momento del estudio fue 27 ± 45 meses. Dos de ellos tenían implantado un desfibrilador automático por haber presentado arritmias letales; 16 de ellos habían sido revascularizados durante la fase aguda o de forma diferida; por el contrario, 3 pacientes carecían de estudio hemodinámico previo tras el infarto y fueron revascularizados antes de la inclusión en el estudio con stents liberadores de medicamento. La media de tiempo de seguimiento en la actualidad es 21 ± 11 meses.
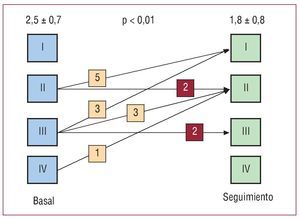
Todos los pacientes mostraron una buena evolución tras la infusión intracoronaria de CMNMO. Ninguno presentó arritmias dignas de mención en las siguientes 24 h ni elevación significativa de enzimas en sangre (media de CPK pico de 125 ± 39 U). Todos los pacientes recibieron el alta con tratamiento médico y estrecho seguimiento. Seis pacientes precisaron rehospitalización por insuficiencia cardiaca y 3, por angina. Dos pacientes presentaron reestenosis, y otro, progresión de enfermedad coronaria, que precisaron nueva revascularización. Tres pacientes fallecieron durante el seguimiento (6, 9 y 11 meses después), debido a infarto de miocardio, insuficiencia cardiaca y accidente cerebrovascular, respectivamente. La evolución del grado funcional de los supervivientes queda reflejada en la figura 1. Como en ella puede observarse, en general hubo una mejora en el grado funcional, sin cambio detectable en 4 pacientes. La prueba de esfuerzo con consumo de oxígeno a los 6 meses no reflejó cambios significativos, aunque tampoco empeoramientos (23 ± 8 frente a 24 ± 8 ml/kg/min; sin significación estadística).
Fig. 1. Evolución del grado funcional. Se observó, en general, una mejora en el grado funcional, sin cambios detectables en 4 pacientes.
Estudio biológico
Los pacientes recibieron una media de 10,02 ± 0,9 × 108 CMNMO. El número de células infundidas que expresaban cada uno de los fenotipos estudiados mediante citometría de flujo y sus características funcionales en cuanto a migración y formación de colonias endoteliales quedan reflejados en la tabla 1.
Evolución funcional
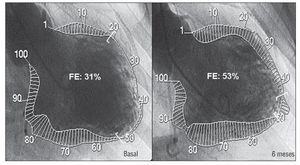
La tabla 2 refleja los cambios observados en volúmenes ventriculares en el grupo total de pacientes con seguimiento angiográfico a los 6 meses y ecocardiográfico al año de la terapia celular. Como en ella puede observarse, la FE por métodos angiográficos mostró una ganancia neta media del 5% que resultó algo mayor (10%) al valorarla por métodos ecocardiográficos. No hubo cambios significativos en los volúmenes ventriculares angiográficos, es decir, no se observó en 6 meses un empeoramiento del remodelado ventricular. Al analizar la función regional en el latido sinusal, se observó una disminución significativa del número de cuerdas hipocinéticas o acinéticas en el ventriculograma. Es decir, la mejora funcional está basada en una cierta recuperación de las zonas periinfarto de la pared anterior (fig. 2). De hecho, se observó una correlación directa entre la ganancia en FE y la ganancia de cuerdas (r = 0,57; p < 0,02). Sin embargo, no se observaron cambios significativos en el SCA. La HRC de la descendente anterior se mantuvo en valores normales y similares a los del estudio basal. En relación con el latido postextrasistólico, tampoco se observaron cambios significativos en volúmenes ventriculares, en la FE ni en el SCA. Sin embargo, sí hubo una disminución significativa del número de cuerdas hipocinéticas o acinéticas en la zona anterior periinfarto. Tampoco se apreciaron cambios significativos en la potenciación postextrasistólica, que parece mantenerse en valores parecidos al cabo de 6 meses.
Fig. 2. Cambios ventriculográficos funcionales en un paciente claramente respondedor a la infusión celular.
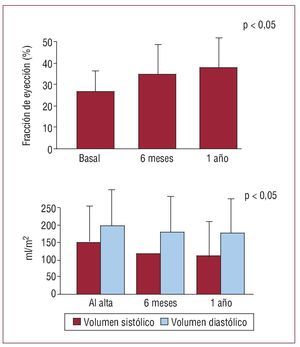
Al analizar los cambios seriados en función ventricular por métodos ecocardiográficos, se observa una disminución significativa de los volúmenes ventriculares al año, junto con una mejora de la FE (fig. 3).
Fig. 3. Cambios en volúmenes y fracción de eyección observados con ecocardiografía.
Al observar los cambios funcionales angiográficos de una forma individualizada, se observaron dos tipos de respuesta a la terapia celular. Por un lado, los aparentemente «no respondedores» con cambios netos en FE < 3% o incluso con empeoramiento (grupo I; n = 9). Por otro, los que mostraban una ganancia > 3% (grupo II; n = 8) y que, por lo tanto, podrían considerarse como «respondedores» a los teóricos efectos de la terapia celular actual. El punto de corte del 3% se ajustó por una buena distribución de los dos grupos de pacientes y por haber sido el cambio medio en el grupo control del estudio TOPCARE-AMI2. No hubo cambios significativos en los pacientes del grupo I, en volúmenes ni en FE. Sin embargo, sí presentaban mayores volúmenes ventriculares y un remodelado más adverso en condiciones basales. En los pacientes del grupo II, sí se observaron cambios significativos en parámetros de función global y regional, con una ganancia media neta del 10% (intervalo, 6-22) en FE (tabla 3).
Factores relacionados con el grado de recuperación
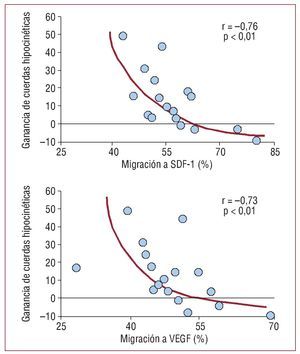
La tabla 3 también muestra los parámetros analizados en el estudio univariable. El número total de células infundidas no pareció tener influencia en nuestro estudio, aunque este número fue bastante homogéneo, por encima de 10 × 108 en el 79% de los pacientes. El tiempo de la resvascularización al implante sí parece influir, así como la hipertensión. Por otro lado, la tabla 4 muestra una matriz de correlaciones lineales entre parámetros de recuperación funcional y parámetros del estudio biológico in vitro. Como en ella puede apreciarse, se observó una persistente relación inversa entre los parámetros de ganancia funcional y los biológicos que expresan un estado de actividad proclive a la migración en la muestra de células infundidas. Al analizar detenidamente estas relaciones, comprobamos que tienen un carácter exponencial en determinados parámetros (fig. 4) y, paradójicamente, siempre indican que a mayor migración específica de las células a SDF-1 y a VEGF, menor recuperación funcional. Sin embargo, no existía relación alguna entre la ganancia funcional y CXCR4.
Fig. 4. Correlaciones exponenciales entre la ganancia de cuerdas hipocinéticas con la migración, en porcentaje, a stromal derived factor 1 (SDF-1) y con la migración al vascular endothelial growth factor (VEGF).
DISCUSIÓN
Los pacientes seleccionados para este ensayo clínico tenían en común haber padecido un infarto anterior antiguo con pobre función ventricular residual, a pesar de presentar revascularización completa. Estaban con tratamiento médico óptimo para luchar contra el remodelado ventricular, aunque presentaban síntomas de insuficiencia cardiaca. Se trata, pues, de una serie homogénea de pacientes con alto riesgo y difícil tratamiento. En cualquier caso, el riesgo de mortalidad en estos pacientes es alto, bien por arritmias o bien por insuficiencia cardiaca. Diferentes estudios sobre pacientes en condiciones similares han mostrado la eficacia de diferentes formas y estrategias de terapia celular (tanto en la vía de administración como en el tipo de célula utilizada). En ellos se muestran mejorías clínicas y ganancias funcionales en pacientes con infarto crónico14-20. Nuestros hallazgos también indican que la infusión intracoronaria de CMNMO puede suponer un beneficio funcional de dimensiones reducidas, aunque en determinados pacientes se observa una mayor ganancia. Podríamos distinguir entre respondedores y no respondedores, en términos de función ventricular, a la infusión intracoronaria de CMNMO. En determinados pacientes la mejora funcional resulta clara (fig. 2), mientras que otros no muestran cambios funcionales o incluso empeoran su FE. Los factores que influyen en la respuesta no son conocidos, aunque, según nuestras observaciones, ni la edad, ni el tiempo desde el infarto, ni la RC, ni la potenciación postextrasistólica, ni el número de células infundidas parecen factores influyentes. Sin embargo, el tiempo desde la revascularización a la infusión celular sí pudiera influir (tabla 3). El tiempo entre la revascularización y el implante de células fue más corto entre los respondedores. Aunque separados siempre por meses, la cercanía entre ambos procedimientos parece favorecer la recuperación funcional. Realmente, no puede descartarse un efecto revascularizador tardío, sobre todo en los pocos pacientes con revascularización más próxima a la terapia celular. De igual forma, la hipertensión era más frecuente en los no respondedores.
En relación con los parámetros biológicos analizados, se observaba una pertinaz relación inversa entre los parámetros funcionales y los biológicos que refieren un estado de actividad proclive a la migración. Se ha demostrado que el reclutamiento de células progenitoras medulares por parte del miocardio está determinado por un gradiente positivo de SDF-1, es decir, por una concentración de citocina mayor en el miocardio que en el lecho vascular coronario, y a su vez en la sangre circulante con respecto a la médula ósea 22. Este mecanismo opera de forma natural en las condiciones fisiopatológicas que se producen en las horas siguientes a un infarto agudo, pero en las situaciones de infarto crónico, el gradiente está invertido 23 y la capacidad neovascularizadora de las CMNMO marcadamente reducida 24, lo que dificulta o impide el reclutamiento y la consiguiente anidación de las células progenitoras en el miocardio crónicamente infartado. La infusión intracoronaria de un elevado número de células con capacidad migratoria a SDF-1 puede resultar poco útil en una situación de gradiente invertido de SDF-1 que impide la quimiotaxis imprescindible para la extravasación y la anidación celular. Nuestros resultados muestran que la infusión de un porcentaje más elevado de células con capacidad migratoria rápida (24 h de migración in vitro) a SDF-1 produce una recuperación funcional significativamente menor. La explicación a este fenómeno podría buscarse en el reciente descubrimiento de que la médula ósea posee al menos dos nichos de células madre: un nicho de localización perivascular de movilización rápida y un nicho de localización osteoblástica, en el que residen las células quiescentes, es decir, las verdaderas células madre inmaduras cuya migración en respuesta a SDF-1 sólo se produce al cabo de varios días 23. Es posible que, si pensamos en un teórico efecto paracrino de la infusión celular 25, la mejora funcional del miocardio se deba a esas células en estado quiescente e indiferenciado, capaces de aportar todo tipo de factores de crecimiento al tejido periinfarto. Este hallazgo sorprendente, sin embargo, precisa una confirmación en estudios más numerosos, así como su análisis en agudos, donde la situación es completamente diferente.Limitaciones del estudio
Se trata de un ensayo prospectivo y no tiene un grupo control que permitiera comparar. Además, el número de pacientes estudiados, aunque homogéneo, es limitado, por lo que los resultados deben ser interpretados con mucha precaución y corroborados con series mayores. Por otro lado, la posible mejoría clínica detectada en nuestros pacientes supervivientes pudiera conllevar un cierto efecto placebo, dado el alto interés social por los avances en terapia celular. Sin embargo, no ocurre así con los cambios en la función ventricular.
CONCLUSIONES
La infusión intracoronaria de CMNMO en pacientes con infarto anterior crónico y depresión severa de la función ventricular pudiera producir una ligera mejoría clínica y de la función ventricular, más acusada en un grupo de pacientes que hemos denominado respondedores (grupo II). Éstos se caracterizaban por la revascularización en los últimos 7 meses de media y por no tener hipertensión arterial. Al correlacionar los parámetros de ganancia funcional con los obtenidos del estudio biológico in vitro, se observó una relación inversa entre los parámetros funcionales y los biológicos que indican un estado de actividad proclive a la migración. Este hallazgo paradójico precisa confirmación, pero pudiera tener un significado que hemos de descifrar.
ABREVIATURAS
CMNMO: células mononucleadas de la médula ósea.
FE: fracción de eyección.
RC: reserva coronaria.
SCA: segmento de contracción anormal.
SDF: factor de crecimiento derivado de la estroma.
VEGF: factor de crecimiento vasculoendotelial.
Full English text available from: www.revespcardiol.org
VÉASEEDITORIALENPÁGS. 1117-9
Correspondencia: Dr. J.M. Suárez de Lezo.
Servicio de Cardiología. Hospital Universitario Reina Sofía. Avda. Menéndez Pidal, s/n. 14004 Córdoba. España.
Correo electrónico: grupocorpal@grupocorpal.com
Recibido el 28 de julio de 2009.
Aceptado para su publicación el 26 de enero de 2010.