La fibrilación auricular significa un grave problema de salud pública por sus complicaciones, por lo que su manejo debería incluir no sólo su tratamiento, sino también la prevención de las complicaciones tromboembólicas. El objetivo principal es conocer las proporciones de la fibrilación auricular desconocida y la no tratada con anticoagulantes.
MétodosEstudio observacional, transversal, retrospectivo, de base poblacional y multicéntrico. Se seleccionó aleatoriamente a 1.043 sujetos mayores de 60 años para realizarles un electrocardiograma en visita concertada. Se registraron variables sociodemográficas, valores en las escalas CHA2DS2-VASc y HAS-BLED, razón internacional normalizada y motivos de no recibir tratamiento anticoagulante oral.
ResultadosLa prevalencia total de fibrilación auricular fue del 10,9% (intervalo de confianza del 95%, 9,1-12,8%), de la que el 20,1% era desconocida. De la fibrilación auricular conocida, el 23,5% con un valor de CHA2DS2-VASc ≥ 2 no recibía tratamiento anticoagulante y el 47,9% tenía un valor HAS-BLED ≥ 3. La odds ratio de no recibir tratamiento anticoagulante fue 2,04 (intervalo de confianza del 95%, 1,11-3,77) para las mujeres, 1,10 (intervalo de confianza del 95%, 1,05-1,15) para la mayor edad de diagnóstico y 8,61 (intervalo de confianza del 95%, 2,38-31,0) si el valor de CHA2DS2-VASc es<2. El deterioro cognitivo (15,2%) fue el motivo principal de no recibir tratamiento anticoagulante.
ConclusionesEl 20,1% de las fibrilaciones auriculares de pacientes mayores de 60 años son desconocidas previamente y no se trata con anticoagulantes al 23,5% del total.
Palabras clave
La fibrilación auricular (FA) es un grave problema de salud pública con un significativo impacto en los costes sanitarios1. Se asocia a graves complicaciones2 como ictus, embolia sistémica, insuficiencia cardiaca y deterioro mental, lo que comporta una considerable morbimortalidad2–4; de ahí la gran importancia de su diagnóstico precoz y el tratamiento adecuado5. Hoy sabemos que el ictus asociado a la FA implica mayor gravedad, mayor mortalidad y mayor discapacidad6,7, lo que supone un mayor impacto socioeconómico por los costes derivados de la hospitalización y los cuidados y la atención domiciliarios que precisan los pacientes8–10. Por ello el manejo de los pacientes con FA debe incluir el tratamiento no sólo de la propia fibrilación, sino también para la prevención de ictus y otros accidentes tromboembólicos11.
Si bien desde 194712 el tratamiento anticoagulante oral (TAO) es efectivo en la prevención primaria y secundaria de las embolias en pacientes con FA valvular, hasta después de 1986 no se recomendó13 su uso en pacientes con FA no valvular, mientras actualmente14–16 se recomienda como elección óptima. La inclusión de nuevas herramientas como el índice de riesgo CHADS2 (por las siglas en inglés de insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus [doble])17 y su actualización a CHA2DS2-VASc (por las siglas en inglés de insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes, ictus [doble], enfermedad vascular y categoría de sexo [mujeres])18–20 para estratificar a los pacientes según su riesgo y la escala HAS-BLED (por las siglas en inglés de hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad > 65 años y toma concomitante de fármacos o alcohol) para evaluar el riesgo de hemorragia21–23 permite decisiones clínicas más eficientes tanto en la indicación como en el tipo de TAO. Aun así, hoy es frecuente que una proporción significativa de pacientes con FA no reciba TAO24.
ObjetivosLos principales objetivos de este estudio son estimar la prevalencia de FA desconocida entre los pacientes mayores de 60 años en la comarca del Baix Ebre y el porcentaje de pacientes con FA sin TAO. Los objetivos secundarios: conocer la distribución de la población con FA en las escalas CHA2DS2-VASc y HAS-BLED; identificar las características de los pacientes con FA sin TAO y conocer los motivos de que no se administrara TAO a los pacientes con indicación de recibirlo.
MÉTODOSTipo de estudioEstudio observacional transversal, retrospectivo, multicéntrico y de base poblacional. Se entiende por FA paroxística la que tiene una duración < 7 días; persistente, la que dura más de 7 días y menos de 12 meses, y permanente, la que dura indefinidamente25. Nuestro estudio incluye la FA en cualquiera de sus presentaciones en función del registro en la historia clínica. Se consideró FA desconocida cuando el registro electrocardiográfico era positivo pero no había registros de FA en la historia clínica del sujeto. Para el primer objetivo principal, se obtuvo una muestra aleatoria de 1.043 pacientes de más de 60 años y residentes en la comarca del Baix Ebre, con un nivel de confianza del 95% y un error de precisión del 5%. Se seleccionó de cada centro de atención primaria o consultorio un número de casos proporcional a los mayores de 60 años asignados a ellos (tabla 1). Se los convocó telefónicamente a realizarse un electrocardiograma (ECG) en su centro de atención primaria previo consentimiento informado. En el momento de la visita personal concertada, se revisaba la historia clínica y los médicos investigadores y el cardiólogo después realizaban e interpretaban el ECG.
Análisis descriptivo de la distribución de los pacientes geográfica y por ámbitos
| Variables | Pacientes (n=1.043) | Casos con historia de FA (n=271) |
| Centro de Atención Primaria | ||
| Aldover | 17 (1,6) | 4 (1,4) |
| Alfara de Carles | 7 (0,6) | 2 (0,7) |
| Tortosa-Baix Ebre | 179 (17,2) | 46 (17,0) |
| Benifallet | 13 (1,2) | 4 (1,5) |
| Bítem | 21 (2,0) | 5 (1,8) |
| Camarles | 32 (3,1) | 8 (3,0) |
| Camp-Redó | 17 (1,6) | 4 (1,5) |
| Deltebre | 151 (14,5) | 39 (14,4) |
| El Perelló | 55 (5,3) | 14 (5,2) |
| El Raval de Crist | 16 (1,5) | 4 (1,5) |
| Tortosa-El Temple | 151 (14,5) | 42 (15,5) |
| Els Reguers | 7 (0,7) | 3 (1,1) |
| Jesús | 48 (4,6) | 13 (4,8) |
| L’Aldea | 53 (5,1) | 13 (4,8) |
| L’Ampolla | 43 (4,1) | 11 (4,1) |
| L’Ametlla de Mar | 84 (8,1) | 21 (7,7) |
| Lligallo de Ganguil | 13 (1,2) | 3 (1,1) |
| Mas de Barberans | 12 (1,2) | 3 (1,1) |
| Paüls | 10 (1,0) | 3 (1,1) |
| Roquetes | 76 (7,3) | 20 (7,4) |
| Tivenys | 18 (1,7) | 4 (1,5) |
| Xerta | 20 (1,9) | 5 (1,8) |
| Ámbito | ||
| Rural | 171 (16,4) | 44 (16,2) |
| Semiurbano | 391 (37,5) | 100 (36,9) |
| Urbano | 481 (46,1) | 127 (46,9) |
FA: fibrilación auricular.
Los datos expresan n (%).
Para el segundo objetivo principal, se obtuvo una segunda muestra aleatoria (n=271) de historias clínicas con FA conocida. Esta muestra incluyó a los 64 pacientes con FA ya conocida y confirmada que integraban la primera muestra. Se seleccionó de cada centro de atención primaria o consultorio un número de casos proporcional a los mayores de 60 años asignados a ellos entre la población de pacientes con FA conocida previamente. La recogida de las variables del estudio se realizó en un formulario electrónico en Microsoft Access.
Variables del estudioVariables identificadoras de paciente: código identificador de paciente (número de centro-número de paciente para el estudio).
Variables sociodemográficas y clínicas: se ha considerado como relacionados con ámbito rural a los ubicados en municipios de menos de 1.000 habitantes; semiurbano, a los de entre 1.000 y 10.000, y urbano a los de más de 10.000.
Variables recogidas en relación con el indicador CHA2DS2-VASc: fecha de nacimiento, sexo, diagnóstico de hipertensión, diagnóstico de diabetes mellitus, historia de insuficiencia cardiaca, ictus previo, accidente isquémico transitorio previo, tromboembolia previa e historia de enfermedad vascular (infarto previo, placa aórtica compleja, enfermedad arterial periférica, incluidas revascularización previa, amputación debida a enfermedad arterial periférica o evidencia angiográfica de enfermedad arterial periférica).
Variables adicionales recogidas en relación con el indicador HAS-BLED: valor de la última toma de presión arterial (mmHg), función renal alterada (diálisis crónica, trasplante renal o creatinina en suero ≥ 200mol/l), función hepática alterada (enfermedad crónica hepática —como cirrosis— o evidencia bioquímica significativa de trastorno hepático —p. ej., bilirrubina 2 veces por encima del límite, en asociación con AMT/AAT/APT 3 veces por encima del límite—), historia o predisposición a hemorragia (historia previa de hemorragia y/o predisposición al hemorragia), razón internacional normalizada (INR) lábil (valor de INR inestable/elevado o poco tiempo en el intervalo terapéutico: < 60%) y uso crónico de fármacos concomitante (agentes antiplaquetarios, antiinflamatorios no esteroideos y abuso de alcohol).
Tratamiento que se está recibiendo el día de análisis de la historia clínica (categorías: sin tratamiento, antiagregante, anticoagulante oral y anticoagulante parenteral).
Variable de motivo por el que no se prescribiría o se retiraría el TAO: las categorías de la variable fueron imposibilidad de realizar controles periódicos, riesgo de hemorragia, rechazo o preferencia del paciente, deterioro cognitivo, caídas frecuentes, hipertensión mal controlada, polimedicación, no corresponde por CHA2DS2-VASc, no está indicada y otros. Para cubrir el objetivo se realizaron entrevistas a 28 profesionales de atención primaria seleccionados aleatoriamente y se revisaron las historias clínicas incluidas en el segundo objetivo. Se envió por correo electrónico un cuestionario especialmente diseñado para el estudio a cada uno de los profesionales seleccionados aleatoriamente (n=30). Se dieron 30 días para obtener respuesta al cuestionario. En caso de no recibirse respuesta, se procedió a pedir la colaboración al médico seleccionado como suplente. Los mismos investigadores revisaron las historias clínicas. La recogida de las variables se realizó de forma electrónica mediante un formulario en Microsoft Access específicamente diseñado.
Valores de INR tomados en los últimos 3 meses: para cada valor tomado, fecha en formato DD/MM/AAAA y porcentaje de tiempo en que el paciente presentó valores de INR dentro de la banda terapéutica (2-3).
Análisis estadísticoSe realizó un análisis descriptivo de las variables utilizando mínimo, media, desviación estándar y máximo en el caso de las variables continuas y el número de casos y porcentaje de pacientes en el caso de variables categóricas, y sus intervalos de confianza considerando una población de referencia finita. Se comparó la distribución de diferentes factores de riesgo en los grupos de individuos clasificados a partir del diagnóstico de FA. Los resultados se obtuvieron a partir del test de la χ2 o el exacto de Fisher para variables categóricas, o análisis de la varianza o Kruskal-Wallis para continuas. Se realizó un análisis de regresión logística con los 271 pacientes de la segunda muestra para analizar posibles factores que caractericen a la población que está diagnosticada pero no recibe TAO, calculando su capacidad de discriminación mediante la curva ROC (receiver operating characteristic) y de calibración mediante el test de Hosmer-Lameshow, con los intervalos de confianza del 95% (IC95%) para los coeficientes del modelo. La variable dependiente dicotómica fue la condición de estar recibiendo TAO o no.
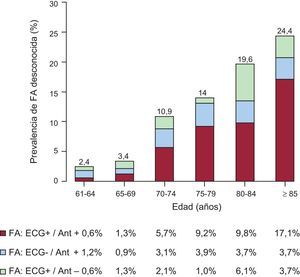
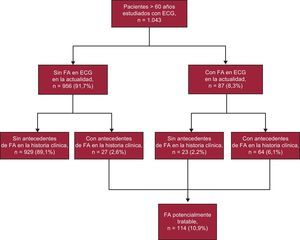
RESULTADOSLa figura 1 muestra la prevalencia de FA estratificada por grupos de edad. La media de edad de la población de estudio (n=1.043) era 78,9±7,3 años. La prevalencia de FA era del 10,9% (IC95%, 9,1-12,8%). Se incrementa con la edad del 2,4% a los 61–64 años al 24,4% en la ≥ 85, donde se invierte a favor de las mujeres y se alcanza la máxima prevalencia, el 26,2%. En la figura 2 se describen las diferentes situaciones posibles, de modo que 23 (20,1%) casos de 114 FA confirmadas o registradas serían desconocidas y alrededor de una de 45 personas (23 de 1.043 participantes) padecería una FA desconocida.
En la tabla 2 se describen las variables descriptivas y relacionadas con las escalas CHA2DS2-VASc y HAS-BLED, los antecedentes de enfermedades vasculares, el tratamiento y la procedencia de la muestra poblacional con FA conocida. La distribución del indicador CHA2DS2-VASc estaba centrada en el valor 4, y el 94,1% tiene un valor ≥ 2. En cuanto a la escala HAS-BLED, los sujetos con función renal anormal y función hepática anormal fueron el 14,4 y el 15,1% respectivamente. El 47,9% tenía valores de HAS-BLED ≥ 3. El valor de CHA2DS2-VASc se correlacionó positivamente con el de HAS-BLED (rho de Spearman=0,33). Los hipertensos y los diabéticos en la población de estudio fueron el 70,8 y el 26,6% respectivamente. El 14,8% de la población tenía registrada la presencia de enfermedades vasculares. De los casos que tenían registrado algún tipo de enfermedad vascular, prácticamente un 90% había sufrido un infarto previamente. Considerando el agregado de los factores de riesgo, la gran mayoría de la población estudiada tenía tres o menos factores de riesgo.
Análisis descriptivo de las variables demográficas y relacionadas con las puntuaciones CHA2DS2-VASc y HAS-BLED y otros factores de riesgo de fibrilación auricular
| Casos de FA | Persistente/permanente | Paroxística | p | Varones | Mujeres | p | |
| Pacientes | 271 (100) | 228 (84,1) | 43 (15,9) | 136 (50,2) | 135 (49,8) | ||
| Sexo femenino | 135 (49,8) | 107 (49,9) | 28 (65,1) | 0,03 | |||
| Edad ≥ 75 años | 203 (74,9) | 176 (77,2) | 27 (62,8) | 0,46 | 93 (68,4) | 110 (81,5) | 0,01 |
| Edad (años) | 78,90±7,33 | 79,37±7,42 | 76,42±6,36 | 0,15 | 78,7±8,1 | 79,1±6,5 | 0,65 |
| Edad al diagnóstico (años) | 73,65±8,00 | 74,03±8,05 | 71,63±7,45 | 0,07 | 73,3±8,9 | 73,9±7,0 | 0,54 |
| Tiempo hasta el diagnóstico (años) | 5,24±3,66 | 5,32±3,74 | 4,78±3,18 | 0,37 | 5,4±309 | 5,1±3,4 | 0,44 |
| Diagnóstico de hipertensión | 192 (70,8) | 160 (70,2) | 32 (74,4) | 0,57 | 90 (66,2) | 102 (75,6) | 0,09 |
| Diagnóstico de diabetes mellitus | 72 (26,6) | 63 (27,6) | 9 (20,9) | 0,36 | 34 (25,0) | 38 (28,1) | 0,56 |
| Historia clínica de IC | 62 (22,9) | 58 (25,4) | 4 (9,3) | 0,02 | 25 (18,4) | 37 (27,4) | 0,08 |
| Ictus previo | 39 (14,4) | 33 (14,5) | 6 (14,0) | 0,93 | 19 (14%) | 20 (14,8) | 0,84 |
| AIT previo | 8 (3,0) | 7 (3,1) | 1 (2,3) | 1 | 3 (2,2) | 5 (3,7) | 0,47 |
| Tromboembolia previa | 6 (2,2) | 6 (2,6) | 0 | 0,59 | 5 (3,7) | 1 (0,7) | 0,21 |
| Historia de enfermedad vascular | 40 (14,8) | 32 (14,0) | 8 (18,6) | 0,44 | 22 (16,2) | 18 (13,3) | 0,51 |
| CHA2DS2-Vasc ≥ 2 | 255 (94,1) | 217 (95,2) | 38 (88,4) | 0,15 | 123 (90,4) | 97,8 (97,8) | 0,01 |
| CHA2DS2-Vasc ≥ 1 | 269 (99,3) | 226 (99,1) | 43 (100) | 1 | 134 (98,5) | 135 (100) | 0,50 |
| Función renal anormal | 39 (14,4) | 37 (16,2) | 2 (4,7) | 0,047 | 28 (20,6) | 11 (8,1) | 0,004 |
| Función hepática anormal | 41 (15,1) | 36 (15,8) | 5 (11,6) | 0,48 | 29 (21,3) | 12 (8,9) | 0,004 |
| Historia o predisposición a hemorragia | 6 (2,2) | 5 (2,2) | 1 (2,3) | 1 | 5 (3,7) | 1 (0,7) | 0,21 |
| Uso crónico de fármacos (AAS y/o AINE) | 14 (5,2) | 12 (5,3) | 2 (4,7) | 1 | 8 (5,9) | 6 (4,4) | 0,60 |
| HAS-BLED ≥ 3 | 90 (47,9) | 78 (48,1) | 12 (46,2) | 0,85 | 50 (51,5) | 40 (44,0) | 0,30 |
| Alcoholismo de riesgo (actual y/o previo) | 7 (2,7) | 6 (2,7) | 1 (2,4) | 1 | 7 (5,5) | 0 | 0,006 |
| Tabaquismo de riesgo (actual y/o previo) | 48 (17,9) | 41 (18,2) | 7 (16,3) | 1 | 48 (36,1) | 0 | < 0,001 |
| Sin TAO | 66 (24,4) | 51 (22,4) | 15 (34,9) | 0,08 | 27 (19,9) | 39 (28,9) | 0,08 |
| Rural | 44 (16,2) | 39 (17,1) | 5 (11,6) | 0,37 | 22 (16,2) | 22 (16,3) | 0,98 |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; AIT: accidente isquémico transitorio; FA: fibrilación auricular; IC: insuficiencia cardiaca; TAO: tratamiento anticoagulante oral.
Los datos expresan n (%) o media±desviación estándar.
Como se puede apreciar en la figura 3, los no tratados eran el 23,5% de los casos en que sí estaba indicado por CHA2DS2-VASc ≥ 2 y el 37,5% de los casos en que no por CHA2DS2-VASc < 2. Valores más altos del indicador, el sexo masculino y la edad se asociaron con TAO. De los pacientes con antecedentes de FA no confirmada en el ECG actual, el 37,5% (IC95%, 21,1-57,3%) recibían TAO. De las FA desconocidas, ninguna se trataba con TAO.
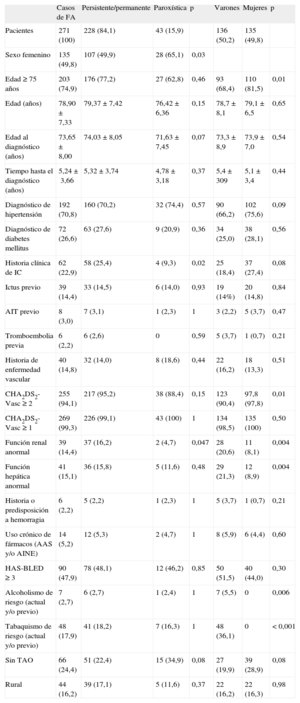
Al 86,7% de los sujetos con TAO se los monitorizaba en los centros de atención primaria de referencia mediante un programa informatizado para definir los ajustes de dosificación. De los 895 valores de INR recogidos, el 38,0% estaba fuera de la banda terapéutica, sin diferencias significativas (p=0,47) entre centro de atención primaria y hospital de referencia. De los 195 casos con mediciones disponibles, la media fue 2,60±0,44. Si bien el 17,9% de los casos tenían un valor medio fuera del rango terapéutico, el 80,5% de los casos había tenido algún valor de INR fuera de este (2-3) (tabla 3). La media del porcentaje de tiempo en que el paciente presentó valores de INR dentro de franja terapéutica en los últimos 3 meses fue del 69,1±27,9%. El 32,3% de los casos tuvieron INR en franja terapéutica menos del 60% del tiempo.
Análisis descriptivo de la razón internacional normalizada < 2 y > 3 en pacientes diagnosticados de fibrilación auricular
| Variables | Casos, n (%) |
| Pacientes con valores de INR fuera de rango terapéutico | |
| No | 38 (19,5) |
| Sí | 157 (80,5) |
| Valores de INR fuera de rango terapéutico | |
| No | 555 (62,0) |
| Sí | 340 (38,0) |
INR: razón internacional normalizada.
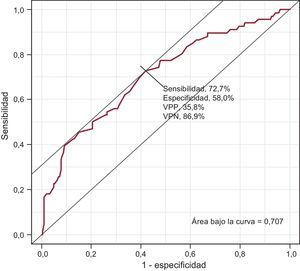
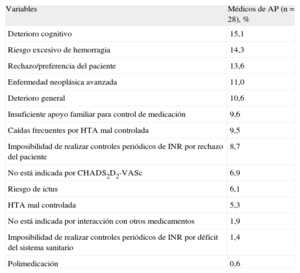
Entre los pacientes con recomendación de TAO (tabla 4) a partir de la revisión de la historia clínica, «no corresponde por CHA2DS2-VASc», «deterioro cognitivo» y «riesgo de hemorragia» fueron las causas más frecuentes de no prescribirlo. Cabe destacar que hay un 30,3% de casos de los que no se pudo obtener información. Según las respuestas de los profesionales de atención primaria (tabla 5), los motivos para no establecer o retirar un TAO que obtuvieron un mayor porcentaje medio fueron deterioro cognitivo (15,1%), riesgo excesivo de hemorragia (14,3%) y rechazo/preferencia del paciente (13,6%). No recibir TAO se asociaba a sexo femenino (odds ratio [OR]=1,82; IC95%, 1,01-3,30), diagnóstico de hipertensión (OR=0,50; IC95%, 0,27-0,93), edad al diagnóstico de FA (OR=1,07; IC95%, 1,03-1,11) y CHA2DS2-VASc < 2. El riesgo de no recibir TAO era mayor entre las mujeres y aumentaba con la edad de diagnóstico de FA (tabla 6). Todos los coeficientes del modelo son significativos (p<0,001) explicando el 13,9% de la variabilidad. Las propiedades discriminativas mediante el área bajo la curva (0,707) y de calibración (χ2=6,9; p=0,54) demuestran que se ajusta bien a los datos (fig. 4).
Análisis descriptivo del tratamiento e indicadores de riesgo de ictus en pacientes diagnosticados de fibrilación auricular (n=271)
| Variables | Casos, n (%) |
| Motivo no recibir TAO (n=66) | |
| Caídas frecuentes | 5 (7,6) |
| Deterioro cognitivo | 10 (15,1) |
| Hipertensión mal controlada | 1 (1,5) |
| No corresponde por CHADS2 | 14 (21,2) |
| No está indicada | 1 (1,5) |
| Otros | 2 (3,1) |
| Polimedicación | 2 (3,1) |
| Rechazo del paciente | 3 (4,5) |
| Riesgo de hemorragia | 8 (12,1) |
| Sin información | 20 (30,3) |
| CHADS2(n=271) | |
| 0 | 19 (7,0) |
| 1 | 59 (21,7) |
| 2 | 84 (31,0) |
| 3 | 61 (22,5) |
| 4 | 33 (12,2) |
| 5 | 11 (4,1) |
| 6 | 4 (1,5) |
| CHA2DS2-VASc (n=271) | |
| 0 | 2 (0,7) |
| 1 | 14 (5,2) |
| 2 | 36 (13,3) |
| 3 | 53 (19,6) |
| 4 | 76 (28,0) |
| 5 | 43 (15,9) |
| 6 | 33 (12,2) |
| 7 | 9 (3,3) |
| 8 | 3 (1,1) |
| 9 | 2 (0,7) |
| HAS-BLED (n=181) | |
| 0 | 1 (0,5) |
| 1 | 20 (10,6) |
| 2 | 77 (41,0) |
| 3 | 59 (31,4) |
| 4 | 22 (11,7) |
| 5 | 8 (4,3) |
| 6 | 1 (0,5) |
| 7 | 0 |
| 8 | 0 |
| 9 | 0 |
TAO: tratamiento anticoagulante oral.
Motivos para no prescribir o retirar el tratamiento anticoagulante oral a pacientes con fibrilación auricular
| Variables | Médicos de AP (n=28), % |
| Deterioro cognitivo | 15,1 |
| Riesgo excesivo de hemorragia | 14,3 |
| Rechazo/preferencia del paciente | 13,6 |
| Enfermedad neoplásica avanzada | 11,0 |
| Deterioro general | 10,6 |
| Insuficiente apoyo familiar para control de medicación | 9,6 |
| Caídas frecuentes por HTA mal controlada | 9,5 |
| Imposibilidad de realizar controles periódicos de INR por rechazo del paciente | 8,7 |
| No está indicada por CHADS2D2-VASc | 6,9 |
| Riesgo de ictus | 6,1 |
| HTA mal controlada | 5,3 |
| No está indicada por interacción con otros medicamentos | 1,9 |
| Imposibilidad de realizar controles periódicos de INR por déficit del sistema sanitario | 1,4 |
| Polimedicación | 0,6 |
AP: atención primaria; HTA: hipertensión arterial; INR: razón internacional normalizada.
Análisis de regresión logística con factores que caractericen a la población no tratada con anticoagulantes entre los pacientes diagnosticados de fibrilación auricular y con CHA2DS2-VASc ≥ 2. Variables significativas en el modelo multivariable (n=60)
| Variables independientes | OR (IC95%) | p |
| Sexo | ||
| Varones | 1 | |
| Mujeres | 2.049 (1.112-3.776) | 0,021 |
| CHA2DS2-VASc < 2 | ||
| No | 1 | |
| Sí | 8.613 (2.389-31.049) | 0,001 |
| Edad al diagnóstico de FA | 1.103 (1.053-1.155) | < 0,001 |
FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio.
La prevalencia de FA en nuestra población no hospitalizada es similar a la descrita en otros estudios3,24,26,27, con una prevalencia absoluta del 2,2% de FA desconocida, equivalente al 20,1% de la prevalencia total de FA, por encima de los resultados de otros estudios, cuya magnitud oscila en un 0,49%-1,7%24,28–30 con método de ECG convencional, pero incluso inferior a la FA identificada (30%)31 en pacientes con factores de riesgo de sufrir un ictus según la monitorización continua. Probablemente, la prevalencia de la FA en la comunidad esté subestimada como consecuencia de la falta de detección y diagnóstico. Si bien existen estudios6,27 sobre la prevalencia de FA entre pacientes que han sufrido un ictus en los que parece confirmarse un posible infradiagnóstico de la afección, no se puede compararlos con resultados de la población general. Si bien los datos confirman el evidente incremento con la edad en la prevalencia de la FA persistente y que la hipertensión arterial es el factor de riesgo cardiovascular más frecuentemente asociado3,32,33, junto con la presencia de enfermedad cardiovascular34, no hay suficiente evidencia de qué procedimientos puedan ser más efectivos35 para un diagnóstico precoz de la FA y reducir los riesgos asociados. Las propuestas van desde el cribado oportunista36,37 a monitorizar a los pacientes sin historia de FA pero con CHA2DS2-VASc38,39.
La FA no conocida y la no tratada suman el 43,9% de la prevalencia total, lo cual define la magnitud del problema, diferente del de la FA conocida y no tratada. Si bien en la línea de resultados aportados por el Plan Director para la atención de la enfermedad cerebrovascular en Cataluña40 —el estudio muestra un porcentaje de pacientes tratados con TAO superior a la evidencia publicada24,27,41–43 y con un porcentaje de tiempo en que el paciente presenta valores de INR en franja terapéutica similar o superior a los publicados44 según los centros y los estados: p. ej., en Reino Unido y en Suecia, los centros participantes alcanzaron porcentajes de tiempo con el paciente en INR terapéutica del 72 y el 77% respectivamente—, aún estaríamos lejos de obtener resultados cercanos al 80% de nuestros pacientes, según el principio de aplicabilidad de las guías de práctica clínica en nuestra práctica clínica habitual45–47 y deberíamos profundizar en las causas del TAO en alrededor de un tercio de los sujetos en los que no estaría indicado por CHA2DS2-VASc, ya que podría ser un riesgo evitable.
Por la evidencia del incremento del efecto beneficioso absoluto del TAO a medida que aumenta la edad de los pacientes, junto con la disponibilidad de escalas que permiten estratificar el riesgo y facilitar las decisiones en cuanto a profilaxis antitrombótica, los médicos de atención primaria desempeñan un papel esencial en el cribrado, la detección precoz, la evaluación del riesgo y la prescripción y el ajuste del TAO de los sujetos con FA, por lo que resulta interesante conocer los motivos de que un paciente con indicación de TAO no lo reciba. No podemos descartar un sesgo de subjetividad con el «deterioro cognitivo» y el «riesgo de hemorragia». Dado que con las nuevas escalas se produce una tendencia a la inclusión de pacientes, consideramos apropiado un debate más allá de criterios estrictamente clínicos relacionado con el mantenimiento del TAO considerando los beneficios y las oportunidades que han generado los nuevos anticoagulantes orales desde la perspectiva de la sociedad48. Finalmente, el uso sistemático de la escala HAS-BLED16,20,49 podría disminuir los riesgos de hemorragia manteniendo los beneficios del TAO. La mediana de puntuación de la escala HAS-BLED en nuestra población y el tiempo en franja terapéutica son similares a los de la evidencia conocida20, y destaca que la coincidencia en la mayor parte de los factores utilizados en ambas escalas pueda ser altamente predictiva no sólo del riesgo de hemorragia, sino también de la incidencia de eventos cardiovasculares en los pacientes con FA y TAO, como ya evidencian algunos estudios49.
Comparado con los resultados de la regresión, el riesgo de no recibir TAO es mayor para las mujeres y se incrementa según aumenta la edad, pero no según el tiempo desde el diagnóstico, lo que coincide con la evidencia conocida50. Por otra parte, si bien ya se han descrito diferencias en el manejo de la FA entre varones y mujeres51 que podrían justificarse especialmente por la mayor edad de estas, aunque no exclusivamente por sus características clínicas, el uso de escalas para estratificar el riesgo de hemorragia y el riesgo cardiovascular debería mejorar la prescripción estándar del TAO y disminuir el efecto del progresivo envejecimiento de la población.
CONCLUSIONESEl envejecimiento de la población se asocia a un incremento progresivo de la prevalencia de FA (24,4%), de la que alrededor del 20% no ha sido diagnosticada.
Los pacientes con FA sin TAO son el 23,5%, a los que debería sumarse una parte del porcentaje sin TAO de la FA desconocida o no diagnosticada.
El riesgo de no recibir TAO aumenta con la edad al diagnóstico de la FA y es mayor para las mujeres.
CONFLICTO DE INTERESESEl presente proyecto fue promovido por el Pla Director de la Malaltia Vascular Cerebral del Departament de Salut de la Generalitat de Catalunya y pretende conocer la situación real de la FA y su manejo sanitario en el contexto geográfico de Cataluña. Estudio aprobado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS, Clinical Trial Registration MGL-ANT-2011-01) y el Comité Ético de Investigación Clínica del IDIAP (Instituto de Investigación en Atención Primaria) Jordi Gol (5011/011). Estudio financiado por Boehringer Ingelheim España, S.A.