La muerte súbita cardiaca (MSC) suma más de 4 millones de muertes anuales en el mundo. Si bien su causa más común es la enfermedad coronaria, las diferentes etiologías comparten un mecanismo de arritmias común. El desfibrilador automático implantable (DAI) es la estrategia de prevención primaria y secundaria más efectiva. La decisión de implantar un DAI en prevención primaria se basa en gran medida en la fracción de eyección del ventrículo izquierdo ≤ 35%, pero este criterio por sí solo no es sensible ni específico. Los nuevos parámetros de imagen son prometedores para mejorar la selección de candidatos a un DAI. La resonancia magnética cardiaca (RMC) es una técnica poderosa y versátil, con la capacidad de evaluar exhaustivamente la estructura y la función cardiaca. Diversas variables basadas en técnicas de RMC (realce tardío de gadolinio, mapeo T1, relaxometría T2*, imagen por deformación) se han asociado con arritmias ventriculares y riesgo de MSC. En este artículo se revisa el papel de la RMC en la estimación del riesgo de las arritmias ventriculares y de la MSC en la enfermedad coronaria, las miocardiopatías no isquémicas, el trasplante cardiaco, la miocardiopatía por sobrecarga de hierro y la cardiopatía valvular. Antes de que se pueda recomendar su uso habitual para guiar las estrategias de prevención de la MSC, se necesitan estudios prospectivos aleatorizados y la estandarización de las técnicas de RMC.
Palabras clave
La muerte súbita cardiaca (MSC) se define como «una muerte no traumática e inesperada que tiene lugar en la primera hora tras el inicio de los síntomas en un individuo aparentemente sano»1. La MSC es la causa de una quinta parte de todas las muertes y excede los 4 millones anuales1. Aunque las causas son variadas (enfermedad coronaria, miocardiopatías, miocarditis, cardiopatía congénita y valvular, así como enfermedades electrofisiológicas primarias), las distintas etiologías comparten las arritmias ventriculares (AV) como vía final común. La inserción de un desfibrilador automático implantable (DAI) es la estrategia más eficaz en prevención tanto primaria como secundaria. En la práctica actual, la decisión de implantar un DAI en prevención primaria se basa en gran medida en la fracción de eyección del ventrículo izquierdo (FEVI) ≤ 35%1. Sin embargo, apeas 1/5 pacientes que sufren MSC tienen una FEVI ≤ 35%, y las terapias apropiadas de DAI ocurren en menos de un tercio de los receptores de DAI con FEVI ≤ 35%2-4. Por lo tanto, basar la decisión de implantar un DAI solo en la FEVI no es ni sensible ni específico. El reciente estudio DANISH (estudio danés para evaluar la eficacia de los DAI sobre la mortalidad en pacientes con insuficiencia cardiaca no isquémica) ha vuelto a poner el énfasis en la necesidad de mejorar la selección de los candidatos a un DAI, pues no pudo confirmar un claro beneficio del DAI en la prevención primaria para pacientes con insuficiencia cardiaca no isquémica5. Además, para los pacientes con miocardiopatías, que con frecuencia tienen la FEVI conservada (> 50%) y un sabido mayor riesgo de AV y MSC, la decisión de implantar un DAI como prevención primaria se basa en otros parámetros, como las dimensiones de la aurícula izquierda, el grosor del miocardio en el ventrículo izquierdo (VI) y la obstrucción del tracto de salida del VI (p. ej., en la miocardiopatía hipertrófica [MCH])6. No obstante, estas variables no se han probado en ensayos clínicos aleatorizados y siguen siendo mayormente empíricas.
Las nuevas técnicas de diagnóstico por la imagen cardiaca se muestran prometedoras en cuanto a una mejor predicción de la MSC y la precisión de los criterios para la inserción de un DAI. La resonancia magnética cardiaca (RMC) es una técnica potente y versátil, que sirve para evaluar exhaustivamente la estructura y la función cardiacas. Son varias las técnicas de RMC (realce tardío de gadolinio [RTG], mapeo T1, relaxometría T2*, imagen por deformación [strain]) asociadas con riesgo de AV y MSC. En el presente artículo se revisa el papel de la RMC para estimar el riesgo de AV y MSC, relacionando las técnicas de la RMC con: a) la evaluación del sustrato arritmógeno; b) la evidencia clínica, y c) las implicaciones terapéuticas.
TÉCNICAS DE RMC: VISUALIZACIÓN DEL SUSTRATO ARRITMÓGENORealce tardío de gadolinio: cicatriz focal/fibrosisLa cicatriz focal del miocardio es eléctricamente inerte, pero está rodeada por una «zona gris» en la que los miocardiocitos normales se entremezclan con densos haces de fibrosis7. La conducción lenta del impulso en la zona gris permite establecer los circuitos de reentrada, causantes de las AV7. La cicatriz densa, así como la zona gris a su alrededor, puede visualizarse en la RMC con RTG. El gadolinio se acumula en el espacio extracelular, que es mayor en las zonas de cicatriz o fibrosis8. Las imágenes de la secuencia inversión-recuperación se consiguen entre 10 y 20 min después de la administración del gadolinio, y la señal del miocardio normal se anula eligiendo un tiempo apropiado de inversión, que proporciona contraste entre las zonas de acumulación de gadolinio (cicatriz focal/fibrosis) y el tejido normal8. La cicatriz densa se diferencia de la zona gris por la aplicación de un umbral en la intensidad de señal, por ejemplo, ≥ 50% para la cicatriz densa, entre el 30 y el 50% para la zona gris y <30% para el miocardio normal7. Tanto la presencia como la extensión del RTG (masa o porcentaje de masa/volumen miocárdico) se han asociado con riesgo de AV y MSC9.
Mapeo T1 y fracción del volumen extracelular: fibrosis difusaAunque la fibrosis miocárdica difusa causa AV de un modo parecido a la cicatriz/fibrosis, no puede visualizarse con el RTG convencional. El mapeo T1 representa la constante de tiempo de relajación longitudinal del miocardio sobre un mapa de distintos colores píxel por píxel. La presencia de fibrosis difusa se pone de manifiesto en los mapas T1 nativos (sin contraste con gadolinio) y en los posteriores a la administración de contraste mediante varias secuencias de RMC, por ejemplo, inversión-recuperación de look-locker modificada (MOLLI) y versión corta de MOLLI (ShMOLLI)10. El aumento de la fibrosis miocárdica difusa da como resultado valores más altos en el T1 nativo, mientras que tras la administración del medio de contraste con gadolinio los valores T1 son más bajos que en el miocardio normal. El mapeo T1 nativo se ha relacionado de forma independiente con la presencia de AV en las miocardiopatías de etiología isquémica y no isquémica11. Además, la fracción del volumen extracelular (FVE) del miocardio puede calcularse a partir de valores T1 sanguíneos y miocárdicos anteriores y posteriores a la administración de contraste. La FVE refleja el tamaño del espacio extracelular12. Puesto que el colágeno de tipo I es el elemento principal del espacio extracelular en ausencia de edema o amiloidosis, la FVE constituye también un marcador de la fibrosis difusa8.
Relaxometría T2*: hierroLos depósitos de hierro en el miocardio son arritmógenos, aunque el mecanismo específico aún no está claro13,14. El hierro es paramagnético, por lo que influye en el tiempo de relajación T2* alterando la homogeneidad del campo magnético y provocando el desfase de los espines de los protones, con o que se acorta el tiempo T2*. Las secuencias eco de gradiente multieco en apnea sirven para establecer una curva de relajación T2* con una serie de imágenes a tiempos eco cada vez mayores15. A continuación, se ajusta una función exponencial a los puntos de datos según la fórmula siguiente: y=Ke–TE/T2*, donde y es la intensidad de señal, K es una constante, TE es el tiempo eco y T2* el tiempo de relajación T2*, que refleja la cantidad de hierro depositado en el miocardio15,16.
TÉCNICAS DE RMC: DEMOSTRACIÓN INDIRECTA DEL SUSTRATO ARRITMÓGENOImágenes por deformación (strain)Tanto la fibrosis focal como la difusa causan rigidez del miocardio, que puede ponerse de manifiesto como la deformación anómala (strain longitudinal y circunferencial) mediante varias técnicas de marcado de la RMC17. Las anomalías en el strain circunferencial, puestas de manifiesto con el tagging, se relacionan con la AV inducible y la identificación de la zona gris, que desempeña un papel crucial en la arritmogénesis18-20. A diferencia del tagging de la RMC, la técnica de «rastreo de marcas», o feature tracking, identifica los bordes epicárdicos o endocárdicos y sigue su movimiento durante el ciclo cardiaco21. No se requieren otras secuencias, el procesado de los datos es automático por medio de imágenes de cine, lo que hace la técnica muy factible21. El análisis de feature tracking se ha aplicado a la medición global del strain longitudinal como marcador del riesgo de AV y MSC22. Además, la dispersión mecánica del VI, calculada como la desviación estándar del tiempo hasta alcanzar el nivel máximo de strain circunferencial (análisis de feature tracking) de 16 segmentos del VI, es un marcador de la falta de homogeneidad electromecánica debida a la fibrosis/cicatriz miocárdica, que se ha asociado con AV y MSC23,24.
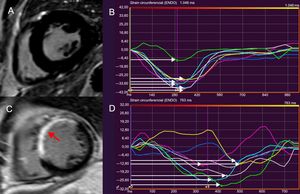
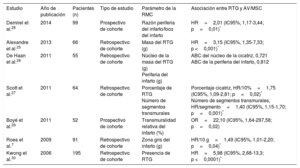
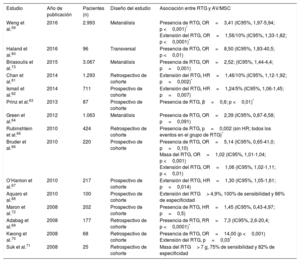
ETIOLOGÍAS DE LA MUERTE SÚBITA CARDIACA: SUSTRATOS ARRITMÓGENOS Y EVIDENCIA DE LA ESTRATIFICACIÓN DEL RIESGO CON LA RMCEnfermedad coronariaLa enfermedad coronaria es la causa más habitual de MSC, debida a la arritmogenicidad de la cicatriz posterior al infarto7. Las pruebas que vinculan la presencia y la carga del RTG a la AV/MSC en el contexto crónico posterior al infarto proceden de varios estudios (tabla 1, figura 1)7,25-30. En 195 pacientes con enfermedad coronaria sospechada sometidos a RMC, la presencia de RTG se relacionó de manera independiente con el desenlace clínico, incluidas las AV que requerían la descarga apropiada del DAI (hazard ratio [HR]=5,98; intervalo de confianza del 95% [IC95%], 2,68-13,3; p <0,0001)30. La carga del RTG (calculada como masa cicatricial) se relacionó de manera independiente con el tratamiento apropiado del DAI en 66 pacientes con enfermedad coronaria crónica (HR=3,15; IC95%, 1,35-7,33; p <0,001)25. El RTG también se relaciona con AV y MSC en el contexto posterior al infarto agudo31,32. En una cohorte de pacientes con enfermedad coronaria, se vio que la proporción entre la zona alrededor del infarto y la zona central (como medida de la zona gris: cicatriz densa) se relacionaba de modo independiente con la AV sostenida y el tratamiento apropiado del DAI (HR=2,01; IC95%, 1,17-3,44; p=0,01)28. En pacientes que han sufrido infarto, las anomalías del strain circunferencial (en las secuencias de tagging) se relacionan con AV inducible y caracterizan la zona gris alrededor del infarto18-20. La dispersión mecánica del VI se relacionó independientemente con la mortalidad y la MSC, incluida la AV y el tratamiento apropiado del DAI (HR=1,39; IC95%, 1,20-1,62; p <0,001) en una cohorte de 130 pacientes que habían sufrido infarto de miocardio con elevación del segmento ST (figura 1)23.
Estudios que informan del riesgo de arritmias ventriculares o muerte súbita cardiaca asociado con el realce tardío de gadolinio en pacientes con enfermedad coronaria
| Estudio | Año de publicación | Pacientes (n) | Tipo de estudio | Parámetro de la RMC | Asociación entre RTG y AV/MSC |
|---|---|---|---|---|---|
| Demirel et al.28 | 2014 | 99 | Prospectivo de cohorte | Razón periferia del infarto/foco del infarto | HR=2,01 (IC95%, 1,17-3,44; p=0,01)* |
| Alexandre et al.25 | 2013 | 66 | Retrospectivo de cohorte | Masa del RTG (g) | HR=3,15 (IC95%, 1,35-7,33; p <0,001)* |
| De Haan et al.26 | 2011 | 55 | Retrospectivo de cohorte | Núcleo de la masa del RTG (g) Periferia del infarto (g) | ABC del núcleo de la cicatriz, 0,721 ABC de la periferia del infarto, 0,812 |
| Scott et al.27 | 2011 | 64 | Retrospectivo de cohorte | Porcentaje de RTG Número de segmentos transmurales | Porcentaje cicatriz, HR/10%=1,75 (IC95%, 1,09-2,81; p=0,02)* Número de segmentos transmurales, HR/segmento=1,40 (IC95%, 1,15-1,70; p=0,001)* |
| Boyé et al.29 | 2011 | 52 | Prospectivo de cohorte | Transmuralidad relativa del infarto (%) | OR=22,10 (IC95%, 1,64-297,58; p=0,02) |
| Roes et al.7 | 2009 | 91 | Retrospectivo de cohorte | Zona gris del infarto (g) | HR/10 g=1,49 (IC95%, 1,01-2,20; p=0,04)* |
| Kwong et al.30 | 2006 | 195 | Retrospectivo de cohorte | Presencia de RTG | HR=5,98 (IC95%, 2,68-13,3; p <0,0001)* |
ABC: área bajo la curva; AV: arritmias ventriculares; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MSC: muerte súbita cardiaca; OR: odds ratio; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
Resonancia magnética cardiaca de rastreo de características para evaluar la DMVI. La DMVI se define como la desviación estándar del tiempo hasta alcanzar el strain circunferencial máximo, expresada como porcentaje de la longitud del ciclo cardiaco. La imagen A muestra el corte medioventricular de eje corto del VI de un sujeto sano, en el que se observa ausencia de RTG. Se constata que la DMVI del paciente es normal (A) por medio de la deformación sincronizada de los distintos segmentos del VI (señalados con distintos colores) y del tiempo hasta alcanzar el nivel máximo de strain circunferencial, indicado con flechas blancas (B). La imagen C muestra el adelgazamiento y la extensión del RTG en el septo interventricular y la pared anterior del VI tras sufrir un infarto de miocardio (flecha). Aumento de la DMVI (11,8%) en el paciente (C), que refleja la disincronía en los segmentos del VI (D). La DMVI> 9,79% se relaciona con arritmias ventriculares y riesgo de muerte súbita cardiaca tras sufrir un infarto. DMVI: dispersión mecánica del ventrículo izquierdo; RTG: realce tardío de gadolinio; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
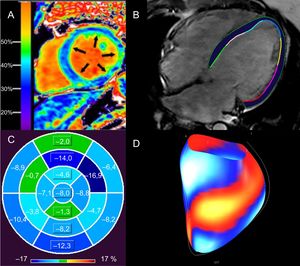
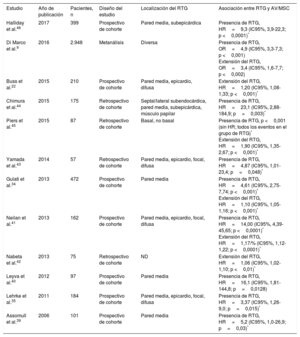
La miocardiopatía dilatada (MCD) se caracteriza por dilatación y disfunción del VI o de ambos ventrículos que no se explican por condiciones de sobrecarga hemodinámica o la enfermedad coronaria33. Se han identificado multitud de etiologías genéticas y ambientales, además de más de 50 genes patógenos33. La fibrosis (tanto focal como difusa) causa reentrada relacionada con la cicatriz y AV34-37. El riesgo de AV y MSC relacionado con el RTG se ha documentado ampliamente en este grupo heterogéneo de pacientes (tabla 2)9,24,34,35,38-46. Se han descrito varios patrones de RTG distintos, con algunos estudios que correlacionan el RTG de la pared media con un riesgo mayor, aunque este hallazgo no fue tan claro en otros estudios (tabla 2)35,41,43,44,47,48. En determinadas MCD genéticas, se han podido observar las implicaciones pronósticas del RTG para la AV/MSC; por ejemplo, mutaciones de la lamina A/C y distrofia muscular de Duchenne y Becker49,50. Según varios estudios, cada vez hay más indicios pronósticos de la presencia y la extensión del RTG en la «miocardiopatía no isquémica», que se superpone a la MCD36,38,48,51,52. También se observó que el FVE es un predictor independiente de una variable combinada (incluida la AV) en la MCD no isquémica (figura 2A)12,53. En la distrofia muscular de Becker, el aumento de la FVE se ha relacionado con AV (odds ratio [OR]=1,97; IC95%, 1,21-32,22; p=0,032)54. La alteración del strain longitudinal global del VI (HR=1,27; IC95%, 1,06-1,52; p <0,02), evaluada por medio de feature tracking, se relacionó de modo independiente con una variable combinada que incluía AV y MSC en un estudio con 210 pacientes con MCD (figuras 2B-D)22.
Estudios que informan del riesgo de arritmias ventriculares y muerte súbita cardiaca asociado con el realce tardío de gadolinio en pacientes con miocardiopatía dilatada
| Estudio | Año de publicación | Pacientes, n | Diseño del estudio | Localización del RTG | Asociación entre RTG y AV/MSC |
|---|---|---|---|---|---|
| Halliday et al.46 | 2017 | 399 | Prospectivo de cohorte | Pared media, subepicárdica | Presencia de RTG, HR=9,3 (IC95%, 3,9-22,3; p <0,0001)* |
| Di Marco et al.9 | 2016 | 2.948 | Metanálisis | Diversa | Presencia de RTG, OR=4,9 (IC95%, 3,3-7,3; p <0,001) Extensión del RTG, OR=3,4 (IC95%, 1,6-7,7; p <0,002) |
| Buss et al.22 | 2015 | 210 | Prospectivo de cohorte | Pared media, epicardio, difusa | Extensión del RTG, HR=1,20 (IC95%, 1,08-1,33; p <0,001)* |
| Chimura et al.44 | 2015 | 175 | Retrospectivo de cohorte | Septal/lateral subendocárdica, pared media, subepicárdica, músculo papilar | Presencia de RTG, HR=23,1 (IC95%, 2,88-184,9; p=0,003)* |
| Piers et al.45 | 2015 | 87 | Retrospectivo de cohorte | Basal, no basal | Presencia de RTG, p <0,001 (sin HR; todos los eventos en el grupo de RTG)* Extensión del RTG, HR=1,90 (IC95%, 1,35-2,67; p <0,001)* |
| Yamada et al.43 | 2014 | 57 | Retrospectivo de cohorte | Pared media, epicardio, focal, difusa | Presencia de RTG, HR=4,87 (IC95%, 1,01-23,4; p=0,048)* |
| Gulati et al.34 | 2013 | 472 | Prospectivo de cohorte | Pared media | Presencia de RTG, HR=4,61 (IC95%, 2,75-7,74; p <0,001)* Extensión del RTG, HR=1,10 (IC95%, 1,05-1,16; p <0,001)* |
| Neilan et al.41 | 2013 | 162 | Prospectivo de cohorte | Pared media, epicardio, focal, difusa | Presencia de RTG, HR=14,00 (IC95%, 4,39-45,65; p <0,0001)* Extensión del RTG, HR=1,17/% (IC95%, 1,12-1,22; p <0,0001)* |
| Nabeta et al.42 | 2013 | 75 | Retrospectivo de cohorte | ND | Extensión del RTG, HR=1,06 (IC95%, 1,02-1,10; p <0,01)* |
| Leyva et al.40 | 2012 | 97 | Prospectivo de cohorte | Pared media | Presencia de RTG, HR=16,1 (IC95%, 1,81-144,8; p=0,0128) |
| Lehrke et al.35 | 2011 | 184 | Prospectivo de cohorte | Pared media, epicardio, focal, difusa | Presencia de RTG, HR=3,37 (IC95%, 1,26-9,0; p=0,015)* |
| Assomull et al.39 | 2006 | 101 | Prospectivo de cohorte | Pared media | Presencia de RTG, HR=5,2 (IC95%, 1,0-26,9; p=0,03)* |
AV: arritmias ventriculares; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MSC: muerte súbita cardiaca; ND: no disponible; OR: odds ratio; RTG: realce tardío de gadolinio.
Evaluación de la fibrosis miocárdica difusa y consecuencias funcionales con resonancia magnética cardiaca de pacientes con MCD. A: elevación de la FVE del 37% en un paciente con MCD no isquémica; una FVE alta se relaciona con arritmias ventriculares en la MCD no isquémica12. B: contornos epicárdicos y endocárdicos del VI en una imagen de precesión libre en estado estacionario, horizontal y de eje largo, de un paciente con MCD idiopática (FEVI <10%) a partir de la cual se calcula el strain longitudinal global con rastreo de características. C: mapa polar del strain longitudinal segmentario del VI en el paciente (B), que muestra alteración del strain longitudinal global (–4,4%); los segmentos del ventrículo izquierdo se señalan con distintas tonalidades de azul (los tonos más oscuros indican mejor strain segmentario) y verde (peor strain segmentario); el strain longitudinal global superior al –12,5% se relaciona con muerte súbita cardiaca en la MCD no isquémica, independientemente de la FEVI22. D: visualización de la superficie del strain segmentario del VI de (B), con segmentos azul/blanco que representan el mejor strain respecto a los segmentos rojo/amarillo (peor strain). FEVI: fracción de eyección del ventrículo izquierdo; FVE: fracción del volumen extracelular; MCD: miocardiopatía dilatada; VI: ventrículo izquierdo. La imagen A se ha reproducido con autorización de Schelbert et al.53. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
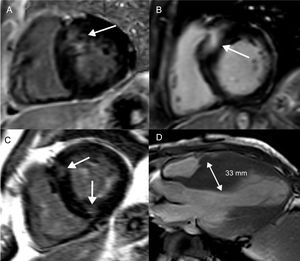
La miocardiopatía hipertrófica es una miocardiopatía genética, identificada por un aumento inexplicable del grosor de la pared del VI con una cámara no dilatada55. Se han descrito más de 1.400 mutaciones, que se acompañan de varios fenotipos55. El engrosamiento de la pared del VI es más habitual en el septo basal del VI, pero también tiene lugar en patrones apicales y medioventriculares (figura 3D). Un engrosamiento de la pared del VI ≥ 30 mm en cualquier segmento es un factor de riesgo de MSC (figura 3D)56. La formación de aneurisma apical se asocia con obstrucción medioventricular, probablemente a causa de la exposición crónica del ápice del VI a la elevada tensión parietal causada por el aumento de la presión sistólica57,58. Esto origina isquemia y fibrosis de sustitución focal del ápice del VI58. La obstrucción medioventricular con un gradiente ≥ 30 mmHg (HR=3,19; IC95%, 1,62-6,29; p <0,001), con o sin formación de aneurisma apical, fue un determinante independiente de AV y MSC en un estudio llevado a cabo en 490 pacientes japoneses58. Varios estudios han proporcionado pruebas sobre la asociación del RTG con las AV y la MSC (tabla 3)59-73. No solo la presencia, sino también la extensión del RTG, se relaciona con el riesgo de AV/MSC (figuras 3A y B)59,61,62,66,67,70,71. Además, el patrón del RTG tiene implicaciones pronósticas: aunque la presencia de RTG en los puntos de inserción del ventrículo derecho es característica del diagnóstico de MCH, no parece que pronostique un mayor riesgo de MSC (figura 3C)74.
Fibrosis focal en la miocardiopatía hipertrófica. Cortes del ventrículo izquierdo de eje corto (A-C) y un corte apical de eje largo (D) que muestran distintos patrones de RTG y engrosamiento de la pared del VI en la miocardiopatía hipertrófica. A: engrosamiento basal y septal del VI y colocalización del RTG. B: localización basal y septal más extensa del RTG, lo que representa un mayor riesgo de MSC. C: RTG en las uniones anterior e inferior derechas del VI, lo que no se relaciona con un aumento del riesgo de MSC. D: patrón medioventricular de engrosamiento del VI, con un septo interventricular de 33 mm; tanto la hipertrofia medioventricular como el engrosamiento del VI ≥ 30 mm son marcadores del riesgo de MSC. MSC: muerte súbita cardiaca; RTG: realce tardío de gadolinio; VI: ventrículo izquierdo.
Estudios que informan del riesgo de arritmias ventriculares y muerte súbita cardiaca asociado con el RTG en pacientes con miocardiopatía hipertrófica
| Estudio | Año de publicación | Pacientes (n) | Diseño del estudio | Asociación entre RTG y AV/MSC |
|---|---|---|---|---|
| Weng et al.59 | 2016 | 2.993 | Metanálisis | Presencia de RTG, OR=3,41 (IC95%, 1,97-5,94; p <0,001)* Extensión del RTG, OR=1,56/10% (IC95%, 1,33-1,82; p <0,0001)* |
| Haland et al.60 | 2016 | 96 | Transversal | Presencia de RTG, OR=8,50 (IC95%, 1,83-40,5; p <0,01) |
| Briasoulis et al.73 | 2015 | 3.067 | Metanálisis | Presencia de RTG, OR=2,52; (IC95%, 1,44-4,4; p=0,001) |
| Chan et al.61 | 2014 | 1.293 | Retrospectivo de cohorte | Extensión del RTG, HR=1,46/10% (IC95%, 1,12-1,92; p=0,002)* |
| Ismail et al.62 | 2014 | 711 | Prospectivo de cohorte | Extensión del RTG, HR=1,24/5% (IC95%, 1,06-1,45; p=0,007) |
| Prinz et al.63 | 2013 | 87 | Prospectivo de cohorte | Presencia de RTG, β=0,6; p <0,01)* |
| Green et al.64 | 2012 | 1.063 | Metanálisis | Presencia de RTG, OR=2,39 (IC95%, 0,87-6,58; p=0,091) |
| Rubinshtein et al.65 | 2010 | 424 | Retrospectivo de cohorte | Presencia de RTG, p=0,002 (sin HR; todos los eventos en el grupo de RTG)* |
| Bruder et al.66 | 2010 | 220 | Prospectivo de cohorte | Presencia de RTG, OR=5,14 (IC95%, 0,65-41,0; p=0,10) Masa del RTG, OR=1,02 (IC95%, 1,01-1,04; p <0,001) Extensión del RTG, OR=1,06 (IC95%, 1,02-1,11; p <0,01) |
| O’Hanlon et al.67 | 2010 | 217 | Prospectivo de cohorte | Extensión del RTG, HR=1,30 (IC95%, 1,05-1,61; p=0,014) |
| Aquaro et al.68 | 2010 | 100 | Prospectivo de cohorte | Extensión del RTG> 4,9%, 100% de sensibilidad y 86% de especificidad |
| Maron et al.72 | 2008 | 202 | Prospectivo de cohorte | Presencia de RTG, HR=1,45 (IC95%, 0,43-4,97; p=0,5) |
| Adabag et al.69 | 2008 | 177 | Retrospectivo de cohorte | Presencia de RTG, RR=7,3 (IC95%, 2,6-20,4; p <0,0001)* |
| Kwong et al.70 | 2008 | 68 | Retrospectivo de cohorte | Presencia de RTG, OR=14,00 (p <0,001) Extensión del RTG, p=0,03* |
| Suk et al.71 | 2008 | 25 | Retrospectivo de cohorte | Masa del RTG> 7 g, 75% de sensibilidad y 82% de especificidad |
AV: arritmias ventriculares; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MSC: muerte súbita cardiaca; OR: odds ratio; RR: riesgo relativo; RTG: realce tardío de gadolinio.
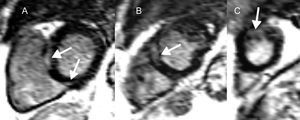
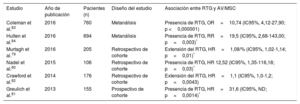
La sarcoidosis es una enfermedad granulomatosa y multisistémica que en el 2-5% de los casos afecta al corazon75,76. La inflamación miocárdica evoluciona a granulomas no caseosos y, a la larga, a zonas de fibrosis focal. Aunque la reentrada subyace a la AV relacionada con la cicatriz en las últimas fases, se han documentado actividad provocada y automaticidad anómala77. Se cree que el RTG refleja la actividad inflamatoria y la fibrosis y, en consecuencia, la fase aguda no puede diferenciarse de la fase crónica de la enfermedad (figura 4)78. Son múltiples los estudios (tabla 4)79-84 que proporcionan indicios de las implicaciones del RTG en la AV y la MSC.
Resonancia magnética cardiaca en la sarcoidosis cardiaca y riesgo de arritmias ventriculares y muerte súbita cardiaca. Cortes del ventrículo izquierdo de eje corto (A-C) que muestran realce tardío de gadolinio en la pared media y el epicardio (flechas) a nivel basal (A), medioventricular (B) y apical (C) en un paciente con sarcoidosis cardiaca. En esta enfermedad, tanto la presencia como la extensión del realce tardío de gadolinio se relacionan con arritmias ventriculares y muerte súbita cardiaca.
Estudios que informan del riesgo de arritmias ventriculares y muerte súbita cardiaca asociado con el realce tardío de gadolinio en pacientes con sarcoidosis
| Estudio | Año de publicación | Pacientes (n) | Diseño del estudio | Asociación entre RTG y AV/MSC |
|---|---|---|---|---|
| Coleman et al.83 | 2016 | 760 | Metanálisis | Presencia de RTG, OR=10,74 (IC95%, 4,12-27,90; p <0,000001) |
| Hulten et al.84 | 2016 | 694 | Metanálisis | Presencia de RTG, RR=19,5 (IC95%, 2,68-143,00; p=0,003)* |
| Murtagh et al.79 | 2016 | 205 | Retrospectivo de cohorte | Extensión del RTG, HR=1,08/% (IC95%, 1,02-1,14; p=0,01)* |
| Nadel et al.80 | 2015 | 106 | Retrospectivo de cohorte | Presencia de RTG, HR 12,52 (IC95%, 1,35-116,18; p=0,03)* |
| Crawford et al.82 | 2014 | 176 | Retrospectivo de cohorte | Extensión del RTG, HR=1,1 (IC95%, 1,0-1,2; p=0,0043) |
| Greulich et al.81 | 2013 | 155 | Prospectivo de cohorte | Presencia de RTG, HR=31,6 (IC95%, ND; p=0,0014)* |
AV: arritmias ventriculares; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MSC: muerte súbita cardiaca; ND: no disponible; OR: odds ratio; RR: riesgo relativo; RTG: realce tardío de gadolinio.
Las causas más frecuentes de miocarditis viral son los herpesvirus 6 (HH6) y los parvovirus B19 (PVB19) humanos. La MSC tiene lugar en un 2-8,6%, y puede atribuirse a AV85,86. Aunque la cicatriz focal causa AV y MSC, otros mecanismos pueden entrar en juego en el contexto agudo, como la actividad provocada y la automaticidad anómala87. En un estudio llevado a cabo en 405 pacientes con sospecha de miocarditis, se constató RTG en el 80% de las muertes, MSC recuperadas o descargas del DAI apropiadas, frente al 27% de aquellos sin ellas (p <0,001)85. En el estudio ITAMY (ITalian multicenter study on Acute MYocarditis), sobre pacientes con miocarditis aguda, el patrón del RTG que afectaba a la pared anteroseptal del VI se relacionó con un peor desenlace clínico (incluido el tratamiento apropiado del DAI y la reanimación tras parada cardiaca) que otros patrones (inferolateral, «otros» y ausencia de RTG)88. El tropismo viral relaciona mecánicamente el patrón del RTG con el riesgo de AV/MSC88. El HHV6 infecta el sistema de conducción cardiaca, que da cuenta tanto de la distribución del RTG septal como del alto riesgo de AV88,89. Además, el HHV6 se reactiva repetidamente tras una infección en la infancia y causa alteraciones tisulares miocárdicas y de la conducción recurrentes88,90. Por contra, el PVB19 infecta el pericardio y la pared subyacente del VI, representada por una localización lateral del RTG, con consecuencias menos perniciosas88,91.
TRASPLANTE CARDIACOLa fibrosis miocárdica en los receptores de trasplante cardiaco probablemente sea multifactorial y conlleva isquemia, inflamación, rechazo subclínico e infección92. Tanto la masa absoluta del RTG (HR=1,042; IC95%, 1,018-1,067; p=0,0007) como el porcentaje de RTG en el VI (HR=1,083; IC95%, 1,038-1,120; p=0,0002) se relacionaron con una variable combinada que incluía las AV en un estudio con 48 receptores de trasplante cardiaco ortotópico92.
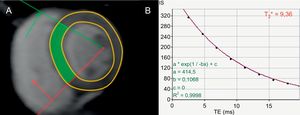
MIOCARDIOPATÍA POR SOBRECARGA DE HIERROLas alteraciones genéticas del metabolismo del hierro (hemocromatosis primaria), que causan una excesiva absorción intestinal de hierro, así como las repetidas transfusiones de eritrocitos en los casos de anemia dependiente de transfusión, como por ejemplo en la talasemia mayor (hemocromatosis secundaria), causan depósito miocárdico de hierro15. Los pacientes con miocardiopatía por sobrecarga de hierro pueden sufrir AV13. El grado de acortamiento del T2* se correlaciona con el riesgo de arritmias como las AV. En un estudio llevado a cabo con 652 pacientes con talasemia mayor, el riesgo relativo de arritmias fue de 4,60 (IC95%, 2,66-7,95) para los pacientes con un T2* <20 ms comparados con aquellos con un T2* >20 ms (figura 5)93,94. Cuando el T2* se reduce a <6 ms, el riesgo relativo aumenta hasta 8,79 (IC95%, 4,03-19,2)93.
Evaluación del riesgo de muerte súbita cardiaca en la miocardiopatía por sobrecarga de hierro. A: corte del ventrículo izquierdo de eje corto a nivel de los músculos papilares, adquirido con una secuencia en T2*. B: curva de relajación en T2*, que traza la intensidad de señal frente al tiempo de eco desde la región septal de interés (indicada en verde en la imagen A), que muestra un tiempo de relajación T2* reducido, de 9,36 ms, debido a la sobrecarga de hierro miocárdica; un T2* <20 ms se relaciona con arritmias ventriculares93. Adaptado con autorización de Gupta et al.94. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
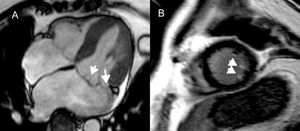
La valvulopatía mitral degenerativa puede afectar al engrosamiento de las valvas, la redundancia, la elongación de las cuerdas, la dilatación anular y la dinámica anular anómala95,96. Las fuerzas mecánicas ejercidas por las valvas y las cuerdas posiblemente afecten repetidamente al músculo papilar y el miocardio subyacente, lo que a la larga cuasa la formación de cicatrices en el miocardio95. El RTG en el músculo papilar y la pared inferobasal del VI se correlaciona con la aparición de AV95. Se constata RTG en el músculo papilar (en especial en los extremos, junto a la inserción de las cuerdas) en el 63% de los pacientes con prolapso de la válvula mitral y se relaciona con AV (figura 6)4,97.
Realce tardío de gadolinio en la resonancia magnética cardiaca de pacientes con prolapso de la válvula mitral. A: imagen de precesión libre en estado estacionario horizontal de eje largo, que muestra el prolapso de ambas valvas de la válvula mitral. B: proyección de eje corto, con realce tardío de gadolinio de los extremos del músculo papilar, que se ha vinculado a arritmias ventriculares95. Reproducido con autorización de Van der Bijl et al.4.
Los estudios prospectivos en relación con la eficacia del DAI en la prevención primaria y secundaria de la MSC en la enfermedad coronaria y la MCD se basa en la FEVI obtenida mediante ecocardiografía, y aún no puede recomendarse el uso sistemático de parámetros de la RMC, como el RTG4. No obstante, el uso de la RMC con RTG para decidir sobre la idoneidad de implantar un DAI a pacientes con MCH en los que la estratificación del riesgo es ambigua se ha incluido en las recomendaciones del American College of Cardiology/American Heart Association sobre MCH56. Además, la terapia de quelación del hierro guiada mediante relaxometría T2* ha reducido la mortalidad en la miocardiopatía por sobrecarga de hierro98. Siguen sin estar claras las implicaciones terapéuticas de la RMC en la prevención de la MSC en la sarcoidosis, la miocarditis viral, el trasplante cardiaco y las valvulopatías.
Para establecer un uso sistemático de la RMC en la predicción y prevención de la MSC, se requieren estudios prospectivos y aleatorizados. Un ensayo prospectivo (CMR_GUIDE, NCT01918215) asignará aleatoriamente a los pacientes con miocardiopatía isquémica y no isquémica con FEVI> 35% a un DAI o un dispositivo de registro de eventos implantable, en función de la presencia de RTG en la RMC87. Además, la normalización de varios parámetros de la RMC, como la carga del RTG y el mapeo paramétrico, es requisito para la integración de la RMC en la práctica diaria de prevención de la MSC.
CONCLUSIONESLa RMC es una técnica versátil de diagnóstico por la imagen que sirve para visualizar exhaustivamente alteraciones cardiacas estructurales y funcionales. Varios parámetros de la RMC pueden predecir las AV y la MSC, de modo que la RMC es muy prometedora por los beneficios adicionales y crecientes en la predicción de MSC. Se requieren estudios prospectivos y aleatorizados y normalizar las técnicas de la RMC para que se pueda recomendar su uso sistemático en la prevención de la MSC, como en la selección de candidatos a un DAI en prevención primaria.
CONFLICTO DE INTERESESEl Servicio de Cardiología del Centro Médico de la Universidad de Leiden ha recibido subvenciones de Biotronik, Medtronic, Boston Scientific y Edwards Lifesciences. V. Delgado ha recibido honorarios de conferenciante de Abbott Vascular.