La amiloidosis hereditaria por transtiretina (ATTR) con la mutación Val30Met (V30 M) es la forma más habitual de polineuropatía amiloidótica familiar (PAF). Aunque se considera principalmente una enfermedad neurológica, cada vez está más clara la afección cardiaca. A continuación se presenta el caso de un varón con PAF endémica de tipo V30M que ingresó por insuficiencia cardiaca congestiva (ICC) descompensada, con notable afección cardiaca y ascitis quilosa, una complicación muy poco frecuente. Se analizan la variabilidad fenotípica de la ATTR, los mecanismos que explican la ascitis quilosa en la IC y el tratamiento complejo de los pacientes con afección grave de la distensibilidad cardiaca.
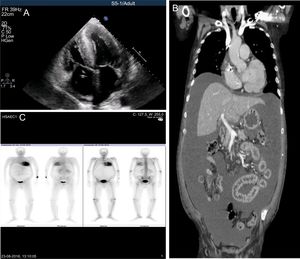
Se presenta el caso de un portugués de 70 años con PAF endémica de tipo V30M. La enfermedad había aparecido 10 años antes (inicio tardío) con polineuropatía. El paciente era el primer caso descrito (caso índice) de su familia, aunque su padre era portador asintomático de la mutación. Los antecedentes personales incluían fibrilación auricular, implante de marcapasos debido a bloqueo auriculoventricular, enfermedad renal crónica e IC de clase funcional II de la New York Heart Association, sin hospitalizaciones previas. El paciente fue transferido a nuestro centro a causa de una descompensación de la IC. Durante el mes anterior, el paciente había sufrido un edema generalizado que no respondió a los diuréticos orales, disnea que empeoró rápidamente e hipotensión ortostática sintomática. Cuando llegó al centro, presentaba anasarca con ascitis por aumento de la presión hidrostática, que requirió una paracentesis de urgencia. Sorprendentemente, el líquido del peritoneo tenía un aspecto lechoso y su análisis reveló una alta concentración de triglicéridos (444 mg/dl; proporción de triglicéridos entre el suero y el líquido ascítico, 3,2), lo que cumplía los requisitos para el diagnóstico de ascitis quilosa. La concentración de la fracción aminoterminal del propéptido natriurético cerebral era muy alta (140.454 pg/ml). La ecocardiografía reveló un considerable aumento del grosor de la pared de ambos ventrículos (máximo en el septo interventricular, con 30 mm), alteración sistólica moderada, velocidad sistólica tisular reducida y un ligero derrame pericárdico. El miocardio tenía una apariencia granular compatible con infiltración (figura A).
A: ecocardiografía; hipertrofia grave, dilatación biauricular, derrame pericárdico y apariencia granular del miocardio. B: tomografía de las cavidades torácica, abdominal y pelviana; ascitis difusa generalizada con compresión intestinal. C: gammagrafía con DPD: gran absorción de trazador en el miocardio y el túnel carpiano. DPD: 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico.
Tras la evaluación inicial, nuestro trabajo fue entender los resultados observados. La notable afección cardiaca no es característica de la mutación tipo V30M y se había mantenido «silente» porque no se habían producido descompensaciones previas de la IC, y la ascitis quilosa no acababa de encajar en este rompecabezas clínico. Dadas estas discrepancias, se decidió excluir cualquier enfermedad subyacente que pudiera explicar la ascitis quilosa y también contribuir al infarto de miocardio.
La tomografía de las cavidades torácica, abdominal y pelviana mostró una ascitis difusa grave, causante de la compresión intestinal, pero también descartó que la ascitis quilosa se debiera a una enfermedad neoplásica, obstructiva o linfática (figura B). La gammagrafía con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico reveló considerable absorción miocárdica del trazador, lo cual indica firmemente ATTR y hace poco probables las causas infiltrativas y la miocardiopatía hipertrófica (figura C). Las exhaustivas pruebas de laboratorio también dieron resultados negativos. Tras revisar la literatura médica en busca de casos parecidos, se asumió como diagnóstico por exclusión que la IC era la causa de la ascitis quilosa.
El control de líquidos fue complejo debido a la hipotensión sintomática y se tuvo que aumentar ligeramente los diuréticos de asa intravenosos. El equilibrio se alcanzó mediante la administración subcutánea de furosemida junto con metolazona y espironolactona, la paracentesis programada y restricciones en la ingesta de líquidos. El paciente mejoró lentamente y se le dio de alta al cabo de 3 semanas. En casa, fue el propio paciente quien se administró la furosemida por vía subcutánea utilizando un catéter subcutáneo que cambiaba cada semana.
Dada la gran variabilidad genotípica y fenotípica, la ATTR sigue siendo un diagnóstico difícil. La PAF de tipo V30M es la mutación más frecuente y las manifestaciones neurológicas son las que habitualmente predominan en el cuadro clínico. La afección cardiaca suele estar más relacionada con alteraciones en la conducción, pero la infiltración (normalmente de leve a moderada) y la disfunción diastólica aparecen cada vez más en los informes, principalmente en los casos esporádicos de inicio tardío1-3. Esto recalca la necesidad de realizar un cribado ecocardiográfico sistemático a todos los pacientes con PAF de tipo V30M. La infiltración cardiaca grave observada aquí no es característica de la PAF endémica de tipo V30M y justifica la exclusión de otras causas de hipertrofia o infiltración cardiacas.
La gammagrafía con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico es útil por sus altas sensibilidad y especificidad para el amiloide-TTR. La alta puntuación visual confirmó que la causa de la grave infiltración cardiaca eran los depósitos de amiloide-TTR, aunque no fue posible distinguir entre las formas mutada y natural (wild-type) de amiloide-TTR1.
La ascitis quilosa asociada con IC es muy poco frecuente. En una búsqueda en PubMed, solo se recuperaron 6 artículos relevantes y, por lo que se sabe, este es el primer informe sobre la asociación entre amiloidosis cardiaca por TTR (ATTR) y ascitis quilosa. El mecanismo subyacente está relacionado con altas presiones venosas causantes de un aumento en la producción de linfa abdominal (también debido a la mayor filtración capilar) y con menor drenaje linfático torácico debido a altas presiones en la vena subclavia izquierda4,5. Debería considerarse la existencia de IC en el diagnóstico diferencial de la ascitis quilosa en los pacientes apropiados.
En este caso, la eliminación de líquido del tercer espacio fue bastante compleja. El sistema nervioso vegetativo y el sistema angiotensina-aldosterona no pudieron contrarrestar la disminución inicial normal del volumen intravascular causada por los diuréticos de asa, pues estaban alterados. El fallo de los mecanismos de compensación, junto con el hecho de que la cavidad ventricular fuera reducida y sin distensibilidad, causó una disminución repentina de la precarga con la administración de diuréticos. Esto llevó a una disminución del gasto cardiaco que indujo hipotensión sintomática y, por lo tanto, impidió la suficiente eliminación de líquido. La administración cuidadosa de diuréticos y de furosemida subcutánea fue crucial para superar la menor absorción oral y mejorar el edema. También sería efectivo utilizar una bomba elastomérica para la infusión subcutánea de furosemida6.
En conclusión, este caso es singular porque de él pueden extraerse tres mensajes importantes: a) el inicio tardío y la exuberancia en la infiltración cardiaca son poco frecuentes en la PAF endémica de tipo V30M; b) la IC es una causa muy poco frecuente de ascitis quilosa y debería constituir un diagnóstico de exclusión, y c) la existencia de alteración en la distensibilidad dificulta conseguir una administración de diuréticos que permita eliminar líquido del tercer espacio sin que se produzca una disminución intravascular importante. La administración subcutánea de furosemida puede ser de gran utilidad.
.