Palabras clave
INTRODUCCIÓN
El pericardio es una membrana que rodea el corazón a modo de saco y consta de 2 capas fibrosas. Aunque el pericardio puede resultar afectado por agentes etiopatogénicos múltiples y heterogéneos que van desde infecciones por virus, bacterias u otros microorganismos hasta la invasión por enfermedades neoplásicas, pasando por inflamaciones inespecíficas y la afección pericárdica secundaria a enfermedades cardíacas o sistémicas1-3, en realidad, la gran mayoría de enfermedades del pericardio están causadas por un número limitado de procesos relativamente comunes y, en general, de fácil identificación. Por otra parte, la repercusión de estas diferentes etiologías se puede englobar en 3 grupos fundamentales de manifestaciones clínicas. En primer lugar, los síntomas derivados de la inflamación del pericardio que se traducen, fundamentalmente, en forma de dolor pericardítico y fiebre; en segundo lugar, los síntomas debidos a la producción de derrame pericárdico, con su manifestación más extrema, el taponamiento cardíaco; y, en tercer lugar, los síntomas debidos al engrosamiento, la retracción y la calcificación del pericardio, es decir, la pericarditis constrictiva. El presente trabajo está dedicado, fundamentalmente, al diagnóstico y tratamiento de la pericarditis aguda. También se comentarán algunos aspectos del taponamiento cardíaco y su tratamiento, ya que esta complicación se puede presentar en cualquier tipo de pericarditis. Aunque no es un objetivo de este trabajo hacer una revisión de la pericarditis constrictiva, sí se comentarán algunas formas de constricción cardíaca (aguda y subaguda) que pueden aparecer de forma temprana en la evolución de algunas pericarditis agudas.
PERICARDITIS AGUDA
La pericarditis aguda es un síndrome clínico plurietiológico que se manifiesta por dolor torácico, roce pericárdico y cambios evolutivos de la repolarización en el electrocardiograma (ECG). El diagnóstico de pericarditis exige, por lo menos, 2 de estos 3 elementos, aunque la auscultación de un roce pericárdico permite, por sí sola, establecer el diagnóstico. Aunque se han descrito numerosas causas de pericarditis aguda (tabla 1), en nuestro medio, la etiología más frecuente es la idiopática o viral, especialmente en pacientes ambulatorios, en los que esta etiología representa más del 90% de los casos. Estos 2 términos se utilizan de una forma casi sinónima, ya que se considera que la mayoría de pericarditis «idiopáticas» son, en realidad, de origen viral (etiología que no se investiga en la práctica clínica habitual dada la limitación de las técnicas de laboratorio y la muy escasa repercusión en el manejo de la enfermedad). En el medio hospitalario son relativamente frecuentes las pericarditis secundarias a infarto de miocardio, cirugía cardíaca, insuficiencia renal o enfermedades neoplásicas. La pericarditis tuberculosa y la pericarditis purulenta son muy poco frecuentes en España, pero la pericarditis tuberculosa es la etiología más frecuente de pericarditis en algunas zonas geográficas (África subsahariana).
Manifestaciones clínicas
La manifestación clínica fundamental de la pericarditis aguda es el dolor torácico. El dolor suele instaurarse de una forma relativamente rápida, aunque no tan brusca como el dolor del infarto agudo de miocardio. Su duración es prolongada (en general de varios días), se localiza en la región precordial o retroesternal y se puede irradiar al cuello, la espalda, el hombro y el brazo izquierdo; es muy característica su irradiación a la región supraclavicular y a la zona de los trapecios debido a la afección de los nervios frénicos que atraviesan el diafragma. El dolor suele aumentar de intensidad con la inspiración, los movimientos torácicos, el decúbito y la tos, y suele mejorar en sedestación con el tronco inclinado hacia delante. Aunque el dolor torácico propio de la pericarditis es bastante característico, no permite, por sí solo, establecer el diagnóstico. Se debe poner énfasis en este punto, ya que con cierta frecuencia vemos a pacientes que han sido diagnosticados de pericarditis sólo por este síntoma y a menudo por dolores torácicos relativamente inespecíficos. Otros síntomas frecuentes son la sensación de disnea, que puede estar presente no sólo en los pacientes con taponamiento cardíaco, sino también en los pacientes sin ningún tipo de compromiso hemodinámico debido a la limitación de la amplitud de la inspiración causada por el propio dolor. Puede haber también fiebre, tos y astenia.
El signo característico y patognomónico de la pericarditis aguda es el roce pericárdico, el cual se ausculta en un 60-85% de los casos, aproximadamente. Su presencia permite establecer con seguridad el diagnóstico de pericarditis aguda, pero su ausencia no lo descarta. El roce es un ruido rugoso y superficial que se ausculta con la máxima intensidad en el mesocardio y el borde paraesternal izquierdo bajo y que varía de intensidad con los movimientos respiratorios, aumentando habitualmente en la inspiración. El roce típico tiene 3 componentes (presistólico causado por la contracción auricular, sistólico causado por la contracción ventricular y diastólico en relación con la fase de llenado ventricular rápido en la protodiástole), pero a veces tiene sólo 2 o 1 componente, en cuyo caso se puede confundir con un soplo. El roce es a menudo evanescente, de forma que es importante auscultar repetidamente a los pacientes con sospecha clínica de pericarditis. Por otra parte, puede estar presente tanto en las pericarditis sin líquido como en las pericarditis con derrame importante, incluso en pacientes con taponamiento cardíaco. Cuando la pericarditis cursa con derrame importante pueden aparecer signos de taponamiento que comentaremos más adelante. Cuando el derrame es muy importante, los ruidos cardíacos pueden estar apagados, aunque no siempre.
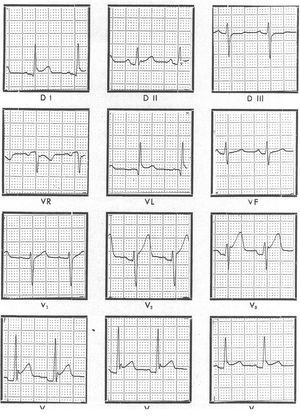
El ECG está alterado en un 80% de los casos de pericarditis aguda4. En los casos más típicos el ECG evoluciona en 4 estadios. El estadio I consiste en una elevación difusa del segmento ST de concavidad superior (curva de lesión subepicárdica) y con ondas T positivas; el segmento PQ o PR puede estar descendido (curva de lesión auricular) (fig. 1). Estos cambios suelen durar horas o unos pocos días. En el estadio II, el segmento ST vuelve a la línea isoeléctrica. El estadio III se caracteriza por la aparición de ondas T negativas. Las ondas T pueden normalizarse en pocos días, pero a menudo siguen siendo negativas durante semanas o meses, lo cual no debe ser interpretado como persistencia de la enfermedad. El estadio IV corresponde a la normalización. Los cambios del estadio I se pueden prestar a confusión con el infarto agudo de miocardio y con la variante normal de la repolarización conocida como «repolarización precoz». En el infarto no hay depresión del segmento PR, la elevación del segmento ST es de convexidad superior y localizada en algunas derivaciones con imagen especular en las derivaciones contrapuestas, y a menudo aparecen ondas Q. En la pericarditis, por el contrario, no aparecen ondas Q y raramente hay arritmias diferentes de la taquicardia sinusal. La repolarización precoz es una variante de la normalidad que consiste en una elevación del segmento ST de concavidad superior y con ondas T positivas que asemeja los cambios propios de la pericarditis aguda. El dato distintivo más fiable es la relación de la elevación del ST respecto de la amplitud de la onda T en la derivación V6. Una relación > 0,24 es sugestiva de pericarditis. De todas formas, el dato más definitivo es observar la evolución del ST, que cambia en la pericarditis aguda mientras que se mantiene sin modificaciones en la repolarización precoz. Cuando hay derrame pericárdico importante, puede haber disminución del voltaje del complejo QRS o cambios cíclicos de la amplitud del QRS (alternancia eléctrica), hallazgos que son más frecuentes en pacientes con taponamiento.
Fig. 1. Electrocardiograma de un paciente con pericarditis aguda idiopática. Se puede apreciar la elevación difusa del segmento ST, de concavidad superior y con ondas T positivas (estadio I). Además, en las derivaciones V2-V4 se aprecia un descenso del segmento PR que traduce la presencia de una curva de lesión auricular.
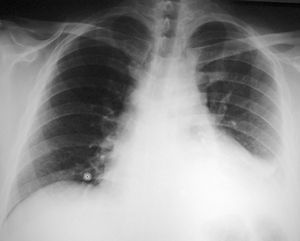
Desde el punto de vista radiológico, el corazón es normal en las pericarditis sin derrame o con derrame ligero. Cuando se produce derrame en cantidad > 250 ml, aparece cardiomegalia. En las pericarditis agudas es frecuente la presencia de derrame pleural, que es más habitual en el lado izquierdo (fig. 2).
Fig. 2. La radiografía muestra la presencia de cardiomegalia (debida a derrame pericárdico) y de derrame pleural izquierdo. Corresponde a un paciente con una pleuropericarditis idiopática.
El ecocardiograma es la exploración más útil para identificar la presencia y cuantificar el derrame pericárdico. Sin embargo, el ecocardiograma no debe ser considerado como una exploración imprescindible para establecer el diagnóstico de pericarditis aguda, el cual, como ya se ha comentado, debe basarse en otros criterios. Una pericarditis aguda puede cursar sin derrame y, por otra parte, no todos los derrames pericárdicos se deben a una pericarditis aguda. El ecocardiograma puede aportar, además, datos muy útiles para establecer el diagnóstico de taponamiento, fundamentalmente colapso de la aurícula o del ventrículo derechos y alteraciones de los flujos mitral y tricuspídeo.
Con excepción de algunas etiologías concretas (uremia, leucemia), la analítica general de sangre suele mostrar, únicamente, datos inespecíficos (elevación de la velocidad de sedimentación globular). En algunos casos puede haber una ligera elevación de los marcadores de lesión miocárdica debido a la inflamación epicárdica o a la afección miocárdica acompañante. La elevación de la creatincinasa o de su fracción MB (CK-MB) es muy poco frecuente, pero la elevación de las troponinas se puede observar hasta en un 35-50% de los pacientes con pericarditis5.
Diagnóstico diferencial
En las primeras horas de evolución, el cuadro de la pericarditis se puede prestar a confusión con el de un infarto agudo de miocardio con elevación del segmento ST. Sin embargo, suele haber elementos que permiten establecer el diagnóstico diferencial correcto en la gran mayoría de los casos (tabla 2). El aneurisma disecante de aorta raramente se puede confundir con una pericarditis si se hace una correcta anamnesis, ya que el dolor suele ser de inicio muy brusco, muy intenso y localizado en la espalda más que en la región precordial. Hay que recordar, no obstante, que el aneurisma de aorta puede romperse en el saco pericárdico y producir un cuadro de taponamiento cardíaco. El dolor pleurítico tiene elementos comunes con la pericarditis, pero el dolor se localiza lateralmente en el tórax; sin embargo, es bastante frecuente la coexistencia de pericarditis con pleuritis (pleuropericarditis), de forma que el dolor puede tener características mixtas. Los dolores originados en la pared torácica también varían de intensidad con los movimientos, pero la sensibilidad dolorosa a la presión local permite establecer el diagnóstico.
Con cierta frecuencia se observa a pacientes con dolor en el plano anterior del tórax de características compatibles con pericarditis pero sin ningún otro dato objetivo en la exploración física o en el ECG. En estos casos es preferible no establecer el diagnóstico de pericarditis y adoptar una actitud expectante.
Diagnóstico etiológico
Una vez establecido el diagnóstico sindrómico de pericarditis hay que intentar establecer el diagnóstico etiológico. La primera consideración que hay que hacer es valorar si hay alguna enfermedad de base que pueda ser la causa de la pericarditis. Los pacientes con insuficiencia renal, infarto de miocardio reciente, cirugía cardíaca, radioterapia en el tórax, neoplasia conocida, etc., pueden desarrollar un cuadro de pericarditis aguda que, lógicamente, hay que considerar secundario a la enfermedad de base6. Estas etiologías suelen observarse en pacientes ingresados en centros hospitalarios. La situación más frecuente, no obstante, especialmente en pacientes ambulatorios, es que la pericarditis se presente como una enfermedad primaria. En estos casos, la gran mayoría (más del 90%) de pericarditis son idiopáticas o virales. El término «idiopático» aplicado a las pericarditis agudas alude a la forma más corriente de esta enfermedad, en la que hay evidencia suficiente para suponer que la mayoría de los casos se deben a una infección viral o a una respuesta inmunológica a ésta. Demostrar objetivamente estas situaciones en cada paciente representaría un esfuerzo de una complejidad, coste y agresividad (determinación de inmunoglobulina (Ig) G, IgM, IgA y complemento en líquido pericárdico, biopsia de pericardio y epicardio, técnicas virológicas e inmunohistoquímicas) de ninguna manera compensados por hallazgos de interpretación segura y, fundamentalmente, por el hecho de que la enfermedad se resuelve de manera espontánea sin secuelas en la gran mayoría de los pacientes. Recientemente se ha introducido el término «pericarditis autorreactiva»7, que pretende caracterizar a una proporción de los pacientes que tradicionalmente son calificados como idiopáticos mediante la identificación en ellos de elementos que supuestamente traducen una respuesta autoinmunitaria. Nuestro grupo es contrario a adoptar tal denominación por 2 razones: a) no se han establecido los criterios precisos para aceptar que estos hallazgos inmunológicos definan una forma específica de enfermedad pericárdica, y b) su demostración en un paciente concreto es sumamente compleja y de muy dudosa relevancia para la toma de decisiones clínicas.
Se dispone de una serie de datos clínicos que pueden ser muy útiles para orientar el diagnóstico etiológico de las pericarditis agudas. Una pericarditis que se autolimita en pocos días es prácticamente siempre de origen idiopático/viral, etiología que se puede asegurar si se trata de una pericarditis recidivante con claros intervalos asintomáticos entre los brotes. La presencia de una infección bacteriana intratorácica (neumonía, empiema, mediastinitis) o subfrénica obliga a descartar la posibilidad de una pericarditis purulenta8. Por el contrario, otros datos clínicos, como un curso clínico prolongado o la presencia de derrame pericárdico o de taponamiento, son inespecíficos. Una pericarditis idiopática/viral puede tener un curso clínico prolongado y puede cursar con taponamiento. De hecho, aunque en términos relativos el taponamiento es más frecuente en las pericarditis específicas, no es raro en las pericarditis idiopáticas/virales (alrededor de un 15% de los casos que ingresan en el hospital). Como la gran mayor&i acute;a de pericarditis agudas son de origen idiopático/viral, en términos absolutos ésta es la etiología más frecuente de las pericarditis agudas que cursan con taponamiento. En una serie de 231 pacientes con enfermedad pericárdica aguda primaria9, 22 de 24 pacientes con pericarditis específicas (tuberculosa, purulenta o neoplásica) tenían derrame pericárdico y, de ellos, 15 (68%) tenían taponamiento; por el contrario, sólo 102 de 207 pacientes con pericarditis de otras etiologías tenían derrame pericárdico y, de ellos, 29 (28%) desarrollaron taponamiento. Por tanto, del conjunto de los 44 pacientes que presentaron taponamiento, la causa más frecuente (29 de 44) fue la pericarditis idiopática. Otro dato que no tiene valor para el diagnóstico etiológico es el derrame pleural, que puede estar presente tanto en las pericarditis específicas como en las pericarditis virales o idiopáticas.
Los conceptos centrales que deben presidir cualquier protocolo de manejo diagnóstico de las pericarditis agudas son: a) noción de la prevalencia de las diferentes etiologías según el contexto geográfico/epidemiológico; b) relevancia de identificar algunas etiologías concretas, y c) conocimiento del rendimiento diagnóstico de las exploraciones invasivas del pericardio (pericardiocentesis y biopsia pericárdica). La pericarditis tuberculosa es el ejemplo más paradigmático de la importancia de aplicar el primer concepto para el manejo diagnóstico y terapéutico de las pericarditis agudas. En España, la pericarditis tuberculosa es muy poco frecuente (alrededor de un 4% de los casos de pericarditis)9,10, pero en algunas áreas geográficas (como el África subsahariana) la tuberculosis es la etiología más frecuente de las pericarditis (alrededor del 70-80%, proporción que sube al 90-100% en los pacientes que, además, tienen sida)11. Así pues, mientras que en España una pericarditis aguda no es tuberculosa a menos que se demuestre lo contrario, en otras zonas y en grupos concretos de pacientes puede estar justificado incluso administrar de entrada tratamiento antituberculoso. El segundo concepto también es importante. El hecho de establecer con seguridad el diagnóstico de pericarditis viral (por aislamiento del virus, determinaciones serológicas o técnicas como la reacción en cadena de la polimerasa [PCR]) es muy poco relevante ya que, en definitiva, el manejo terapéutico y la evolución serán los mismos que los de una pericarditis idiopática. El diagnóstico de una pericarditis neoplásica no suele comportar la posibilidad de un tratamiento eficaz (aparte de solucionar el taponamiento). Por el contrario, la identificación de las pericarditis tuberculosa y purulenta tiene obvia trascendencia. La pericardiocentesis y la biopsia pericárdica pueden aportar datos definitivos para la identificación de las pericarditis purulenta, tuberculosa y neoplásica. En conjunto, el rendimiento diagnóstico global de la pericardiocentesis y la biopsia pericárdica es del 19 y el 22%, respectivamente, pero hay una diferencia significativa cuando estos procedimientos se realizan con finalidad puramente diagnóstica (es decir, en pacientes sin compromiso hemodinámico) (rendimiento del 6%) o bien si se practican con finalidad terapéutica en pacientes taponados (rendimiento del 35%), probablemente porque en este grupo se concentran los pacientes con causas específicas de pericarditis9.
Según estas consideraciones, nosotros proponemos el siguiente protocolo para el diagnóstico y manejo de las enfermedades del pericardio12,13 que, con leves modificaciones, hemos usado durante más de 2 décadas y cuyo buen rendimiento diagnóstico hemos validado en sucesivos estudios6,14. Este protocolo se basa en la prevalencia muy predominante de la pericarditis viral o idiopática, carente de tratamiento específico, y pretende representar un compromiso entre realizar el mínimo número de exploraciones cruentas innecesarias y, al mismo tiempo, realizar el máximo número posible de diagnósticos específicos. Dividimos este protocolo en 3 estadios que exponemos a continuación.
Estadio I: estudios generales y ecocardiograma
Este estadio comprende la práctica de una historia clínica completa, exploración física, ECG, radiografía de tórax, ecocardiograma y analítica general de sangre. En los pacientes con taponamiento o con pericarditis con derrame pericárdico de más de 1 semana de evolución se practica una determinación de anticuerpos antinucleares y una investigación de bacilo de Koch en 3 muestras de esputo o de aspirado gástrico. Nosotros no practicamos estudios virológicos debido a su escasa relevancia práctica. Aunque se han descrito pericarditis debidas a una gran variedad de agentes infecciosos (mononucleosis, Mycoplasma pneumoniae, Legionella, Coxiella, etc.), estas etiologías son muy poco frecuentes, por lo que no está justificada una investigación sistemática e indiscriminada en todos los pacientes con pericarditis aguda. Únicamente cuando hay un contexto epidemiológico específico u otros hallazgos sugestivos (adenopatías, infiltrados pulmonares, etc.) puede tener sentido investigar estas posibles etiologías. En este estadio hay que realizar también las exploraciones que se derivan de hallazgos concretos (p. ej., biopsia ganglionar en presencia de adenopatías, broncoscopia en pacientes con masas pulmonares). Siempre que hay derrame pleural acompañante es muy importante obtener líquido, fundamentalmente para la determinación de la adenosindesaminasa (ADA). Un valor de ADA > 45 U es muy sugestivo de tuberculosis, mientras que un valor muy bajo prácticamente la descarta, de forma que este sencillo análisis es muy útil como método de cribado para decidir la conveniencia de otras exploraciones. Hay que tener en cuenta, no obstante, que el derrame pleural puede tener un componente de trasudado cuando hay hipertensión venosa, lo que puede ocasionar unos valores de ADA falsamente bajos. En casos seleccionados puede ser muy útil la determinación de la PCR para el bacilo de Koch.
Estadio II: pericardiocentesis
La pericardiocentesis debería practicarse sólo cuando hay taponamiento cardíaco (con finalidad terapéutica) o cuando hay sospecha de pericarditis purulenta. Las investigaciones que hay que practicar en el líquido pericárdico son un hematocrito (en caso de derrames hemorrágicos), determinación de la concentración de proteínas, valor de la ADA15, estudio citológico, cultivo para gérmenes aerobios y anaerobios e investigación del bacilo de Koch, a ser posible mediante un sistema de cultivo de crecimiento rápido (BACTEC). Además, siempre que haya la sospecha de pericarditis tuberculosa conviene guardar una muestra de líquido para la práctica de una PCR, cuyo valor predictivo positivo y negativo para la tuberculosis es alto16, aunque aún se dispone de relativamente poca información acerca de la precisión diagnóstica de esta prueba. Asimismo, en casos de sospecha de pericarditis neoplásica puede ser útil la determinación del antígeno carcinoembriónico (CEA) en el líquido pericárdico15. En nuestro medio, la pericardiocentesis no está indicada ante un derrame pericárdico sin signos de taponamiento, ya que en estas circunstancias su rendimiento en cuanto al diagnóstico etiológico es muy pobre9.
Estadio III: biopsia pericárdica
La biopsia pericárdica debe restringirse a los enfermos con taponamiento recidivante tras la pericardiocentesis (procedimiento que comporta, además, un drenaje pericárdico) y a los casos con derrame pericárdico y actividad clínica persistente a las 3 semanas del ingreso hospitalario sin que se haya llegado al diagnóstico etiológico. La biopsia pericárdica podría estar indicada también en los pacientes con alta sospecha de pericarditis tuberculosa pero sin que se haya podido establecer un diagnóstico seguro (p. ej., un valor de ADA claramente elevado en el líquido pleural o pericárdico, pero sin otra evidencia).
Esta actitud restrictiva de las indicaciones de los procedimientos pericárdicos con finalidad puramente diagnóstica está justificada debido a que, aun en presencia de derrame, taponamiento y de un curso clínico prolongado, en nuestro medio la gran mayoría de pericarditis agudas son idiopáticas.
En las recientes «Guías de práctica clínica» de la Sociedad Europea de Cardiología, publicadas posteriormente en versión resumida en Revista Española de Cardiología17, se propone también un enfoque sistematizado del diagnóstico etiológico de las pericarditis, pero de su redacción el lector puede deducir una actitud sobre el uso de las exploraciones cruentas radicalmente distinto del nuestro en 2 puntos fundamentales: a) un uso liberal del estudio del líquido pericárdico y de la biopsia pericárdica y epicárdica, y b) la recomendación de un amplio uso de la pericardioscopia. Algunos autores18 propician el uso de esta exploración para la práctica de biopsia pericárdica invocando un elevado rendimiento para el diagnóstico de las pericarditis virales, las «pericarditis autorreactivas» y las pericarditis neoplásicas. Si bien es posible que la pericardioscopia posea una sensibilidad y especificidad ligeramente mayor que la pericardiocentesis y la biopsia pericárdica convencional en situaciones precisas, ello no representa una razón para ampliar las indicaciones generales de drenaje pericárdico, dado el ya mencionado gran predominio de pericarditis idiopáticas que convertiría en innecesarias muchas de las aplicaciones del método. Hemos mencionado ya la futilidad práctica de la demostración de la etiología viral y de la ilustración de los mecanismos inmunológicos de la pericarditis aguda. Por otra parte, el diagnóstico de pericarditis neoplásica se puede establecer en la gran mayoría de los casos con las modernas técnicas de imagen, el estudio citológico del líquido pericárdico y la biopsia pericárdica convencional. La pericardioscopia, por otra parte, es una técnica que no se encuentra ampliamente disponible, que requiere una curva de aprendizaje y que tiene un cierto riesgo si se usa un pericardioscopio rígido. Por tanto, creemos que las «Guías de práctica clínica» de la Sociedad Europea de Cardiología17 comportan el riesgo de conducir a prodigar las exploraciones cruentas de forma innecesaria en muchos pacientes con pericarditis de curso benigno y autolimitado.
Un comentario especial merece la pericarditis que pueden presentar los pacientes con sida19. Estos pacientes presentan con cierta frecuencia derrame pericárdico, el cual se suele observar en estadios avanzados de la enfermedad y que es un dato de mal pronóstico global. No obstante, el taponamiento cardíaco es poco frecuente. La afección pericárdica puede ser causada por agentes infecciosos como el propio virus de la inmunodeficiencia adquirida (VIH), otros virus (herpes simple, citomegalovirus), bacterias y hongos, o puede ser debida a procesos neoplásicos (linfoma, sarcoma de Kaposi). Sin embargo, en la mayoría de los casos se trata de pericarditis inespecíficas. Por tanto, el manejo de estos pacientes debe ser similar al manejo general comentado anteriormente (por lo menos en nuestro medio).
Tratamiento
Los pacientes con pericarditis aguda idiopática o viral deben guardar reposo en cama o butaca mientras persistan los síntomas inflamatorios (dolor pericardítico y fiebre). Probablemente, la mayoría de los pacientes pueden ser tratados en régimen ambulatorio, siempre y cuando puedan ser controlados de cerca por personal médico conocedor de esta enfermedad. El ingreso hospitalario debe reservarse para los pacientes con fiebre alta, curso clínico subagudo, taponamiento cardíaco, derrame importante, afección miocardítica y pacientes inmunodeprimidos o que están recibiendo tratamiento anticoagulante20. El tratamiento farmacológico consiste en la administración de aspirina o de otros antiinflamatorios no esteroideos. El fármaco de primera elección es la aspirina. La dosis inicial es de 500 o 1.000 mg/6 h y debe mantenerse mientras persistan el dolor y la fiebre. Una vez han cedido estos síntomas se puede retirar paulatinamente (p. ej., 500 mg/8 h durante una semana, luego 250 mg/8-12 h otras 2 semanas). En caso de falta de respuesta a la aspirina o en los pacientes con contraindicaciones para ésta, la siguiente opción son los antiinflamatorios no esteroideos (p. ej., indometacina 75-225 mg/día, paracetamol 2-4 g/día o ibuprofeno 1.600-3.200 mg/día, aisladamente o en combinación entre sí o con la aspirina). Como medida adicional para calmar las exacerbaciones del dolor se pueden utilizar dosis puntuales de diclofenaco. También puede ser útil la aplicación de una bolsa de hielo en el tórax. Los corticoides no son fármacos de primera elección. Al contrario, debe intentarse evitar al máximo su uso y es preferible dar apoyo psicológico al paciente y animarle a soportar el dolor unos pocos días más antes que recurrir prematuramente a la administración de corticoides. Los corticoides consiguen, en la mayoría de los casos, un rápido control de los síntomas, pero es posible que favorezcan la aparición de recidivas. De hecho, algunos pacientes presentan brotes repetidos cada vez que se intenta disminuir la dosis, quedando «enganchados» a los corticoides con los efectos secundarios consiguientes. Así pues, sólo se debe considerar su administración en casos de persistencia de dolor intenso o fiebre alta, rebelde a los fármacos antes mencionados, durante más de 7 o 10 días de evolución, y si se considera descartada la tuberculosis. Nuestra experiencia es que con una utilización adecuada de los antiinflamatorios y analgésicos mencionados raramente hay que recurrir a los corticoides. En caso de administrarlos, el tiempo de administración debe ser como mínimo de 2 a 4 semanas. La dosis inicial (40-60 mg de prednisona o equivalente) debe mantenerse mientras persistan el dolor, la fiebre o un derrame importante, y reducirse luego de forma paulatina con el objetivo de suprimirlos totalmente en el plazo de unas 4-6 semanas.
Las formas específicas de pericarditis deben ser tratadas de acuerdo con su etiología. La aspirina es el fármaco de primera elección en los pacientes con infarto de miocardio reciente, mientras que la indometacina debe evitarse en los pacientes con cardiopatía isquémica en fase aguda, ya que disminuye el flujo arterial coronario. El tratamiento de la pericarditis purulenta requiere, aparte de la administración de los antibióticos adecuados, la práctica de un drenaje quirúrgico del pericardio. La pericarditis tuberculosa debe ser tratada con los mismos fármacos que se administran para la tuberculosis pulmonar. No está clara la eficacia de los corticoides para evitar la posible evolución hacia constricción pericárdica. Hay que insistir en que el tratamiento antituberculoso se debe administrar sólo cuando el diagnóstico es absolutamente seguro (aislamiento del bacilo de Koch en el líquido pericárdico o en otras localizaciones, o hallazgo de granulomas con caseum en el tejido pericárdico o en otros tejidos). En ningún caso se debe administrar tratamiento antituberculoso a ciegas.
PERICARDITIS RECIDIVANTE
Entre un 8 y un 80% (como promedio alrededor de un 24%) de los pacientes con pericarditis aguda presentan recidivas. La mayoría de ellos presenta una sola recidiva, en general dentro de las primeras semanas después del episodio inicial, pero algunos pacientes presentan brotes repetidos durante meses o años12,21. En ocasiones, la reaparición de los síntomas se produce cada vez que se intenta suprimir el tratamiento antiinflamatorio o con un intervalo < 6 semanas desde el brote inicial, definiéndose estos casos como «pericarditis incesante». Esta situación se puede observar tras la supresión de los fármacos antiinflamatorios habituales, pero es especialmente frecuente y engorrosa en los pacientes que han recibido corticoides. Algunos pacientes tienen un umbral de dosis de prednisona (en general entre 10 y 20 mg) por debajo del cual la recidiva es probable. El término «pericarditis intermitente» se refiere a los pacientes con intervalos libres de síntomas de más de 6 semanas sin tratamiento.
La forma más típica de pericarditis recidivante es la que ocurre después de un primer episodio de pericarditis idiopática, presumiblemente de origen viral. La patogenia de este síndrome puede estar relacionada con una infección viral persistente o recurrente, con un mecanismo inmunopatoló gico o con un tratamiento farmacológico inadecuado. Se ha sugerido que el tratamiento con corticoides en el brote inicial puede favorecer la aparición de recurrencias debido a su efecto deletéreo sobre la replicación viral. El mecanismo inmunológico es, particularmente, el más probable en la pericarditis recidivante del lupus eritematoso sistémico. La pericarditis recidivante puede ocurrir también después de un infarto de miocardio o de la cirugía cardíaca; las recidivas después de la cirugía cardíaca son más frecuentes en niños y adolescentes, especialmente después del cierre de la comunicación interauricular22. Las pericarditis infecciosas (purulenta y tuberculosa) tienen un curso agudo, subagudo o crónico con síntomas persistentes, pero no se manifiestan con un cuadro de auténtica pericarditis recidivante. Asimismo, la pericarditis neoplásica tiene un curso persistente y, en general, la mala evolución de la neoplasia de base no permite un curso crónico. No obstante, de forma excepcional, algunas pericarditis neoplásicas se manifiestan inicialmente con un brote de pericarditis aguda en apariencia autolimitado, con la reaparición posterior de las manifestaciones pericárdicas23. Así pues, en los pacientes que no han recibido cirugía cardíaca y en aquellos en los que se ha descartado un lupus eritematoso, que presentan una pericarditis recidivante-intermitente con períodos asintomáticos > 6 semanas, se puede establecer el diagnóstico de pericarditis idiopática con toda seguridad y sin necesidad de exploraciones adicionales.
Aunque las manifestaciones durante las recurrencias son similares a las del primer episodio de pericarditis, es bastante característico que el primer episodio sea el más severo, mientras que los brotes subsiguientes sean clínicamente más ligeros. En especial, los signos objetivos de pericarditis (roce pericárdico, cambios electrocardiográficos y derrame pericárdico) son mucho más frecuentes en el brote inicial y a menudo están ausentes en los brotes posteriores, que se manifiestan con «dolor pericardítico» exclusivamente, de forma que muchas veces es difícil saber si el paciente presenta realmente un nuevo brote. Si el primer brote cursa sin derrame pericárdico es muy poco probable que éste aparezca en brotes posteriores. Asimismo, el taponamiento es muy raro en las recidivas. El número de recurrencias y el intervalo entre los episodios varían mucho entre los pacientes y son muy difíciles de prever en un paciente concreto. En nuestra experiencia con 44 pacientes con pericarditis recurrente que no habían recibido corticoides, 20 pacientes tuvieron 2 episodios, 19 pacientes tuvieron 3-5 episodios y 5 pacientes tuvieron más de 5 episodios2. El intervalo entre los brotes es muy variable. En la serie de Fowler y Harbin24, la mitad de los pacientes (15 de 31) tuvieron períodos asintomáticos de 1 año o más y 12 pacientes estuvieron asintomáticos durante 2 años o más (2 pacientes incluso durante 8 años). En general, no obstante, los brotes se van haciendo menos frecuentes y progresivamente menos severos. Como se ha comentado, el taponamiento es muy poco frecuente y, por otra parte, la evolución hacia una pericarditis constrictiva es absolutamente excepcional.
En cuanto al manejo de estos pacientes, se debe valorar en primer lugar si el tratamiento del brote inicial fue correcto, o bien, si fue inadecuado (período de reposo demasiado corto, dosis bajas de antiinflamatorios, interrupción prematura de éstos). En líneas generales, el tratamiento de las recurrencias debe ser el mismo que el del brote de pericarditis inicial. Es importante mantener el reposo hasta que la fiebre y el dolor torácico hayan desaparecido, así como administrar los antiinflamatorios no esteroideos a las dosis adecuadas siguiendo las pautas de tratamiento descritas en el apartado anterior. De nuevo, hay que poner énfasis en evitar el uso de corticoides.
En los pacientes que hayan presentado 2 o más recurrencias o en los pacientes con pericarditis incesante está indicado iniciar el tratamiento con colchicina (asociada con antiinflamatorios no esteroideos). Desde la observación inicial de Rodríguez de la Serna et al25 publicada en 1987 se ha ido acumulando experiencia clínica sobre la eficacia de la colchicina para interrumpir los brotes de pericarditis recidivante. En el estudio multicéntrico más importante26 se incluyó a 51 pacientes (33 con pericarditis idiopática y 18 con pericarditis secundarias) que fueron tratados con colchicina durante 6-128 meses (media 36 meses); cabe destacar que 29 de ellos habían recibido corticoides. Antes del tratamiento con colchicina, el número de recurrencias oscilaba entre 2 y 15 (media, 3,5 por paciente) con un intervalo entre las crisis de 2 meses. Durante un período total de 1.004 pacientes-meses (media, 12 meses por paciente) de tratamiento con colchicina (dosis inicial de 0,5-3 mg/día y dosis de mantenimiento de 0,5-2 mg/día) sólo 7 (13,7%) de los 51 pacientes presentaron recurrencias. En 39 pacientes se suprimió la colchicina y 14 de ellos presentaron recidivas que, en general, fueron poco severas y pudieron controlarse en todos los pacientes reinstaurando el tratamiento con colchicina. Durante los 2.333 pacientes-meses de seguimiento, 31 pacientes (60,7%) permanecieron libres de recurrencias. Aunque estas observaciones son importantes, no se trata de un estudio prospectivo, aleatorizado y doble ciego. Además, la gran variabilidad en los intervalos entre las crisis que presentan estos pacientes, con la posibilidad de largos períodos asintomáticos en pacientes sin tratamiento, junto con algunas dudas sobre la selección de los pacientes, plantea ciertas reticencias sobre la validez de estos hallazgos. En este sentido, cabe destacar que otros autores23 no han apreciado la eficacia de la colchicina en sus pacientes.
La eficacia real de la colchicina no se conoce, ya que no hay estudios prospectivos y controlados con placebo. Nuestra impresión es que la colchicina es realmente útil en más de la mitad de los pacientes y aconsejamos su administración en los pacientes que han presentado 2 o más recidivas. La dosis inicial aconsejable es de 1 mg/12 h, que se puede reducir a 0,5 mg/12 h en caso de intolerancia digestiva. Se recomienda mantener el tratamiento con colchicina (0,5-1 mg/día, según peso del paciente y tolerancia) durante 1 año.
Si por cualquier motivo el paciente está recibiendo tratamiento con corticoides y presenta recurrencias durante la fase de supresión de éstos, hay que hacer los máximos esfuerzos para controlar los brotes con aspirina o antiinflamatorios no esteroideos (solos o en combinación), intentando evitar aumentar de nuevo la dosis de corticoides. Como se ha dicho anteriormente, la colchicina (1-2 mg/día) puede ser útil para conseguir la retirada de los corticoides. En estos pacientes, la reducción de la dosis de corticoides debe ser muy lenta (1,25-2,5 mg/mes).
En contraste con la recomendación de evitar los corticoides en los pacientes con pericarditis, algunos autores27 han abogado la postura contraria, es decir, la administración de corticoides a dosis altas. La base fisiopatológica para esta recomendación es el efecto inmunodepresor de estas dosis altas, que conseguiría inhibir la citólisis mediada por las células T, las cuales pueden desempeñar un papel en las recidivas de la pericarditis. Asimismo, en pacientes rebeldes al tratamiento médico con pericarditis recurrente de larga evolución (> 1 año) que hayan presentado múltiples crisis (> 6) que limiten seriamente su calidad de vida se puede considerar la posibilidad de tratamiento inmunodepresor (azatioprina 75-100 mg/día) o la pericardiectomía. Sin embargo, el tratamiento inmunodepresor es una alternativa poco probada, y la pericardiectomía a menudo no es eficaz. Por tanto, estas opciones terapéuticas deben considerarse sólo en casos excepcionales y antes de plantearse su uso hay que estar totalmente seguros de que se han agotado el resto de alternativas terapéuticas. Nosotros, personalmente, nunca hemos administrado inmunodepresores y sólo hemos practicado pericardiectomía en muy pocos pacientes con resultados variables. De hecho, los pacientes pueden seguir presentando brotes de pericarditis, ya que la pericardiectomía nunca es total. Nuestra impresión, de acuerdo con la experiencia de otros autores24, es que con un uso adecuado de los fármacos mencionados el cuadro de pericarditis aguda benigna recidivante se puede controlar de una manera satisfactoria en la gran mayoría de los pacientes y que, finalmente, el síndrome acaba cediendo.
El papel de la actividad física en la recurrencia y exacerbación de la pericarditis es desconocido. En la práctica clínica es relativamente frecuente encontrar pacientes que refieren empeoramiento de sus síntomas con el ejercicio. Esto es especialmente frecuente en los pacientes con dolor precordial persistente como única manifestación de la enfermedad, mientras que el papel del ejercicio como desencadenante de brotes claros de pericarditis (con dolor, fiebre y roce) es mucho más dudoso. En cualquier caso, parece razonable restringir la actividad física, especialmente cuando se está retirando el tratamiento corticoideo o antiinflamatorio. La magnitud de esta restricción es difícil de establecer, pero es aconsejable restringir la actividad física hasta un nivel que permita realizar actividades domésticas y trabajos sedentarios.
TAPONAMIENTO CARDÍACO
El taponamiento cardíaco es el síndrome debido a la compresión del corazón por el derrame pericárdico. El taponamiento no es una situación del «todo o nada» como se creía hace algunos años, sino que corresponde a un continuum con una gradación de severidad que va desde una ligera elevación de la presión intrapericárdica con mínima repercusión sobre la función cardíaca (y sin ninguna manifestación clínica) hasta una situación de severa afección hemodinámica que puede llevar incluso a la muerte28.
El taponamiento se puede presentar en cualquier tipo de pericarditis pero, en términos relativos, es más frecuente en las pericarditis neoplásica, tuberculosa y purulenta que en la viral o idiopática. Sin embargo, como se ha comentado anteriormente, en términos absolutos, la causa más frecuente de taponamiento en los pacientes médicos (es decir, que no han recibido intervenciones quirúrgicas o procedimientos invasivos y que no han presentado traumatismos torácicos) es la pericarditis aguda idiopática, debido a su mayor prevalencia. Estos pacientes tienen habitualmente signos inflamatorios francos (fiebre, dolor torácico, roce). Por el contrario, estos signos están ausentes en muchos pacientes con taponamiento de origen neoplásico, de forma que un cuadro de taponamiento aislado obliga a descartar esta última etiología6. La disección de aorta tipo A con rotura en el saco pericárdico es otra causa de taponamiento, pero su presentación clínica global es suficientemente característica para sospecharla.
Los pacientes con taponamiento presentan sobre todo disnea y dolor torácico. También pueden presentar síncope, sobre todo cuando el taponamiento es agudo, como el causado por la disección de aorta. Los signos clínicos de taponamiento consisten en ingurgitación yugular, hepatomegalia, pulso arterial paradójico (descenso de la presión arterial sistólica > 10 mmHg con la inspiración durante la respiración espontánea) y, en los casos severos, hipotensión arterial y shock. Ninguno de estos signos es patognomónico de taponamiento, pero su presencia (en especial el pulso paradójico) obliga a descartarlo, sobre todo cuando no hay signos concomitantes de insuficiencia cardíaca izquierda (excepcionalmente presentes en el taponamiento). En caso de duda, el ecocardiograma Doppler es una exploración de gran ayuda ya que, en este contexto, la presencia de derrame pericárdico con signos de compromiso hemodinámico (colapso de cavidades derechas, cambios respiratorios exagerados de los flujos mitral y tricuspídeo) tiene un valor predictivo positivo muy alto para el diagnóstico de taponamiento, mientras que su ausencia obliga a reconsiderar el diagnóstico. Una situación particular es el taponamiento cardíaco localizado que se puede presentar después de la cirugía cardíaca, que puede ser difícil de diagnosticar y puede requerir la práctica de otras técnicas de imagen, como la tomografía computarizada. El taponamiento clínico es la manifestación más severa del espectro del taponamiento cardíaco. Es relativamente frecuente encontrar a pacientes con derrame pericárdico moderado o severo que presentan algún signo ecocardiográfico de taponamiento (en especial, colapso de aurícula y/o ventrículo derechos) pero sin ningún signo clínico de compromiso hemodinámico. Mientras que la ausencia de signos ecocardiográficos tiene un valor predictivo negativo de taponamiento muy alto, el valor predictivo positivo de estos hallazgos para el diagnóstico de taponamiento clínico (en particular del colapso aislado de aurícula derecha) es muy bajo, alrededor del 30%29. Aunque ello pueda traducir la presencia de un grado ligero de compromiso hemodinámico, no obliga por sí mismo a realizar un drenaje pericárdico.
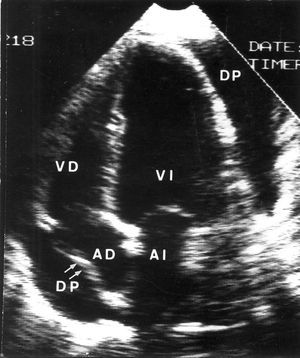
Si el paciente presenta taponamiento cardíaco severo (hipotensión, bajo gasto o shock), se debe practicar un drenaje pericárdico. La elección entre la pericardiocentesis o el drenaje quirúrgico está condicionada, fundamentalmente, por las preferencias y experiencia del médico responsable y por la propia estructura del hospital (disponibilidad de cardiólogo de guardia o de un equipo de cirugía). Nuestra actitud es empezar con una pericardiocentesis por vía subxifoidea y reservar el drenaje quirúrgico para los casos en los que la pericardiocentesis no ha sido eficaz (por dificultades técnicas o por el propio carácter del líquido) o bien si se produce una recidiva del taponamiento. En pacientes con taponamiento ligero o moderado y con baja probabilidad de tener formas específicas de pericarditis se puede adoptar, inicialmente, una actitud contemporizadora28. Muchos pacientes con pericarditis aguda idiopática y con taponamiento poco severo evolucionan bien con reposo y antiinflamatorios, de forma que la pericardiocentesis se puede obviar en muchos casos (fig. 3). Una situación diferente es la de los pacientes con derrame pericárdico neoplásico, ya que en ellos es muy probable que aumente el derrame y se agrave el taponamiento, por lo que está justificado proceder al drenaje pericárdico aun en casos de taponamiento poco severo. El tipo de drenaje pericárdico más adecuado en los pacientes con pericarditis neoplásica es discutible. En principio hay que recurrir a procedimientos poco agresivos (sobre todo en los pacientes con mal pronóstico global) pero que, a la vez, sean eficaces para evitar la reaparición del derrame. La pericardiocentesis simple con aguja soluciona inicialmente el taponamiento en muchos casos, pero la probabilidad de recidiva es muy alta. Por el contrario, el drenaje quirúrgico (o su equivalente mayor, la pericardiectomía) es un procedimiento excesivo para muchos pacientes. La mejor opción es la pericardiocentesis con técnica de Seldinger, dejando un catéter pigtail de drenaje que debe mantenerse mientras sea productivo30. Si tras la retirada del catéter pigtail el derrame recidiva, se puede proceder a la instilación de una sustancia esclerosante (tetraciclina o bleomicina) en el saco pericárdico, o bien a la práctica de una pericardiostomía con balón por vía subxifoidea30.
Fig. 3. Ecocardiograma 2-D de un paciente con pericarditis aguda en el que se aprecia la presencia de derrame pericárdico importante con colapso de la aurícula derecha. Clínicamente el cuadro correspondía a una pericarditis aguda idiopática y el paciente presentaba signos clínicos de taponamiento poco severo. El paciente evolucionó bien con tratamiento antiinflamatorio no esteroideo y no fue necesario practicar una pericardiocentesis.
Otra situación especial es la del derrame pericárdico en los pacientes sometidos a hemodiálisis. Aun en ausencia de taponamiento severo estos pacientes pued en tolerar mal la hipovolemia que se produce durante las sesiones de hemodiálisis, por lo que a veces hay que recurrir al drenaje pericárdico.
PERICARDITIS CONSTRICTIVA (AGUDA Y SUBAGUDA)
No es un objetivo de este trabajo hacer una descripción exhaustiva de la pericarditis constrictiva. En este apartado se harán, simplemente, algunos comentarios sobre algunas formas de constricción relacionadas con la pericarditis aguda.
En la fase de resolución de las pericarditis agudas exudativas idiopáticas es relativamente frecuente que aparezcan signos de constricción pericárdica, lo cual puede ocurrir hasta en un 30% de los casos31,32. En general se trata de signos subclínicos (pulso venoso yugular vivo con colapso «Y», ruido protodiastólico, muesca en el tabique interventricular en el ecocardiograma y alteración de los flujos venosos), pero algunos pacientes pueden llegar a presentar signos de insuficiencia cardíaca derecha. En la gran mayoría de los casos estos signos retroceden sin medidas especiales (y sin corticoides) en unas pocas semanas («constricción cardíaca transitoria»), de forma que es excepcional que una pericarditis idiopática o viral evolucione a una pericarditis constrictiva severa y persistente con necesidad de una pericardiectomía (esto ocurre sólo en un 1% aproximadamente de los casos). Por el contrario, un 50% de los pacientes con pericarditis tuberculosa y un 30% de los pacientes con pericarditis purulenta requieren pericardiectomía a causa de esta evolución. Estas formas de pericarditis constrictiva se presentan bastante precozmente, a las pocas semanas o primeros 3 meses tras la fase de pericarditis exudativa y, en especial en el caso de la pericarditis purulenta, se pueden instaurar de una forma muy aguda. En algunos pacientes incluso la constricción aparece ya durante la fase exudativa y puede coexistir el taponamiento con la constricción, lo que configura el cuadro de la pericarditis exudativo-constrictiva33. En estas formas de constricción hay una participación muy importante del pericardio visceral («epicarditis constrictiva») que es muy importante reconocer en el caso de una eventual pericardiectomía.
Correspondencia: Dr. J. Sagristà Sauleda.
Servei de Cardiologia. Hospital General Universitari de la Vall d'Hebron.
Passeig de la Vall d'Hebron, 118-128. 08035 Barcelona. España.
Correo electrónico: jsagrist@vhebron.net