Palabras clave
INTRODUCCION
La aterosclerosis es una enfermedad sistémica difusa que se caracteriza por la existencia de placas ricas en lípidos en la pared arterial de arterias de medio y gran calibre. Las placas con alto contenido lipídico han sido también denominadas «inestables», «vulnerables» o «de alto riesgo» por su propensión a romperse facilitando de esta manera la precipitación de un evento agudo. La manifestación clínica aterosclerótica se caracteriza fundamentalmente por la formación de un trombo agudo (oclusivo) anclado en la placa rota o erosionada, por ello el término aterotrombosis define de forma más global la naturaleza de la enfermedad. Pese a que hoy en día el diagnóstico de la severidad de la enfermedad aterosclerótica se realiza, habitualmente, una vez se han producido las manifestaciones locales (síndrome coronario agudo [SCA], AIT [accidente isquémico transitorio], ACVA [accidente cerebrovascular agudo] o isquemia de los miembros), debido a la naturaleza generalizada de la enfermedad existe la posibilidad de diagnosticar la presencia de la enfermedad arterosclerótica en un estadio preclínico o asintomático. Esto permitiría la instauración de un tratamiento en un estadio precoz. La aterotrombosis es la mayor causa de morbimortalidad en los países desarrollados y el futuro no se prevé mucho más halagüeño, tanto en los países desarrollados como en aquellos en vías de desarrollo. Ya desde que Virchov propusiese su hipótesis sobre el desarrollo de la aterosclerosis, tradicionalmente se han catalogado tres tipos de enfermedad aterosclerótica obstructiva: enfermedad arterial coronaria, enfermedad cerebrovascular y enfermedad arterial periférica.
Fundamentado en un origen común, hoy en día todas estas manifestaciones clínicas se agrupan bajo un término común como es el de enfermedad aterotrombótica.
FISIOPATOLOGÍA
Desde el punto de vista fisiopatológico, la aterosclerosis es una enfermedad sistémica única causada por un mismo proceso, independiente del territorio vascular afectado.
Diferentes estudios muestran que la aterosclerosis se puede evidenciar ya desde la segunda o tercera década de la vida, antes de manifestarse clínicamente1-3. La aterosclerosis comienza por una disfunción del endotelio (barrera natural entre el flujo sanguíneo y la pared arterial). Su función principal es hacer de ésta una superficie «antiadherente» y con capacidad de adaptarse a las necesidades reológicas del vaso arterial. Las lesiones iniciales son de tipo fatty streak (digitaciones de grasa) que consisten en la acumulación subendotelial de macrófagos cargados de colesterol (células espumosas) que aparecen en la aorta de manera muy temprana, posteriormente, en las arterias coronarias, y luego, en la circulación cerebral4. Una vez el endotelio se hace disfuncionante, permite que las moléculas de LDL-colesterol penetren la pared arterial a través del endotelio. En un intento de contener esta «invasión», los monocitos/macrófagos fagocitan el LDL-colesterol previamente oxidado, transformándose en células cargadas de colesterol. Cuando los macrófagos están repletos de colesterol, se convierten en células espumosas. Debido a que el colesterol no es fácilmente metabolizable fuera del hígado, el acúmulo continuo de éste dentro de las células hace que, ante su fracaso vital, cometan «suicidio» (apoptosis o muerte celular programada)5, con la consiguiente liberación de sustancias protrombóticas, como el factor tisular. Tras la muerte de las células espumosas-macrófagos, el colesterol es de nuevo liberado a la pared arterial, perpetuándose el proceso6;7. El colesterol finalmente puede cristalizar, siendo éste un factor recientemente identificado como desestabilizador de la placa8.
La disfunción endotelial es un trastorno sistémico y reversible considerado como el proceso patológico más precoz de la aterosclerosis9;10. Se trata del fracaso del endotelio como barrera natural, promoviendo no sólo una incompetencia a nivel funcional, sino una infiltración de diferentes sustancias deletéreas dentro de la pared arterial, incluyendo el reclutamiento de células inflamatorias en la pared del vaso.
Asimismo la tensión hemodinámica (shear stress) juega un papel fundamental no sólo en la formación de la placa aterosclerótica, sino en la diferente composición y comportamiento de las placas11, estimulando incluso la expresión de genes de inflamación y de moléculas de adhesión por parte del endotelio12.
Las células endoteliales activadas producen citocinas y expresan moléculas de adhesión como ICAM-1 y VCAM-1. Las células sanguíneas con receptores para estas moléculas de adhesión (linfocitos, monocitos) se unen a ellas13 y gracias a las citocinas secretadas son estimuladas para migrar a través de las uniones endoteliales hacia la íntima, donde se transforman en macrófagos, paso muy importante en el desarrollo de la aterosclerosis14. Las partículas LDL-colesterol que en condiciones normales serían transportadas al hígado sufren una oxidación, lo cual provoca una reacción inflamatoria y su captación por los macrófagos.
A medida que el núcleo lipídico de la placa de ateroma crece por acumulación de partículas LDL-colesterol y macrófagos, células de músculo liso migran desde la media hacia la íntima. Estas células producen y segregan colágeno y elementos fibrosos de la matriz extracelular formándose así la envoltura fibrosa de las placas fibroateromatosas. Inicialmente estas placas no disminuyen el lumen vascular, porque hay una dilatación compensadora de la pared vascular (remodelado positivo)15. La placa crece de forma excéntrica causando adelgazamiento de la media y adventicia, hasta que la dilatación compensadora ya no puede proseguir, momento en el cual empieza a crecer hacia el interior de la luz vascular, comprometiendo el flujo sanguíneo.
Las mayoría de los eventos cardiovasculares agudos no están provocados por el estrechamiento progresivo del lumen vascular sino por complicaciones en la placa aterosclerótica (rotura, ulceración, hemorragia, erosión) que provocan la oclusión vascular aguda por trombosis del vaso.
DETECCIÓN PRECOZ DE ATEROSCLEROSIS POR IMAGEN
Como ya se comentó con anterioridad, la aterosclerosis puede aparecer tan pronto como en la segunda o tercera década de la vida. Además, las lesiones que provocan la sintomatología en muchas ocasiones no son estenóticas, por lo que no serían detectables con la angiografía de contraste convencional, confiriendo esto mayor importancia a la visualización y composición de la placa que al grado de estenosis.
A lo largo de los últimos años se ha producido un gran avance de las técnicas de imagen que permiten la visualización y caracterización de las placas de ateroma, así como la progresión o regresión de las mismas (fig. 1)16. Además, una vez que se detecta enfermedad en un territorio podemos asumir que todos los territorios están afectados, dado lo difuso de la enfermedad aterosclerótica. Esta detección precoz de la aterosclerosis generaría nuevas oportunidades para la prevención primaria, bien a través de la modificación del estilo de vida o incluso a través de terapia farmacológica, sobre todo para pacientes con un grado intermedio de riesgo cardiovascular.
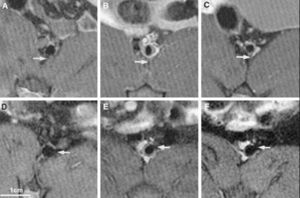
Fig. 1. Estudios seriados en aorta abdominal de conejo con resonancia magnética que demuestran progresión y regresión de la placa aterosclerótica. Se puede observar un aumento de la placa de ateroma tras 9 meses de inducción de aterosclerosis, y una regresión de ésta 6 meses después de retirar la dieta aterogénica. Paneles A y D corresponden a las imágenes obtenidas basalmente a diferentes niveles de aorta abdominal. Los paneles B y E corresponden a las imágenes obtenidas en el mismo nivel de la aorta tras 9 meses de inducción de aterosclerosis. Finalmente paneles C y F corresponden a las imágenes obtenidas 6 meses tras suspender la dieta aterogénica. Tomada con permiso de Helft et al16.
GROSOR ÍNTIMO-MEDIAL
El grosor íntimo-medial es considerado y ha sido validado como un marcador de enfermedad aterosclerótica generalizada17 y de hecho se correlaciona de forma lineal con el número de factores de riesgo ateroscleróticos18.
La medición del grosor íntimo-medial, así como el análisis cuantitativo y cualitativo de las placas de ateroma, puede realizarse, entre otros, por resonancia magnética y por ultrasonido de superficie o transesofágico.
El modo B de ultrasonido con flujo Doppler se ha impuesto como la modalidad de imagen de elección para la visualización del grosor íntimo-medial. Los transductores de 8 Mhz pueden ser utilizados para medir este índice en arterias de mediano-gran calibre, como las carótidas, femorales o radiales. Asimismo, se puede caracterizar la placa de ateroma visualizada, ya que la ecogenicidad de la placa está determinada por su composición: una placa hipoecogénica heterogénea está asociada a la existencia de lípidos, mientras que una placa hiperecogénica homogénea es sobre todo fibrosa19.
Diversos estudios en los que se comparaban las mediciones ultrasonográficas con la histología han demostrado que la medición con ultrasonidos del grosor íntimo-medial de la pared posterior de la carótida refleja el verdadero grosor de la pared20-22, aunque parece ser que las medidas por ultrasonidos pueden ser ligeramente mayores. La medición de la pared proximal de la carótida aporta unos valores menos precisos.
Aunque se pueden hacer diversas mediciones que difieren en complejidad, como la realización de una media de 12 puntos diferentes de la carótida o la inclusión de la medición de la bifurcación de la carótida, la medición más frecuentemente utilizada es la de la arteria carótida común23;24, por dos razones: por ser la más reproducible y por haber demostrado una capacidad similar de predicción de eventos que las más complejas y completas. No obstante, la combinación de información de diferentes segmentos puede aumentar la precisión de este índice.
Hay que tener claro que el grosor íntimo-medial es una variable continua, por lo que no hay un valor de corte claro superior con el que se pueda definir una placa aterosclerótica. Se ha establecido de forma arbitraria como normal un grosor íntimo-medial carotídeo que oscila entre 0,5 y 1,2 mm25, por lo que valores superiores a 1,1-1,2 mm son los usados para definir la presencia de placa aterosclerótica.
Una de las premisas del uso de este índice como marcador vascular es que refleje aterosclerosis generalizada. El aumento del grosor íntimo-medial carotídeo refleja aterosclerosis en la aorta abdominal26, en las arterias de las extremidades inferiores27-29, e incluso se ha visto asociación con el aumento de la masa del ventrículo izquierdo30,31. Respecto a la enfermedad coronaria, diversos estudios han demostrado que la aterosclerosis en la carótida y la aorta son marcadores de la existencia de aterosclerosis coronaria32-35. Pacientes con enfermedad coronaria sintomática tienen aumentado el grosor intimo-medial carotídeo en comparación con controles asintomáticos36. También se ha encontrado engrosamiento de la pared carotídea en pacientes con isquemia silenciosa37. De todas maneras, aunque la relación existente entre el grosor íntimo-medial carotídeo y la severidad de la enfermedad arterial coronaria es bastante habitual, es importante hacer notar que es débil38.
El grosor íntimo-medial no es sólo un marcador de la existencia de aterosclerosis coronaria, sino también un marcador de la progresión de la enfermedad arterial coronaria, como se ha visto en estudios epidemiológicos prospectivos17. El Cardiovascular Health Study encontró que un aumento en el grosor íntimo-medial producía un aumento del riesgo relativo de SCA o ACVA en pacientes mayores de 65 años de edad34. En ensayos de prevención con tratamientos hipolipemiantes vieron que la disminución del grosor íntimo-medial se asociaba a un descenso en la incidencia de eventos cardiovasculares39-42. Por esto, dado que se correlaciona bien con la progresión/regresión de la aterosclerosis, la medición del grosor íntimo-medial de la carótida puede ser un buen método para monitorizar el efecto que ejerce el tratamiento en los pacientes.
IMPORTANCIA DEL CALCIO Y SU CORRELACIÓN CON LA CARGA ATEROSCLERÓTICA
La identificación de calcio coronario es un indicador de cambios crónicos arteroscleróticos en la pared arterial coronaria43. La calcificación coronaria es un fenómeno frecuente que no necesariamente significa enfermedad coronaria obstructiva. La mayoría de las veces traduce cambios crónicos en remodelado de pared arterial y en menos ocasiones placas vulnerables o de alto riesgo. No obstante, sabemos que a mayor afectación crónica aterosclerótica, mayor asociación con placas vulnerables o de alto riesgo, y por lo tanto mayor incidencia de eventos isquémicos.
Hoy en día, existen dos técnicas para cuantificar el calcio coronario: electron-beam (tomografía computarizada por haz de electrones) y la tomografía con multidetectores (TCMD o TAC multicorte). Ambas técnicas son capaces de cuantificar de forma precisa la carga de calcio coronario. Aunque el electron-beam es considerado la prueba diagnóstica «patrón oro», actualmente la técnica más usada para la cuantificación de calcio coronario es la TAC multicorte, debido a su mayor disponibilidad y a la buena correlación que tiene con el electron-beam, incluso con mejor reproducibilidad44;45.
La técnica descrita por Agatston et al46 consiste en medir el área total de placa coronaria calcificada en píxeles, corte por corte, asignándole una puntuación (score). El score cálcico de Agatston se obtiene como resultado de la multiplicación del área de la lesión calcificada por un factor dependiente de la señal pico de intensidad de la lesión. Puede haber problemas con artefactos de ruido y con variaciones en el protocolo de escaneo (principalmente por diferencias en el grosor de corte), que conducen a variaciones en la reproducibilidad. Por este motivo, últimamente se han diseñado nuevas aproximaciones para el cálculo del volumen cálcico y la masa de calcio, que presentan una mayor reproducibilidad y consistencia de la técnica47.
El score cálcico proporciona una estimación precisa de la carga aterosclerótica coronaria y es un predictor potente de eventos cardiacos en pacientes asintomáticos48. Los pacientes sin calcio coronario o con score cálcico bajo tienen menor probabilidad de presentar eventos clínicos que aquellos con scores altos49. Cómo líneas generales y basado en un consenso se considera que la carga arterosclerótica coronaria es mínima (score cálcico 0-10), leve (score cálcico 11-100), moderada (score cálcico 101-400), o severa (score cálcico mayor de 400). Un score cálcico mayor de 1.000 va asociado a un 25% de riesgo anual de padecer un evento cardiovascular (y por lo tanto traduce una necesidad de medidas agresivas de tratamiento en estos pacientes). No obstante, estos valores hay que ajustarlos por edad y sexo, basándonos en los percentiles de población general, pues no es lo mismo un score cálcico de 45 en un hombre de 45 años (riesgo moderado puesto que está por encima del percentil 95 para esa edad) que el mismo score en un hombre de 75 años (que se encontraría por debajo del percentil 10)50.
Interesantemente, se han descrito también variaciones raciales en la carga cálcica aterosclerótica y que no se explican por los factores de riesgo convencionales conocidos51.
Es importante reseñar que no está demostrado que el score cálcico coronario sea un factor predictor de eventos independiente de los factores de riesgo convencionales50. Generalmente a la hora de estratificar el riesgo de eventos cardiovasculares, se usan algoritmos que combinan los factores de riesgo clásicos, tales como los del estudio de Framingham o el estudio PROCAM (Prospective Cardiovascular Munster). La V Conferencia sobre prevención cardiovascular de la Sociedad Americana de Cardiología52 estableció el uso del score cálcico entre otros test no invasivos, en poblaciones seleccionadas de pacientes asintomáticos. Esto ha sido respaldado por la NCEP (National Cholesterol Educational Program, Panel III)53. Por ejemplo, los pacientes asintomáticos que tienen un riesgo intermedio (10-20% en 10 años, 2 o más factores de riesgo coronarios según criterios Framingham) comprenden el grupo que más se puede beneficiar de un cambio en tratamiento y hábitos de vida, y por lo tanto sería el grupo en el que la cuantificación del score cálcico estaría más indicado. Además, habría también algunos subgrupos de pacientes seleccionados con riesgo bajo que se podrían beneficiar de la técnica, como por ejemplo pacientes jóvenes con historia familiar precoz de cardiopatía isquémica54. Si en estos pacientes el score cálcico es alto, se incrementaría mucho el riesgo de eventos cardiovasculares, con lo que habría que intensificar las medidas encaminadas a la prevención. Si por el contrario el test fuera negativo, el riesgo sería menor. Algunos autores indican que la combinación del score cálcico con los factores de riesgo convencionales sería una aproximación mejor a la hora de estimar el riesgo en pacientes asintomáticos55,56. Además en los pacientes con factores de riesgo cardiovascular y un score cálcico alto, la realización de un test de esfuerzo con perfusión y/o función ventricular puede proporcionar información diagnóstica y pronóstica56.
Datos recientes indican que en la actualidad no esté recomendada la monitorización seriada con score cálcico para observar la progresión o regresión aterosclerótica54,57.
NUEVAS TÉCNICAS DE IMAGEN PARA CUANTIFICACIÓN DE CARGA ATEROSCLERÓTICA GLOBAL
Tradicionalmente la imagen de placas ateroscleróticas se había centrado en la valoración del grado de estenosis que producían en la luz arterial estas placas, sin embargo, como ha sido expuesto con anterioridad, hoy en día es bien conocido que la mayoría de eventos cardiovasculares son secundarios a placas que previamente no eran estenóticas15. Esto ha puesto de manifiesto la necesidad de técnicas de imagen que puedan identificar no sólo el grado de estenosis de las lesiones ateromatosas, sino también su composición y niveles de inflamación, y así poder identificar las posibles placas de alto riesgo (placas vulnerables) antes de su manifestación clínica. Dentro de estas técnicas de imagen, las hay invasivas: ecografía intravascular (IVUS), angioscopia, tomografía por coherencia óptica; y no invasivas: resonancia magnética (RM), tomografía por emisión de positrones (PET), y tomografía axial computarizada (TAC) (tabla 1). Aquí nos centraremos únicamente en las técnicas no invasivas, haciendo especial hincapié en las técnicas de imagen molecular (molecular imaging).
La RM es una técnica que nos permite evaluar de forma detallada el árbol vascular arterial prácticamente a todos los niveles: arterias coronarias, aorta y sus ramas principales, carótidas, y arterias de miembros inferiores, siendo inocua para el paciente. La RM se ha propuesto como técnica capaz de visualizar la composición de la placa, basándose en propiedades biofísicas y bioquímicas distintas de los diferentes componentes de la placa58. Mediante la combinación de secuencias multicontraste es posible determinar la anatomía de la placa y su composición.
La angio-RM con contraste es una técnica con altas sensibilidad y especificidad cuando se compara con la técnica convencional de rayos X a la hora de detectar estenosis > 50%59. Podemos realizar una angiografía de todo el árbol vascular (whole blood). Los vasos intracraneales y las arterias coronarias son los únicos territorios que requieren estudios especiales dirigidos.
Estudio de las placas carotídeas con resonancia magnética
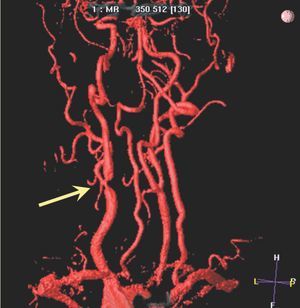
Las carótidas son unos vasos de buen calibre y que no están sometidos a movimientos, con lo cual resultan idóneos para los estudios de imagen no invasiva. Mediante esta técnica es posible cuantificar no sólo el tamaño de la placa aterosclerótica, sino valorar la integridad de la cápsula fibrosa60. Existe una asociación estrecha entre el adelgazamiento o rotura de la cubierta fibrosa de la placa carotídea detectada con RM y la historia reciente de AIT o ACVA61. Técnicamente es posible combinar la angio-RM (cuantificación del grado de estenosis y su distribución espacial) con la RM de alta resolución (caracterización de la pared arterial y la composición de la placa)62 (fig. 2).
Fig. 2. Estudio de angiorresonancia en paciente con sintomatología neurológica. Se puede observar una estenosis en la bifurcación carotídea derecha.
Estudio de placas en aorta con resonancia magnética
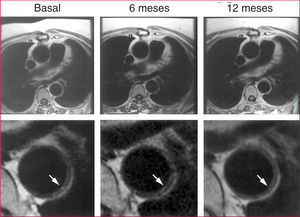
Las placas ateromatosas de la aorta torácica se pueden evaluar con RM de alta resolución (resolución submilimétrica), aunque existen potenciales artefactos secundarios a los movimientos respiratorios. La RM es superior a la ecografía transesofágica en cuanto a la caracterización de la placa, aunque ambas técnicas han mostrado una fuerte correlación en los hallazgos sobre grosor de la placa63. También es posible realizar angio-RM de contraste de la aorta torácica-abdominal y de sus ramas, proporcionando una información espacial sobre la distribución de las placas y la afectación de arterias renales16. La RM es la herramienta ideal para monitorizar la regresión de la placa tras iniciar un tratamiento hipolipemiante, como fue demostrado por nuestro grupo64,65 (fig. 3).
Fig. 3. Regresión de placa aterosclerótica en aorta torácica descendente en humano tras inicio de tratamiento hipolipemiante. Imagen reproducida con permiso de Corti et al64.
Imagen molecular con resonancia magnética (molecular imaging)
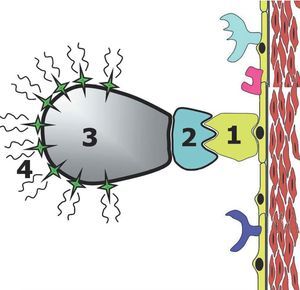
Con anterioridad hemos expuesto cómo diferentes técnicas de imagen pueden detectar la enfermedad aterosclerótica cuando se encuentra en estadios avanzados, llegándose a cuantificar el tamaño y la composición de la placa aterosclerótica. Sin embargo, recientemente se han desarrollado nuevas técnicas de imagen (técnicas de imagen molecular) que potencialmente son capaces de detectar estadios precoces de enfermedad. Las técnicas de imagen molecular pueden considerarse un equivalente in vivo a las técnicas de inmunohistoquímica. El objetivo de estas técnicas es identificar diferentes moléculas y/o células, a través de marcadores con contraste, que realzan la señal allí donde se depositan. El agente de contraste debe identificar la diana u objetivo, con una alta especificidad y a la vez con la suficiente intensidad de señal para poder ser detectada y diferenciada de las zonas no contrastadas66 (fig. 4).
Fig. 4. Representación esquemática del concepto de imagen molecular. La molécula específica que se quiere investigar (receptores específicos, integrinas, moléculas de adhesión, etc., representado en la gráfica con el número 1) es identificada por un ligando, que se une a la molécula a estudio. Los ligandos (representado por el número 2 en la gráfica) suelen ser anticuerpos monoclonales que reconocen específicamente la molécula a estudio. Previamente (in vitro) el ligando ha sido unido a sustancias emisoras de señal (4 en la gráfica). Esta unión a los emisores de señal se hace mediante un vehículo (3 en la gráfica) que tiene la capacidad de unirse específicamente al ligando y las sustancias emisoras de señal. De esta manera se pueden localizar determinadas moléculas mediante técnicas de imagen.
Existen diferentes técnicas desarrolladas con suficiente resolución espacial para ofrecer imagen molecular: RM con contrastes dirigidos, sondas ultrasónicas, técnicas de imagen óptica (fluorescente y bioluminiscente) y técnicas de medicina nuclear (PET y SPECT).
La RM posee una excelente resolución espacial, aunque una sensibilidad más baja que las técnicas de medicina nuclear66. Los contrastes se pueden unir a anticuerpos monoclonales o péptidos específicos67. Los mejores resultados se obtienen con nanopartículas que combinan una alta afinidad para unirse a la zona diana, y además poseen la capacidad de transportar una cantidad suficiente de contraste paramagnético. Las nanopartículas más usadas son los liposomas y las emulsiones lipídicas de fluorocarbono. Las técnicas de imagen molecular se han utilizado para la visualización de trombos68 (mediante contrastes unidos a anticuerpos dirigidos contra la fibrina, los receptores plaquetarios avb3), de angiogénesis (contrastes dirigidos contra la integrina avb3, que es expresada por las células endoteliales únicamente durante la angiogénesis)68, o bien para visualizar inflamación (contrastes unidos a anticuerpos dirigidos contra antígenos presentes durante procesos inflamatorios, como VCAM 1, ICAM 1 y E-selectina69-72). Además se ha reportado en modelos de conejo73 que las partículas paramagnéticas de óxido de hierro (USPIO) pueden ser «atraídas» por los macrófagos (células predominantes de las placas «vulnerables»74). Esta misma observación ha sido replicada en arterias carótidas de humanos, donde tras la administración de USPIO hay un acúmulo de este contraste en las zonas ricas en macrófagos de las placas inestables75.
Tomografía por emisión de positrones y tomografía computarizada por emisión de fotón único
Los isótopos radiactivos (radionúclidos), a través de su unión con diferentes compuestos, son capaces de detectar diferentes procesos moleculares y celulares, proporcionando así una herramienta útil de imagen con la que podemos identificar diferentes componentes de las placas de ateroma. El isótopo radiactivo se tiene que unir a un compuesto trazador antes de ser administrado. La detección del isótopo se realiza fundamentalmente por dos técnicas: PET y SPECT. Los datos obtenidos son procesados y reconstruidos con una computadora obteniéndose imágenes bidimensionales o tridimensionales, localizándose la distribución del trazador en los tejidos a estudio76. Los trazadores ideales para la imagen de placa de ateroma se deben unir a componentes de la placa y posteriormente tener un lavado rápido, para que exista el suficiente contraste entre la placa y la sangre. A continuación expondremos brevemente las diferentes regiones diana de las placas ateromatosas en las que pueden depositarse los radionúclidos para proporcionarnos información sobre la composición de la placa.
Metaloproteinasas de la matriz
Las metaloproteinasas de la matriz son proteínas que «digieren» la matriz extracelular de la placa de ateroma, pudiendo inestabilizar la placa. Su actividad es considerada un marcador importante de vulnerabilidad de la placa. Se han reportado modelos ateroscleróticos murinos77 y de conejo78 en los que contrastes dirigidos contra estas proteínas se depositaban en placas complicadas. Si bien es importante reseñar que estas técnicas de imagen distan mucho de ser aplicables en humanos, su potencial es enorme en vistas a una futura aplicación clínica.
Visualización de apoptosis en la placa de ateroma
La apoptosis desempeña un papel importante tanto en la génesis de la placa de ateroma como en su inestabilización y rotura. Las células en apoptosis forman los llamados cuerpos apoptóticos, que son pequeñas moléculas «cubiertas» de fosfatidil serina. La anexina V tiene una alta afinidad por la fosfatidil serina. Existen diferentes compuestos de contrastes y trazadores unidos a la anexina V. Se han publicado diferentes trabajos en animales en los que estos compuestos son captados por determinadas placas ateroscleróticas78. Adicionalmente, también se han testado en humanos, donde la administración de Anexia V unida a 99Tc fue captada por las placas carotídeas en pacientes con AIT reciente79. Las piezas de endarterectomía de estos pacientes demostraron la presencia del trazador en las placas con alto contenido de macrófagos. Este campo tiene un potencial enorme, que no obstante ha de ser expandido.
Imagen de los macrófagos de la placa con tomografía por emisión de positrones
El PET tiene la ventaja sobre el SPECT de tener mayor resolución espacial (4-5 mm frente a 1-1,5 cm). Las imágenes del PET derivan de la detección de la emisión de positrones por parte de algunos radionúclidos como 11C o 18F. Por todo ello el PET ofrece mayor potencial a la hora de visualizar la placa aterosclerótica. La deoxiglucosa es un compuesto que «compite» con la glucosa como sustrato energético de las células metabólicamente activas, existiendo un acúmulo incremental en función del grado de actividad metabólica que tengan. La combinación de 18F con deoxiglucosa (FDG) es muy útil a la hora de «visualizar» mediante PET la actividad metabólica celular. Esta técnica ha sido utilizada ampliamente en la detección de tumores, o en la valoración del consumo de glucosa miocárdica80. Además esta técnica ha demostrado su utilidad para «visualizar» la inflamación vascular81. Además de diversos estudios animales82, un trabajo reciente en humanos con FDG-PET mostró que los macrófagos eran los responsables de la captación de FDG81. Adicionalmente una combinación de PET-TAC en pacientes con AIT reciente mostró que las placas responsables del cuadro, y no las contralaterales, captaban de forma más importante el FDG. De confirmarse, esta técnica podría revolucionar el campo de la detección de la placa de alto riesgo, así como la monitorización del efecto de determinados tratamientos (hipolipemiantes, etc.).
Tomografía axial computarizada multidetector
Además de proporcionar información sobre el score cálcico como hemos señalado previamente, el TCMD puede identificar placas no calcificadas mediante el uso de contrastes yodados. También tiene la capacidad potencial de poder distinguir diferentes componentes de la placa83. Existen estudios ex vivo en arterias coronarias de humanos, comparando la anatomía patológica de las placas ateroscleróticas con los hallazgos por TCMD, demostrando que existe una buena correlación con los diferentes estadios de la placa84. Se pueden diferenciar las placas con alto contenido lipídico de las placas fibrosas y placas calcificadas, puesto que cada una tiene diferente intensidad de señal, medida en unidades Hounsfield. A pesar de todo, se necesita mejorar la resolución espacial del TCMD con contraste, para incrementar la sensibilidad y la precisión a la hora de poder clasificar las placas ateroscleróticas tanto de coronarias como de carótidas o aorta85,86.
CONCLUSIONES
La aterosclerosis es un proceso sistémico con manifestaciones locales. Un conocimiento íntimo de los procesos implicados en la génesis-progresión de la enfermedad y sus manifestaciones locales nos permite abordar un diagnóstico (por imagen) precoz de una manera muy detallada.
Existen diversas modalidades de imagen no invasivas establecidas para mostrar y cuantificar la aterosclerosis en determinados territorios (carótidas, aorta). Hay indicios de que existe una correlación fuerte entre la extensión de la enfermedad aterosclerótica en estos territorios y otros menos accesibles de forma no invasiva (coronarias), sugiriendo que puede ser cuantificada la carga aterosclerótica global de una forma no invasiva.
Tecnologías en desarrollo pueden ayudar en el diagnóstico por imagen no sólo anatómico, sino funcional (imagen molecular). Este campo es altamente prometedor, ya que de esta manera se podrían identificar lugares con alto riesgo de desarrollar eventos en el futuro.
AGRADECIMIENTOS
Este trabajo ha sido financiado en parte por la Fundación Conchita Rábago de Jiménez Díaz, Fundación la Caixa (Borja Ibáñez, años 2005 y 2006), y Sociedad Española de Cardiología (Antonio Pinero, 2006). Borja Ibáñez actualmente es becario electo de la sección de Cardiopatía Isquémica de la Sociedad Española de Cardiología (2007).
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. JJ. Badimon.
Mount Sinai School of Medicine.
One Gustave L. Levy Place, Box 1030. New York NY 10029. USA.
Correo electrónico: juan.badimon@mssm.edu