En este trabajo se comentan críticamente los artículos sobre arritmias y estimulación cardiaca aparecidos en 2013 seleccionados como más relevantes. Se repasan las arritmias, subdivididas en taquiarritmias supraventriculares regulares, fibrilación auricular y arritmias ventriculares, incluido su tratamiento mediante desfibrilador automático implantable. Se revisan las publicaciones referidas a estimulación cardiaca, subdivididas en terapia de resincronización, monitorización a domicilio dispositivos implantables y marcapasos. Finalmente, se trata el síncope.
Palabras clave
El volumen anual de publicaciones en esta disciplina es literalmente inabarcable, por lo que cualquier intento de síntesis resultaría incluso temerario. Por lo tanto, tómese el presente artículo a modo de pinceladas acerca de una selección de la información publicada relevante en este campo.
TAQUICARDIAS SUPRAVENTRICULARES PAROXÍSTICAS Y FLUTTER AURICULARHay dos interesantes trabajos que exprimen aún más la información obtenida del electrocardiograma de superficie: González-Torrecilla et al1 diferencian los síndromes de preexcitación con vías accesorias estrictamente perihisianas del resto de las vías anteroseptales y medioseptales, y objetivan que la onda delta negativa en V1-V2 las identifica con muy pobre sensibilidad (25%) pero muy alta especificidad (92%) y que la suma de las ondas r en las mismas derivaciones (< 0,5 mV) permite identificarlas con sensibilidad y especificidad del 85,5 y el 75,5% respectivamente.
Haghjoo et al2 añaden la presencia de una «seudo-r’» en avR para identificar la taquicardia intranodular común; en su comparación, supera en bondad estadística a los signos electrocardiográficos habitualmente utilizados (seudo-r’ en V1-V2 y seudo-S en derivaciones inferiores).
En cuanto a las herramientas electrofisiológicas para diferenciar la taquicardia intranodular común de la ortodrómica, es conocido el valor de los ciclos de retorno tras encarrilamiento con trenes ventriculares desde el ápex del ventrículo derecho (VD) y la medida de los intervalos (estímulo-auriculograma)-(ventrículo-auriculograma en taquicardia), pero hay un 15% de casos en los que no se puede tomar dichas medidas porque los trenes ventriculares interrumpen la taquicardia. Se ha descrito3 la validez de la determinación de las mismas medidas tras la introducción de extraestímulos ventriculares únicos o dobles durante la taquicardia, con la ventaja de que es aplicable a prácticamente todas las taquicardias.
Se conoce la importante asociación entre el síndrome de apnea obstructiva del sueño y la fibrilación auricular (FA). Bazan et al4 describen en su serie que el 82% de los pacientes con flutter auricular común sometidos a ablación sufrían apnea del sueño. En el seguimiento observaron el desarrollo de FA en un 38% de ellos; los factores protectores fueron la ausencia de FA previa y el uso de presión positiva continua en las vías respiratorias en los pacientes sin antecedentes de FA, hallazgos realmente interesantes, que hacen que nos planteemos la búsqueda de apnea del sueño en pacientes con flutter, ya que ese diagnóstico precoz y el inicio de la presión positiva continua en las vías respiratorias pueden disminuir el alto riesgo de caída en FA que presenta este grupo.
García-Seara et al5, tras 1 año de seguimiento de ablación de flutter común, han observado mejora de la fracción de eyección del ventrículo izquierdo y la función diastólica y reducción de la presión pulmonar, con lo que comprueban el remodelado inverso funcional y estructural tras el retorno a ritmo sinusal.
Se han publicado varios artículos contradictorios acerca del uso de la adenosina para desenmascarar la conducción silente tras la ablación del istmo cavotricuspídeo, como ocurre en las venas pulmonares. Finalmente, en un estudio prospectivo6 de 81 pacientes, con un seguimiento de 12 ± 8 meses, se objetivó que el grupo con reconexión transitoria con adenosina tenía mayor riesgo de recurrencia (riesgo relativo = 31,7), por lo que no se puede dar por finalizado el procedimiento si dicha reconexión se produce.
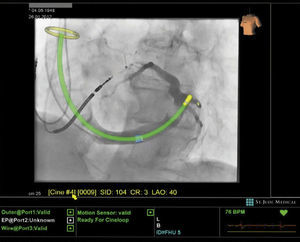
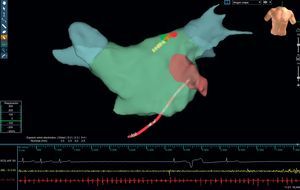
Con la idea de reducir el tiempo y la dosis de fluoroscopia sin aumentar el tiempo total del procedimiento de ablación, como se ha demostrado recientemente en taquicardia paroxística supraventricular y flutter, se ha lanzado una plataforma tecnológica (Mediguide Technology MG, St. Jude Medical Inc.) (figura 1). Consiste en crear un campo electromagnético tridimensional para localizar sensores en dispositivos médicos (vainas, catéteres, guías, etc.) que consiga la visualización de las puntas de los catéteres con movimientos en tiempo real sobre las imágenes fluoroscópicas pregrabadas.
FIBRILACIÓN AURICULAREmbolias cerebrales silentes: también sin ablaciónEn los últimos años ha surgido gran preocupación tras observarse, mediante técnicas sofisticadas de resonancia magnética cerebral, pequeñas embolias clínicamente silentes tras procedimientos de ablación. Vázquez et al7, al estudiar la resonancia magnética cerebral antes y después de la cardioversión eléctrica, encuentran que no se producen lesiones nuevas tras la cardioversión, pero que el 56% de los pacientes tenía ya lesiones isquémicas cerebrales clínicamente silentes, que habían ocurrido de manera espontánea. Igualmente, se ha observado que, en pacientes diabéticos, la FA asintomática es frecuente y se asocia con infarto cerebral silente espontáneo en el 61% de los casos8.
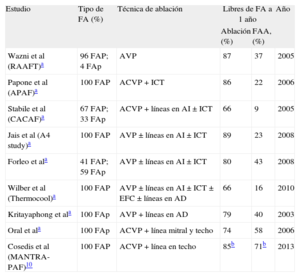
Múltiples publicaciones que comparan ablación y fármacos antiarrítmicosDesde hace 10 años se suceden las publicaciones que comparan tratamientos con ablación y con fármacos antiarrítmicos. En la tabla 1 se resumen estas publicaciones previas según un artículo de revisión reciente9, y se añade una nueva publicación10 de 2013 cuya novedad es que los pacientes incluidos no habían recibido previamente fármacos antiarrítmicos y que la eficacia se mide por carga arrítmica. Aunque la conclusión principal es que no hay diferencias en la carga arrítmica, la ablación muestra mejores resultados a los 24 meses y también cuando se considera la proporción de pacientes libres de recurrencias; además, el 36% de los pacientes asignados a fármacos precisaron ablación. La tabla 1 muestra que la principal diferencia con los estudios previos no es la eficacia de la ablación, sino la mayor eficacia de los fármacos, probablemente porque se trata de pacientes que no los han recibido previamente. También se ha comparado por primera vez la ablación con una estrategia de control de frecuencia en pacientes con FA persistente e insuficiencia cardiaca (IC) con el objetivo primario del consumo pico de oxígeno; sin embargo, la ablación resultó superior11.
Estudios controlados que comparan ablación por catéter y fármacos antiarrítmicos
| Estudio | Tipo de FA (%) | Técnica de ablación | Libres de FA a 1 año | Año | |
| Ablación (%) | FAA, (%) | ||||
| Wazni et al (RAAFT)a | 96 FAP; 4 FAp | AVP | 87 | 37 | 2005 |
| Papone et al (APAF)a | 100 FAP | ACVP + ICT | 86 | 22 | 2006 |
| Stabile et al (CACAF)a | 67 FAP; 33 FAp | ACVP + líneas en AI ± ICT | 66 | 9 | 2005 |
| Jais et al (A4 study)a | 100 FAP | AVP ± líneas en AI ± ICT | 89 | 23 | 2008 |
| Forleo et ala | 41 FAP; 59 FAp | AVP ± líneas en AI ± ICT | 80 | 43 | 2008 |
| Wilber et al (Thermocool)a | 100 FAP | AVP ± líneas en AI ± ICT ± EFC ± líneas en AD | 66 | 16 | 2010 |
| Kritayaphong et ala | 100 FAp | AVP + líneas en AD | 79 | 40 | 2003 |
| Oral et ala | 100 FAp | ACVP + línea mitral y techo | 74 | 58 | 2006 |
| Cosedis et al (MANTRA-PAF)10 | 100 FAP | ACVP + línea en techo | 85b | 71b | 2013 |
ACVP: ablación circunferencial de venas pulmonares; AD: aurícula derecha; AI: aurícula izquierda; AVP: aislamiento de venas pulmonares; EFC: electrogramas fraccionados complejos; FA: fibrilación auricular; FAA: fármacos antiarrítmicos; FAP: fibrilación auricular paroxística; FAp: fibrilación auricular persistente; ICT: istmo cavotricuspídeo.
Numerosos ensayos clínicos aleatorizados han demostrado que la estrategia de control de frecuencia no conduce a mayor mortalidad que la de control de ritmo. Sin embargo, se sospecha que se debe a la escasa eficacia de las terapias para control de ritmo, ya que, cuando se considera el subgrupo de pacientes que mantienen el ritmo sinusal, la supervivencia es mejor. Dos nuevos estudios parecen confirmar la superioridad del ritmo sinusal. En pacientes con IC, la estrategia de control de ritmo no es superior a la de control de frecuencia, pero los pacientes con mayor proporción de tiempo en ritmo sinusal presentan mejoría de la clase funcional12. En un estudio poblacional en más de 26.000 pacientes con un seguimiento de 8 años, se ha observado por primera vez que la estrategia de control de ritmo es superior, pero empieza a mostrar mejor supervivencia a partir del cuarto año de seguimiento13.
ARRITMIAS VENTRICULARESAlgunas arritmias ventriculares pueden tener consecuencias fatales para el paciente, por lo que es importante precisar el diagnóstico, optimizar el tratamiento y asegurar su pronóstico. Así, Della Bella et al14 describen la creación de una unidad multidisciplinaria de referencia para pacientes con taquicardia ventricular, donde la ablación tiene un papel importante. Además de presentar una serie de pacientes amplia (n = 528), realizan procedimientos muy completos y con muy buenos resultados agudos (> 77% de arritmia clínica no inducible al final del procedimiento) otorgando un papel pronóstico importante al estudio electrofisiológico tras la ablación. Los pacientes que seguían teniendo arritmias inducibles tras la ablación tuvieron peor evolución en el seguimiento, tanto por recurrencia de la arritmia como por muerte.
Para mejorar la precisión del diagnóstico clínico, Hoffmayer et al15 proponen una puntuación para la siempre difícil diferenciación entre paciente con arritmia ventricular del tracto de salida idiopática y paciente con displasia arritmogénica del VD. En ella se valora la inversión de la onda T de V1-V3 en ritmo sinusal (3 puntos) y durante la arritmia ventricular, que la duración del QRS en V1 sea > 120 ms (2 puntos), que el QRS tenga melladuras en varias derivaciones (2 puntos) y que la transición en precordiales sea en V5 o V6 (1 punto). Una puntuación ≥ 5 pudo identificar a los pacientes con displasia arritmogénica de VD en un 93% de las ocasiones.
Las técnicas de imagen, utilizadas como ayuda en la mejor caracterización de las cicatrices ventriculares, han sido nuevamente motivo de diversas publicaciones. Fernández-Armenta et al16 utilizaron la resonancia magnética tridimensional de alta resolución en pacientes postinfartados, y observaron un área de cicatriz mayor en el epicardio que en el endocardio, a pesar de lo cual pudieron detectar más canales en el borde de la cicatriz endocárdica que en la epicárdica. Además, estos canales observados de forma no invasiva tuvieron una muy buena correlación con los obtenidos tras el mapeo electroanatómico.
Muchos pacientes postinfartados y con arritmias ventriculares son portadores de desfibrilador automático implantable (DAI), lo que limitaría la realización de resonancia magnética, Por ello, Komatsu et al17 utilizan la tomografía computarizada multidetectores y correlacionan las áreas de miocardio adelgazadas con < 5 mm con las áreas de bajo voltaje y potenciales retrasados obtenidas con el mapeo electroanatómico. A pesar de obtener una buena correlación, el área de adelgazamiento < 5 mm era ligeramente inferior al área con bajos voltajes. Por el contrario, todos los potenciales retrasados se encontraron en el área adelgazada y los más tardíos (> 100 ms post-QRS), en áreas todavía más adelgazadas (< 3 mm). Todos estos hallazgos pueden suponer una ayuda para delimitar con antelación el área de interés en pacientes que van a someterse a ablación de taquicardia ventricular.
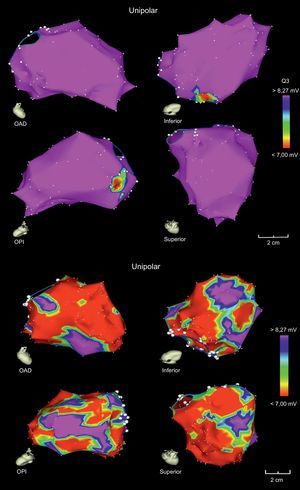
La posibilidad de revertir las miocardiopatías dilatadas tras realizar la ablación de extrasístoles ventriculares vuelve a ser motivo de publicación de diversos artículos. Campos et al18 utilizan el mapa de voltaje unipolar para identificar a los pacientes que tienen una miocardiopatía reversible tras la ablación de sus extrasístoles cuando el área de potenciales unipolares anormales (< 8,27 mV) es < 32% de la superficie total del ventrículo izquierdo (figura 2).
Mapa electroanatómico de ventrículo izquierdo de 2 pacientes con miocardiopatía dilatada no isquémica, cuyos mapas de voltaje unipolar marcan la mayor probabilidad de reversibilidad (arriba) o irreversibilidad (abajo) de la miocardiopatía tras la ablación de los extrasístoles ventriculares. OAD: oblicua anterior derecha; OPI: oblicua posterior izquierda. Adaptada con permiso de Campos et al18. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El último registro nacional de DAI19 recoge un total de 4.481 implantes, cifra que representa más del 80% del total de procedimientos estimado en nuestro país en 2011. Se aprecia por primera vez una ligera disminución en la tasa de implantes respecto a años previos, similar a lo observado en otros países de nuestro entorno. Con una tasa de 97 implantes por millón de habitantes, seguimos estando por debajo de la media europea. A pesar de ello, siguen aumentando las indicaciones de DAI en prevención primaria, que alcanzan la mitad del total de implantes, manteniéndose la expansión de la terapia de resincronización cardiaca (TRC).
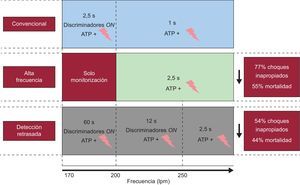
Programación de los desfibriladores automáticos implantablesEn 2013 se ha reforzado la evidencia de que una óptima programación de los DAI repercute favorablemente en la calidad de vida y la supervivencia de los pacientes. El MADIT–RIT20 es un estudio multicéntrico y aleatorizado que incluyó a 1.500 pacientes con indicación de DAI como prevención primaria y comparó el esquema de terapia antitaquicárdica convencional con el de una zona única de alta frecuencia (≥ 200 lpm) o con una programación de un tiempo de monitorización prolongado antes de la terapia. Este ensayo demuestra que la programación de terapias para taquiarritmias rápidas exclusivamente o la prolongación de los tiempos de detección antes de iniciar el tratamiento reduce significativamente las terapias inapropiadas, con lo que finalmente se mejora la supervivencia (figura 3).
Esquemas de programación de terapia antitaquicárdica utilizados en el estudio Multicenter Automatic Defibrillator Implantation Trial-Reduce Inappropriate Therapy20. A la derecha se muestran los principales beneficios obtenidos con cada uno de los esquemas de programación comparados con el convencional. ATP + símbolo: estimulación antitaquicárdica + choques.
El ADVANCE III21 es un ensayo multicéntrico aleatorizado, a simple ciego, con 1.902 pacientes portadores de DAI como prevención primaria o secundaria. Comparó la programación convencional (tiempo de detección, 18 de 24 intervalos) con la detección prolongada (30 de 40 intervalos) siguiendo a los pacientes durante 12 meses. Finalmente, en el grupo de pacientes con detección prolongada se obtuvo una reducción significativa en el número de terapias antitaquicárdicas y choques apropiados e inapropiados.
Desfibrilador automático implantable totalmente subcutáneoEl DAI totalmente subcutáneo consta de un generador con capacidad para liberar 80 J y un electrodo implantado subcutáneamente paralelo al borde esternal izquierdo. Este sistema permite simplificar la intervención que se realiza sin necesidad de fluoroscopia y, por otro lado, evita los riesgos derivados de implantar electrodos intracardiacos. Weiss et al22 han evaluado la eficacia y la seguridad de este dispositivo en un estudio multicéntrico prospectivo y no aleatorizado con más de 300 pacientes con indicación de DAI (seguimiento, 11 meses). La probabilidad de estar libre de eventos a los 6 meses de la intervención era del 99%, con una eficacia en el tratamiento de la fibrilación ventricular inducida del 90% y de la documentada espontáneamente, del 100%. La tasa de choques inapropiados fue del 13,1%, problema que podía reducirse en gran parte reprogramando el dispositivo.
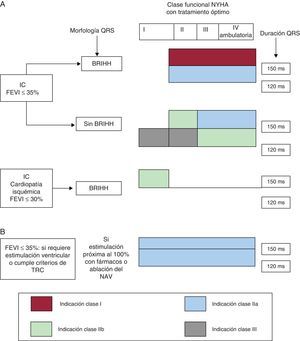
NOVEDADES EN TERAPIA DE RESINCRONIZACIÓN CARDIACADurante el año 2012, el Grupo de Trabajo de Diagnóstico y Tratamiento de la Insuficiencia Cardiaca Aguda y Crónica de la ESC/EHRA (European Society of Cardiology/European Heart Rhythm Association) y la ACCF/AHA/HRS (American College of Cardiology Foundation/American Heart Association/Heart Rhythm Society) publicaron nuevas guías con recomendaciones sobre la TRC23,24. En enero de 2013, se presentó la actualización de las guías de la ACCF/AHA/HRS que incorpora novedades en TRC25, y en agosto de 2013, el grupo de trabajo de estimulación cardiaca y TRC de la ESC/EHRA publicó la actualización de las guías de estimulación cardiaca y TRC26. Algunas modificaciones en las recomendaciones son comunes a ambas guías, pero también se observan algunas diferencias (tabla 2 y figuras 4 y 5). La guía de la ESC/EHRA de 2013 incluye por primera vez recomendaciones sobre la selección entre solo TRC y TRC con DAI. En el paciente candidato a TRC se consideran datos clínicos en favor de implantar solo TRC (IC avanzada, insuficiencia renal grave o diálisis, comorbilidades, fragilidad o caquexia) frente a datos clínicos a favor de TRC con DAI (IC estable en clase funcional de la New York Heart AssociationII, esperanza de vida > 1 año, cardiopatía isquémica con una puntuación de riesgo MADIT baja o intermedia y ausencia de comorbilidades). En el paciente candidato a implante de un DAI, se deberá implantar TRC con DAI siempre que esté indicado26.
Modificaciones más relevantes en las indicaciones de terapia de resincronización cardiaca en la actualización de la guías de la American College of Cardiology Foundation/American Heart Association/Heart Rhythm Society de 2013 y de la European Society of Cardiology/European Heart Rhythm Association 2013
| ACCF/AHA/HRS 2013 | ESC/EHRA 2013 |
| 1. Limitación de la indicación de clase I para los pacientes con morfología del QRS de bloqueo de rama izquierda | |
| 2. Expansión de la indicación de clase I para los pacientes en clase funcional II de la NYHA, en ritmo sinusal, con bloqueo de rama izquierda y FEVI ≤ 35% | |
| 1. Se limita la recomendación de clase I a los pacientes con una duración del QRS ≥ 150 ms | 1. Se incluye como recomendación de clase I a los pacientes con duración del QRS de 120-150 ms, en ritmo sinusal, con morfología del QRS de bloqueo de rama izquierda, FEVI ≤ 35% y en clase funcional II-IV de la NYHA con tratamiento médico óptimo |
| 2. Se incluye como recomendación de clase IIb a los pacientes en clase funcional I de la NYHA, con cardiopatía isquémica, en ritmo sinusal, con bloqueo de rama izquierda y duración del QRS ≥ 150 ms | |
ACCF/AHA/HRS: American College of Cardiology Foundation/American Heart Association/Heart Rhythm Society; ESC/EHRA: European Society of Cardiology/European Heart Rhythm Association; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association.
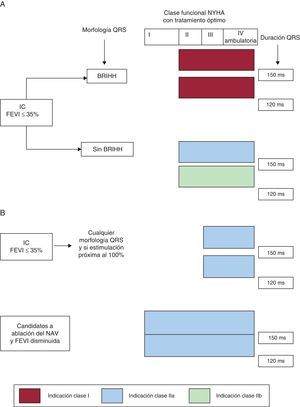
Esquema que muestra las indicaciones de terapia de resincronización cardiaca en pacientes en ritmo sinusal (A) y en fibrilación auricular (B), según la actualización de la guía de la European Society of Cardiology/European Heart Rhythm Association de 2013. BRIHH: bloqueo de rama izquierda del haz de His; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NAV: nódulo auriculoventricular; NYHA: New York Heart Association.
Esquema que muestra las indicaciones de terapia de resincronización cardiaca en pacientes en ritmo sinusal (A) y en fibrilación auricular (B), según la actualización de la guía del American College of Cardiology Foundation/American Heart Association/Heart Rhythm Society de 2013. BRIHH: bloqueo de rama izquierda del haz de His; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NAV: nódulo auriculoventricular; NYHA: New York Heart Association; TRC: terapia de resincronización cardiaca.
La optimización de la respuesta a la TRC trata de disminuir la tasa de pacientes no respondendores27. La programación recomendada incluye la estimulación simultánea de ambos ventrículos, con un intervalo auriculoventricular programado de 100-120 ms. Además, se recomienda el implante del electrodo de estimulación del ventrículo izquierdo en la vena lateral o posterolateral para mejorar la respuesta a la TRC. Durante el seguimiento, se recomienda mantener un porcentaje de estimulación biventricular tan próximo al 100% como sea posible (al menos > 93%), programar el intervalo auriculoventricular óptimo para lograr la mayor contribución de la contracción de la aurícula izquierda al llenado ventricular izquierdo y programar un intervalo interventricular óptimo para disminuir la asincronía ventricular izquierda residual (incluso con estimulación aislada del ventrículo izquierdo)27,28. La ergometría convencional permite evaluar la pérdida de estimulación biventricular durante el ejercicio y tomar decisiones sobre el tratamiento farmacológico, la programación del dispositivo o la necesidad de ablación del nódulo auriculoventricular en los pacientes con TRC29. Ha aumentado el interés por conocer la influencia de las alteraciones estructurales del VD en la predicción de la respuesta a la TRC, así como la influencia del remodelado de dicha cavidad en la evolución clínica y la incidencia de arritmias ventriculares en los pacientes tratados con TRC30,31.
Durante el último año se han presentado avances tecnológicos interesantes, entre los que destaca la utilización de electrodos cuadripolares con diferentes sistemas de fijación y diferentes distancias entre electrodos para la estimulación del ventrículo izquierdo, con el consiguiente desarrollo de software que permite la estimulación multipunto en el ventrículo izquierdo32. Asimismo es de destacar la implantación de los primeros dispositivos de estimulación endocárdica del ventrículo izquierdo sin cables33 y dispositivos de TRC con estimulación endocárdica del ventrículo a través del septo interventricular34, lo que permitirá superar las limitaciones de la anatomía venosa coronaria.
ACTUALIDAD Y PERSPECTIVAS DEL MONITORIZACIÓN A DOMICILIO EN ESTIMULACIÓN CARDIACAEn los últimos años, la monitorización a domicilio (MD) se ha ido abriendo paso como un método eficiente y bien aceptado por los pacientes portadores de sistemas de estimulación cardiaca y que aporta una información superponible a la revisión presencial. En los últimos meses estamos viviendo la consolidación de varios aspectos, por lo que deberíamos considerarla el sistema de seguimiento de elección, incluso por encima de la revisión presencial. A continuación se reflexiona brevemente sobre algunos de ellos.
SeguridadEl registro ALTITUDE, con un amplio número de pacientes portadores de DAI, con o sin TRC, mostró una clara disminución de mortalidad en el seguimiento a largo plazo35. La realización de estudios prospectivos aleatorizados confirma la seguridad de la MD36,37, pues disminuye el número de choques procedentes e improcedentes y, en consecuencia, incide positivamente en la duración de las baterías y la mortalidad. Otros estudios han demostrado la capacidad de la MD de detectar precozmente IC o episodios de FA, incluso asintomáticos, con lo que facilita el tratamiento temprano y disminuye la morbimortalidad38–40. Ante esto, las últimas guías europeas de estimulación cardiaca consideran la MD con indicación II y nivel de evidencia A26.
Posteriormente estas reflexiones se han reforzado confirmando la importancia de la precocidad de la información sobre potenciales complicaciones clínicas y de funcionamiento de los dispositivos41, en lo que se considera a la MD superior a la revisión presencial42.
Organización de consultasTras varios años de experiencia los centros con alto volumen de pacientes en MD se han organizado utilizando dos conceptos claros: no todos los pacientes portadores de marcapasos, DAI o DAI con TRC necesitan la misma densidad de revisiones a distancia o presenciales43,44 y se considera muy conveniente diseñar un cribado por enfermería, que previamente deberá alcanzar una cualificación específica43–45; en este último aspecto, se está trabajando activamente en el grupo de trabajo de MD de la Sociedad Española de Cardiología. La confección de unidades de corrección extrahospitalarias centralizadas puede ser de gran utilidad para hospitales con consultas de MD poco numerosas46. Por último, para optimizar el manejo de la información de la MD, es necesario implementar herramientas informáticas que faciliten el volcado de la información a la historia electrónica y evaluar resultados mediante bases de datos de ámbito multicéntrico, ya iniciadas en España.
Análisis económicoSe adolece de criterios estructurados de facturación de la MD. El diseño y el porcentaje de sanidad pública hacen que este problema sea de menor cuantía en nuestro país, si bien es imprescindible corregir la situación actual en beneficio de su implantación generalizada. Se está desarrollando algún estudio prospectivo con el ánimo de paliar esta carencia47.
Aspectos legalesContamos con escasa información al respecto48; desde la Sociedad Europea de Cardiología se ha propuesto la necesidad de contar con una normativa general y específica de cada país49. El grupo de trabajo de MD de la Sociedad Española de Cardiología está elaborando un manual, que abordará estos aspectos y con el que contaremos en pocos meses, patrocinado por el Ministerio de Sanidad, Política Social e Igualdad.
A la vista de estos datos, parece lógico preguntarse si hoy día se justifica implantar dispositivos de estimulación cardiaca sin capacidad para realizar MD.
MARCAPASOSDurante el último año se han publicado 1.003 artículos con el término cardiac pacing como palabra clave, de los cuales resumimos los de mayor interés.
Estimulación en sitios alternativosSe ha publicado un ensayo clínico aleatorizado con el objetivo de comparar la estimulación en ápex del VD con respecto al septo medio, en términos de fracciones de eyección del ventrículo izquierdo y del VD medidas por ventriculografía isotópica al año y a los 4 años de seguimiento50. La estimulación en septo (según criterio radiológico) no confirió ventajas en cuanto a la función ventricular y, además, la ubicación anterior inadvertida del electrodo (confirmada mediante ecocardiografía en el 46% de los pacientes con teórica posición septal) supuso una reducción en la fracción de eyección del ventrículo izquierdo a lo largo del seguimiento, lo que no ocurrió en el grupo con electrodo posicionado en septo medio. Un subestudio del DANPACE51, que comparó los modos AAIR y DDDR en 1.415 pacientes con enfermedad del nódulo sinusal, demostró que la hospitalización por IC no se asociaba a modo de estimulación, porcentaje de estimulación o localización del electrodo (apical o no apical, según criterios radiológicos).
DISPOSITIVOS DE ESTIMULACIÓN Y DETECCIÓN DE ARRITMIAS AURICULARESUn análisis del ASSERT52 compara el valor predictivo positivo de los episodios catalogados como frecuencia auricular rápida, tras la revisión de los electrogramas almacenados, para varios puntos de corte de frecuencia auricular y duración de los episodios. Los autores concluyen que, para la interpretación de episodios de menor duración, es crucial revisar los electrogramas. En línea con los resultados del ASSERT, un estudio prospectivo en 560 pacientes con IC portadores de TRC demostró que, en este grupo de pacientes de alto riesgo, la presencia de arritmias auriculares detectadas por el dispositivo y revisadas mediante MD se asocia a un incremento del riesgo de eventos tromboembólicos53. Un subestudio del TRENDS54, realizado en pacientes portadores de dispositivos con CHADS2 (por las siglas en inglés de insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus [doble]) ≥ 1 y sin FA clínica previa, destaca la elevada incidencia de taquicardia auricular o FA detectada en monitorización continua en este grupo de pacientes (30%), que era de mayor duración en los pacientes con múltiples factores de riesgo. Un subestudio del ASSERT55 evaluó la utilidad del algoritmo de sobrestimulación auricular en la prevención de FA > 6 min. No hubo diferencias entre los que tenían activado el algoritmo y los que no en cuanto a la incidencia de FA y eventos tromboembólicos.
MANEJO DE TERAPIA ANTITROMBÓTICA EN EL IMPLANTE DE DISPOSITIVOSEl tema continúa siendo controvertido. Dos metanálisis publicados en 2013 señalan el beneficio de mantener los anticoagulantes orales frente a la heparina en cuanto a menor incidencia de hemorragia, sin diferencias en la tasa de eventos tromboembólicos56,57. La publicación del estudio BRUISE-CONTROL58, ensayo clínico aleatorizado en pacientes de riesgo embólico moderado-alto sometidos a implante de dispositivo, confirma los datos disponibles hasta el momento demostrando una menor incidencia de hematoma clínicamente significativo en los pacientes con mantenimiento de los anticoagulantes orales con respecto a los tratados con heparina (el 3,5 frente al 16,0%; riesgo relativo = 0,19; p < 0,001). Este estudio probablemente implique un cambio en el manejo de la terapia anticoagulante en el implante de dispositivos.
SÍNCOPEEn el último año se han presentado trabajos significativos relacionados con el síncope.
En el diagnóstico del síncope, se considera de referencia el registrador de eventos implantable. Un estudio español refuerza este concepto. El Spanish RevealTMRegistry de Lacunza-Ruiz et al59 es un registro prospectivo multicéntrico en el que participaron 40 centros con el mayor número de pacientes incluido hasta la fecha (743; el 91% de ellos, por síncope). Los resultados fueron similares a los de estudios previos, con un rendimiento diagnóstico en 1 de 3 pacientes con un seguimiento ≥ 1 año. No hubo diferencias en el rendimiento diagnóstico para grupos preespecificados (bloqueo de rama y enfermedad estructural) al compararlos con el grupo sin cardiopatía, pero sí se observó que este rendimiento aumentaba si el síncope era recurrente en comparación con el subgrupo de síncope aislado o palpitaciones.
El tratamiento del síncope vasovagal es un reto. Este año se han presentado dos trabajos significativos en este campo. Tras el entusiasmo inicial, en los últimos años se había abandonado los bloqueadores beta como tratamiento, pero un estudio de Sheldon et al60 les devuelve cierto protagonismo. Se analizó en dos estudios previos (uno observacional y otro aleatorizado, el estudio Prevention of Syncope Trial) el papel de la edad en la efectividad del metoprolol en un total de 361 pacientes. Sorprendentemente, se observó que los bloqueadores beta aumentaban en un 58% el riesgo de recurrencia en pacientes < 42 años, pero lo disminuían en un 48% por encima de esa edad. Aunque se precisa de un estudio aleatorizado en pacientes > 40 años para certificar la validez de estos resultados, de momento respaldan su uso en una población de edad más avanzada.
Para el síncope vasovagal refractario, las alternativas son escasas; el marcapasos sigue manteniendo una indicación IIb en la última guía europea publicada26, y por ello son bienvenidas nuevas alternativas terapéuticas. La modulación autonómica está ganando peso en cardiología; así, la denervación renal en la hipertensión o la estimulación vagal en la IC. En este contexto, Yao et al61 han publicado que la denervación con radiofrecuencia parcial y limitada a la aurícula izquierda sirvió para tratar con excelentes resultados a largo plazo (30 meses de media) a un grupo de 10 pacientes muy sintomáticos (mediana, 3,5 síncopes en el año previo) y mesa basculante positiva (no necesariamente con respuesta cardioinhibitoria). Para ello se localizaron los plexos ganglionares endocárdicos mediante estimulación de alta frecuencia y se observaron las respuestas vagales (figura 6). El objetivo principal fue la abolición de estas respuestas tras la radiofrecuencia. En 10 pacientes se ablacionó el ganglión superior izquierdo; en otros 5, el superior derecho y en otros 3, el inferior izquierdo (en 6 pacientes, dos gangliones, y solo en 1 los tres). No hubo complicaciones agudas o derivadas de la denervación (como taquicadia sinusal, parexia gástrica, etc.) ni recurrencia de síncope en el seguimiento, aunque sí se produjeron presíncopes. Conceptualmente es un trabajo muy interesante y, dada la experiencia en la ablación de la FA, muchos centros podrían incorporarlo en su arsenal terapéutico para casos refractarios; sin embargo, sigue siendo un tratamiento agresivo no exento de potenciales complicaciones y que requiere un estudio más amplio para conocer su verdadera efectividad.
Reconstrucción anatómica de la aurícula izquierda con sistema de navegación Ensite-NavX®. Durante la aplicación de radiofrecuencia a la zona del ganglión superior izquierdo (lesiones marcadas en rojo) en un paciente con fibrilación auricular persistente, se puede observar una respuesta vagal con pausa nodular significativa. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El estudio danés de Ruwald et al62 ha puesto en duda el buen pronóstico del síncope en pacientes aparentemente sanos. Se estudió a 37.017 pacientes con un primer evento sincopal entre 2001 y 2009 registrado en una base de datos nacional (mediana de edad, 47 años). De ellos, se eligió al 40% por ausencia de cardiopatía y comorbilidades y se lo siguió durante una media de 4,5 años comparándolos con una muestra equiparable > 185.085 sujetos. La mortalidad total a 1 año fue baja e idéntica en ambos grupos (≈ 2%), pero en el subgrupo de edad intermedia, definido como 25–74 años, hubo una mortalidad total superior entre los pacientes con síncope (hazard ratio = 1,3-2,0). A largo plazo, la mortalidad total fue mayor en todos los grupos de edad, salvo el de pacientes > 75 años. Estos sorprendentes resultados implicaron un aumento de las hospitalizaciones por motivos cardiacos, síncope recurrente y accidentes cardiovasculares y un mayor implante de dispositivos (marcapasos y desfibriladores). Aunque el trabajo tiene limitaciones (la definición de comorbilidades puede ser difusa, la ausencia del electrocardiograma del episodio índice y datos escasos sobre el tipo de muerte), plantea un interrogante sobre el pronóstico del síncope en una población aparentemente sana, al menos en el subgrupo de edad intermedia, que nuevos estudios epidemiológicos tendrán que validar.
CONFLICTO DE INTERESESNinguno.