La superoxigenación tras la reperfusión coronaria genera daños por reperfusión, en parte por la infiltración macrofágica que contribuye a la activación de metaloproteinasas de la matriz extracelular (MMP), efectores principales de la necrosis ventricular1; el EMMPRIN (Extracellular-Matrix-Metalloproteinase-INducer) es un factor indispensable para su activación2. En un modelo murino de isquemia/reperfusión (IR) coronaria, se ha descrito la relevancia del EMMPRIN como diana contra el infarto agudo de miocardio1 y, más recientemente, el uso de nanopartículas conjugadas afines al EMMPRIN (figura 1), que revelan su potencial como herramienta terapéutica para prevenir la necrosis3. Antes de su estudio clínico, se pretende evaluar su efectividad en un modelo porcino de IR coronaria.
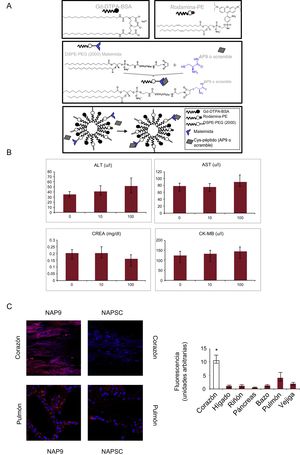
A: estructura de las NAP9 o el péptido de control scramble (NAPSC). B: producción de ALT, AST, creatinina y CK-MB, tras administrar NAP9 10 mg/kg (n = 5). C: a la izquierda se muestra la detección de NAP9 y NAPSC por microscopia confocal en secciones de corazón y pulmón tras 7 días de isquemia/reperfusión coronaria e inyección de NAP9 o NAPSC 10 mg/kg; a la derecha, la distribución de NAP9 tras 7 días de isquemia/reperfusión coronaria e inyección de NAP9 10 mg/kg en los tejidos que se indican (n = 10). Los gráficos muestran media ± desviación estándar. ALT: alanina transaminasa; AST: aspartato transaminasa; CK-MB: isoenzima MB de la creatincinasa; CREA: creatincinasa; NAP9: nanopartículas que contienen AP9; NAPSC: péptido de control scramble.
*p < 0,05, corazón frente a pulmón.
Se realizó un estudio con 15 hembras Yorkshire albinas, 5 sin infartar, y las restantes anestesiadas mediante la administración intravenosa de propofol (2 ml/kg/h)/fentanilo (50 mg/kg/h) y sometidas a 45 min de oclusión de la arteria descendente anterior media mediante inflado de balón, tras lo que se inyectaron 10 mg/kg de la nanosonda NAP9, o NAPSC (figura 1A), que contiene el péptido AP9 (NAP9) de unión específica al EMMPRIN3, o un péptido scramble (NAPSC), utilizado como control. Se evaluó mediante ecocardiografía la función miocárdica antes y 7 días tras el infarto, y en el tejido, la presencia de las nanopartículas (microscopia confocal), la integridad del miocardio (tinción histológica con hematoxilina-eosina), la extensión del área necrosada (tinción con trifenil tetrazolio), y la expresión de EMMPRIN, MMP-9 y MMP-13, como marcadores de necrosis.
Se estudió la citotoxicidad inyectando NAP9 a 0, 10 y 50 mg/kg, midiendo las concentraciones séricas de aspartato transaminasa y alanina transaminasa como marcadores de daño hepático, creatinina como marcador renal e isoenzima MB de la creatincinasa como marcador de necrosis cardiaca; la ausencia total de citotoxicidad se produjo a la dosis de 10 mg/kg (figura 1B). La biodistribución se analizó mediante microscopia confocal en secciones de corazón, hígado, riñón, páncreas, bazo, pulmón, vejiga e intestino, tras 7 días de IR; el corazón y el pulmón resultaron ser los tejidos de mayor captación de NAP9 (figura 1C).
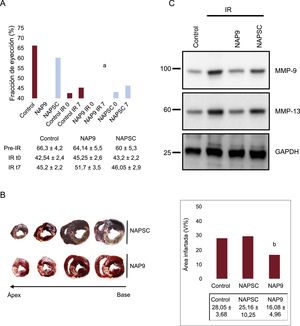
Se estudió el efecto de la NAP9 en la progresión del infarto agudo de miocardio inyectando NAP9 o NAPSC 10 mg/kg tras 15 min de reperfusión de la descendente anterior; se observó que la fracción de eyección del ventrículo izquierdo (estimada en modo B de Simpson biplano y en modo M [Teichholz], con similares resultados) de los cerdos inyectados con NAP9 resultó significativamente superior que la de los animales control (NAP9 IR7 frente a control IR7, el 51,7 ± 3,5 frente al 45,2 ± 2,2%; p < 0,05) (figura 2A), mientras que la extensión del área necrosada —expresada como porcentaje de la superficie total del ventrículo izquierdo (control frente a NAP9, el 28,05 ± 3,68 frente al 16,08 ± 4,96%; p < 0,0003) (figura 2B)— y la expresión de MMP-9 y MMP-13 —que indican necrosis por degradación de la matriz extracelular (figura 2C)— se redujeron en los cerdos tratados con NAP9.
A: en el panel superior se muestra la fracción de eyección del ventrículo izquierdo (media ± desviación estándar) de los cerdos sin infartar o infartados e inyectados o no con NAP9 o NAPSC 10 mg/kg (n = 15); en el panel inferior se muestra la tabla de valores de la fracción de eyección previa al procedimiento, tras la IR (IR0) y tras 7 días de IR (IR7). B: en el panel izquierdo se muestran las secciones seriadas de 0,5 cm de los corazones de cerdos inyectados con nanosondas NAP9 o NAPSC; en el panel derecho se muestra la tabla de valores (media ± desviación estándar) del área infartada expresada como porcentaje respecto a la superficie ventricular total (n = 15). C: detección de las metaloproteinasas MMP-9 y MMP-13 en los corazones de cerdos inyectados con NAP9 o NAPSC tras 7 días de isquemia/reperfusión. Se utilizó GAPDH como control (n = 15). GAPDH: gliceraldehído 3-fosfatodeshidrogenasa; IR: isquemia/reperfusión; MMP: metaloproteinasas; NAP9: péptido AP9; NAPSC: péptido scramble; VI: ventrículo izquierdo.
*: a NAP9 IR7 frente a control IR7, p < 0,05.
**: b NAP9 frente a control, p < 0,0003.
La nanotecnología aplicada al tratamiento y la prevención de los daños por reperfusión es una disciplina con resultados prometedores para la clínica4,5. En conclusión, en los cerdos que recibieron IR coronaria con NAP9 se redujo significativamente la extensión del infarto, con lo que al menos mejoró la funcionalidad ventricular a través de la reducción de la necrosis que la degradación de la matriz extracelular conlleva. Antes de su evaluación clínica, y teniendo en cuenta la limitación del uso de la ecocardiografía frente a la resonancia magnética para la estimación funcional de la contractilidad, se considera necesario incrementar el tamaño muestral del estudio y, en función de la visibilidad de la NAP9 mediante resonancia magnética, completar los resultados obtenidos de manera no invasiva por resonancia magnética, con lo cual se evaluaría el futuro de la imagen molecular del EMMPRIN como herramienta contra el infarto agudo de miocardio.
FINANCIACIÓNBeca de la Sociedad Española de Cardiología 2016.