Actualmente hay pocos estudios sobre el marcapasos sin cable (Micra) en la práctica clínica, especialmente con seguimientos>6 meses. El objetivo es evaluar los parámetros eléctricos al implante y en el seguimiento, así como la seguridad de esta nueva técnica.
MétodosEstudio prospectivo y observacional en el que se incluyó a 30 pacientes consecutivos de edad ≥ 65 años con indicación de implante de marcapasos unicameral.
ResultadosSe implantó exitosamente el Micra en los 30 pacientes incluidos. La media de edad era 79,4±6,4 (66-89) años; 20 (66,6%) eran varones; 28 (93,3%) presentaban fibrilación auricular permanente; 1, taquicardia auricular y 1, ritmo sinusal. En 5 pacientes (16,6%) se realizó ablación del nódulo auriculoventricular en el mismo procedimiento (4 pacientes en fibrilación auricular rápida y 1 con taquicardia auricular); en 2 pacientes la indicación fue tras el implante percutáneo de válvula aórtica. En 23 (76,6%) el implante se realizó estando en tratamiento anticoagulante oral (INR máximo, 2,4). No hubo complicaciones mayores, salvo un derrame pericárdico moderado sin repercusión hemodinámica. El seguimiento medio fue de 5,3±3,3 meses y 4 pacientes superaron el año de seguimiento. Los parámetros de estimulación fueron excelentes tanto en el implante como en el seguimiento a corto-medio plazo.
ConclusionesEl implante de marcapasos sin cables es factible y seguro y presenta potenciales ventajas sobre los sistemas convencionales. Serán necesarios estudios con mayor seguimiento antes de generalizar su uso en la práctica clínica diaria.
Palabras clave
Debido en parte al envejecimiento poblacional, en la medicina actual se asiste a un significativo incremento en el número de implantes de dispositivos de estimulación, lo cual conlleva un incremento de las complicaciones asociadas a ellos1. La tasa de complicaciones se estima en un 6-10%, en relación tanto con el procedimiento de implante (neumotórax), el derrame pericárdico y la perforación y la bolsa del generador (hematoma, infección, erosión) como con el/los cables empleados (fractura, desplazamiento, deterioro del aislante) y en ocasiones oclusión del sistema venoso2–6.
En este contexto han surgido recientemente los sistemas de estimulación cardiaca sin cables. Teóricamente estos podrían subsanar algunas de las complicaciones de los sistemas de estimulación convencionales. Actualmente se dispone de datos referentes a su seguridad y eficacia7–9 principalmente de ensayos clínicos. Sin embargo, hay menos evidencia de pacientes de la vida real.
El propósito del estudio es evaluar los parámetros eléctricos al implante y en el seguimiento, así como informar potenciales indicaciones y posibles complicaciones del implante del sistema de marcapasos transcatéter Micra (Medtronic Ibérica, S.A.)
MÉTODOSSe trata de un estudio prospectivo y observacional en el que se incluyó a 30 pacientes consecutivos (desde el 17 de junio de 2015 hasta el 10 de mayo de 2016) con indicación de implante de marcapasos unicameral y edad ≥ 65 años. El implante del marcapasos se realizó por vía femoral según la técnica convencional7. Los parámetros objetivo en el implante fueron: umbral de estimulación ≤ 1,0 V a 0,24 ms, impedancia de estimulación de 400-1.500Ω y una amplitud de onda R ≥ 5 mV. A todos los pacientes se les realizó un ecocardiograma transtorácico, una radiografía de tórax y un electrocardiograma tras el implante. En todos los casos se obtuvo el consentimiento informado del paciente.
De acuerdo con Reynolds et al.9, se consideró complicación mayor el evento que condujera a la muerte o produjera serio deterioro en el estado clínico del paciente y/o el evento con riesgo vital para el paciente que requiriera alguna intervención para resolverlo y/o cualquier complicación que prolongase el ingreso hospitalario más de 48 h.
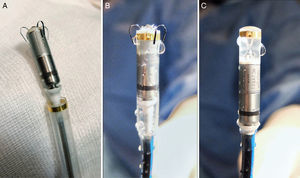
Método de implante del marcapasos MicraEl dispositivo implantable MicraEl marcapasos percutáneo Micra (MC1VR01 Medtronic) es un sistema de estimulación transcatéter monocameral miniaturizado que proporciona detección y estimulación bipolar al ventrículo derecho. El dispositivo Micra está contenido en una cápsula sellada herméticamente, con un volumen de 0,8 cm3, una longitud de 25,9 mm, un diámetro externo de 6,7 mm y un peso de 2,0 g. Cuenta con un mecanismo de fijación activa que se compone de 4 patillas de nitinol sin actividad eléctrica diseñadas para anclarse al tejido cardiaco en el lugar del ventrículo derecho elegido para el implante (figura 1). En lo referente a la estimulación, el cátodo es un electrodo de platino sinterizado recubierto de nitruro de titanio con dilución de esteroide. En su extremo opuesto presenta un rebaje en forma de anillo para permitir utilizar un catéter lazo para su extracción aguda.
Marcapasos Micra y herramienta de liberación. A: imagen del dispositivo según se extrae del embalaje. B: aspecto una vez iniciada la irrigación con suero salino antes de completar el encapsulamiento (y también cómo estará una vez iniciada su liberación). C: totalmente encapsulado en la herramienta de liberación, adecuadamente perfundido de solución salina heparinizada, antes de su introducción a través de la vaina del sistema.
La comunicación con el dispositivo se realiza por telemetría de radiofrecuencia convencional del programador de Medtronic. El Micra es compatible con resonancia magnética de 3 T y tiene una longevidad estimada de 10 años con el 100% de estimulación a 60 lpm, salida de 1,5 V con duración del impulso de 0,24 ms e impedancia de 600Ω.
Introductor y catéter de accesoSe utiliza un introductor específico para acceso vía femoral Medtronic MI2355A de 55,7 cm de longitud y 23 Fr de diámetro interno (diámetro externo, 27 Fr). El introductor posee un recubrimiento hidrófilo para favorecer su inserción. Una vez insertado el introductor del dispositivo, se hepariniza al paciente mediante un bolo de 3.000 UI y perfusión continua de suero heparinizado a través del puerto lateral. El catéter de acceso para el dispositivo está diseñado para colocar el dispositivo en el ventrículo derecho accediendo a través de la vena femoral. Su cuerpo es flexible y deflectable de 23 Fr y 105 cm de longitud, con un compartimento en su extremo distal en el que se aloja el dispositivo (figura 1). Este permanece unido al catéter durante el implante a través de un hilo de sujeción que recorre el catéter describiendo un bucle desde el mango hasta el cono de enganche distal que permite recuperar el Micra para posibles recolocaciones. El mango permite también ceñir el hilo de sujeción y retirar o avanzar el compartimento distal para enganchar y recolocar el dispositivo.
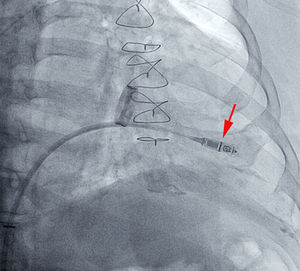
Una vez situado el catéter dirigible en el ventrículo derecho, se explora una posición septoapical o medioseptal, se valora el grado de adosamiento y la posición adecuada para la liberación mediante la inyección de contraste y su filmación para análisis posterior en 2 proyecciones radiológicas complementarias ().
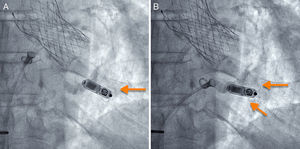
Si la posición es adecuada, se procede a liberarlo, generalmente en proyección oblicua derecha (figura 2 y ). Posteriormente se realizan las mediciones eléctricas del implante y, si son apropiadas, se procede a la valoración del grado de anclaje del dispositivo mediante la maniobra de tracción y retención durante unos segundos, se filma el movimiento de las púas del dispositivo y después se analiza cuadro a cuadro la grabación. Se considera adecuado si se comprueba el movimiento de al menos 2 de las 4 patillas (figura 3 y ). Tras esta maniobra, se procede nuevamente a las mediciones eléctricas y, si no han variado y se considera terminado el implante, se cortan y se retiran los hilos de retención y luego se retira el introductor mediante cierre percutáneo «en 8» con seda del n.o 1.
En todos los casos se realizó electrocardiograma y radiografía de tórax posteroanterior y lateral antes del alta (24 h tras el implante), y 1, 3, 6 y 12 meses después se realizó revisión de las medidas automáticas del dispositivo y comprobación manual de los parámetros de estimulación y programación adecuada.
Análisis estadísticoInicialmente se realizó un análisis descriptivo en el cual las variables continuas gaussianas se expresan como media±desviación típica y las no gaussianas, como mediana (intervalo). Se utilizó el programa SPSS 19.
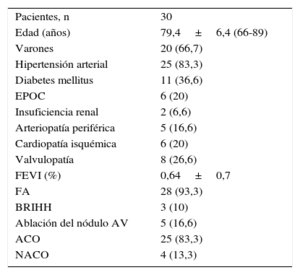
RESULTADOSCaracterísticas basalesLas características basales de los pacientes se muestran en la tabla.
Características basales de los pacientes
| Pacientes, n | 30 |
| Edad (años) | 79,4±6,4 (66-89) |
| Varones | 20 (66,7) |
| Hipertensión arterial | 25 (83,3) |
| Diabetes mellitus | 11 (36,6) |
| EPOC | 6 (20) |
| Insuficiencia renal | 2 (6,6) |
| Arteriopatía periférica | 5 (16,6) |
| Cardiopatía isquémica | 6 (20) |
| Valvulopatía | 8 (26,6) |
| FEVI (%) | 0,64±0,7 |
| FA | 28 (93,3) |
| BRIHH | 3 (10) |
| Ablación del nódulo AV | 5 (16,6) |
| ACO | 25 (83,3) |
| NACO | 4 (13,3) |
ACO: anticoagulantes orales; AV: auriculoventricular; BRIHH: bloqueo de rama izquierda del haz de His; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; NACO: nuevos anticoagulantes orales.
Los valores expresan n (%) o media±desviación estándar (intervalo).
Se pudo realizar el implante de manera satisfactoria en los 30 pacientes seleccionados. La media de edad de los pacientes era 79,4±6,4 (66-89) años y 20 pacientes (66,7%) eran varones. El seguimiento medio fue de 5,3±3,3 meses. En el momento del implante el ritmo era fibrilación auricular (FA) permanente en 28/30 pacientes. Las indicaciones del implante fueron FA lenta en 28 pacientes (93,3%), bloqueo trifascicular y síncope en 1 paciente en ritmo sinusal, en el que se preveía un bajo porcentaje de estimulación, y episodios recurrentes de taquicardia auricular rápida en otro caso. Destaca que en 2 pacientes fuese tras implante percutáneo de válvula aórtica. Un paciente era portador de una prótesis mecánica mitral y anuloplastia tricuspídea de De Vega y otra paciente presentaba una insuficiencia mitral grave.
En 5 pacientes (16,6%) con control inadecuado de la respuesta ventricular, se realizó en el mismo procedimiento, inmediatamente tras el implante percutáneo del marcapasos Micra, la ablación del nódulo auriculoventricular (AV) con radiofrecuencia, utilizando la vaina del sistema, telescopando con introductores del 16 y 8 Fr para mejorar el grado de competencia de la válvula, sin una prolongación del procedimiento significativa, lo cual supuso una media de 5±2 min adicionales.
El implante se realizó en tratamiento con anticoagulantes orales (ACO) con dicumarínicos ininterrumpido en 23 pacientes (76,6%) y la razón internacional normalizada (INR) máxima fue 2,4. Otros 4 pacientes se encontraban en tratamiento con nuevos anticoagulantes orales. En estos se omitió la dosis el día previo al implante y se reinició el mismo día de este. No se utilizó, por lo tanto, terapia puente con heparina en ningún paciente.
El dispositivo se posicionó en la región apical en 20 pacientes (66,6%), en la medioseptal en 9 (30%) y en el tracto de salida del ventrículo derecho en 1 (3,3%).
ComplicacionesSe consiguió el implante en la totalidad de los pacientes, con baja tasa de complicaciones mayores, sin desplazamientos ni infecciones sistémicas. Destaca 1 caso que sufrió un derrame pericárdico moderado, sin repercusión hemodinámica, que se resolvió de forma conservadora y no prolongó la estancia hospitalaria. Se trataba de un paciente de 83 años que no se encontraba en tratamiento con ACO cuyo implante se realizó en la región medioseptal. En otro caso se implantó el dispositivo a través de la vena femoral izquierda por excesiva tortuosidad y disección local de la vena femoral derecha. Se dio el alta al paciente a las 24 h del implante, sin complicaciones locales, que tampoco aparecieron en el seguimiento. No hubo complicaciones locales derivadas del acceso venoso en ningún paciente.
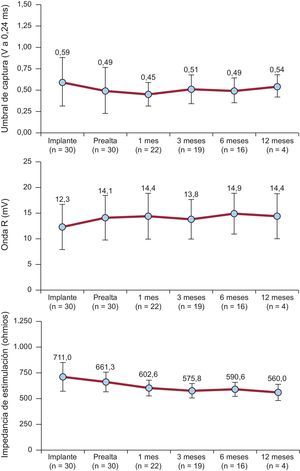
SeguimientoLas variables de estimulación fueron excelentes, tanto al implante como en el seguimiento a corto y medio plazo (figura 4); 4 pacientes completaron el año de seguimiento sin alteraciones en los parámetros de estimulación y sensado ni en las impedancias de estimulación.
DISCUSIÓNEn el presente trabajo se describe nuestra experiencia con el implante transcatéter de marcapasos Micra. Se trata de los primeros datos sobre evolución de estos pacientes en una gran serie española, que vienen a reforzar los resultados publicados por otros grupos. Es una técnica segura, con excelentes parámetros agudos y a corto plazo, que confirma (en pacientes de la práctica clínica) los datos indicados en ensayos clínicos. Asimismo dispone de ventajas potenciales sobre los sistemas de estimulación convencionales, como la posibilidad de evitar hematomas a pacientes en tratamiento con ACO, infecciones de la bolsa del generador y cables y la realización simultánea de ablación del nódulo AV.
Contextualización del problemaCon el envejecimiento poblacional la medicina actual se enfrenta a un incremento en el número de implante de dispositivos de estimulación cardiaca, que presentan una no desdeñable tasa de complicaciones, entre las que destacan las infecciones y los hematomas2–6, complicaciones que también se dan a la hora de los recambios5,10–13.
En el implante de un marcapasos convencional, la tasa de complicaciones asociadas se estima que puede oscilar entre un 6 y un 10%2,3 y aumenta al 14,2% cuando hay necesidad de implantar un nuevo cable, realizar una revisión del sistema por disfunción o una optimización del sistema a resincronizador2.
En cuanto a la perforación cardiaca, en marcapasos convencionales la tasa de perforación cardiaca es del 1%2,14,15. El empleo de sondas de fijación activa se ha asociado con una tasa de perforaciones baja. Así, Cano et al.15 encuentran una tasa de perforación cardiaca clínicamente relevante de solo el 0,8% y que sus predictores son la edad avanzada y el sexo femenino.
Con la introducción del nuevo sistema de estimulación transcatéter Micra, se puede, al menos teóricamente, minimizar las complicaciones asociadas a los sistemas convencionales, en particular las relacionadas con los 2 elementos de los que prescinde el sistema: a) los cables de estimulación y sus conexiones, y b) el bolsillo del generador en la región prepectoral. Se trata además de un dispositivo con una longevidad estimada>10 años16. Plantea dudas su utilización para los pacientes con larga expectativa de vida pero, al menos experimentalmente, se ha determinado que el ventrículo derecho podría alojar hasta 3 dispositivos17–19. También han sido posibles su captura y su extracción aguda con pocos meses de seguimiento, pero el grado de conocimiento de la fibrosis asociada al implante por el momento es insuficiente para prever las posibilidades de una futura extracción del dispositivo20–23.
Análisis de la serie y sus particularidadesLa actual serie presenta ciertas particularidades relevantes. En primer lugar, desde nuestro punto de vista tiene la peculiaridad de haberse realizado sin interrumpir los ACO, sin que ello implicara mayores incidencias de derrame pericárdico o complicaciones del lugar de punción. Este dato es relevante, puesto que en el ensayo pivotal8, no se aplicó ningún régimen anticoagulante al 36% de los pacientes frente al 64% al que sí (terapia puente con heparina en el 40% de los casos y ACO en el 24%). En la serie de Pachón et al.24, 7 de los 10 pacientes presentados se encontraban en tratamiento con ACO, pero se suspendió para al procedimiento en 5 de ellos24. Desde nuestro punto de vista, parece seguro realizar el implante en régimen anticoagulante, terapia que, como es sabido, se asocia con hematomas en el uso de sistemas de estimulación convencional. Por lo tanto, esto permite realizar un implante seguro en poblaciones de riesgo (como acontece con pacientes portadores de prótesis valvulares) al evitar la terapia puente con heparina endovenosa)25–27. Como se puede observar en esta serie, en 2 pacientes fue inmediatamente tras el implante de una válvula percutánea, 1 paciente era portador de una prótesis mitral y 2 pacientes presentaban FA e insuficiencia mitral grave, situaciones en que la interrupción de los ACO, incluso con puente de heparina, aumenta significativamente el riesgo de complicaciones28.
En segundo lugar, y por primera vez, se indica la versatilidad del procedimiento combinando el implante del dispositivo de estimulación con la ablación del nódulo AV. En nuestra experiencia (aunque limitada a únicamente 5 casos) se pudo realizar de manera satisfactoria aprovechando la vaina del sistema. Esto supone una ventaja respecto a los sistemas convencionales, puesto que permite ahorrar una punción además de los costes adicionales de otro procedimiento extra. No obstante, podría discutirse si esto no es una estrategia arriesgada. Desde nuestro punto de vista, con base en la experiencia previa en el implante de este dispositivo, la realización del primer procedimiento combinado en los que no hubo ninguna dislocación-disfunción, y dado que se controlaba a estos pacientes con telemetría durante un mínimo de 24 h tras el procedimiento, se consideró que esta podría ser una estrategia segura y cómoda para los pacientes. Por otra parte, dicha estrategia (ablación de nódulo AV e implante de marcapasos en el mismo procedimiento) es la habitual en nuestro centro, y no ha habido complicaciones por dislocación del electrodo ventricular. No obstante, también creemos que dicha estrategia se deberá confirmar en futuros estudios con mayor número de pacientes antes de que se generalice.
En tercer lugar, creemos que nuestro trabajo ofrece una información de relevancia clínica, ya que, pese a ser pacientes de la práctica clínica y que se incluyó la curva de aprendizaje, comunica una menor tasa de complicaciones que la publicada en el ensayo clínico pivotal8. En concreto, en dicho estudio hubo 30 complicaciones relevantes (en 26 pacientes [18,6%]), que incluyeron arritmias ventriculares (n=9 [6,4%]), complicaciones femorales (n=9 [6,4%]) y 1 derrame pericárdico (n=1 [0,7%]) (sin taponamiento). En el estudio de Reynolds et al.9 hubo 28 complicaciones mayores (en 26 pacientes [3,2%]), las más relevantes embolia/trombosis (n=2 [0,3%]), complicaciones vasculares (n=5 [0,7%]), daño miocárdico (n=11 [1,6%]) y problemas del sistema de estimulación (n=2 [0,3%]).
En el estudio de Reynolds et al.9, la tasa total de complicaciones fue de solo el 4%, la mitad que la observada en la serie histórica empleada para comparación (7,4%). No obstante, el daño miocárdico en pacientes con implantes de Micra fue del 1,6%, superior a la del 1,1% del grupo control. Sus predictores fueron: edad avanzada, bajo peso, sexo femenino, broncopatía crónica obstructiva, uso de esteroides y revascularización coronaria percutánea previa. Son los factores clásicamente asociados al riesgo de perforación con las sondas endovenosas de estimulación permanente convencionales9,14,15.
En nuestra serie hubo una complicación mayor (derrame pericárdico) y no se observaron complicaciones mayores en el sitio de acceso venoso. Por lo tanto, nuestros datos concuerdan con los de Pachón et al.24 que tampoco registraron ninguna complicación reseñable tras el implante y pueden ser alentadores para la implementación más generalizada de esta técnica en otros centros, siempre en grupos de pacientes seleccionados acordes con las características de este dispositivo.
Evolución de parámetros eléctricosEn los seguimientos clínicos programados (24 h y 1, 3 y 6 meses tras el implante) no se encontró dislocación del dispositivo ni elevación de los umbrales de estimulación. Además hubo 4 pacientes que completaron el año de seguimiento mostrando idéntica tendencia. La evolución de los parámetros eléctricos de estimulación (figura 4) fue muy buena, lo que corrobora lo descrito en el estudio de Reynolds et al.9, esto es, en las primeras 24 h un descenso del umbral agudo, que se mantiene estable durante el seguimiento, comportamiento similar observado con los valores de impedancia. Este hecho es de particular importancia clínica ya que, junto con el control automático de captura, permite conseguir unas longevidades del dispositivo estimadas en más de 8-9 años.
Por otra parte, los valores de detección de la onda R tienden a aumentar ligeramente en el seguimiento. Probablemente esta secuencia se relacione con microtraumatismo y lesión local asociada con la liberación del dispositivo y el efecto benéfico posterior de la elución de esteroides presente en el cátodo del dispositivo. Por lo tanto, desde nuestro punto de vista, aunque esto ha suscitado controversia en algunos foros29,30, y es cierto que es importante ceñirse a la recomendación de obtener valores>5 mV, valores limítrofes podrían ser aceptables y pueden no compensar el riesgo inherente a una recolocación. De hecho, en la serie de Pachón et al.24, 1 de los pacientes presentó un valor de onda R al implante de 4,7 mV que aumentó durante el seguimiento a 5,7 mV. En nuestra experiencia hubo 1 caso con 4,4 mV en el implante y excelentes umbral e impedancia, que en 24 h aumentó a 5,5 mV. En este sentido, creemos que son mucho más importantes para la estimulación tanto un umbral de captura óptimo (incremento de la duración del dispositivo) como una buena impedancia en torno a 700-800Ω, que además de favorecer la longevidad es un importante marcador indirecto de buena fijación al endocardio (y de seguridad del implante).
LimitacionesEste estudio se debe interpretar con la limitación de que es un estudio unicéntrico no aleatorizado. Asimismo el número de pacientes y el seguimiento son relativamente pequeños, y aunque proporciona por primera vez seguimiento a 1 año, este se pudo completar únicamente en 4 sujetos, por lo que ahora son necesarios estudios con seguimientos a más largo plazo y con mayor número de pacientes. Finalmente, 2 únicos operadores realizaron todos los procedimientos, por lo que los resultados podrían no ser generalizables a todos los centros/implantadores.
CONCLUSIONESEn nuestra experiencia, el implante transcatéter de marcapasos Micra es seguro, con excelentes parámetros agudos y a corto-medio plazo, lo cual podría evitar las complicaciones de los sistemas convencionales, y además se puede realizar con seguridad en pacientes en tratamiento anticoagulante. Asimismo permite la realización simultánea de ablación del nódulo AV a través del sistema de implante. Son necesarios futuros estudios que confirmen estos datos y aporten información a largo plazo antes de que su uso se generalice.
CONFLICTO DE INTERESESJ.L. Martínez-Sande es proctor de marcapasos Micra.
- –
Los sistemas de estimulación convencional poseen una no desdeñable tasa de complicaciones agudas y crónicas que teóricamente se podría evitar con los nuevos dispositivos de estimulación endocavitaria sin cable.
- –
Según datos publicados en ensayos clínicos y pequeñas series retrospectivas, el implante transcatéter de marcapasos Micra presenta un aceptable perfil de seguridad.
- –
Es una alternativa atractiva para determinados subgrupos de pacientes enviados para implante de marcapasos endocavitario como, por ejemplo, aquellos con problemas para obtener accesos venosos, riesgo de hematoma e infección y con cardiopatías congénitas.
- –
Se comunica la experiencia en el implante transcatéter de marcapasos Micra en pacientes de la vida real.
- –
Se aportan datos de seguridad referentes no solo al implante del dispositivo, sino también a la posibilidad de realizarlo en tratamiento con ACO ininterrumpido en pacientes de alto riesgo tromboembólico.
- –
Se comunica por primera vez la factibilidad de realizar simultáneamente en el mismo procedimiento el implante del marcapasos transcatéter y ablación del nódulo AV.
- –
Se indican resultados de seguimiento tras el implante de hasta 1 año, que muestran excelentes parámetros de estimulación y sensado durante dicho periodo.