En los últimos años, el número de pacientes anticoagulados y antiagregados está aumentando significativamente. Al ser un tratamiento crónico, es de esperar que a lo largo de su vida necesiten un procedimiento quirúrgico o intervencionista que pueda requerir la interrupción del fármaco antitrombótico. La decisión de retirar o mantener dicho tratamiento estará determinada, por un lado, por el riesgo trombótico y, por otro, por el hemorrágico. De la interacción entre estos 2 factores dependerá la actitud ante la anticoagulación y la antiagregación. El objetivo de este documento de consenso, coordinado desde el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología y certificado por un amplio número de sociedades científicas que participan en el proceso asistencial del paciente durante el periodo perioperatorio o periprocedimiento, consiste en proponer una serie de recomendaciones prácticas y sencillas con el fin de homogeneizar la práctica clínica diaria.
Palabras clave
El número de pacientes en tratamiento anticoagulante está aumentando significativamente en los últimos años. Se estima que más de 800.000 pacientes se encuentran anticoagulados en España, fundamentalmente por fibrilación auricular (FA)1. Por otro lado, se ha incrementado el uso de fármacos antiagregantes como prevención secundaria de la enfermedad ateroesclerótica y debido a una mayor tasa de intervenciones coronarias percutáneas (ICP) e implante de stents2–6. Dado que en la mayoría de los casos se trata de un tratamiento crónico, es de esperar que a lo largo de la vida de un paciente con terapia antitrombótica sea necesaria la realización de un procedimiento quirúrgico o intervencionista que pueda requerir su interrupción7. Este hecho adquiere gran relevancia con el tratamiento antiagregante, puesto que su interrupción prematura se asocia con mayor riesgo de eventos cardiovasculares, entre ellos la trombosis del stent8. La decisión de retirar o mantener dicho tratamiento estará determinada, por un lado, por el riesgo trombótico y, por otro, por el riesgo hemorrágico. De la interacción entre estos 2 factores dependerá la actitud ante la anticoagulación y la antiagregación5−9.
Aunque se han publicado recomendaciones acerca del manejo perioperatorio del tratamiento antitrombótico, su implementación en la práctica clínica es escasa7,9–17. Muchas no engloban a todos los protagonistas del proceso perioperatorio (cirujanos, anestesiólogos, etc.), otras se ciñen únicamente a un campo determinado de actuación (como las endoscopias) e incluso algunas se han quedado obsoletas con la aparición de nuevos tratamientos farmacológicos. Por estas razones, se creó un grupo de trabajo, coordinado desde la Sociedad Española de Cardiología y formado por representantes de la mayoría de las sociedades científicas que participan en el proceso asistencial del paciente durante el periodo perioperatorio o periprocedimiento (tabla 1). Como resultado de ese trabajo, nace este documento de consenso que, de un modo práctico y directo, propone una serie de recomendaciones acerca del manejo de los fármacos antitrombóticos en estos escenarios, certificadas por todas las sociedades participantes, con el fin de homogeneizar la práctica clínica diaria.
Sociedades científicas y representantes que han participado y certifican el documento de consenso
| Sociedad Española de Cardiología (SEC) | David Vivas, Inmaculada Roldán, Jose Luis Ferreiro, Francisco Marín, Vanessa Roldán, Antonio Tello-Montoliu, Juan Miguel Ruiz-Nodar, Juan José Gómez-Doblas, Manuel Anguita y Andrés Íñiguez |
| Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor (SEDAR) | Raquel Ferrandis, Juan Vicente Llau, Concepción Cassinello, Aurelio Gómez-Luque, Francisco Hidalgo y Pilar Sierra |
| Sociedad Española de Angiología y Cirugía Vascular (SEACV) | María José Ramos-Gallo |
| Sociedad Española de Cirugía Torácica-Cardiovascular (SECTCV) | Rafael Muñoz |
| Asociación Española de Cirujanos (AEC) | Juan Ignacio Arcelus |
| Sociedad Española de Cirugía Plástica, Reparadora y Estética (SECPRE) | Francisco Leyva |
| Sociedad Española de Patología Digestiva (SEPD) | Fernando Alberca |
| Sociedad Española de Ginecología y Obstetricia (SEGO) | Raquel Oliva |
| Sociedad Española de Hematología y Hemoterapia (SEHH) | Pascual Marco Vera |
| Sociedad Española de Trombosis y Hemostasia (SETH) | José Mateo Arranz |
| Sociedad Española de Médicos de Atención Primaria (SEMERGEN) | José Luis Listerri |
| Sociedad Española de Medicina de Familia y Comunitaria (SEMFYC) | José María Lobos |
| Sociedad Española de Médicos Generales y de Familia (SEMG) | Isabel Egocheaga y Vicente Palomo |
| Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) | Ainhoa Serrano |
| Sociedad Española de Medicina Interna (SEMI) | Olga Madridano |
| Sociedad Española de Medicina de Urgencias y Emergencias (SEMES) | Alfonso Martín |
| Sociedad Española de Neumología y Cirugía Torácica (SEPAR) | Ana María Gómez y Carmen Montero |
| Sociedad Española de Neurocirugía (SENEC) | Fuat Arikan y Luis Ley |
| Sociedad Española de Oftalmología (SEO) | Enrique Santos-Bueso |
| Sociedad Española de Periodoncia (SEPA) | Elena Figuero, Antonio Bujaldón y Adrián Guerrero |
| Sociedad Española de Radiología Vascular e Intervencionista (SERVEI) | José Urbano |
| Sociedad Española de Traumatología y Cirugía Ortopédica (SECOT) | Rafael Otero |
| Asociación Española de Urología (AEU) | Juan Francisco Hermida |
El riesgo tromboembólico por la afección que originó la anticoagulación (válvulas cardiacas mecánicas, FA y tromboembolia venosa) se clasifica en alto, medio y bajo en función de la probabilidad de que se produzca un evento tromboembólico anual (tanto arterial como venoso): > 10%, entre el 5 y el 10% y < 5% respectivamente18. En el caso de la FA, se han tenido en cuenta las recientes recomendaciones que utilizan la escala CHA2DS2-VASc en vez de la CHADS216. La tabla 2 resume la estratificación del riesgo tromboembólico de los pacientes que precisan tratamiento anticoagulante.
Estratificación del riesgo tromboembólico de los pacientes en tratamiento anticoagulante
| Riesgo | Motivo de la anticoagulación | ||
|---|---|---|---|
| Válvulas cardiacas mecánicas | Fibrilación auricular | Tromboembolia venosa | |
| Alto | Posición mitral Posición tricuspídea (incluido biológicas) Posición aórtica (prótesis monodisco) Ictus/AIT < 6 meses | CHA2DS2-VASc* 7-9 Ictus/AIT < 3 meses Valvulopatía reumática mitral | TEV reciente (< 3 meses) Trombofilia grave (homocigosis factor V Leiden, 20210 protrombina, déficit de proteína C, S o antitrombina, defectos múltiples, síndrome antifosfolipídico) |
| Moderado | Posición aórtica + 1 FR: FA, ictus/AIT previo > 6 meses, DM, IC, edad > 75 años | CHA2DS2-VASc 5-6 Ictus/AIT > 3 meses | TEV 3-12 meses previos Trombofilia no grave (heterocigosis para factor V Leiden o mutación 20210 A de la protrombina) TEV recurrente TEV + cáncer activo |
| Bajo | Posición aórtica sin FR | CHA2DS2-VASc 1-4 Sin ictus/AIT previo | TEV > 12 meses |
AIT: accidente isquémico transitorio; DM: diabetes mellitus; FA: fibrilación auricular; FR: factor de riesgo; IC: insuficiencia cardiaca; TEV: tromboembolia venosa.
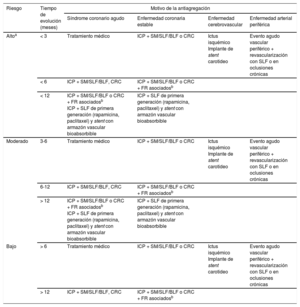
En la definición del riesgo trombótico de los procesos ateroescleróticos que precisan antiagregación, es necesario considerar los siguientes aspectos: el tiempo de evolución hasta la intervención, el tipo de presentación (evento agudo frente a enfermedad estable), las características clínicas del paciente y el tratamiento realizado (ICP y el tipo de stent implantado, cirugía o únicamente tratamiento médico)19. Es importante destacar la falta de ensayos clínicos dirigidos a dilucidar estos riesgos, y que se ha tenido que recurrir a estudios observacionales y retrospectivos, así como los consensos de expertos13. En función de la combinación de estos factores, el riesgo trombótico se clasifica en alto, moderado o bajo, como se resume en la tabla 313,20.
Estratificación del riesgo trombótico de los pacientes en tratamiento antiagregante
| Riesgo | Tiempo de evolución (meses) | Motivo de la antiagregación | |||
|---|---|---|---|---|---|
| Síndrome coronario agudo | Enfermedad coronaria estable | Enfermedad cerebrovascular | Enfermedad arterial periférica | ||
| Altoa | < 3 | Tratamiento médico | ICP + SM/SLF/BLF o CRC | Ictus isquémico Implante de stent carotideo | Evento agudo vascular periférico + revascularización con SLF o en oclusiones crónicas |
| < 6 | ICP + SM/SLF/BLF, CRC | ICP + SM/SLF/BLF o CRC + FR asociadosb | |||
| < 12 | ICP + SM/SLF/BLF o CRC + FR asociadosb ICP + SLF de primera generación (rapamicina, paclitaxel) y stent con armazón vascular bioabsorbible | ICP + SLF de primera generación (rapamicina, paclitaxel) y stent con armazón vascular bioabsorbible | |||
| Moderado | 3-6 | Tratamiento médico | ICP + SM/SLF/BLF o CRC | Ictus isquémico Implante de stent carotideo | Evento agudo vascular periférico + revascularización con SLF o en oclusiones crónicas |
| 6-12 | ICP + SM/SLF/BLF, CRC | ICP + SM/SLF/BLF o CRC + FR asociadosb | |||
| > 12 | ICP + SM/SLF/BLF o CRC + FR asociadosb ICP + SLF de primera generación (rapamicina, paclitaxel) y stent con armazón vascular bioabsorbible | ICP + SLF de primera generación (rapamicina, paclitaxel) y stent con armazón vascular bioabsorbible | |||
| Bajo | > 6 | Tratamiento médico | ICP + SM/SLF/BLF o CRC | Ictus isquémico Implante de stent carotideo | Evento agudo vascular periférico + revascularización con SLF o en oclusiones crónicas |
| > 12 | ICP + SM/SLF/BLF, CRC | ICP + SM/SLF/BLF o CRC + FR asociadosb | |||
AIT: accidente isquémico transitorio; BLF: balón liberador de fármaco; CRC: cirugía de revascularización coronaria; DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IRC: insuficiencia renal crónica; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco coronario izquierdo.
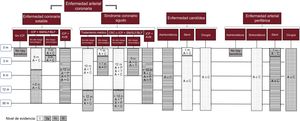
De las variables que evalúan el riesgo trombótico, el tiempo transcurrido entre el episodio isquémico y la intervención es el principal determinante de eventos relacionados con la suspensión de la doble antiagregación plaquetaria (DAP) durante la cirugía o el procedimiento21. Recientes estudios apuntan un mayor riesgo de eventos trombóticos en cirugías urgentes y cuando la cirugía programada acontece en los primeros 6 meses tras el implante de un stent coronario22. Las recomendaciones del Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología acerca de la duración óptima de la DAP se resumen en la figura 123,24.
Recomendaciones acerca de la duración óptima de la doble antiagregación plaquetaria de pacientes con enfermedad aterotrombótica. A: ácido acetilsalicílico; AVB: armazón vascular bioabsorbible; BLF: balón liberador de fármaco; C: clopidogrel; CRC: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; m: meses; P:prasugrel; SFA: stent farmacoactivo; SM: stent metálico; T: ticagrelor. Adaptado con permiso de Gómez-Polo et al.23.
Uno de los aspectos que más influye en la valoración del riesgo trombótico es el tipo de stent implantado. Los pacientes con ICP e implante de stent farmacoactivo (SFA) de primera generación se asociaban con más trombosis tardía y muy tardía que los stents metálicos25. Sin embargo, los SFA de segunda generación, con mejoras en el diseño y los polímeros utilizados, han mejorado su perfil de seguridad y tienen una tasa de trombosis incluso menor que las de los stents metálicos26. Además, el desarrollo de nuevas plataformas y la posibilidad de realizar ICP con balón liberador de fármaco está permitiendo la búsqueda de dispositivos con perfiles de seguridad mayores sin perder eficacia27. En cuanto a los stents con armazón vascular bioabsorbible, y aunque todavía hay poca experiencia, varios estudios han objetivado una mayor incidencia de trombosis del stent a largo plazo, por lo que la recomendación en estos casos es mantener la DAP al menos 12 meses5,23. Por último, en el caso de los pacientes tratados mediante cirugía de revascularización coronaria o mediante tratamiento médico no invasivo, el riesgo de complicaciones es mucho menor, dado que se elimina la muchas veces catastrófica trombosis del stent.
Otra variable que considerar es la forma de presentación del evento. Así, los pacientes con un síndrome coronario agudo tienen más riesgo trombótico que aquellos con enfermedad coronaria estable. También es de interés valorar la comorbilidad del paciente: factores como la diabetes mellitus, la enfermedad renal crónica, la disfunción ventricular izquierda grave o los antecedentes de ictus y/o accidente isquémico transitorio se han asociado clásicamente con un aumento del riesgo de trombosis26. Por último, los pacientes sometidos a ICP de procedimiento complejo (definido como los que requieren stents largos, múltiples, con solapamiento, implantados en bifurcaciones o tronco coronario izquierdo, en vasos < 2,5mm o en injertos de vena safena) también han de considerarse como de mayor riesgo trombótico28.
La necesidad de una intervención quirúrgica en pacientes con un ictus reciente presenta un riesgo aumentado de nuevos eventos, fundamentalmente en los primeros 30 días, incidencia mayor en caso de que se suspenda la antiagregación29. Con respecto a la enfermedad arterial periférica, se han descrito casos de trombosis del stent principalmente en el primer mes. Los pacientes con más riesgo son los tratados con SFA o con stents utilizados para el tratamiento de oclusiones crónicas. La reciente guía de práctica clínica recomienda la DAP durante al menos 1 mes para los pacientes tratados mediante procedimientos endovasculares por enfermedad arterial de las extremidades inferiores, independientemente del tipo de stent24.
RIESGO HEMORRÁGICODe manera similar que con el riesgo tromboembólico, este grupo de trabajo ha considerado estratificar el riesgo hemorrágico en 3 grupos en función de las características del procedimiento que se vaya a realizar7,10,13,16. Así, se consideran de riesgo hemorrágico bajo las intervenciones en que la hemostasia se puede conseguir adecuadamente, una posible hemorragia no supone un riesgo vital para el paciente ni compromete el resultado de la cirugía y no requiere transfusión. El riesgo hemorrágico moderado define procedimientos en los que la hemostasia quirúrgica puede ser difícil y la hemorragia aumenta la necesidad de transfusión o reintervención. Por último, el riesgo hemorrágico alto se ha definido como aquel en que la hemorragia perioperatoria puede comprometer la vida del paciente o el resultado de la cirugía. Hay que puntualizar que, en lo referente al riesgo hemorrágico en procedimientos no quirúrgicos (cardiología intervencionista, endoscopias, broncoscopias, odontología y radiología vascular intervencionista), no hay una estratificación tan clara, puesto que en muchas ocasiones no es posible la adecuada hemostasia primaria o compresión. Por eso, en general, se debe considerar porcentajes de posibilidades de hemorragia, y se admite en general que el riesgo hemorrágico es bajo cuando esta posibilidad es < 1% e intermedio-alto si es > 1%. Además de la probabilidad, puede ser muy relevante para la toma de decisiones la potencial gravedad de la hemorragia (por su localización o por la imposibilidad de una hemostasia adecuada). En la se resumen las cirugías y los procedimientos más frecuentes que cada sociedad científica ha querido destacar según la estratificación del riesgo hemorrágico9,10,13,16,30.
Aunque el riesgo hemorrágico depende fundamentalmente del tipo de procedimiento, existen unos factores adicionales inherentes al paciente y al medio que pueden elevar la probabilidad de hemorragia30. En general, estos factores ya han sido establecidos por escalas de riesgo hemorrágico de enfermedades tan prevalentes como la FA o el síndrome coronario agudo: edad > 65 años, insuficiencia renal/hepática o tratamiento farmacológico concomitante que pueda alterar la hemostasia (combinación de antiagregación y anticoagulación)31–33. A estos factores hay que añadir otros, como el antecedente de hemorragia espontánea en los 3 meses que preceden a la intervención o en procedimientos invasivos previos, trombocitopenia y/o trombopatía o variabilidad de la razón normalizada internacional (INR) en los tratados con fármacos antagonistas de la vitamina K (AVK)34.
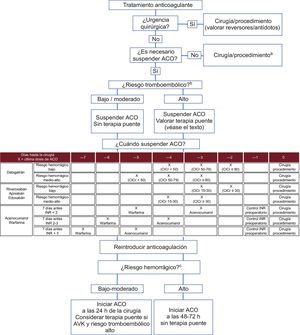
RECOMENDACIONES DE RETIRADA Y REINTRODUCCIÓN DEL TRATAMIENTO ANTICOAGULANTEA la hora de decidir la conducta más apropiada sobre la anticoagulación en el periodo perioperatorio/periprocedimiento, este grupo de trabajo recomienda una serie de pautas sencillas, en función de los riesgos tromboembólico y hemorrágico, que se resumen en el algoritmo de la figura 29,16,30,34.
Recomendaciones para la retirada y reintroducción de los anticoagulantes orales en función del tipo de intervención y los riesgos tromboembólico y hemorrágico. ACO: anticoagulación oral; AVK: antagonista de la vitamina K; ClCr: aclaramiento de creatinina (ml/min); HBPM: heparina bajo peso molecular; HNF: heparina no fraccionada; INR: international normalized ratio. aProcedimientos de bajo riesgo en que la posible hemorragia sea clínicamente poco importante y asumible por el operador (). bClasificación del riesgo tromboembólico (tabla 2). cClasificación del riesgo hemorrágico ().
En general, la gran mayoría de las cirugías o los procedimientos intervencionistas requieren la suspensión del tratamiento anticoagulante. Sin embargo, hay una serie de procedimientos en los que el riesgo de mantener la anticoagulación conlleva un riesgo de hemorragia muy bajo y asumible por el operador35. El estudio BRUISE CONTROL36, que incluyó a pacientes con alto riesgo trombótico a quienes se implantó un marcapasos o un desfibrilador, demostró que mantener el tratamiento anticoagulante con AVK (INR < 3) se asociaba con menos riesgo de hemorragia que la terapia puente con heparina de bajo peso molecular (HBPM)34. En este mismo contexto, los recientes resultados del estudio BRUISE CONTROL-2 no mostraron diferencias en la incidencia de eventos isquémicos y/o hemorrágicos entre mantener o interrumpir el tratamiento con anticoagulantes de acción directa (ACOD)37. En el estudio COMPARE, los pacientes sometidos a ablación por catéter de venas pulmonares presentaron menos riesgo de hemorragia y eventos tromboembólicos si no se interrumpía la anticoagulación oral con AVK (INR 2-3) en vez de sustituirlos por HBPM38. Aunque hay evidencia reciente acerca de la seguridad de algunas intervenciones sin la interrupción de los ACOD, se necesitan más estudios para realizar una recomendación definitiva39. En conclusión, este grupo de trabajo recomienda que se valore no interrumpir la anticoagulación para procedimientos de bajo riesgo en que la posible hemorragia sea clínicamente poco importante y asumible por el operador ().
¿Cuándo suspender la anticoagulación?El principal determinante para conocer en qué momento hay que suspender el tratamiento anticoagulante es su vía de eliminación. Los AVK presentan un metabolismo predominantemente hepático y mínimamente renal. Por ello, y salvo hepatopatía que modifique la conducta (que en su mayoría contraindican la anticoagulación), se recomienda en general suspender el acenocumarol 3 días antes de la intervención y la warfarina, 5 días antes (figura 2)9,16. Esta recomendación es aplicable únicamente si el INR 7 días antes de la intervención se encuentra en rango terapéutico (INR 2-3). En caso de INR supraterapéutico o de que el riesgo hemorrágico del procedimiento sea alto, depende de la cifra exacta y del INR deseado antes del procedimiento. Si el INR se encontrara en un rango subterapéutico, el AVK podría suspenderse 1 día después (con 2 días de antelación el acenocumarol y 4 días la warfarina). En todos los casos, se recomienda realizar un control de INR antes de la intervención teniendo como objetivo general INR < 1,5. En cuanto a los ACOD, dado que su farmacocinética es predecible y depende de la función renal, la decisión de cuándo interrumpir depende del valor del aclaramiento de creatinina y del riesgo hemorrágico de la intervención34,40,41.
¿Es necesaria la terapia puente?En general, el riesgo tromboembólico asociado con la interrupción del tratamiento anticoagulante oral sin terapia puente con heparina es bajo42. Además, datos recientes demuestran que la terapia puente con heparina se asocia con mayos riesgo de hemorragia, sin beneficios en la incidencia de eventos tromboembólicos43. En el estudio aleatorizado BRIDGE se evaluó el uso de terapia puente en 1.884 pacientes con FA44. No se objetivaron diferencias significativas en las tasas de eventos tromboembólicos, pero hubo más hemorragias en el grupo de terapia puente. La limitación principal del estudio es la inclusión de pacientes con bajo riesgo tanto trombótico (exclusión de prótesis mecánicas e ictus < 3 meses, CHADS2 medio de 2,3), como hemorrágico (solo un 11% de los procedimientos eran de riesgo moderado-alto). Actualmente está en marcha un ensayo similar para pacientes con alto riesgo tromboembólico (PERIOP-2, NCT00432796).
A raíz de la evidencia disponible, este grupo de trabajo recomienda únicamente el uso de terapia puente con heparina para pacientes con riesgo tromboembólico alto (tabla 2). En general, en lo que respecta a los AVK, es suficiente con iniciar HBPM (o heparina no fraccionada en caso de insuficiencia renal con aclaramiento de creatinina < 30 ml/min) cuando el INR sea < 2 o, en caso de que no se disponga de este valor, tras omitir 2-3 dosis del fármaco. En el caso de los ACOD, este grupo de trabajo no recomienda su uso como terapia puente (aunque existen todavía protocolos que consideran su uso tras omitir 2-3 dosis del fármaco). La última dosis de HBPM debe administrarse 12 h (en caso de dosis profilácticas) o 24 h (dosis terapéuticas) antes de la intervención y la heparina no fraccionada, en las 4-6 h previas.
¿Cuándo y cómo reintroducir la anticoagulación?El principal factor que tener en cuenta para reintroducir la anticoagulación es haber conseguido una adecuada hemostasia durante la intervención y la ausencia de hemorragia posprocedimiento. Por ello, el momento exacto para reiniciar la anticoagulación debe determinarse conjuntamente con el equipo quirúrgico/intervencionista. Como regla general, y salvando esta premisa, este grupo de trabajo recomienda reintroducir la anticoagulación a las 24 h del procedimiento. Si el paciente presenta un riesgo tromboembólico alto, y dado que el efecto anticoagulante de los AVK empieza a las 24-72 h, es recomendable el uso de terapia puente con heparina, lo cual no es necesario con los ACOD41. Solo si el paciente tiene alto riesgo hemorrágico posoperatorio, el inicio de la anticoagulación oral debe posponerse entre 48 y 72 h (figura 2). Para los pacientes en que no es posible el uso de la vía oral para reiniciar la anticoagulación, se debe valorar la anticoagulación con antitrombóticos parenterales, de preferencia las HBPM a dosis balanceadas para cubrir el riesgo trombótico y minimizar el hemorrágico.
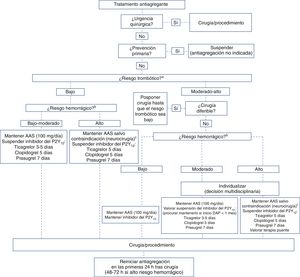
RECOMENDACIONES DE RETIRADA Y REINTRODUCCIÓN DEL TRATAMIENTO ANTIAGREGANTELa decisión acerca de la antiagregación en el periodo perioperatorio/periprocedimiento no solo depende del balance entre los riesgos trombótico y hemorrágico, sino también del tipo y la indicación del tratamiento antiplaquetario5,9,10. Es necesario puntualizar que, actualmente, no está recomendado el uso de antiagregación en prevención primaria7. En la figura 3 se describe un sencillo algoritmo con el que, a través de una serie de preguntas, se facilitan las decisiones sobre la terapia antiagregante.
Recomendaciones para la retirada y reintroducción de los fármacos antiagregantes en función del tipo de intervención y los riesgos trombótico y hemorrágico. AAS: ácido acetilsalicílico; DAP: doble antiagregación plaquetaria. aClasificación del riesgo trombótico (tabla 3). bClasificación del riesgo hemorrágico (). cDe ser necesario, suspender el AAS 3 días antes de la intervención.
Para los pacientes con antiagregación simple, se recomienda mantener el ácido acetilsalicílico (AAS), puesto que se ha demostrado que reduce el riesgo isquémico sin aumentar significativamente el riesgo de hemorragia45. Solo para las intervenciones con muy alto riesgo hemorrágico (p. ej., los procedimientos neuroquirúrgicos), se propone considerar suspenderlo 3 días9. Se recomienda utilizar y mantener una dosis baja (100 mg/día), salvo contraindicación, aunque si el paciente acude al procedimiento con dosis mayores (p. ej., 300 mg), no se justifica posponer la intervención. En los casos en que la monoterapia sea con un inhibidor del P2Y12, se recomienda suspender el fármaco 3-7 días (ticagrelor, 3-5 días; clopidogrel, 5 días; prasugrel, 7 días) y sustituirlo por AAS 100mg si es posible45.
La primera consideración con los pacientes con DAP es valorar la necesidad de intervención electiva mientras el riesgo trombótico sea moderado-alto; si la intervención puede demorarse, se pospone hasta que el riesgo trombótico del paciente se considere bajo. En caso contrario, se recomienda:
- •
Mantener el AAS salvo para procedimientos que lo contraindiquen (p. ej., neurocirugía).
- •
Si el riesgo trombótico es moderado, suspender el inhibidor del receptor P2Y12 antes de la cirugía/procedimiento, salvo en situaciones de riesgo hemorrágico bajo, de la siguiente forma: ticagrelor, 3-5 días; clopidogrel, 5 días, y prasugrel, 7 días5,9. En cirugía urgente aplazable (en las primeras 72 h, como la de fractura de cadera), se ha de valorar la indicación quirúrgica a partir del tercer día de la suspensión del ticagrelor y el clopidogrel y del quinto día de la suspensión del prasugrel5,9,30.
- •
En caso de alto riesgo trombótico, la decisión depende del riesgo hemorrágico de la intervención. Si el riesgo de hemorragia es bajo, este grupo de trabajo recomienda no suspender la DAP. Más controvertido es el tratamiento de pacientes con riesgo hemorrágico moderado-grave, por lo que se recomienda individualizar cada caso y tomar la decisión en equipos multidisciplinarios. En general, es importante evitar la suspensión de la DAP durante los primeros 30 días tras el evento índice por el que se pautó5.
A diferencia de la anticoagulación, la experiencia con la terapia puente en el campo de la antiagregación tanto en la literatura como en la práctica clínica es muy escasa. Un error frecuente consiste en considerar la utilización de heparinas en este contexto, ya que puede producir un efecto contrario al deseado, al aumentar la reactividad plaquetaria13. En caso de que sea necesaria la terapia puente, se recomienda el uso de agentes antiplaquetarios, y no los anticoagulantes, puesto que el uso de heparina puede ser perjudicial12. Entre los antiagregantes plaquetarios intravenosos estudiados, destacan los fármacos inhibidores de la glucoproteína IIb/IIIa (tirofibán, eptifibatida) y el inhibidor del receptor de ADP P2Y12 cangrelor.
El uso perioperatorio del tirofibán y la eptifibatida, los 2 inhibidores intravenosos del receptor de la glucoproteína IIb/IIIa de rápido mecanismo de acción, se ha evaluado en pequeños estudios en pacientes con alto riesgo trombótico (fundamentalmente tras ICP e implante de SFA), con resultados controvertidos46. El cangrelor, antagonista intravenoso y reversible del receptor plaquetario de ADP P2Y12, se ha evaluado en un estudio de fase II en pacientes en DAP sometidos a cirugía de revascularizacón coronaria47. No hubo diferencias en la incidencia de eventos trombóticos en comparación con el grupo placebo, y se asoció con un pequeño aumento de las hemorragias menores. No obstante, el ensayo se diseñó para el estudio de la función plaquetaria y no para el estudio de eventos, por lo que hay que tomar estas conclusiones con cautela. Además, todavía no se ha aprobado el uso perioperatorio del cangrelor, y su utilización está indicada solo durante la ICP.
Por lo tanto, y dada la escasa evidencia disponible, este grupo de trabajo recomienda el uso de terapia puente para fármacos antiagregantes en casos muy restringidos en los que converjan un riesgo trombótico alto (fundamentalmente durante los primeros 30 días tras el evento índice que motivó el inicio de la DAP) y un riesgo hemorrágico moderado-grave y no se pueda posponer la intervención. Será necesario una atención multidisciplinaria para individualizar adecuadamente el riesgo-beneficio de la decisión. De estar indicada la terapia puente, ha de iniciarse con un inhibidor de la glucoproteína IIb/IIIa 72 h tras suspender el antagonista del P2Y12 (tirofibán 0,1 μg/kg/min; eptifibatida 2 μg/kg/min, sin dosis de carga) y mantenerse hasta 4-6 h antes de la intervención.
¿Cuándo y cómo reintroducir la antiagregación?El principal factor que tener en cuenta para reintroducir la antiagregación es haber conseguido una adecuada hemostasia durante la intervención y la ausencia de hemorragia posprocedimiento. Así, el momento exacto para reiniciar la antiagregación debe determinarse conjuntamente con el equipo quirúrgico/intervencionista. Como regla general, y salvando esta premisa, se recomienda reintroducir la antiagregación en las primeras 24 h tras el procedimiento. Si el paciente tiene alto riesgo trombótico y está en tratamiento con DAP, hay que considerar reiniciar el inhibidor del P2Y12 con una dosis de carga (clopidogrel 300-600 mg; prasugrel 60 mg; ticagrelor 180 mg). Solo si el paciente tiene alto riesgo hemorrágico posoperatorio, el inicio de la antiagregación oral debe posponerse entre 48 y 72 h (figura 3).
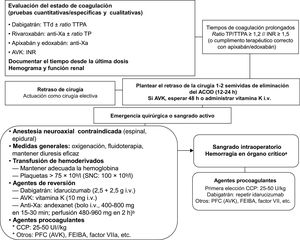
ANTICOAGULACIÓN Y CIRUGÍA URGENTELa necesidad de una cirugía o un procedimiento invasivo urgentes no permite el proceso de espera expuesto para las técnicas electivas, ya que la variable tiempo es fundamental en las situaciones de urgencia. Por lo tanto, el proceso debe ir encaminado a determinar rápidamente los siguientes aspectos (figura 4)40,48:
- •
El estado de anticoagulación del paciente mediante pruebas de laboratorio: INR para los AVK. Para los ACOD, en el caso habitual de que no estén disponibles los más precisos tests cuantitativos, pueden ser útiles las pruebas cualitativas habituales, como el tiempo de tromboplastina parcial activado en el caso del dabigatrán y el tiempo de protrombina con el rivaroxabán y probablemente también con el edoxabán. La normalidad de estas pruebas (entendida como una tasa < 1,2) podría descartar, con alta probabilidad en la mayoría de los pacientes, la existencia de una actividad anticoagulante significativa, con lo que se podría proceder a la intervención de la manera habitual49. Es conveniente que el laboratorio de hemostasia conozca la sensibilidad de las pruebas de coagulación a estos fármacos.
- •
En el caso de los AVK, si el INR es < 1,5, podría intervenirse al paciente sin demora. Si el INR es > 1,5, depende de la urgencia del procedimiento: si el paciente puede esperar 8-12 h, bastaría con administrar 10mg de vitamina K por vía endovenosa. En caso de necesidad de cirugía inmediata, la opción comúnmente aceptada es la administración de complejo protrombínico, 25-50 UI/kg de peso en función del INR actual y objetivo50.
- •
En el caso de los ACOD, si el estudio de hemostasia muestra actividad anticoagulante (o si el cumplimento terapéutico es adecuado en el caso del apixabán o el edoxabán), debe plantearse la demora máxima que puede tener la cirugía según la situación clínica del paciente (hemorragia, estabilidad hemodinámica y riesgo vital y de secuelas). Idealmente, sería deseable diferir la intervención al menos 24 h desde la ingesta del anticoagulante (al menos 2 semividas de eliminación de los ACOD si la función renal es normal)17. En caso contrario, hay que valorar el uso de agentes de reversión en función del tipo de cirugía que vaya a realizarse, el tiempo transcurrido desde la toma del fármaco y la función renal del paciente. Como norma general, en estos pacientes se debe evitar la anestesia neuroaxial40.
Recomendaciones para el tratamiento de pacientes en terapia anticoagulante que requieren cirugía urgente. ACOD: anticoagulantes orales de acción directa; AVK: antagonista de la vitamina K; CCP: concentrado de complejo protrombínico; FVIIa: factor VII activado; INR: international normalized ratio; i.v.: intravenoso; PFC: plasma fresco congelado; SNC: sistema nervioso central; TTd: tiempo de trombina diluida; TTPA: tiempo de tromboplastina parcial activado; TP: tiempo de protrombina; Xa: factor X activado. aSistema nervioso central, pericardio, intraocular, intraarticular o muscular con síndrome compartimental. bEl andexanet actualmente no está autorizado en España para su uso clínico (dosis sujeta a ficha técnica).
Los agentes de reversión son sustancias que antagonizan los efectos del anticoagulante («antídotos»)51. Así, en el caso de pacientes tratados con AVK, debe administrarse vitamina K (5-10mg por vía intravenosa, en función del INR) pero, dada su larga latencia de acción (6-8 h), su utilidad es poca si la cirugía es urgente o hay hemorragia activa, y se debe plantear la administración de agentes hemostáticos48. El idarucizumab es un fragmento de un anticuerpo monoclonal humanizado que antagoniza total y específicamente la actividad anticoagulante del dabigatrán en cuestión de minutos y ha mostrado una muy elevada efectividad en estudios en práctica clínica52. Se administra en forma de infusión intravenosa rápida (2 viales de 2,5g consecutivos, separados 15 min) sin necesidad de tests de coagulación complejos. El idarucizumab está indicado para pacientes bajo el efecto anticoagulante del dabigatrán que presenten una hemorragia aguda grave o en órgano crítico y/o precisen la realización de cirugía o procedimientos invasivos urgentes de alto riesgo hemorrágico en las siguientes 8 h53. Actualmente se encuentra en fase de desarrollo el andexanetalfa (bolo intravenoso de 400-800mg en 15-30min, seguido de perfusión de 480-960mg en 2 h), un agente de reversión específico de los inhibidores del factor Xa y el ciraparantag, con un mecanismo de acción más amplio53–55.
Los agentes procoagulantes son preparados que aportan factores y otras sustancias de la cascada de la coagulación y contribuyen a la génesis de trombina y, por lo tanto, a una hemostasia eficaz, pero no antagonizan los efectos del anticoagulante53. El concentrado de complejo protrombínico, un derivado del plasma humano que aporta los factores II, VII, IX y X, es el hemostático de elección, aunque puede presentar riesgo de complicaciones trombóticas, en función de la dosis y la necesidad de repetición, y de la enfermedad de base; su experiencia de uso con los ACOD es escasa, aunque no así con los AVK.
El plasma fresco congelado es un agente hemostático de segunda elección y únicamente efectivo (a dosis 15-30ml/kg) en el caso de los AVK, y se debe usar solo en caso de que no esté disponible otro agente hemostático. Por último, hay muy poca experiencia con otros hemostáticos como el FEIBA (o complejo protrombínico activado, cuya única indicación establecida es el tratamiento de la hemofilia con inhibidor) y el factor VII recombinante activado, por lo que actualmente no tienen indicación establecida de uso en este campo, además de que conllevan una alta tasa de complicaciones tromboembólicas48,53.
ANTIAGREGACIÓN Y CIRUGÍA URGENTEEn líneas generales, el tratamiento con fármacos antiagregantes plaquetarios tiene poca influencia antes de una cirugía o un procedimiento invasivo urgente, incluso en pacientes ancianos sometidos a neurocirugía10,56. Por un lado, en cuanto al momento de realizarse el procedimiento, hay un consenso generalizado en que, evaluando el riesgo de hemorragia que aportan frente a la necesidad de realizar una técnica invasiva o cirugía urgente, no está justificado retrasarlo por este motivo (incluidos los pacientes con DAP)57. Aunque las guías de práctica clínica mencionan la posibilidad de considerar para pacientes seleccionados el uso de pruebas de función plaquetaria que, si demostraran su retorno al nivel basal, permitirían acortar el tiempo de suspensión del antiagregante, actualmente su uso se encuentra limitado porque además son pruebas que habitualmente no están disponibles en los laboratorios de urgencias5.
Desde un punto de vista práctico, y para facilitar la elección del procedimiento anestésico, es de utilidad diferenciar el tipo de antiagregante que toma el paciente. Así, el tratamiento con AAS no contraindica la anestesia neuroaxial, mientras que esta se desaconseja en el caso de tratamiento activo con inhibidores del P2Y129,30. También es importante recalcar que, ante la eventualidad de una hemorragia grave durante el procedimiento (no atribuible a otros trastornos de la coagulación o tratamiento anticoagulante simultáneo), las medidas más útiles y de validez demostrada son la hemostasia quirúrgica y la transfusión de plaquetas en el acto quirúrgico (no está indicada su transfusión profiláctica y suele requerirse un intervalo mínimo, 6-12 h, desde la toma del fármaco y la transfusión para que sea eficaz)9,30. Sin embargo, el consenso sobre el papel de los agentes hemostáticos es mucho menor. Así, la desmopresina ha mostrado utilidad en algunos estudios realizados en cirugía cardiaca, aunque presentan una gran heterogeneidad58. Por ello, no hay evidencia suficiente que justifique su uso sistemático, y menos aún la administración de agentes hemostáticos (complejo protrombínico, FEIBA, factor VII activado) que actúan generando trombina (por lo tanto, en un nivel de la hemostasia distinta que los antiagregantes) y conllevan alto riesgo protrombótico, de especial importancia en pacientes con enfermedad isquémica establecida9,30.
CONCLUSIONESLa heterogeneidad en el tratamiento antitrombótico durante el periodo perioperatorio o periprocedimiento es un problema habitual en la práctica clínica diaria. A través de este documento de consenso, que incluye a expertos de todas las sociedades científicas españolas implicadas en el proceso perioperatorio del paciente, se pretende sintetizar las recomendaciones más importantes sobre cómo manejar los fármacos anticoagulantes y antiagregantes de un modo sencillo, práctico y fácil de aplicar. Es imprescindible crear grupos de trabajo multidisciplinarios locales que evalúen la evidencia y las recomendaciones en este escenario, como las proporcionadas en este documento, con la intención de adaptarlas a sus necesidades y recursos específicos locales y homogeneizar la actividad asistencial lo máximo posible.
CONFLICTO DE INTERESESNo se declara ninguno.
.