La hipertensión es un factor de riesgo de fibrilación auricular. Parece que la activación del sistema renina-angiotensina interviene en el crecimiento auricular con la liberación de los péptidos natriuréticos auricular y cerebral. El objetivo de este estudio es evaluar la relación de la presión arterial ambulatoria y los valores de péptidos natriuréticos con el tamaño auricular izquierdo en sujetos normotensos con fibrilación auricular idiopática.
MétodosSe llevó a cabo un estudio transversal en pacientes con fibrilación auricular idiopática. Se registraron los siguientes parámetros durante la realización del estudio: presión arterial en la consulta y ambulatoria de 24 h, péptidos natriuréticos auricular y cerebral, renina en plasma, aldosterona y enzima de conversión de la angiotensina.
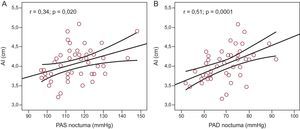
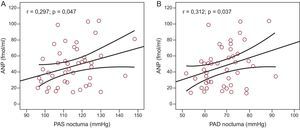
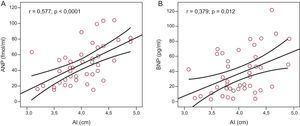
ResultadosSe incluyó en el estudio a un total de 48 pacientes (media de edad, 55±10 años; el 70,6% varones). La media de valores de presión arterial en sedestación en la consulta fue de 132,49±14,9/80,96±9,2mmHg. La media de presión arterial ambulatoria de 24 h sistólica y diastólica fue de 121,10±8,3/72,11±6,8mmHg (diurna, 126,8±9,7/77,58±7,9mmHg; nocturna, 114,56±11,6/68,6±8,8mmHg). Se observó una clara tendencia al aumento del tamaño auricular izquierdo con los valores más elevados de presión arterial ambulatoria, que alcanzaba significación estadística para los valores nocturnos (r=0,34; p=0,020 para la presión sistólica; r=0,51; p=0,0001 para la diastólica). Se observó una correlación significativa entre los valores de péptido natriurético auricular y la presión arterial nocturna sistólica (r=0,297; p=0,047) y diastólica (r=0,312; p=0,037). Se observaron también correlaciones significativas entre el tamaño auricular izquierdo y las cifras de péptido natriurético auricular (r=0,577; p<0,0001) y péptido natriurético cerebral (r=0,379; p=0,012).
ConclusionesLa presión arterial nocturna se asocia al tamaño auricular izquierdo y la liberación de péptidos natriuréticos en los pacientes normotensos con fibrilación auricular idiopática.
Palabras clave
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente en la población general y su prevalencia aumenta en proporción directa con el envejecimiento de la población1. Los datos recientes del estudio Val-FAAP2 (pacientes con FA en atención primaria), un estudio epidemiológico realizado en centros de atención primaria de España, indican una prevalencia de FA del 6,1% de los sujetos evaluados. Sin embargo, otros estudios llevados a cabo en la población general de España han mostrado una prevalencia de FA baja (2,3%) entre los sujetos de edad > 18 años3. En un 70-80% de los casos, el inicio de la FA se asocia a una cardiopatía estructural (valvular o isquémica) demostrable, hipertensión, diabetes mellitus o enfermedad tiroidea4. Un 20-25% de los casos que se producen en personas sin enfermedad orgánica aparente se define como fibrilación auricular idiopática o aislada (FAI)5. En estudios previos sólo se ha observado un aumento del diámetro anteroposterior de la aurícula izquierda en pacientes con FAI en comparación con la población general6; este trastorno podría actuar como sustrato anatómico que favoreciera la aparición de FAI7.
Los estudios epidemiológicos han puesto de manifiesto que la hipertensión es el factor de riesgo más importante que interviene en la aparición de FA8. Fomenta la aparición de alteraciones morfológicas y funcionales, como hipertrofia ventricular izquierda, remodelado concéntrico del ventrículo izquierdo, disfunción diastólica y aumento del diámetro auricular izquierdo9. En los últimos años se han identificado biomarcadores que están correlacionados con las lesiones estructurales cardiacas, como los péptidos natriuréticos auriculares (ANP) y los péptidos natriuréticos cerebrales (BNP), aunque sigue sin estar claro el mecanismo por el que se produce la elevación de estos péptidos natriuréticos en la hipertensión10. Algunos autores señalan que la elevación de los péptidos natriuréticos, específicamente el ANP, tiene relación con la presión arterial (PA) en sí más estrecha que con el remodelado ventricular secundario a la hipertensión11.
Estudios recientes indican que la activación del sistema renina-angiotensina-aldosterona (SRAA) desempeña un papel importante en el desarrollo de la FA a través de dos mecanismos principales: a) el fomento de la fibrosis miocárdica, principalmente auricular, con lo que actúa como sustrato anatómico potencialmente arritmogénico12, y b) la inducción de cambios estructurales como hipertrofia ventricular izquierda y crecimiento auricular, que también originan la activación neurohormonal involucrada en el desarrollo de la FAI13–15.
El objetivo de este estudio es verificar la hipótesis de que los valores de PA ambulatoria se asocian a anomalías estructurales cardiacas, como el crecimiento auricular, y con marcadores neurohormonales en sujetos normotensos con FAI.
MÉTODOSDiseño y población en estudioSe llevó a cabo un estudio transversal en una cohorte de pacientes con diagnóstico de FAI en el estudio GIRAFA (Grup Integrat de Recerca de Fibril·lació Auricular), en el Hospital Clínic de Barcelona (España), entre enero de 2001 y junio de 2005. La FAI se definió como un episodio sintomático de FA paroxística sin presencia de una cardiopatía estructural demostrable mediante ecocardiografía bidimensional ni otras causas secundarias de FA como un diagnóstico establecido de hipertensión, diabetes mellitus tipo 2, enfermedad pulmonar obstructiva crónica, hepatopatía crónica o enfermedad inflamatoria o infecciosa. Se excluyó a los pacientes con FA secundaria a drogadicción, hipoxemia, abuso de alcohol o enfermedad tiroidea. Se incluyó en el estudio a los pacientes consecutivos tras contacto telefónico y después de obtener su consentimiento informado por escrito. El protocolo fue aprobado por el comité etico del Hospital Clínic de Barcelona.
Determinación de la presión arterial clínica y ambulatoriaLos pacientes acudían al hospital un día laborable entre las 8.00 y las 10.00. La PA se determinó según lo establecido en la guía de la European Society of Hypertension y la Sociedad Europea de Cardiología de 200716. Después de 5 min de reposo, se obtuvieron tres lecturas de la PA en sedestación, separadas 2 min. Se excluyó del estudio a los pacientes con una media de PA > 140/90mmHg. La determinación/monitorización de la PA ambulatoria (MAPA) se realizó con un dispositivo Spacelabs 90207/90217 (Spacelabs® Inc.; Richmond, Washington, Estados Unidos), programando lecturas cada 20 min durante el periodo de 24 h tras haber hecho las recomendaciones habituales a los pacientes. Los periodos de actividad y reposo se determinaron individualmente según las horas de sueño y vigilia. Se registró la duración de la MAPA en horas, el porcentaje de lecturas válidas y la media de PA sistólica (PAS) y diastólica (PAD) durante los periodos de actividad y reposo, y durante todo el periodo de 24 h. Se excluyeron los registros de duración < 24 h, los que carecían de al menos una lectura por hora y los que tenían menos del 80% de lecturas satisfactorias. Según la definición de la guía de 2007 de la European Society of Hypertension y la Sociedad Europea de Cardiología para la MAPA de 24 h; se consideró normales los valores de PA < 130/80mmHg.
Determinaciones analíticasSe extrajeron muestras de sangre entre las 9.00 y las 11.00, con el paciente en decúbito supino y después de un periodo de reposo de 30-45 min. El BNP se determinó con un inmunoanálisis quimioluminométrico utilizando un analizador de inmunoquímica ADVIA Centaur (Siemens Healthcare Diagnostics; Tarrytown, Nueva York, Estados Unidos). La actividad de renina en plasma se determinó mediante radioinmunoanálisis (GammaCoat Plasma Renin Activity 125I RIA Kit, DiaSorin; Stillwater, Mississippi, Estados Unidos). La enzima de conversión de la angiotensina se determinó en suero con una prueba cinética (Bühlmann Laboratories AG; Schonembuch, Suiza). La aldosterona en plasma se determinó con un radioinmunoanálisis estándar (Coat-A-Count Aldosterone, Diagnostic and Products Corporation; Los Angeles, California, Estados Unidos). El ANP se determinó con la extracción de plasma utilizando cartuchos Cl8 Sep-Pack (Waters Associates; Milford, Massachusetts, Estados Unidos) y posteriormente se realizó un radioinmunoanálisis utilizando un kit comercial (Euro-Diagnostica B.V.; Arnhem, Países Bajos).
EcocardiografíaSe realizó una ecocardiografía transtorácica empleando dispositivos validados (Philips IE–33) y se digitalizaron las imágenes para un análisis posterior. Todas las mediciones se realizaron en modo M y bidimensional con los pacientes en ritmo sinusal, según lo recomendado por la American Society of Echocardiography17. Se determinó el tamaño de la aurícula izquierda utilizando las vistas anteroposterior (paraesternal), transversa (mediolateral) y longitudinal (inferosuperior). También se determinó el grosor de la pared posterior, el grosor del tabique interventricular y el diámetro telediastólico ventricular izquierdo en milímetros y la masa ventricular izquierda en gramos. Se calculó el índice de masa ventricular izquierda ajustado respecto al área de superficie corporal en g/m2 y el grosor relativo de la pared (ventricular) con la siguiente fórmula: grosor de la pared posterior×2/diámetro telediastólico ventricular izquierdo. La hipertrofia ventricular izquierda concéntrica se definió como índice de masa ventricular izquierda > 125g/m2 en los varones o > 110 g/m2 en las mujeres, con un grosor relativo de la pared (ventricular) > 0,45. El remodelado concéntrico se definió como el grosor relativo de la pared (ventricular) > 0,45 con un índice de masa ventricular izquierda normal14,15.
Análisis estadísticoLas características clínicas y las variables con distribución normal se expresan como media±desviación estándar. Las variables continuas se analizaron con la prueba de la t de Student y las variables discretas, con la prueba de la χ2. Se aplicaron las pruebas de Kolmogorov-Smirnov y de Shapiro–Wilk para determinar si las variables continuas tenían una distribución normal. Sólo el BNP mostró una distribución que no era normal (p=0,001). Se calcularon correlaciones simples con el coeficiente de correlación de Spearman.
Para analizar la relación entre las variables continuas, se utilizó un análisis multivariable de regresión lineal, mediante pasos secuenciales lineales con su intervalo de confianza del 95%. Se evaluó gráficamente el supuesto de linealidad. Se consideró estadísticamente significativo un valor de p < 0,05. Todos los análisis estadísticos se realizaron con el programa informático de estadística SPSS v11.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSDe la muestra inicial de 107 pacientes con FA paroxística incluidos en el estudio GIRAFA, sólo 60 pacientes aceptaron su inclusión en el presente estudio tras la llamada telefónica. Se excluyó a 3 a causa de un tratamiento concomitante con bloqueadores beta, 5 a causa de unos valores de PA > 130/80mmHg en la MAPA de 24 h y 4 a causa de lecturas de MAPA no válidas. Finalmente se incluyó en el análisis del estudio a 48 pacientes estrictamente normotensos que no habían recibido previamente ningún tratamiento con medicación antihipertensiva.
La media de edad de los pacientes era 55,41±10 años; el 70,6% eran varones. Ninguno de los pacientes había recibido tratamiento antihipertensivo previo; el 23,6% había recibido tratamiento antiarrítmico (el 16,7% recibía tratamiento con flecainida y el 5,6%, con amiodarona) y el 51,7% había recibido tratamiento antiagregante plaquetario (el 24% recibía ácido acetilsalicílico; el 3,5%, dipiridamol y el 24,1%, acenocumarol). La media de valores de PAS/PAD en la clínica fue de 132,45±14,9/80,96±9,20mmHg. Ninguno de los pacientes presentó una PA clínica persistentemente > 140/90mmHg. La media de valores de PAS/PAD ambulatoria de 24 h fue 121,10±8,3/72,11±6,8mmHg; la diurna, 126,8±9,7/77,58±7,9mmHg y la nocturna, 114,56±11,6/68,6±8,8mmHg.
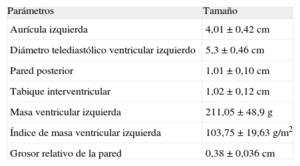
En la tabla 1 se muestran los principales datos ecocardiográficos. El único valor destacable es el tamaño auricular izquierdo, que estaba en la parte alta de la franja normal, con un diámetro medio de 4±0,42cm.
Parámetros ecocardiográficos
| Parámetros | Tamaño |
| Aurícula izquierda | 4,01±0,42 cm |
| Diámetro telediastólico ventricular izquierdo | 5,3±0,46 cm |
| Pared posterior | 1,01±0,10 cm |
| Tabique interventricular | 1,02±0,12 cm |
| Masa ventricular izquierda | 211,05±48,9 g |
| Índice de masa ventricular izquierda | 103,75±19,63 g/m2 |
| Grosor relativo de la pared | 0,38±0,036 cm |
Los datos se expresan en forma de media±desviación estándar.
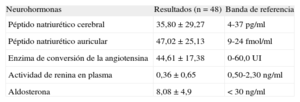
En la tabla 2 se muestran las medias±desviación estándar de ANP, BNP, enzima de conversión de la angiotensina, renina en plasma y aldosterona en plasma y los valores de referencia aplicables. Los valores de BNP estaban en el límite superior de la normalidad, y la media de ANP fue 2 veces mayor que el intervalo de referencia.
Determinaciones neurohormonales
| Neurohormonas | Resultados (n=48) | Banda de referencia |
| Péptido natriurético cerebral | 35,80±29,27 | 4-37 pg/ml |
| Péptido natriurético auricular | 47,02±25,13 | 9-24 fmol/ml |
| Enzima de conversión de la angiotensina | 44,61±17,38 | 0-60,0 UI |
| Actividad de renina en plasma | 0,36±0,65 | 0,50-2,30 ng/ml |
| Aldosterona | 8,08±4,9 | < 30 ng/ml |
Los datos se expresan en forma de media±desviación estándar.
Hubo una clara tendencia a mayor tamaño auricular izquierdo en los pacientes con valores más altos de MAPA de 24 h (r=0,24; p=0,11), y se observó una asociación significativa entre el tamaño de la aurícula izquierda y la PAS ambulatoria nocturna (r=0,34; p=0,020) (fig. 1A) y la PAD ambulatoria nocturna (r=0,51; p=0,0001) (fig. 1B). Hubo correlación significativa entre los valores plasmáticos de ANP y la PAS ambulatoria nocturna (r=0,297; p=0,047) (fig. 2A) y la PAD ambulatoria nocturna (r=0,312; p=0,037) (fig. 2B). No se observó correlación alguna entre las cifras de ANP y la PA diurna ni entre los valores de PA ambulatoria y los de BNP o aldosterona.
Relación entre la presión arterial sistólica ambulatoria nocturna (A) y la presión arterial diastólica ambulatoria nocturna (B), y los valores de péptido natriurético auricular; n=46. ANP: péptido natriurético auricular; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Hubo correlación estadísticamente significativa entre el tamaño de la aurícula izquierda y los valores de ANP (r=0,577; p<0,0001) (fig. 3A) y los de BNP (r=0,379; p=0,012) (fig. 3B). No hubo correlación alguna entre los valores de los marcadores neurohormonales y otros parámetros ecocardiográficos analizados, excepto por el grosor del tabique interventricular y las concentraciones plasmáticas de aldosterona.
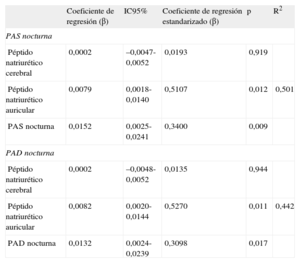
El análisis de regresión múltiple mostró que, por cada centímetro de aumento del tamaño de la aurícula izquierda, la PAS nocturna aumentaba en 15 mmHg (p=0,009) y la PAD nocturna aumentaba en 13 mmHg (p=0,017), independientemente de los marcadores neurohormonales (tabla 3).
Análisis de regresión múltiple con el tamaño de la aurícula izquierda como variable dependiente para presión arterial sistólica nocturna y presión arterial diastólica nocturna
| Coeficiente de regresión (β) | IC95% | Coeficiente de regresión estandarizado (β) | p | R2 | |
| PAS nocturna | |||||
| Péptido natriurético cerebral | 0,0002 | –0,0047-0,0052 | 0,0193 | 0,919 | |
| Péptido natriurético auricular | 0,0079 | 0,0018-0,0140 | 0,5107 | 0,012 | 0,501 |
| PAS nocturna | 0,0152 | 0,0025-0,0241 | 0,3400 | 0,009 | |
| PAD nocturna | |||||
| Péptido natriurético cerebral | 0,0002 | –0,0048-0,0052 | 0,0135 | 0,944 | |
| Péptido natriurético auricular | 0,0082 | 0,0020-0,0144 | 0,5270 | 0,011 | 0,442 |
| PAD nocturna | 0,0132 | 0,0024-0,0239 | 0,3098 | 0,017 | |
IC95%: intervalo de confianza del 95%; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
El hallazgo principal de este estudio es que, en los normotensos nunca tratados con antihipertensivos que sufrían FAI, la PA ambulatoria nocturna estaba directamente asociada al tamaño de la pared auricular izquierda y los valores plasmáticos de ANP y BNP.
Los estudios epidemiológicos han demostrado que la hipertensión se asocia a un aumento del riesgo de FA. La PA elevada induce alteraciones estructurales y funcionales, principalmente en forma de crecimiento auricular izquierdo7. En consecuencia, el tamaño de la aurícula izquierda es un reconocido factor de riesgo de FA e ictus18. Los estudios realizados indican que hay relación lineal entre la PA determinada en la clínica y el tamaño de la aurícula izquierda19, aunque los datos publicados sobre los valores de PA ambulatoria son escasos, sobre todo respecto a normotensos. La evidencia existente hasta la fecha indica que los pacientes con hipertensión esencial tienen un volumen auricular mayor que los normotensos y que estas diferencias parecen ser más intensas en los pacientes sin una reducción de la PA nocturna, el denominado patrón circadiano sin depresión (non-dipper)20. Nuestros resultados concuerdan con los de Cuspidi et al21, que observaron una correlación, moderada pero significativa, entre el tamaño de la aurícula izquierda y los valores de PA ambulatoria nocturna de los hipertensos.
En los últimos años se han obtenido muchas evidencias de que una disminución en la reducción fisiológica de la PA nocturna se asocia a un aumento de las lesiones de órganos subclínicas22 y complicaciones cardiovasculares. En consecuencia, se considera a la PA nocturna el mejor factor predictivo de eventos cardiovasculares e independiente de los valores de la PA ambulatoria diurna y del patrón circadiano dipper/non-dipper23,24. La PA nocturna, y no la PA determinada en consulta, es lo que desempeña un papel más importante en el remodelado y el crecimiento de la aurícula izquierda, posiblemente a causa de la activación del SRAA. Algunos autores señalan que la activación del SRAA induce una serie de cambios eléctricos y estructurales en la aurícula izquierda que actúan como sustrato anatómico que favorece la aparición de FA13,14. Los estudios realizados han puesto de manifiesto que la angiotensina II interviene en la regulación de la proliferación miocardiocitaria y el depósito de colágeno25 en la matriz intersticial. En consecuencia, la activación del SRAA puede actuar como promotor del crecimiento y la fibrosis tisular en el miocardio. Los estudios existentes señalan que la fibrosis auricular puede ser arritmogénica y facilitar los estímulos de reentrada en la aurícula13, lo cual comportaría una predisposición del individuo a la FAI. Las alteraciones estructurales inducidas por la activación del SRAA, junto con las alteraciones anatómicas secundarias a la potente vasoconstricción arterial inducida por la acción de la angiotensina II (como hipertrofia ventricular y crecimiento auricular izquierdo), pueden conducir una aurícula izquierda dilatada y potencialmente arritmogénica en un paciente aparentemente normotenso. Sin embargo, la activación del SRAA en pacientes normotensos, como los de nuestro estudio, es muy baja; no se han observado aumentos significativos de angiotensina II, actividad de renina en plasma o aldosterona. El diseño de nuestro estudio no permite responder a la cuestión relevante de qué va primero, la elevación de la PA (incluso dentro de la normalidad) o la activación del SRAA, aunque esta última sería una explicación más lógica.
En los últimos años, se han producido avances en la búsqueda de biomarcadores de enfermedad cardiovascular con un valor predictivo elevado, como los péptidos natriuréticos cardiacos (BNP y ANP). En estudios previos se ha demostrado que los péptidos vasoactivos están aumentados en los pacientes con hipertensión, aunque los resultados existentes son contradictorios. Por un lado, se propone que cifras altas en la MAPA se asocian a las BNP y ANP más estrechamente que los valores de PA determinada en la clínica26. Además, estudios recientes han puesto de manifiesto que las elevaciones de los péptidos vasoactivos están más estrechamente relacionadas con la PA que con el crecimiento de la masa miocárdica en sí. En estos estudios se ha observado una correlación significativa entre cifras de PAS y ANP (r=0,34; p=0,05)11. Nosotros observamos una correlación directa significativa de la PA nocturna y los valores plasmáticos de ANP tanto con la PAS (r=0,297; p=0,047) como con la PAD (r=0,31; p=0,037). Estos resultados respaldan lo indicado por el estudio de Jensen et al27, que observaron que el patrón circadiano non-dipper se asociaba a un aumento de la liberación de hormonas vasoactivas.
LimitacionesEl estudio tiene algunas limitaciones; la más importante es indudablemente el reducido tamaño muestral. Además, un grupo control podría haber aumentado la solidez de nuestros resultados. Serán necesarios futuros estudios controlados más amplios para confirmar nuestros resultados.
CONCLUSIONESLos resultados de este estudio confirman la importancia de los valores de la PA nocturna, que —pese a estar en el intervalo normal— muestran asociación directa con el tamaño de la pared auricular izquierda y la liberación de ANP y BNP en los pacientes con FAI.
CONFLICTO DE INTERESESNinguno.