La disfunción sistólica subclínica es uno de los mecanismos propuestos para el aumento del riesgo cardiovascular asociado con el síndrome metabólico (SM). Este estudio investigó la asociación entre SM y deterioro del strain longitudinal global (SLG) del ventrículo izquierdo y el papel de cada criterio de SM en esta asociación.
MétodosSe analizó una muestra aleatoria del Estudo Longitudinal da Saúde do Adulto (ELSA-Brasil) después de excluir a aquellos con cardiopatía prevalente.
ResultadosDe los 1.055 participantes que cumplían los criterios de inclusión (el 53% mujeres; edad, 52±9 años), 444 (42%) reunían criterios de SM. Aquellos con SM presentaron un SLG más reducido (–18,0±2,5%) que aquellos sin SM (–19,0±2,4%; p <0,0001). En los modelos de regresión lineal múltiple, el SM se asoció con SLG más reducido después de ajustar por varios factores de riesgo (diferencia de SLG, 0,86%; p <0,0001), incluso después de incluir el índice de masa corporal. Las TP ajustadas para los participantes con SLG reducido evaluados con 3 puntos de corte (1, 1,5 y 2 desviaciones estándar) fueron más altas entre aquellos con SM que sin este: SLG –16,1% (TP=1,76; IC95%, 1,30-2,39); SLG –14,8% (TP=2,35; IC95%, 1,45-3,81), y SLG –13,5% (TP=2,07; IC95%, 0,97-4,41). Después de incluir el índice de masa corporal en los modelos, estas asociaciones se atenuaron; lo que indica que la obesidad puede mediar, al menos en parte, estas asociaciones. En los análisis de regresión cuantílica, la circunferencia de cintura aumentada fue el único componente del SM que se halló independientemente asociado con el SLG a lo largo de todo el rango de valores.
ConclusionesEl SM se asocia de manera independiente con alteración del SLG. Entre los criterios de SM, la obesidad central describe mejor la relación entre el trastorno metabólico y la función cardiaca.
Palabras clave
Con las proporciones epidémicas que están alcanzando el sobrepeso y la obesidad1, cada vez más los efectos metabólicos adversos se asocian con los riesgos de morbilidad y mortalidad cardiovasculares2,3. El síndrome metabólico (SM), una agrupación de factores de riesgo cardiovascular que incluye obesidad abdominal, elevación de la presión arterial, intolerancia a la glucosa, resistencia a la insulina, elevación de triglicéridos y concentraciones bajas de colesterol unido a lipoproteínas de alta densidad4, afecta a alrededor del 25% de la población adulta y aumenta los riesgos de insuficiencia cardiaca5, incremento de la grasa epicárdica6, diabetes, infarto de miocardio, ictus y muerte3,7.
El SM se ha asociado con la disfunción sistólica y diastólica identificadas mediante imágenes de Doppler tisular8,9; sin embargo, la fracción de eyección, que es el parámetro más ampliamente utilizado para la evaluación de la función sistólica, tiene escasa sensibilidad para evaluar la disfunción incipiente de la contractilidad miocárdica10. Las nuevas técnicas ecocardiográficas como el strain (deformación) longitudinal global (SLG) determinado en la ecocardiografía por speckle-tracking bidimensional (2D-STE) permiten evaluar la disfunción ventricular izquierda subclínica mediante una determinación cuantitativa de la deformación miocárdica11, si bien el valor de corte del SLG adecuado para definir la disfunción ventricular izquierda subclínica no se ha establecido aún12.
Dadas la importante epidemia de obesidad y SM asociado y la escasez de estudios que hayan examinado la repercusión de los componentes del SM en la disfunción miocárdica13, el objetivo de este estudio es investigar la asociación del SM y sus componentes con el deterioro del SLG del ventrículo izquierdo, utilizando diferentes valores de corte de SLG, en adultos de mediana edad y sin una cardiopatía prevalente que participaron en el estudio Brazilian Longitudinal Study of Adult Health (ELSA-Brasil).
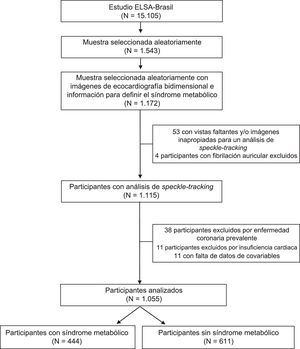
MÉTODOSPoblación del estudioEl ELSA-Brasil es un estudio de una cohorte de 15.105 varones y mujeres, funcionarios civiles de universidades o centros de investigación situados en 6 estados de Brasil (la evaluación inicial se realizó entre agosto de 2008 y diciembre de 2010). Se consideró aptos para el estudio a todos los empleados en activo o jubilados de entre 35 y 74 años de edad. La información detallada del estudio se ha presentado ya en otra publicación14,15. El estudio ELSA-Brasil fue aprobado por los comités de investigación y ética de los diversos centros y todos los participantes dieron su consentimiento informado por escrito. En este estudio se investigó una muestra aleatoria predefinida de participantes elegidos prospectivamente para los estudios complementarios. Incluimos a 1.172 participantes a los que se realizó una ecocardiografía con análisis 2D-STE y se evaluaron todos los componentes del SM. Tras las exclusiones debidas a imágenes de ecocardiografía no disponibles o no apropiadas para la 2D-STE, fibrilación auricular, enfermedad coronaria o insuficiencia cardiaca diagnosticadas clínicamente, o falta de datos de covariables, formaron la muestra final 1.055 participantes (figura 1).
Evaluación de los factores de riesgo cardiovascular y definición del síndrome metabólicoLos participantes respondieron a un conjunto completo de cuestionarios estandarizados sobre sus antecedentes patológicos, en los que se registraba el uso de medicación y los diagnósticos clínicos previos. Se obtuvieron datos antropométricos, de presión arterial y de análisis de laboratorio, que se analizaron siguiendo protocolos estandarizados14. El SM se definió según los criterios de la Joint Interim Statement16. Se consideró que tenían SM los participantes con al menos 3 de los siguientes criterios: a) concentración plasmática de glucosa en ayunas ≥ 100 mg/dl (5,5 mmol/l) o uso de fármacos para la hiperglucemia; b) concentraciones elevadas de triglicéridos ≥ 150 mg/dl (1,7 mmol/l) o tratamiento específico para esta anomalía lipídica; c) concentraciones bajas de colesterol unido a lipoproteínas de alta densidad < 40 mg/dl (1,0 mmol/l) en los varones y < 50 mg/dl (1,3 mmol/l) en las mujeres o tratamiento específico para esta anomalía lipídica; d) obesidad abdominal según la definición original europea (perímetro de cintura ≥ 94cm los varones y ≥ 80cm las mujeres), y e) presión arterial ≥ 130/85mmHg o tratamiento para la hipertensión.
Ecocardiografía bidimensionalCardiólogos adecuadamente preparados realizaron todas las ecocardiografías siguiendo las recomendaciones de las sociedades de cardiología europea y norteamericana17,18. Todas las exploraciones se llevaron a cabo con un equipo idéntico (Aplio XG, Toshiba Corporation; Toshigi, Japón) con un transductor de sectores de 2,5 MHz. Se seleccionaron secuencias de 3 latidos cardiacos consecutivos en cada una de las ventanas de ecocardiografía y se registraron en formato digital para transferirlas al centro de interpretación de ecocardiografía del estudio ELSA-Brasil, junto con un formulario de adquisición de imagen en el que constaba la calidad de la imagen y la evaluación preliminar de los resultados. La determinación de los parámetros ecocardiográficos estándares de todas las exploraciones se realizó con enmascaramiento, según un protocolo preespecificado, en una estación de trabajo dedicada (ComPACS Review Station 10.5, Medimatic Solutions Srl; Italia)14.
Strain (deformación) longitudinal global del ventrículo izquierdoLa evaluación cuantitativa de la deformación miocárdica se realizó según los métodos y las guías actuales para la STE11,18, utilizando un programa informático comercial (2D Cardiac Performance Analysis, TomTec-Arena 1.2 Imaging Systems; Unterschleißheim, Alemania). Para el análisis, los bordes endocárdicos se trazaron en el fotograma telediastólico en las proyecciones apicales bicameral y tetracameral. La fase telediastólica se determinó mediante el complejo QRS o con el fotograma siguiente al cierre de la válvula mitral. El programa informático de la 2D-STE rastrea los patrones de deformación (speckle-tracking) a lo largo del borde endocárdico durante todo el ciclo cardiaco. A continuación, se midió y se calculó automáticamente el SLG (en 6 segmentos de cada proyección) y los resultados se presentan mediante el acortamiento proporcional medio máximo en porcentaje. Se evaluó la reproducibilidad de las mediciones del SLG en una muestra de 50 participantes elegidos aleatoriamente. Los coeficientes de variación interobservadores e intraobservador fueron del 5,4 y el 7,4%, y los coeficientes de correlación intraclase fueron de 0,86 (intervalo de confianza del 95% [IC95%], 0,77-0,92) y 0,76 (IC95%, 0,61-0,86).
Análisis estadísticoLos datos se presentan en forma de media±desviación estándar para las variables continuas y mediante el número total y la proporción para las variables discretas. Se utilizó la prueba de la t de Student para evaluar las diferencias entre los grupos estudiados en cuanto a las variables continuas, mientras que para el análisis de las variables discretas se usaron la prueba de Fisher y la prueba de la χ2. Se utilizó un análisis de regresión lineal múltiple para el ajuste de los posibles factores de confusión en la relación entre el SM y el SLG. La asociación entre el SM y el deterioro del SLG definido como variable discreta se evaluó con una regresión de Poisson robusta19, utilizando 3 valores de corte propuestos para el SLG12. Teniendo en cuenta la incertidumbre existente acerca del umbral de SLG más apropiado, se investigaron también las asociaciones no lineales del SM y de sus componentes aplicando diferentes umbrales de SLG (variable dependiente) mediante análisis de regresión por cuantiles20. Se estimaron las diferencias en el strain (en unidades porcentuales de SLG) relacionadas con la presencia de los componentes del SM en todo el intervalo de valores de la distribución del SLG (cuantiles 5 a 95). Se ajustaron modelos multivariables para las covariables clínicamente relevantes identificadas en la literatura, eliminando de todos los modelos de regresión las variables que no modificaban la asociación entre el SM y el SLG. Todas las pruebas fueron bilaterales y se consideraron estadísticamente significativos los valores de p < 0,05. Los análisis estadísticos se realizaron con el programa SAS 9.4 (SAS Institute, Inc.; Cary, North Carolina, Estados Unidos).
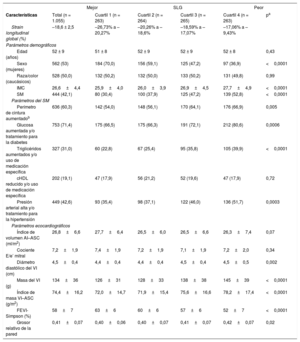
RESULTADOSDel total de 1.055 participantes de nuestra muestra de análisis (el 53% mujeres; edad, 52±9 años), 444 (42%) cumplían los criterios diagnósticos del SM. Las características clínicas y demográficas de todos los participantes según los cuartiles de SLG se muestran en la tabla 1. Un peor SLG (valores menos negativos) se asoció con mayor prevalencia del SM y sus componentes, excepto por el valor bajo de colesterol unido a lipoproteínas de alta densidad (todos los demás, p < 0,001). Las características sociodemográficas iniciales observadas en los datos de esta muestra aleatoria fueron similares las publicadas del perfil de la cohorte total del estudio ELSA-Brasil y se presentan en la tabla 1 del material suplementario.
Características clínicas y demográficas de los participantes según los cuartiles de SLG. Muestra aleatoria de la cohorte del estudio ELSA-Brasil (2008-2012) (n = 1.055)
| Mejor | SLG | Peor | ||||
|---|---|---|---|---|---|---|
| Características | Total (n = 1.055) | Cuartil 1 (n = 263) | Cuartil 2 (n = 264) | Cuartil 3 (n = 265) | Cuartil 4 (n = 263) | pa |
| Strain longitudinal global (%) | –18,6 ± 2,5 | –26,73% a –20,27% | –20,26% a –18,6% | –18,59% a –17,07% | –17,06% a –9,43% | |
| Parámetros demográficos | ||||||
| Edad (años) | 52 ± 9 | 51 ± 8 | 52 ± 9 | 52 ± 9 | 52 ± 8 | 0,43 |
| Sexo (mujeres) | 562 (53) | 184 (70,0) | 156 (59,1) | 125 (47,2) | 97 (36,9) | <0,0001 |
| Raza/color (caucásicos) | 528 (50,0) | 132 (50,2) | 132 (50,0) | 133 (50,2) | 131 (49,8) | 0,99 |
| IMC | 26,6±4,4 | 25,9±4,0 | 26,0±3,9 | 26,9±4,5 | 27,7±4,9 | <0,0001 |
| SM | 444 (42,1) | 80 (30,4) | 100 (37,9) | 125 (47,2) | 139 (52,8) | <0,0001 |
| Parámetros del SM | ||||||
| Perímetro de cintura aumentadob | 636 (60,3) | 142 (54,0) | 148 (56,1) | 170 (64,1) | 176 (66,9) | 0,005 |
| Glucosa aumentada y/o tratamiento para la diabetes | 753 (71,4) | 175 (66,5) | 175 (66,3) | 191 (72,1) | 212 (80,6) | 0,0006 |
| Triglicéridos aumentados y/o uso de medicación específica | 327 (31,0) | 60 (22,8) | 67 (25,4) | 95 (35,8) | 105 (39,9) | <0,0001 |
| cHDL reducido y/o uso de medicación específica | 202 (19,1) | 47 (17,9) | 56 (21,2) | 52 (19,6) | 47 (17,9) | 0,72 |
| Presión arterial alta y/o tratamiento para la hipertensión | 449 (42,6) | 93 (35,4) | 98 (37,1) | 122 (46,0) | 136 (51,7) | 0,0003 |
| Parámetros ecocardiográficos | ||||||
| Índice de volumen AI–ASC (ml/m2) | 26,8±6,6 | 27,7±6,4 | 26,5±6,0 | 26,5±6,6 | 26,3±7,4 | 0,07 |
| Cociente E/e’ mitral | 7,2±1,9 | 7,4±1,9 | 7,2±1,9 | 7,1±1,9 | 7,2±2,0 | 0,34 |
| Diámetro diastólico del VI (cm) | 4,5±0,4 | 4,4±0,4 | 4,4±0,4 | 4,5±0,4 | 4,5±0,5 | 0,002 |
| Masa del VI (g) | 134±36 | 126±31 | 128±33 | 138±38 | 145±39 | <0,0001 |
| Índice de masa VI–ASC (g/m2) | 74,4±16,2 | 72,0±14,7 | 71,9±15,4 | 75,6±16,6 | 78,2±17,4 | <0,0001 |
| FEVI-Simpson (%) | 58±7 | 63±6 | 60±6 | 57±6 | 52±7 | <0,0001 |
| Grosor relativo de la pared | 0,41±0,07 | 0,40±0,06 | 0,40±0,07 | 0,41±0,07 | 0,42±0,07 | 0,02 |
AI: aurícula izquierda; ASC: área de superficie corporal; cHDL: colesterol unido a lipoproteínas de alta densidad; FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal; SLG: strain longitudinal global; SM: síndrome metabólico; VI: ventrículo izquierdo.
Los valores expresan media±desviación estándar o n (%).
En el total de la muestra, la media de SLG fue del –18,6%±2,5%. Los individuos con SM presentaron peor función sistólica ventricular izquierda medida con el SLG (–18,0% ± 2,5%) que los participantes sin SM (–19,0%±2,4%; p < 0,0001). En el análisis de regresión lineal múltiple (tabla 2), la presencia de SM se asoció con una reducción absoluta del SLG de 0,86 (SLG en unidades porcentuales; p < 0,0001) tras un ajuste por edad, sexo, raza/color, nivel de estudios y centro de estudio. Este deterioro absoluto del SLG con el SM se atenuaba hasta un 0,60 (SLG en unidades porcentuales) tras un ajuste por el índice de masa corporal, pero continuaba mostrando alta significación estadística (p = 0,0005).
Empeoramiento del SLG (unidades porcentuales) en términos absolutos, sin ajustar y ajustados, en relación con la presencia del síndrome metabólico. Muestra aleatoria de la cohorte del estudio ELSA-Brasil (2008-2012) (n = 1.055)
| Empeoramiento del SLG | ||
|---|---|---|
| Unidades porcentuales de SLG (EE) | p | |
| Modelo 1 | 0,99 (0,15) | <0,0001 |
| Modelo 2 | 0,86 (0,15) | <0,0001 |
| Modelo 3 | 0,60 (0,17) | 0,0005 |
EE: error estándar; SLG: strain longitudinal global.
Ajustado mediante regresión lineal múltiple para lo siguiente:
Modelo 1: bruto. R2, 4%.
Modelo 2: modelo 1 + sexo, edad (años), raza/color, nivel de estudios, centro del estudio ELSA-Brasil. R2, 13%.
Modelo 3: modelo 2 + índice de masa corporal. R2, 14%.
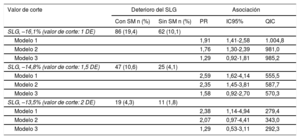
De manera análoga, se observó una prevalencia de aproximadamente el doble de disfunción sistólica subclínica en los participantes con SM (tabla 3, modelo 2), lo cual corresponde a unos cocientes de prevalencia (PR) ajustados superiores para el deterioro del SLG según la estimación realizada con una regresión de Poisson robusta. Con el empleo de valores de corte progresivamente más estrictos para el SLG (1, 1,5 y 2 desviaciones estándares [DE]), las asociaciones fueron las siguientes: para un SLG del –16,1%, PR = 1,76 (IC95%, 1,30-2,39); para un SLG del –14,8%, PR = 2,35 (IC95%, 1,45-3,81), y para un SLG del –13,5%, PR = 2,07 (IC95%, 0,97-4,41) como valores de corte. Tras incluir el índice de masa corporal en el modelo, las asociaciones se atenuaron y dejaron de ser estadísticamente significativas (tabla 3).
Cocientes de prevalencia sin ajustar y ajustados para la asociación del síndrome metabólico con el deterioro del SLG definido mediante diversos valores de corte. Muestra aleatoria de la cohorte del estudio ELSA-Brasil (2008-2012) (n = 1.055)
| Valor de corte | Deterioro del SLG | Asociación | |||
|---|---|---|---|---|---|
| Con SM n (%) | Sin SM n (%) | PR | IC95% | QIC | |
| SLG, –16,1% (valor de corte: 1 DE) | 86 (19,4) | 62 (10,1) | |||
| Modelo 1 | 1,91 | 1,41-2,58 | 1.004,8 | ||
| Modelo 2 | 1,76 | 1,30-2,39 | 981,0 | ||
| Modelo 3 | 1,29 | 0,92-1,81 | 985,2 | ||
| SLG, –14,8% (valor de corte: 1,5 DE) | 47 (10,6) | 25 (4,1) | |||
| Modelo 1 | 2,59 | 1,62-4,14 | 555,5 | ||
| Modelo 2 | 2,35 | 1,45-3,81 | 587,7 | ||
| Modelo 3 | 1,58 | 0,92-2,70 | 570,3 | ||
| SLG, –13,5% (valor de corte: 2 DE) | 19 (4,3) | 11 (1,8) | |||
| Modelo 1 | 2,38 | 1,14-4,94 | 279,4 | ||
| Modelo 2 | 2,07 | 0,97-4,41 | 343,0 | ||
| Modelo 3 | 1,29 | 0,53-3,11 | 292,3 | ||
DE: desviación estándar; IC95%: intervalo de confianza del 95%; PR: cociente de prevalencia; QIC: cuasiprobabilidad según el criterio de modelo de independencia; SLG: strain longitudinal global; SM: síndrome metabólico.
Modelo 1: SM.
Modelo 2: modelo 1 + sexo, edad (años), raza/color, nivel de estudios, centro del estudio ELSA-Brasil.
Modelo 3: modelo 2 + índice de masa corporal.
En la figura 2 se muestran las diferencias en la regresión por cuantiles en el strain (en unidades porcentuales de SLG) entre los participantes con y sin SM o con sus componentes, dentro de todo el intervalo de valores de la distribución del SLG (cuantiles 5 a 95), al introducir un ajuste por edad, sexo, raza/color, nivel de estudios y centro de estudio, y en los análisis de cada uno de los componentes, también para los restantes criterios del SM. Se observó una diferencia significativa del strain en los participantes con SM, que parecía aumentar con el empeoramiento del SLG (figura 2). De entre los diversos componentes del SM, tan solo la elevación del perímetro de cintura se asoció con peor SLG. Como en los demás análisis, estas asociaciones se atenuaban principalmente al incluir en los modelos el índice de masa corporal (tabla 2 del material suplementario).
Diferencias del SLG (en unidades porcentuales de SLG e intervalos de confianza del 95%) en la regresión por cuantiles ajustada, en relación con la presencia del síndrome metabólico o sus componentes entre los cuantiles 5 y 95 del SLG. Con ajuste por sexo, edad (años), raza/color, nivel de estudios y centro del estudio ELSA-Brasil y, en el análisis de los diversos componentes individuales del síndrome metabólico, también para los demás componentes de este síndrome. cHDL: colesterol unido a lipoproteínas de alta densidad; SLG: strain longitudinal global.
Las variables incluidas en la investigación inicial y eliminadas de todos los modelos de regresión finales, puesto que no modificaban la asociación entre el SM y el SLG, fueron la frecuencia cardiaca, la masa del ventrículo izquierdo, el cociente E/e’ mitral, y el diámetro diastólico y la fracción de eyección del ventrículo izquierdo. A pesar de ello, se investigó también el papel de la fracción de eyección como posible factor de confusión en la asociación entre el SM y el SLG. En la regresión lineal, al añadir al modelo la fracción de eyección del ventrículo izquierdo en la 2D-STE, la asociación continuó siendo estadísticamente significativa (diferencia de SLG, 0,62%; p < 0,0001). La fracción de eyección afectaba solo mínimamente a la magnitud y la significación de la asociación entre el SM y el SLG en la regresión de Poisson robusta, con los mismos valores de corte del SLG utilizados en 3 modelos distintos: 1 DE, PR = 1,49 (IC95%, 1,12-1,97); 1,5 DE, PR = 1,95 (IC95%, 1,25-3,02), y 2 DE, PR = 1,66 (IC95%, 0,85-3,23).
DISCUSIÓNEn este estudio de una cohorte multicéntrica de individuos de mediana edad, que constituye una de las muestras de SM de individuos no remitidos a consulta más grandes publicadas, se investigó la asociación del SM y sus componentes con el SLG, un indicador de la disfunción sistólica subclínica. Los participantes con SM (42%) presentaron peor función sistólica del ventrículo izquierdo, según las evaluaciones realizadas con diferentes parámetros del SLG, que los pacientes sin SM. Los participantes con SM tuvieron una prevalencia de disfunción sistólica subclínica de aproximadamente el doble según las evaluaciones realizadas con diferentes valores de corte de SLG. El SM mostró una asociación independiente con el deterioro del SLG. Tras la inclusión en los modelos del índice de masa corporal, las asociaciones se redujeron en cierta medida, lo cual indica que estas se explican, como mínimo en parte, por la obesidad. Además, en el análisis de los diversos componentes individuales del SM, el perímetro de cintura aumentado fue el único componente que mantuvo una asociación independiente con el deterioro del SLG.
En 2009, las principales organizaciones de salud propusieron unos criterios de consenso para el diagnóstico clínico del SM16. Sin embargo, tal como se ha evidenciado, los diferentes componentes muestran asociaciones distintas con el SLG13. Así pues, tal vez tenga más sentido identificar la asociación del deterioro del SLG con los componentes del SM que con la definición más compleja de este21–25.
Anteriormente se han demostrado asociaciones del SM con la disfunción miocárdica en muestras más pequeñas empleando ecocardiografía convencional, imágenes de Doppler tisular8,9 y la STE13. Sin embargo, son pocos los estudios realizados con 2D-STE en los que se ha examinado qué componentes del SM muestran una asociación independiente con el deterioro de la función sistólica. En estudios previos se ha demostrado la influencia desfavorable de diferentes factores de riesgo de SM en la deformación del ventrículo izquierdo, entre ellos la hipertensión22, la diabetes23, la obesidad24 y la dislipemia25.
Además, algunas investigaciones han puesto de manifiesto asociaciones más intensas entre los componentes del SM y la disfunción miocárdica con el número creciente de factores de riesgo de SM. Tadic et al.26 observaron que un número creciente de criterios de SM se asocian con la disfunción diastólica cardiaca. En el Multiethnic Study of Atherosclerosis27, el perímetro de cintura y la glucosa en ayunas mostraron una asociación significativa con el deterioro del strain circular y longitudinal del ventrículo izquierdo respectivamente. Este estudio puso de manifiesto que el SLG pasaba del –14,2% en los participantes con ≤ 1 componente del SM al –13,4% en los participantes con 2 y al –12,1% en los que tenían ≥ 3 criterios de SM (p < 0,01). Recientemente, Tadic et al.28 y Wang et al.29 han observado que, de entre los componentes del SM, la presión arterial, el perímetro de la cintura y la glucosa plasmática en ayunas fueron los que mostraron una asociación más estrecha con los índices de deformación del ventrículo izquierdo. Se ha involucrado a la obesidad y los factores de riesgo cardiometabólicos en disfunciones miocárdicas como la disfunción coronaria y la miocardiopatía diabética30,31. No obstante, los mecanismos que contribuyen a producir estos cambios no se conocen por completo, y se cree que son consecuencia de una interrelación compleja de factores hemodinámicos y neurohumorales, así como de la inflamación y del estrés oxidativo, que contribuyen a causar la apoptosis celular, la hipertrofia y la fibrosis intersticial30–32.
La 2D-STE ha surgido como técnica más robusta para la detección de la disfunción ventricular izquierda subclínica mediante una determinación cuantitativa de la deformación del miocardio11. Esta técnica tiene las ventajas de ser independiente del ángulo y menos dependiente de las condiciones de carga y la geometría que los parámetros tradicionales. Además, permite un posprocesado de las imágenes ordinarias adquiridas en 2 dimensiones, lo cual hace que sea muy factible reproducir el examen de un componente principal de la función regional del miocardio. El uso de la 2D-STE se está difundiendo ampliamente, gracias al desarrollo tecnológico y su inclusión en la mayoría de los sistemas de ecocardiografía comercializados. Aunque preocupa la estandarización del programa informático de speckle-tracking11,33, la distribución de los valores de SLG en nuestro estudio fue similar a la observada en un reciente metanálisis12, al igual que lo fue su variabilidad en las mediciones34, lo cual respalda la calidad de nuestros datos.
Limitaciones y puntos fuertesPara superar la limitación que supone la actual incertidumbre sobre qué valor de corte del SLG es el más apropiado para definir la disfunción sistólica del ventrículo izquierdo subclínica, se exploró la asociación del SM con 3 valores de corte de SLG diferentes. Nuestros resultados ponen de manifiesto una gran prevalencia de deterioro del SLG en los participantes con SM (19,3%), en comparación con el resto de la muestra (10,1%), utilizando el valor de corte menos conservador de 1 DE. Esta prevalencia superior se daba de manera independiente tras introducir un ajuste por las covariables relevantes, con la excepción del índice de masa corporal. Tal como se preveía, la prevalencia fue inferior cuando se utilizaron valores de corte menos estrictos, pero las asociaciones fueron, en general, similares. El valor de corte de 1,5 DE está más próximo a una «reducción porcentual relativa del 15% en el SLG», que muchos expertos han considerado recientemente un valor de corte pertinente para definir la cardiotoxicidad35. La ausencia de significación estadística del deterioro del SLG definido mediante categorías descritas con el valor de corte de 2 DE puede ser consecuencia de que hubiera muy pocos participantes con valores que alcanzaran este nivel de alteración. Es de destacar que las asociaciones entre el SM y sus componentes se dieron empleando diferentes umbrales de SLG del ventrículo izquierdo, lo cual podría implicar que el SM tiene una repercusión progresiva en una amplia variedad de niveles de la función ventricular izquierda, empezando en las fases subclínicas. Tiene interés señalar que, en el presente estudio, todos los parámetros de SM, excepto la reducción del colesterol unido a lipoproteínas de alta densidad, mostraron una asociación individual con el deterioro del SLG (todos los valores de p < 0,01). Además, tras aplicar un ajuste por la mayoría de los factores de confusión, se demostró que el perímetro de cintura aumentado era el único criterio de la definición del SM con asociación independiente con el deterioro del SLG en todo el intervalo de valores de la distribución del SLG (cuantiles 5 a 95). Nuestras observaciones son coherentes con los resultados de un estudio reciente36, en el que se observó que la presencia de adiposidad abdominal se asociaba con cifras inferiores de SLG, tanto en los participantes con obesidad general como sin ella. El concepto de «obesidad metabólicamente sana», que se caracteriza por una sensibilidad a la insulina conservada, una masa adiposa visceral relativamente baja, unas cifras de colesterol favorables y una presión arterial normal, está de moda actualmente37. Aunque las personas con «obesidad metabólicamente no sana» parecen ser más propensos a sufrir complicaciones, estudios recientes han indicado que la obesidad se asocia con diferencias subclínicas de la función tanto sistólica como diastólica, con independencia de que sea «sana» según lo definido por la presencia o ausencia de SM38,39.
Los puntos fuertes de este estudio son el gran número de participantes seleccionados de manera aleatoria de entre una cohorte multicéntrica y el uso de técnicas de imagen avanzadas. Sin embargo, nuestro estudio tiene también limitaciones. Dado el diseño transversal, no puede establecerse una relación causal entre el SM o sus componentes y el SLG. Los estudios prospectivos con gran número de participantes son esenciales para evaluar las repercusiones de un deterioro en la deformación ventricular izquierda en la morbilidad y la mortalidad cardiovasculares de las personas con SM. Aunque se tuvo en cuenta varios factores de confusión y se realizaron análisis multivariables con ajustes por los factores de riesgo cardiovascular establecidos, no se puede descartar la posibilidad de que haya factores de confusión no medidos que tengan efecto en las asociaciones observadas. Por último, continúa sin estar claro cuál es el valor de corte de SLG más apropiado para definir la existencia de una anomalía. Por este motivo, se ha transformado esta limitación teórica en un punto fuerte de la metodología, utilizando un método que permite evaluar continuamente el SLG.
CONCLUSIONESSe observó un deterioro significativo de la función del ventrículo izquierdo evaluada mediante el SLG en los participantes con SM, y la prevalencia del deterioro del SLG del ventrículo izquierdo fue mayor en los participantes con SM utilizando varios valores de corte de SLG diferentes. Además, se identificó que el perímetro de la cintura aumentado es el principal componente del SM asociado con deterioro del SLG del ventrículo izquierdo. De entre los diversos criterios del SM, la obesidad central es el que muestra mejor la relación entre la alteración metabólica y la función cardiaca.
FINANCIACIÓNEste trabajo fue financiado por el Ministerio de Salud (Departamento de Ciencia y Tecnología) de Brasil, el Ministerio de Ciencia, Tecnología e Innovación de Brasil (Financiadora de Estudos e Projetos, subvenciones 01 06 0010.00, 01 10 0643.00 RS, 01 06 0212.00 BA, 01 06 0300.00 ES, 01 06 0278.00 MG, 01 06 0115.00 SP, 01 06 0071.00 RJ), el CNPq (Consejo Nacional de Desarrollo Científico y Tecnológico de Brasil) y la Coordinación de Perfeccionamiento del Personal de Nivel Superior - CAPES (subvenciones 1407742 [W. Cañon-Montañez] y 1556322 [M. Bessel]).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
El SM es una agrupación de factores de riesgo cardiometabólicos que incluye obesidad abdominal, intolerancia a la glucosa, resistencia a la insulina, dislipemia e hipertensión.
- –
El SM afecta a alrededor del 25% de la población adulta y aumenta el riesgo de insuficiencia cardiaca, diabetes, infarto de miocardio, ictus y muerte.
- –
La disfunción sistólica subclínica es uno de los mecanismos que se han propuesto para explicar el aumento del riesgo cardiovascular asociado con el SM y puede detectarse por el SLG del ventrículo izquierdo empleando la 2D-STE.
- –
En este estudio se exploraron las asociaciones del SM con 3 valores de corte de SLG diferentes.
- –
El SM mostró una asociación independiente con el deterioro del SLG del ventrículo izquierdo.
- –
De entre los diversos criterios del SM, la obesidad central es el que muestra mejor la relación entre la alteración metabólica y la función cardiaca.
Los autores quisieran dar las gracias a todos los participantes en el estudio ELSA-Brasil por su valiosa contribución a este estudio.