Este estudio investigó si la escala de vasoactivos inotrópicos (VIS) es un predictor independientemente de la mortalidad en el shock cardiogénico (SC).
MétodosEstudio observacional retrospectivo. Se estudió a los pacientes que ingresaron entre enero de 2012 y diciembre de 2015 en la unidad de cuidados intensivos cardiacos, y finalmente se incluyó a 493 pacientes con SC. Para cuantificar el apoyo farmacológico, se dividió a los pacientes en quintiles de VIS: 1-10, 11-20, 21-38, 39-85 y > 85 puntos. El objetivo primario fue la mortalidad hospitalaria.
ResultadosLa mortalidad hospitalaria de los quintiles de VIS, en orden creciente, fue del 8,2, el 14,1, el 21,1, el 32,0 y el 65,7% respectivamente (p < 0,001). El análisis multivariable indicó que los valores de VIS de 39-85 (ORa = 3,85; IC95%, 1,60-9,22; p = 0,003) y > 85 puntos (ORa = 10,83; IC95%, 4,43-26,43; p < 0,001) siguieron siendo predictores de mortalidad hospitalaria. En la regresión logística múltiple para eliminar cualquier efecto de confusión, se halló que la probabilidad de muerte (tratamiento solo médico frente a combinado con oxigenador extracorpóreo de membrana) se cruzaron entre sí cuando el valor de VIS era de 130 puntos. En contraste con la correlación lineal entre la VIS y la mortalidad de los pacientes tratados solo con terapia médica, hubo poca asociación entre VIS ≥ 130 puntos y la mortalidad hospitalaria de los pacientes tratados además con membrana de oxigenación extracorpórea.
ConclusionesUn alto grado de apoyo con vasoactivos inotrópicos durante las primeras 48 h se asocia significativamente con mayor mortalidad hospitalaria de pacientes adultos con SC.
Palabras clave
El shock cardiogénico (SC) es un trastorno en el que el gasto cardiaco no permite mantener una perfusión suficiente de los órganos finales debido a un fallo de bombeo miocárdico a pesar de una precarga normal o elevada. Hasta ahora, el SC es un trastorno que conlleva peligro para la vida, con una tasa de mortalidad total de aproximadamente un 40%1,2. Para la estabilización hemodinámica, el tratamiento inotrópico o vasopresor desempeña un papel central en el tratamiento inicial de los pacientes con SC3,4. Los fármacos inotrópicos o vasopresores pueden mejorar la hemodinámica en la fase aguda a través de un aumento de la contractilidad miocárdica o una modificación del tono vascular. Sin embargo, estos fármacos pueden causar eventos adversos significativos y posibles riesgos, como los de arritmia, isquemia miocárdica e isquemia periférica, que pueden conducir a la progresión de un síndrome de disfunción multiorgánica y la muerte5,6. Varios estudios han mostrado que la escala de vasoactivos inotrópicos (VIS), que indica la cantidad de apoyo cardiovascular aportado mediante diversos inotrópicos o vasopresores, predijo de manera independiente los resultados clínicos en los pacientes pediátricos o adultos a los que se practicaron intervenciones de cirugía cardiaca7–9.
Sin embargo, son escasos los datos respecto a si el grado de apoyo cardiovascular farmacológico está correlacionado o no con los resultados clínicos en pacientes con SC no quirúrgicos. En consecuencia, en este estudio se investigó si el máximo apoyo cardiovascular farmacológico se asocia con los resultados clínicos en los pacientes con SC, según se usara o no oxigenador extracorpóreo de membrana (ECMO).
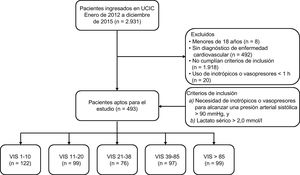
MÉTODOSSe examinó para su posible inclusión a 2.931 pacientes consecutivos que ingresaron en la unidad de cuidados intensivos cardiacos (UCIC) del Samsung Medical Center entre enero de 2012 y diciembre de 2015. Se incluyó a los pacientes que se presentaban con SC de cualquier etiología. El SC se definió como: a) necesidad de apoyo inotrópico o vasopresor para mantener una presión arterial sistólica > 90mmHg, y b) hipoperfusión tisular acompañante manifestada por lactato en suero ≥ 2,0 mmol/l. Se excluyó a los pacientes en los que se daba alguno de los siguientes criterios: a) edad < 18 años; b) ausencia de diagnóstico de enfermedad cardiovascular, y c) duración del uso de inotrópicos o vasopresores < 1 h, ya que los vasopresores pueden usarse en la práctica clínica durante un breve lapso como consecuencia de haberse empleado un fármaco con efecto vasodilatador, como los sedantes, o para una respuesta vasovagal sin SC. A los pacientes aptos para el estudio (n = 493) se los dividió en 5 grupos en función del quintil de la VIS máxima según lo descrito por Gaies et al.7, para cuantificar el grado de apoyo farmacológico durante las primeras 48 h tras el diagnóstico de shock y para investigar en la medida de lo posible la asociación entre el nivel máximo de la VIS y los resultados clínicos en pacientes con SC y variables concentraciones de vasopresores. Los grupos de VIS son 1-10, 11-20, 21-38, 39-85 y > 85 (figura 1). El Comité de Ética de Investigación del Samsung Medical Center aprobó el protocolo y eximió de la exigencia de consentimiento informado.
Esquema de la distribución del grupo; se examinó para su posible inclusión a 2.931 pacientes consecutivos ingresados en la UCIC entre enero de 2012 y diciembre de 2015. Se incluyó a los pacientes en las siguientes situaciones: a) necesidad de apoyo inotrópico o vasopresor durante más de 1 h para mantener una presión arterial sistólica > 90mmHg, y b) hipoperfusión tisular asociada evidenciada por una concentración sérica de lactato ≥ 2,0 mmol/l debido a enfermedad cardiovascular. Los pacientes aptos para el estudio (n = 493) se dividieron en 5 grupos en función del quintil de la VIS máxima, para cuantificar el nivel de apoyo farmacológico durante las primeras 48 h tras el diagnóstico de shock. Los 5 grupos de VIS fueron: 1-10, 11-20, 21-38, 39-85 y > 85. UCIC: unidad de cuidados intensivos cardiacos; VIS: escala de vasoactivos inotrópicos.
La VIS se calculó así: dosis de dopamina (μg/kg/min) + dosis de dobutamina (μg/kg/min) + 100 × dosis de adrenalina (μg/kg/min) + 10 × dosis de milrinona (μg/kg/min) + 10.000 × dosis de vasopresina (unidad/kg/min) + 100 × dosis de noradrenalina (μg/kg/min)7. Un coordinador del estudio adecuadamente formado extrajo retrospectivamente las dosis horarias de dopamina, dobutamina, adrenalina, milrinona, vasopresina y noradrenalina a partir de un examen de las historias clínicas electrónicas. La instauración, el tipo, el aumento gradual de dosis o la combinación de inotrópicos o vasopresores y el objetivo de presión arterial se dejaron al criterio de cada médico. El personal de enfermería que atendía directamente a los pacientes registró la siguiente información en el momento en el que se produjo un evento: hora de inicio, interrupción y ajuste de dosis de cada fármaco con dosis en μg/kg/min, excepto la vasopresina, cuyas dosis se expresan en U/min. Los datos clínicos y analíticos obtenidos el primer día de ingreso en la UCIC se obtuvieron de manera retrospectiva, se analizaron y se utilizaron para el cálculo de las puntuaciones Acute Physiology and Chronic Health Evaluation II (APACHE II).
El objetivo principal de este estudio es la mortalidad hospitalaria. Se exploró también la mortalidad en la UCIC, la estancia en la UCIC y hospitalaria, la tasa de reingresos en la UCIC durante el mismo periodo de hospitalización, y la tasa de reingresos en el hospital para una asistencia cardiaca aguda después del alta. Los resultados clínicos se registraron en las historias clínicas electrónicas hospitalarias. Se utilizó la base de datos nacional de Corea, que incluye un número de registro único para cada ciudadano, para determinar si los pacientes habían fallecido o no.
Para comparar las características y los resultados clínicos de los 5 grupos de VIS, las variables continuas se presentan en forma de media ± desviación estándar o mediana [intervalo intercuartílico], y se usó un análisis de la varianza o una prueba de Kruskal-Wallis, según procediera. Las variables discretas se describen mediante número y porcentaje y se compararon con la prueba de la χ2 o la prueba exacta de Fisher cuando había pocos datos. También se compararon los grupos mediante el log-rank test para las curvas de supervivencia de Kaplan-Meier. Se realizaron análisis de regresión univariables y multivariables para estimar el papel de la VIS en la mortalidad hospitalaria e identificar los factores de riesgo en cuanto a la predicción de la mortalidad hospitalaria. Las variables que parecían estar relacionadas en el análisis univariable con p < 0,2 se analizaron luego en modelos de regresión logística múltiples, y se utilizó un método de eliminación retrógrada escalonada para seleccionar los factores predictivos de la mortalidad. Se presenta el valor de odds ratio (OR) de cada variable junto con el intervalo de confianza del 95% (IC95%). Se evaluó la exactitud predictiva de la VIS con el área bajo la curva, utilizando el método propuesto por DeLong et al.10. Se usó el robusto método de estimación por validación cruzada para el modelo logístico múltiple mediante el procedimiento de «validación dejando uno fuera», y se presenta mediante la tasa de error de predicción.
También se consideró un modelo de regresión logística localizada para explorar de manera detallada el patrón de mortalidad en función de la VIS y del uso combinado de apoyo con ECMO. Dada la asimetría de la VIS, se utilizó una transformación logarítmica antes del ajuste del modelo. A continuación se representaron las rectas de regresión para el grupo con ECMO frente al sin ECMO. La intersección en la VIS de las dos líneas puede interpretarse como un punto de inflexión, que determina en qué momento pasar al uso del ECMO para minimizar el riesgo de muerte.
En todos los análisis, se consideró estadísticamente significativa una prueba bilateral con p < 0,05. Se utilizó el programa SAS 9.2 (SAS Institute Inc.; Cary, North Carolina, Estados Unidos) y el programa R 3.3.1 (The R Foundation for Statistical Computing; Viena, Austria) para Windows en todos los análisis estadísticos.
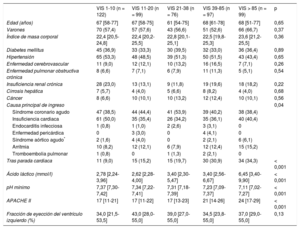
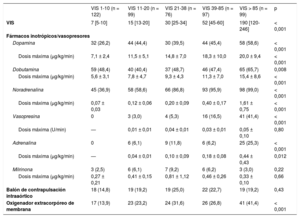
RESULTADOSEn la tabla 1 se presentan las características clínicas basales de los 493 pacientes con SC según la VIS. Las características clínicas, como edad, sexo y comorbilidades, no mostraron diferencias significativas entre las 5 categorías de VIS. La mediana de edad fue 67 (intervalo, 57-77) años y el 58,5% de los pacientes eran varones. Por lo que respecta a las etiologías, el síndrome coronario agudo y la insuficiencia cardiaca fueron la causa, respectivamente, del 42,4 y el 40,0% del total de SC. En términos generales, entre los pacientes con mayor VIS había mayor prevalencia de parada cardiaca recuperada, altas concentraciones séricas de lactato y puntuaciones APACHE II altas al ingreso, mientras que el pH arterial fue significativamente inferior según aumentaba la VIS. La mediana de VIS fue de 27 (intervalo, 10-60) en los pacientes con SC (tabla 2). Excepto en el grupo de VIS 1-10, en el que se utilizó más la dobutamina, la catecolamina más usada fue la noradrenalina (73,0%), y la dosis máxima fue de 0,61 ± 0,74 μg/kg/min. La vasopresina se utilizó con más frecuencia según aumentaba la VIS, pero las dosis máximas fueron similares. No hubo diferencias significativas en los 5 grupos de VIS respecto al porcentaje y las dosis máximas de milrinona. El uso de balón intraaórtico de contrapulsación en los distintos grupos de VIS no mostró diferencias significativas (p = 0,43). Sin embargo, el uso del ECMO (41,4%) fue significativamente superior en el grupo de VIS > 85 (p < 0,001).
Características iniciales
| VIS 1-10 (n = 122) | VIS 11-20 (n = 99) | VIS 21-38 (n = 76) | VIS 39-85 (n = 97) | VIS > 85 (n = 99) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 67 [58-77] | 67 [58-75] | 61 [54-75] | 68 [61-78] | 68 [51-77] | 0,65 |
| Varones | 70 (57,4) | 57 (57,6) | 43 (56,6) | 51 (52,6) | 66 (66,7) | 0,37 |
| Índice de masa corporal | 22,4 [20,5-24,8] | 22,4 [20,2-25,5] | 22,8 [20,1-25,1] | 22,5 [19,8-25,3] | 23,6 [21,2-25,5] | 0,36 |
| Diabetes mellitus | 45 (36,9) | 33 (33,3) | 30 (39,5) | 32 (33,0) | 36 (36,4) | 0,89 |
| Hipertensión | 65 (53,3) | 48 (48,5) | 39 (51,3) | 50 (51,5) | 43 (43,4) | 0,65 |
| Enfermedad cerebrovascular | 11 (9,0) | 12 (12,1) | 10 (13,2) | 16 (16,5) | 7 (7,1) | 0,26 |
| Enfermedad pulmonar obstructiva crónica | 8 (6,6) | 7 (7,1) | 6 (7,9) | 11 (11,3) | 5 (5,1) | 0,54 |
| Insuficiencia renal crónica | 28 (23,0) | 13 (13,1) | 9 (11,8) | 19 (19,6) | 18 (18,2) | 0,22 |
| Cirrosis hepática | 7 (5,7) | 4 (4,0) | 5 (6,6) | 8 (8,2) | 4 (4,0) | 0,68 |
| Cáncer | 8 (6,6) | 10 (10,1) | 10 (13,2) | 12 (12,4) | 10 (10,1) | 0,56 |
| Causa principal de ingreso | 0,04 | |||||
| Síndrome coronario agudo | 47 (38,5) | 44 (44,4) | 41 (53,9) | 39 (40,2) | 38 (38,4) | |
| Insuficiencia cardiaca | 61 (50,0) | 35 (35,4) | 26 (34,2) | 35 (36,1) | 40 (40,4) | |
| Endocarditis infecciosa | 1 (0,8) | 1 (1,0) | 2 (2,6) | 3 (3,1) | 0 | |
| Enfermedad pericárdica | 0 | 3 (3,0) | 0 | 4 (4,1) | 0 | |
| Síndrome aórtico agudo* | 2 (1,6) | 4 (4,0) | 0 | 2 (2,1) | 6 (6,1) | |
| Arritmia | 10 (8,2) | 12 (12,1) | 6 (7,9) | 12 (12,4) | 15 (15,2) | |
| Tromboembolia pulmonar | 1 (0,8) | 0 | 1 (1,3) | 2 (2,1) | 0 | |
| Tras parada cardiaca | 11 (9,0) | 15 (15,2) | 15 (19,7) | 30 (30,9) | 34 (34,3) | < 0,001 |
| Ácido láctico (mmol/l) | 2,78 [2,24-3,96] | 2,62 [2,28-4,00] | 3,40 [2,30-5,47] | 3,40 [2,56-6,67] | 6,45 [3,40-9,90] | < 0,001 |
| pH mínimo | 7,37 [7,30-7,42] | 7,34 [7,22-7,41] | 7,31 [7,18-7,39] | 7,23 [7,09-7,37] | 7,11 [7,02-7,27] | < 0,001 |
| APACHE II | 17 [11-21] | 17 [11-22] | 17 [13-23] | 21 [14-26] | 24 [17-29] | < 0,001 |
| Fracción de eyección del ventrículo izquierdo (%) | 34,0 [21,5-53,5] | 43,0 [28,0-55,0] | 39,0 [27,0-55,0] | 34,5 [23,8-55,0] | 37,0 [29,0-55,0] | 0,13 |
APACHE II: Acute Physiology and Chronic Health Evaluation II; VIS: escala de vasoactivos inotrópicos.
Los valores expresan mediana [intervalo intercuartílico] o n (%).
Características del tratamiento
| VIS 1-10 (n = 122) | VIS 11-20 (n = 99) | VIS 21-38 (n = 76) | VIS 39-85 (n = 97) | VIS > 85 (n = 99) | p | |
|---|---|---|---|---|---|---|
| VIS | 7 [5-10] | 15 [13-20] | 30 [25-34] | 52 [45-60] | 190 [120-246] | < 0,001 |
| Fármacos inotrópicos/vasopresores | ||||||
| Dopamina | 32 (26,2) | 44 (44,4) | 30 (39,5) | 44 (45,4) | 58 (58,6) | < 0,001 |
| Dosis máxima (μg/kg/min) | 7,1 ± 2,4 | 11,5 ± 5,1 | 14,8 ± 7,0 | 18,3 ± 10,0 | 20,0 ± 9,4 | < 0,001 |
| Dobutamina | 59 (48,4) | 40 (40,4) | 37 (48,7) | 46 (47,4) | 65 (65,7) | 0,008 |
| Dosis máxima (μg/kg/min) | 5,6 ± 3,1 | 7,8 ± 4,7 | 9,3 ± 4,3 | 11,3 ± 7,0 | 15,4 ± 8,6 | < 0,001 |
| Noradrenalina | 45 (36,9) | 58 (58,6) | 66 (86,8) | 93 (95,9) | 98 (99,0) | < 0,001 |
| Dosis máxima (μg/kg/min) | 0,07 ± 0,03 | 0,12 ± 0,06 | 0,20 ± 0,09 | 0,40 ± 0,17 | 1,61 ± 0,75 | < 0,001 |
| Vasopresina | 0 | 3 (3,0) | 4 (5,3) | 16 (16,5) | 41 (41,4) | < 0,001 |
| Dosis máxima (U/min) | — | 0,01 ± 0,01 | 0,04 ± 0,01 | 0,03 ± 0,01 | 0,05 ± 0,10 | 0,80 |
| Adrenalina | 0 | 6 (6,1) | 9 (11,8) | 6 (6,2) | 25 (25,3) | < 0,001 |
| Dosis máxima (μg/kg/min) | — | 0,04 ± 0,01 | 0,10 ± 0,09 | 0,18 ± 0,08 | 0,44 ± 0,43 | 0,012 |
| Milrinona | 3 (2,5) | 6 (6,1) | 7 (9,2) | 6 (6,2) | 3 (3,0) | 0,22 |
| Dosis máxima (μg/kg/min) | 0,27 ± 0,21 | 0,41 ± 0,15 | 0,81 ± 1,12 | 0,46 ± 0,26 | 0,33 ± 0,10 | 0,66 |
| Balón de contrapulsación intraaórtico | 18 (14,8) | 19 (19,2) | 19 (25,0) | 22 (22,7) | 19 (19,2) | 0,43 |
| Oxigenador extracorpóreo de membrana | 17 (13,9) | 23 (23,2) | 24 (31,6) | 26 (26,8) | 41 (41,4) | < 0,001 |
VIS: escala de vasoactivos inotrópicos.
Los valores expresan media ± desviación estándar, mediana [intervalo intercuartílico] o n (%).
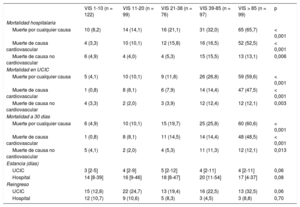
En total, fallecieron durante la hospitalización 136 pacientes (27,6%), y 109 (22,1%) de ellos murieron en la UCIC (tabla 3). Las tasas de mortalidad hospitalaria fueron mayores entre los pacientes con VIS más alta (el 8,2, el 14,1, el 21,1, el 32,0, y el 65,7% en los grupos de VIS < 10, 11-20, 21-38, 39-85 y > 85 respectivamente; p < 0,001). Las muertes de causa no cardiovascular fueron casi una tercera parte del total y, al igual que las muertes de causa no cardiovascular, mostraron un aumento a medida que se incrementaba la VIS.
Resultados clínicos
| VIS 1-10 (n = 122) | VIS 11-20 (n = 99) | VIS 21-38 (n = 76) | VIS 39-85 (n = 97) | VIS > 85 (n = 99) | p | |
|---|---|---|---|---|---|---|
| Mortalidad hospitalaria | ||||||
| Muerte por cualquier causa | 10 (8,2) | 14 (14,1) | 16 (21,1) | 31 (32,0) | 65 (65,7) | < 0,001 |
| Muerte de causa cardiovascular | 4 (3,3) | 10 (10,1) | 12 (15,8) | 16 (16,5) | 52 (52,5) | < 0,001 |
| Muerte de causa no cardiovascular | 6 (4,9) | 4 (4,0) | 4 (5,3) | 15 (15,5) | 13 (13,1) | 0,006 |
| Mortalidad en UCIC | ||||||
| Muerte por cualquier causa | 5 (4,1) | 10 (10,1) | 9 (11,8) | 26 (26,8) | 59 (59,6) | < 0,001 |
| Muerte de causa cardiovascular | 1 (0,8) | 8 (8,1) | 6 (7,9) | 14 (14,4) | 47 (47,5) | < 0,001 |
| Muerte de causa no cardiovascular | 4 (3,3) | 2 (2,0) | 3 (3,9) | 12 (12,4) | 12 (12,1) | 0,003 |
| Mortalidad a 30 días | ||||||
| Muerte por cualquier causa | 6 (4,9) | 10 (10,1) | 15 (19,7) | 25 (25,8) | 60 (60,6) | < 0,001 |
| Muerte de causa cardiovascular | 1 (0,8) | 8 (8,1) | 11 (14,5) | 14 (14,4) | 48 (48,5) | < 0,001 |
| Muerte de causa no cardiovascular | 5 (4,1) | 2 (2,0) | 4 (5,3) | 11 (11,3) | 12 (12,1) | 0,013 |
| Estancia (días) | ||||||
| UCIC | 3 [2-5] | 4 [2-9] | 5 [2-12] | 4 [2-11] | 4 [2-11] | 0,06 |
| Hospital | 14 [8-39] | 16 [9-46] | 18 [8-47] | 20 [11-54] | 17 [4-37] | 0,08 |
| Reingreso | ||||||
| UCIC | 15 (12,8) | 22 (24,7) | 13 (19,4) | 16 (22,5) | 13 (32,5) | 0,06 |
| Hospital | 12 (10,7) | 9 (10,6) | 5 (8,3) | 3 (4,5) | 3 (8,8) | 0,70 |
UCIC: unidad de cuidados intensivos cardiacos; VIS: escala de vasoactivos inotrópicos.
Los valores expresan mediana [intervalo intercuartílico] o n (%).
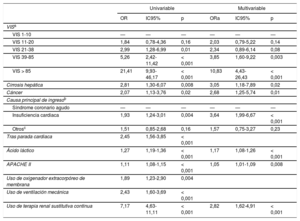
Las variables clínicas que se consideraron posibles factores pronósticos en el análisis de regresión logística univariable fueron: cirrosis hepática, cáncer, problemas cardiovasculares primarios, antecedentes de parada cardiaca, concentración de ácido láctico, APACHE II, uso de ECMO, ventilación mecánica y terapia renal sustitutiva continua. Tras un ajuste del modelo por esas covariables, los valores de OR ajustados (ORa) de los grupos de VIS mostraron un aumento de 2,03 (IC95%, 0,79-5,22; p = 0,14), 2,34 (IC95%, 0,89-6,14; p = 0,08) y 3,85 (IC95%, 1,60-9,22; p = 0,003) a 10,83 (IC95%, 4,43-26,43; p < 0,001) para los intervalos de VIS de 11-20, 21-38, 39-85 y > 85 respectivamente, en comparación con la VIS de 1-10 (tabla 4). La escala VIS continuó teniendo un valor pronóstico de mortalidad hospitalaria significativo, en especial para los pacientes con valores > 39. En el 52,9 y el 29,8% de nuestros pacientes, se utilizó ventilación mecánica y terapia renal sustitutiva continua durante una mediana de 4 (2-8) y 4 (3-8) días respectivamente. La proporción de pacientes con uso de ventilación mecánica y terapia renal sustitutiva continua aumentó con el aumento de la VIS, pero sus duraciones fueron similares en los 5 grupos de VIS. En total, el modelo de predicción multivariable tuvo un área bajo la curva de 0,8676 (IC95%, 0,83-0,90) y se verificó también la bondad de ajuste del modelo con la prueba de Osius-Rojek (p = 0,835). Nuestro modelo produjo una tasa de error de clasificación del 16,4% con la validación cruzada «dejando uno fuera». Ni las estancias ni las tasas de reingresos mostraron diferencias entre los 5 grupos de VIS.
Factores predictivos de la mortalidad hospitalaria
| Univariable | Multivariable | |||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | ORa | IC95% | p | |
| VISa | ||||||
| VIS 1-10 | — | — | — | — | — | — |
| VIS 11-20 | 1,84 | 0,78-4,36 | 0,16 | 2,03 | 0,79-5,22 | 0,14 |
| VIS 21-38 | 2,99 | 1,28-6,99 | 0,01 | 2,34 | 0,89-6,14 | 0,08 |
| VIS 39-85 | 5,26 | 2,42-11,42 | < 0,001 | 3,85 | 1,60-9,22 | 0,003 |
| VIS > 85 | 21,41 | 9,93-46,17 | < 0,001 | 10,83 | 4,43-26,43 | < 0,001 |
| Cirrosis hepática | 2,81 | 1,30-6,07 | 0,008 | 3,05 | 1,18-7,89 | 0,02 |
| Cáncer | 2,07 | 1,13-3,76 | 0,02 | 2,68 | 1,25-5,74 | 0,01 |
| Causa principal de ingresob | ||||||
| Síndrome coronario agudo | — | — | — | — | — | — |
| Insuficiencia cardiaca | 1,93 | 1,24-3,01 | 0,004 | 3,64 | 1,99-6,67 | < 0,001 |
| Otrosc | 1,51 | 0,85-2,68 | 0,16 | 1,57 | 0,75-3,27 | 0,23 |
| Tras parada cardiaca | 2,45 | 1,56-3,85 | < 0,001 | |||
| Ácido láctico | 1,27 | 1,19-1,36 | < 0,001 | 1,17 | 1,08-1,26 | < 0,001 |
| APACHE II | 1,11 | 1,08-1,15 | < 0,001 | 1,05 | 1,01-1,09 | 0,008 |
| Uso de oxigenador extracorpóreo de membrana | 1,89 | 1,23-2,90 | 0,004 | |||
| Uso de ventilación mecánica | 2,43 | 1,60-3,69 | < 0,001 | |||
| Uso de terapia renal sustitutiva continua | 7,17 | 4,63-11,11 | < 0,001 | 2,82 | 1,62-4,91 | < 0,001 |
APACHE II: Acute Physiology and Chronic Health Evaluation II; IC95%: intervalo de confianza del 95%; OR: odds ratio; ORa: OR ajustada; VIS: escala de vasoactivos inotrópicos.
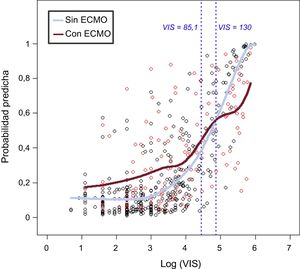
Para un examen más detenido de la mortalidad hospitalaria, se exploró el papel de la VIS y el ECMO. En el análisis bruto, la mortalidad hospitalaria fue superior en el grupo de VIS 1-85 e inferior en el de VIS > 85 en el grupo con ECMO en comparación con el grupo sin ECMO, y esta interacción fue muy significativa (p = 0,007). Se optó por un modelo de regresión logística localizado para la predicción de la mortalidad, con el objeto de hallar un patrón de la mortalidad predicha que se asociaba con la VIS según el uso combinado de apoyo con ECMO. Se observó que las rectas de regresión localizadas se cruzaban entre sí a un valor de VIS = 130 (figura 2). Sin embargo, empezaban de manera muy diferente, y a partir de aproximadamente una VIS ≥ 85 puntos convergía hasta una VIS de 130, punto en el que se cruzaban. Esto indica que una VIS de 85-130 es el punto de inflexión en que la probabilidad de muerte de los pacientes que reciben solo apoyo farmacológico es peor que la de los tratados con apoyo combinado con ECMO.
Probabilidad predicha de mortalidad hospitalaria frente al log (VIS). La probabilidad predicha de mortalidad hospitalaria de los pacientes con solo apoyo farmacológico (sin ECMO) fue significativamente inferior a la de los pacientes con ECMO y VIS < 85. Sin embargo, la diferencia entre los 2 grupos empezaba a reducirse a partir de un valor aproximado de VIS = 85 y la probabilidad predicha en el grupo sin ECMO fue significativamente superior a la del grupo con ECMO para una VIS > 130. ECMO: oxigenador extracorpóreo de membrana; VIS: escala de vasoactivos inotrópicos.
En el presente estudio se investigó la asociación entre el máximo apoyo cardiovascular farmacológico durante las primeras 48 h después del shock y los resultados clínicos en pacientes adultos no quirúrgicos con SC. Los resultados principales del estudio son: a) la VIS, que refleja la cantidad de tratamiento inotrópico o vasopresor, se asocia con la mortalidad hospitalaria y la mortalidad en la UCIC de los pacientes con SC que requieren cuidados críticos cardiacos; b) la VIS fue un factor pronóstico de la mortalidad hospitalaria significativo en el modelo de regresión logística multivariable; c) la VIS tiene un valor predictivo de la mortalidad hospitalaria y la mortalidad en la UCIC superior a los de la puntuación APACHE II y la concentración de lactato en suero; y d) en la VIS ≥ 130, a diferencia de los pacientes tratados con solo tratamiento médico, los que recibieron tratamiento adicional con ECMO mostraron una correlación débil entre la VIS y la probabilidad predicha de muerte hospitalaria.
El presente estudio concuerda con estudios previos que mostraron asociación entre valores altos de VIS y mal resultado clínico después de la cirugía cardiaca en pacientes pediátricos y adultos. En 2010, Gaies et al.7 introdujeron el concepto de VIS en un estudio realizado en lactantes después de cirugía cardiaca con circulación extracorpórea, y observaron que los pacientes con una VIS alta (definida como VIS ≥ 20 en las primeras 24 h o ≥ 15 en las 24 h siguientes) tenían un riesgo significativamente superior por lo que respecta a las variables de valoración combinadas de muerte, asistencia circulatoria mecánico, terapia renal sustitutiva, parada cardiaca y daño del sistema nervioso central. Posteriormente, varios estudios también han mostrado la capacidad de la VIS como predictora de la morbilidad y la mortalidad de niños y adolescentes tras cirugía cardiaca11,12. Aunque Geppert et al.13 no utilizaron la VIS en un estudio de pacientes con SC complicado con infarto agudo de miocardio, esos autores observaron unas tasas de mortalidad a 30 días del 86 y el del 100% cuando la suma de las dosis de adrenalina y noradrenalina eran > 0,31 y 1,16μg/kg/min respectivamente.
Dado su efecto en el sistema cardiovascular, el tratamiento inotrópico y vasopresor es una parte esencial del tratamiento del SC. Sin embargo, este tratamiento puede asociarse también con eventos adversos cardiovasculares, como hipertensión/hipotensión, arritmias, isquemia periférica y cardiaca, que pueden ser mortales5. El uso de catecolaminas puede progresar a una disfunción multiorgánica y, en última instancia, dificultar la recuperación del SC debido a las alteraciones metabólicas inducidas por las catecolaminas, como aumentos del consumo de oxígeno, de la glucolisis, la glucogenolisis y la lipolisis, de la neoglucogénesis y la cetogénesis, de la resistencia periférica a la insulina y de la liberación de lactato14. Además, la acidosis puede reducir el efecto de los fármacos inotrópicos y vasopresores y con frecuencia puede ser motivo de aumento de las dosis. En el presente estudio se observó un aumento de las muertes de causa no cardiovascular, así como de las de causa cardiovascular, entre los pacientes con valores de VIS más altos. La sepsis fue la causa de un 69,0% de las muertes de causa no cardiovascular y las muertes asociadas con ella fueron más entre los pacientes con valores de VIS altos (p = 0,001), si bien no se observaron diferencias entre VIS 39-85 y > 85. En un estudio se examinó la VIS perioperatoria de los pacientes sometidos a trasplante cardiaco, y se observó también que aquellos con VIS ≥ 20 tenían una incidencia de infección significativamente mayor9. Se sabe que las catecolaminas están relacionadas con la inmunosupresión, la estimulación de la proliferación bacteriana y la formación de biofilm y que conllevan un aumento del riesgo de infección15–17.
Tiene interés señalar que este estudio mostró un patrón diferente de la mortalidad hospitalaria predicha según la VIS entre los pacientes que recibieron solo apoyo farmacológico y los asistidos con ECMO combinado. Aunque la mortalidad hospitalaria predicha en el grupo de ECMO fue significativamente superior a la del grupo sin ECMO dentro de los valores de VIS < 85, la probabilidad de muerte en el grupo con ECMO fue similar a la del grupo sin ECMO dentro de los valores de 85-130. La mortalidad hospitalaria predicha en el grupo con ECMO fue inferior a la del grupo sin ECMO con VIS ≥ 130. Algunos posibles beneficios de la asistencia con ECMO proceden de su capacidad de revertir la alteración metabólica y los efectos sistémicos nocivos del SC18,19. Por consiguiente, tanto la guía estadounidense como la europea para el tratamiento del infarto agudo de miocardio con elevación del segmento ST proponen que se considere el uso de dispositivos de asistencia ventricular izquierda para el apoyo circulatorio de los pacientes con un SC refractario20,21. Samuels et al.22 indicaron que el número y el nivel de apoyos inotrópicos están correlacionados con la mortalidad hospitalaria de los pacientes con SC tras una cardiotomía. Concretamente, la mortalidad hospitalaria de los pacientes que necesitaron 2 o más inotrópicos a dosis altas fue superior al 40%, y los autores consideraron las necesidades de dosis como criterio farmacológico para implantar un dispositivo de asistencia ventricular en el shock tras la cardiotomía. Transformado en un valor de VIS, este criterio corresponde a VIS > 15-27 en una persona de 60kg de peso, lo cual es una puntuación relativamente baja en comparación con lo observado en nuestro estudio. Esta discrepancia podría estar relacionada en parte con diferencias entre los 2 estudios en las características de los pacientes incluidos. En este estudio no se incluyó a pacientes en el periodo posoperatorio inmediato. Además, la mortalidad predicha en los pacientes se comparó directamente según hubieran recibido o no tratamiento con ECMO, con objeto de ponderar el beneficio del ECMO en comparación con el riesgo que implica. A diferencia del efecto positivo del ECMO con una VIS > 130, la mayor mortalidad predicha del grupo de ECMO con VIS < 85 podría explicarse por un síndrome de respuesta inflamatoria sistémica asociado con el ECMO, así como por otras complicaciones de este, como hemorragia, infección e isquemia de extremidad23–26. Estos resultados indican que se debe considerar la instauración de una asistencia circulatoria mecánica como el ECMO para los pacientes con SC seleccionados que presenten una VIS > 85, a pesar de los posibles riesgos y complicaciones asociados con los dispositivos de asistencia circulatoria.
LimitacionesEl presente estudio puede tener varias limitaciones. En primer lugar, se llevó a cabo de manera retrospectiva, no utilizó unos criterios predefinidos sobre las pautas de tratamiento inicial o combinado, los ajustes de dosis de los fármacos vasoactivos y el objetivo de presión arterial ni en cuanto al momento de aplicación del ECMO. Serán necesarios nuevos estudios controlados empleando protocolos establecidos para el uso de fármacos vasoactivos y del ECMO con objeto de esclarecer el papel de la VIS y el ECMO en el SC. En segundo lugar, los criterios hemodinámicos, como el índice cardiaco o la presión telediastólica de los ventrículos izquierdo y derecho, no se incluyeron en la definición del shock. En consecuencia, no se puede descartar un síndrome tras parada cardiaca, en el que predomina un componente distributivo del shock, en especial en los pacientes que se encuentran en el estado posterior a la parada cardiaca. En tercer lugar, se utilizó la VIS como forma de cuantificar el nivel de apoyo vasopresor o inotrópico y para reflejar la equivalencia de la propiedad de apoyo hemodinámico de cada fármaco. Sin embargo, la VIS máxima tiene ciertas limitaciones inherentes en la evaluación del estado hemodinámico del paciente, ya que la dosis máxima de cada vasopresor se ve influida por diversos trastornos médicos como los fármacos sedantes, la aplicación de ventilación mecánica y el área de superficie corporal. Además, en el estudio solo se incluyeron fármacos en la fórmula de la VIS. En cuarto lugar, se asumió que la bomba de balón intraaórtico tiene poco efecto en los resultados clínicos. Esta presunción se basa en los estudios previos que no mostraron efecto positivo alguno de la bomba de balón intraaórtico en la mortalidad de los pacientes con infarto agudo de miocardio complicado con un SC3,27,28. Por último, se utilizó la puntuación APACHE II para evaluar la capacidad de la VIS como parámetro predictivo de la mortalidad debido a la ausencia de un patrón de referencia para un sistema de puntuación del riesgo en el SC. Aunque la puntuación APACHE II se validó en un estudio previo que incluyó a pacientes con diversas enfermedades cardiovasculares, nuestro modelo predictivo puede ser inadecuado para reflejar las características específicas de los pacientes con SC29.
CONCLUSIONESUna VIS alta mostró asociación independiente con el aumento de la mortalidad hospitalaria y en la UCIC, aunque hubo poca asociación entre la VIS y la probabilidad de muerte hospitalaria de los pacientes tratados con ECMO y muy altas concentraciones de vasopresores, y se observó un alto valor predictivo de la mortalidad hospitalaria y la mortalidad en la UCIC de los pacientes con SC que necesitan cuidados críticos cardiacos. Estos resultados indican que la decisión de aumentar la posología de vasopresores o inotrópicos debe tomarse cuidadosamente tras considerar un análisis del riesgo-beneficio de los fármacos.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Los fármacos inotrópicos o vasopresores pueden mejorar la hemodinámica en la fase aguda a través de un aumento de la contractilidad miocárdica o una modificación del tono vascular. Sin embargo, estos fármacos pueden causar eventos adversos significativos y posibles riesgos, que pueden conducir a la progresión de un síndrome de disfunción multiorgánica y la muerte. Además, la VIS que refleja la cantidad de tratamiento inotrópico o vasopresor predijo de manera independiente los resultados clínicos en pacientes pediátricos y adultos tratados con cirugía cardiaca.
- –
La escala de vasoactivos inotrópicos se asocia con la mortalidad hospitalaria y la mortalidad en la UCIC de los pacientes con SC que requieren cuidados críticos cardiacos y tiene mayor valor predictivo de la mortalidad hospitalaria y la mortalidad en la UCIC que la puntuación APACHE II y la concentración sérica de lactato. Concretamente, en la VIS ≥ 130, a diferencia de los pacientes con solo tratamiento médico, los que recibieron tratamiento adicional con ECMO mostraron una correlación débil entre la VIS y la probabilidad predicha de mortalidad hospitalaria.