La prótesis aórtica Mitroflow es una válvula de pericardio bovino especialmente diseñada para aumentar el área valvular. Hay controversia en relación con su patrón de degeneración estructural valvular (DEV). El objetivo es conocer la incidencia acumulada de DEV, los factores que influyen en su aparición y su impacto sobre la mortalidad.
MétodosSe siguió a 1.028 pacientes clínica y ecocardiográficamente. Puesto que se trata de una población cardiópata y anciana, se realizó un análisis de riesgos competitivos.
ResultadosEl porcentaje de DEV a los 5 años fue 4,22% (IC95%, 2,96-5,81) y a los 8 años 15,77% (IC95%, 12,46-19,43). La incidencia fue superior para las válvulas de tamaños pequeños (19 y 21mm). A los 5 años llegó al 6,43% (IC95%, 4,48-8,84) y a los 8 años al 20,06% (IC95%, 15,53-25,01). El desajuste paciente-prótesis (DPP) grave influyó en la incidencia de DEV (sHR = 3,53; IC95%, 2,20-5,66; p < 0,001). Sin embargo, el DPP moderado no tuvo ningún impacto. La presencia de DEV fue el mayor predictor de mortalidad (HR = 4,59; IC95%, 2,91-7,22; p < 0,001).
ConclusionesUtilizando una definición basada en el aumento del gradiente transprotésico, la incidencia de DEV de la prótesis Mitroflow es superior a la indicada por otras series, especialmente para las de tamaños pequeños (19 y 21mm) o en pacientes con DPP grave. Aumenta exponencialmente a partir del quinto año y desde que se diagnostica aumenta por 4,5 el riesgo de muerte.
Palabras clave
La estenosis aórtica es la afección más frecuente de las válvulas cardiacas y la tercera enfermedad cardiovascular después de la hipertensión y la enfermedad coronaria en el mundo occidental. El 2% de la población mayor de 65 años y el 4% de los mayores de 85 años tiene una estenosis aórtica grave1. La relevancia de esta enfermedad es enorme, tanto por su gran prevalencia como por el pronóstico ominoso que su presencia implica.
Actualmente, el recambio valvular aórtico es el procedimiento más ejecutado por los servicios de cirugía cardiaca de España y se estima que se realizan anualmente en torno a 200.000 en todo el mundo1,2.
Las prótesis biológicas suponen en la actualidad más del 50% de todas las prótesis quirúrgicas implantadas1,2. Entre las válvulas biológicas de pericardio bovino, la bioprótesis Mitroflow (Sorin Group Inc., Mitroflow Division; Vancouver, Canadá) disponible desde 1982, se diseñó específicamente para conseguir el mejor perfil hemodinámico3,4. Los resultados del primer modelo (11A) han estado empañados por la aparición de desgarros en sus velos debido al contacto de estos con el esqueleto de la válvula5. Los 2 modelos siguientes (12A y LX) subsanaron este fallo y su diseño demostró conseguir un perfil hemodinámico superior al del resto de prótesis biológicas3,4. Con un pequeño stent y unos velos de pericardio montados externamente en torno a este, su arquitectura permite maximizar el área relativa a su tamaño6. Estas características, junto con su versatilidad y facilidad para el implante supraanular, convirtieron la válvula aórtica biológica Mitroflow en la prótesis ideal para pacientes con anillo pequeño y calcificado4 que se utiliza de forma habitual en España y en más de 100.000 pacientes en todo el mundo5.
La principal desventaja de las prótesis biológicas es la degeneración estructural valvular (DEV). Mientras que los factores dependientes del paciente (como la edad, la función renal o el metabolismo paratiroideo) han demostrado ser elementos influyentes en la incidencia de esta, los factores dependientes de la prótesis (como el diseño o el proceso de manufactura) se han asociado igualmente a esta complicación tardía7.
Algunos autores demostraron resultados satisfactorios con la prótesis Mitroflow a medio y largo plazo4,8–11. Sin embargo, en otros estudios se observó un porcentaje preocupante de DEV5,12 y se llegó incluso a pronosticar una epidemia global de pacientes con prótesis Mitroflow degeneradas5. La ausencia de tratamiento anticalcificante de los modelos 12A y LX emergió como principal hipótesis para explicar una DEV excesivamente precoz5,12.
Basado en el supuesto de que todos los pacientes desarrollarían el evento de interés si se prolongara suficientemente el tiempo de seguimiento, la estimación de Kaplan-Meyer (KM) se utilizó por todos estos trabajos para calcular la incidencia de DEV4,5,8–12. Este análisis considera a los pacientes fallecidos como «censurados», suponiendo falsamente que su prótesis podría degenerar en el futuro13. La realidad es que en numerosas ocasiones ocurren eventos competitivos (EC) que impiden la aparición del suceso objeto de estudio. Estos métodos estadísticos convencionales4,5,8–12 asumen que los EC no existen, lo que conlleva invariablemente a una sobreestimación de la verdadera incidencia acumulada del evento de interés14.
El objetivo primario de este estudio es conocer la verdadera incidencia acumulada de DEV de la prótesis aórtica Mitroflow 12A y LX y los factores que predicen su aparición. El objetivo secundario es conocer el impacto de la DEV sobre la supervivencia.
MÉTODOSMuestraSe incluyó a todos los pacientes intervenidos de recambio valvular aórtico convencional mediante una prótesis Mitroflow (12A o LX) en un centro terciario de referencia de España, entre enero de 2006 y diciembre de 2014. Las características basales, preoperatorias y durante el posoperatorio se recogieron de forma prospectiva. El tipo de prótesis utilizada, el abordaje quirúrgico o la cardioplejia fueron decisión del cirujano. Se intervino a los pacientes mediante esternotomía media completa y el implante de la prótesis fue supraanular.
Definición de degeneración estructural valvular y otras variablesA falta de un criterio estándar que defina la DEV, se consideró de acuerdo a los siguientes criterios ecocardiográficos5: progresión del gradiente transaórtico ≥ 30mmHg asociado a un área valvular aórtica ≤ 1cm2 o insuficiencia intraprotésica > 2/4 siempre y cuando no estuviera presente en los 30 días posteriores al procedimiento y no fuera consecuencia de endocarditis. Todos los casos de DEV, así como aquellos casos dudosos, los evaluaron 2 ecocardiografistas expertos independientes al estudio.
Las definiciones referentes a morbimortalidad durante el seguimiento se ajustaron a las recomendaciones de la American Association for Thoracic Surgery y la European Association for Cardio-Thoracic Surgery (material suplementario)15.
Las áreas indexadas del orificio efectivo ≤ 0,85cm2/m2 y ≤ 0,65cm2/m2 se diagnosticaron por desajuste paciente-prótesis (DPP) moderado y grave respectivamente. El área indexada del orificio efectivo se calculó dividiendo el área valvular obtenida con la ecocardiografía previa al alta por la superficie corporal del paciente obtenida mediante la fórmula de Dubois16. Para aquellos pacientes fallecidos durante el periodo posoperatorio se utilizó el área del orificio efectivo según valores in vivo publicados en la bibliografía17.
SeguimientoSe realizó una ecocardiografía previa al alta a todos los pacientes supervivientes al periodo posoperatorio. Se garantizó el seguimiento a largo plazo recopilando para este estudio todos los datos clínicos y ecocardiográficos, tanto de este centro como de todos los centros sanitarios de referencia del paciente (hospitales, centros de salud, etc.). Aquellos pacientes cuya ecocardiografía presentaba dudas o con sospecha de DEV se enviaron al centro para realización de una nueva ecocardiografía y revaluación. De la misma forma, se envió al centro para realizar una nueva ecocardiografía a aquellos pacientes cuya última ecocardiografía era más antigua de 1 año, presentaba gradientes elevados o algún grado de insuficiencia aórtica. En caso de ausencia de DEV, la última ecocardiografía realizada fue la que se tuvo en cuenta para el análisis. Por el contrario, ante la presencia de DEV, se utilizó el intervalo medio entre la primera ecocardiografía en la que se detectó y la última en la que no existía (mid-point imputation). Se consideró día 0 el día del recambio valvular aórtico.
Análisis estadístico. Eventos competitivosLas variables cuantitativas se expresan como media ± desviación estándar. Para más información, en ciertos casos se añade la mediana (intervalo intercuartílico). Las variables categóricas se expresan como n (%).
Teniendo en cuenta que se trata de una población cardiópata y anciana, en la que es previsible que el porcentaje de muertes durante el seguimiento sea elevado, se decidió realizar un análisis de riesgos competitivos. Hay acuerdo unánime en que este método, publicado por Fine y Gray en 199918, estima correctamente la probabilidad del evento de interés (DEV) en presencia de otros eventos (muerte) que impiden la aparición del primero13,14. En el caso de la curva de supervivencia de KM o de la curva de incidencia acumulada basada en este análisis (1-KM), los EC son «censurados» y la estimación de la probabilidad del evento de interés se encuentra invariablemente sobreestimada. Además, el efecto de las covariables sobre el evento de interés no se puede interpretar. Cuando se realiza el análisis teniendo en cuenta los EC, la probabilidad se estima correctamente y el modelo tiene una interpretación clínica, práctica y sencilla14.
Se consideró EC todas aquellas situaciones que impiden la aparición del evento de interés (en este caso, DEV): muerte de origen cardiaco (incluyendo a los pacientes fallecidos durante el posoperatorio y excluyendo a los que presentaban DEV), la muerte de origen no cardiaco y el recambio de la válvula por motivos distintos a la DEV. Se consideró «censurados» exclusivamente a aquellos pacientes que terminaron el seguimiento con vida, con la misma válvula implantada y sin DEV.
Solamente 19 pacientes murieron sin una ecocardiografía realizada durante el año previo a su fallecimiento. Al no poder conocerse si presentaban DEV en el momento de su fallecimiento, se consideraron perdidos durante el seguimiento y se excluyeron. Cinco pacientes no aceptaron firmar el consentimiento y realizar una nueva ecocardiografía.
Utilizando el análisis de EC18 se calculó la incidencia acumulada de DEV junto con su intervalo de confianza del 95% (IC95%) a los 3, 5 y 8 años. Asimismo, se calculó el modelo de subdistribución de incidencia (subdistribution hazard model) o modelo de regresión de la función de incidencia acumulada como modelo óptimo para conocer el impacto de determinadas covariables en la incidencia de DEV14. Debido a su uso más frecuente, y para contrastar con los estudios previos, las curvas de incidencia acumulada basadas en el estimador 1-KM, así como el modelo incidencia de causa específica, también se analizaron. Este último se calculó de la misma forma que el modelo proporcional de Cox, tratando los EC como «censurados»14.
En ambos modelos de regresión se introdujeron como posibles predictoras de DEV las siguientes covariables: edad, aclaramiento de creatinina, dislipemia, diabetes, sexo y DPP.
Para conocer el impacto de la DEV sobre la mortalidad, se realizó un modelo de regresión de Cox mediante el procedimiento «exclusión por pasos» (inclusión, p < 0,05; exclusión, p ≥ 0,10) utilizando las siguientes covariables: edad, sexo, diabetes mellitus, dislipemia, hipertensión arterial, enfermedad vascular periférica, aclaramiento de creatinina, movilidad reducida, cirugía cardiaca previa, enfermedad pulmonar crónica, disfunción ventricular (fracción de eyección del ventrículo izquierdo ≤ 50%), hipertensión pulmonar grave (presión sistólica arterial pulmonar > 55mmHg), enfermedad coronaria, cirugía de aorta, cirugía mitral y DEV. Esta última entró en el modelo como una variable dependiente del tiempo y se calculó su influencia en la mortalidad desde su aparición.
La proporcionalidad de las hazard ratio (HR) se comprobó mediante el análisis visual gráfico del ln-minus-ln probabilidad de supervivencia y mediante el análisis de los residuales de Schoenfeld.
El análisis estadístico se realizó con STATA v.14.1 (STATA Corp.; Texas, Estados Unidos).
El estudio obtuvo la autorización del Comité de Ética de Investigación del Principado de Asturias con el número de referencia 2916.
RESULTADOSCaracterísticas basales y datos intraoperatorios y posoperatoriosDurante el periodo de inclusión, se implantó una prótesis Mitroflow 12A o LX a 1.052 pacientes. La media de edad fue de 77,01 ± 4,78 años, la mediana del 77,33 (74,11-80,48), el 28% tenía más de 80 años y solamente el 6% tenía menos de 70 años. El paciente más joven tenía 34 años y el mayor, 91 años (figura 1 del material suplementario). La media del EuroSCORE logístico fue de 10,71 ± 9,97 y la del EuroSCORE II de 5,23 ± 6,74. Solo 54 pacientes (5,18%) se encontraban asintomáticos y 826 (78,82%) se intervinieron por estenosis aórtica. Las características basales se muestran en la tabla 1.
Características basales y preoperatorias
| Datos clínicos | |
| Mujer | 508 (48,29) |
| Edad (años) | 77,01 ± 4,78 |
| Hipertensión arterial | 767 (73,82) |
| Diabetes mellitus | |
| No | 753 (72,47) |
| No insulinodependiente | 244 (23,48) |
| Insulinodependiente | 42 (4,04) |
| Dislipemia | 470 (45,24) |
| Superficie corporal (m2) | 1,76 ± 0,81 |
| Índice de masa corporal (kg/m2) | 28,71 ± 4,12 |
| Enfermedad pulmonar crónica | 177 (16,99) |
| Aclaramiento de creatinina (ml/min) | |
| ≥ 85 | 101 (9,62) |
| ≥ 50 y < 85 | 624 (59,43) |
| < 50 | 323 (30,76) |
| Diálisis | 2 (0,19) |
| Accidente cerebrovascular previo | 68 (6,53) |
| Movilidad gravemente reducida | 22 (2,1) |
| Enfermedad vascular periférica | 121 (11,65) |
| Cirugía cardiaca previa | 27 (2,59) |
| Estado preoperatorio crítico | 27 (2,59) |
| EuroSCORE logístico | 10,71 ± 9,97 |
| EuroSCORE II | 5,23 ± 6,74 |
| Datos cardiológicos | |
| Endocarditis activa | 35 (3,35) |
| Antecedente de taquicardia supraventricular | 215 (20,67) |
| Enfermedad coronaria asociada | 405 (38,5) |
| Infarto agudo de miocardio < 3 meses | 34 (3,25) |
| Grado funcional NYHA | |
| NYHA I | 54 (5,18) |
| NYHA II | 523 (50,19) |
| NYHA III | 381 (36,56) |
| NYHA IV | 84 (8,06) |
| Parámetros ecocardiográficos | |
| FEVI | |
| > 50% | 872 (83,05) |
| > 30% y ≤ 50% | 139 (13,24) |
| ≤ 30% y > 20% | 34 (3,24) |
| ≤ 20% | 5 (0,48) |
| Septo interventricular > 17 mm | 288 (27,56) |
| Diámetro tracto salida ventrículo izquierdo (mm) | 2,14 ± 0,23 |
| Presión sistólica arteria pulmonar > 55 mmHg | 81 (7,78) |
| Valvulopatía aórtica | |
| Estenosis aislada | 826 (78,82) |
| Insuficiencia aislada | 93 (8,87) |
| Doble lesión | 129 (12,31) |
| Gradiente medio (mmHg) | 46,91 (14,07) |
| Gradiente máximo (mmHg) | 80,01 ± 23,65 |
FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association.
Los datos expresan n (%) o media ± desviación estándar.
Se operó de forma no electiva a 207 pacientes (19,68%) y a 351 (33,36%) se les realizó cirugía de revascularización miocárdica asociada. Un total de 81 (7,70%) murieron durante el ingreso o en los 30 primeros días. La principal causa de muerte fue el shock cardiogénico, motivo por el cual fallecieron 29 (35,80%) pacientes. En la tabla 2 se exponen las características de la intervención y las complicaciones posoperatorias.
Resultados intraoperatorios y posoperatorios
| Características de la intervención | |
| Preferencia | |
| Cirugía electiva | 845 (80,32) |
| Cirugía en el ingreso | 181 (17,21) |
| Cirugía en < 24 h | 24 (2,28) |
| Resucitación de camino a quirófano o previa a inducción anestésica | 2 (0,19) |
| Tamaño de la prótesis implantada | |
| 19 mm | 190 (18,06) |
| 21 mm | 443 (42,11) |
| 23 mm | 335 (31,84) |
| 25 mm | 83 (7,89) |
| 27 mm | 1 (0,10) |
| Cirugía mitral | 76 (7,23) |
| Cirugía tricúspide | 15 (1,43) |
| Cirugía de raíz de aorta o aorta ascendente | 36 (3,42) |
| Número de derivaciones aortocoronarias | |
| Ninguna | 701 (66,63) |
| 1 | 170 (16,18) |
| 2 | 122 (11,61) |
| 3 | 52 (4,95) |
| 4 o más | 7 (0,67) |
| Tiempo de circulación extracorpórea | 85,86 ± 38,89 |
| Tiempo de pinzamiento aórtico | 68,47 ± 26,40 |
| Mortalidad y complicaciones tras la cirugía | |
| Mortalidad previa al alta o < 30 primeros días | 81 (7,70) |
| Intubación > 24 h | 231 (21,96) |
| Accidente cerebrovascular | 26 (2,47) |
| Infarto agudo de miocardio | 102 (9,69) |
| Implante marcapasos definitivo | 36 (3,71) |
| Taquicardia supraventricular sin cardioversión efectiva | 151 (14,52) |
Los datos expresan n (%) o media ± desviación estándar.
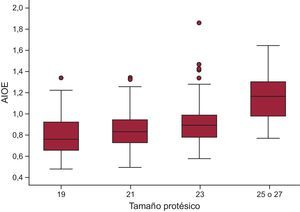
Un total de 3 pacientes (0,31%) presentó insuficiencia aórtica intraprotésica ≥ 2/4 y otros 3 (0,31%) insuficiencia aórtica periprotésica ≥ 2/4 justo después de la intervención. Presentaron DPP moderado 374 (35,55%) y 104 (9,89%) grave. La figura 1 muestra la distribución del área indexada del orificio efectivo para cada número.
La tabla 3 expone la ecocardiografía y el tratamiento al alta.
Ecocardiografía y tratamiento al alta entre los supervivientes al posoperatorio
| Medicación al alta | |
| Antiagregantes/anticoagulantes | |
| Nada | 36 (3,71) |
| Antiagregantes aislados | |
| Simple | 562 (57,88) |
| Doble | 56 (5,77) |
| Anticoagulantes aislados | 234 (24,10) |
| Antiagregantes + anticoagulantes | 83 (8,55) |
| Estatinas | 450 (46,34) |
| Ecocardiografía previa al alta | |
| Gradiente medio (mmHg) | |
| Número 19 mm | 22,14 ± 9,44 |
| Número 21 mm | 17,93 ± 8,47 |
| Número 23 mm | 14,65 ± 6,54 |
| Número 25 o 27 mm | 9,61 ± 4,22 |
| Gradiente máximo (mmHg) | |
| Número 19 mm | 37,86 ± 13,26 |
| Número 21 mm | 30,93 ± 11,00 |
| Número 23 mm | 27,63 ± 9,94 |
| Número 25 o 27 mm | 20,80 ± 6,30 |
| Desajuste paciente-prótesis | |
| No | 557 (57,36) |
| Moderado | 317 (32,65) |
| Grave | 97 (9,99) |
| Insuficiencia aórtica | |
| Intraprotésica | |
| No | 872 (89,80) |
| 1/4 | 96 (9,89) |
| 2/4 | 3 (0,31) |
| 3/4 | 0 (0,00) |
| 4/4 | 0 (0,00) |
| Periprotésica | |
| No | 951 (97,94) |
| 1/4 | 17 (1,75) |
| 2/4 | 2 (0,21) |
| 3/4 | 0 (0,00) |
| 4/4 | 1 (0,10) |
Los datos expresan n (%) o media ± desviación estándar.
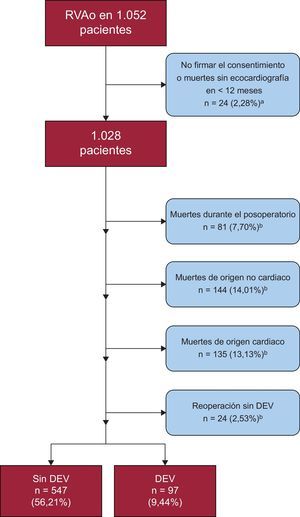
Del total de 1.052 se excluyó a 24 pacientes del análisis por no tener ecocardiografía válida o no firmar el consentimiento. La media de seguimiento de los 1.028 restantes fue de 49,16 ± 30,31 meses y su mediana 49 (25-70) meses.
Durante el seguimiento hubo 135 (13,13%) muertes de origen cardiaco sin evidencia de DEV, 144 (14,01%) fallecidos de origen no cardiaco y a 24 (2,33%) se les cambió la prótesis por motivos diferentes a la DEV (figura 2); a 22 (91,67%) de ellos por endocarditis, y a 2 por insuficiencia periprotésica grave.
Exclusivamente para este estudio, se realizaron 511 nuevas ecocardiografías y se analizaron 5.693. La media de ecocardiografías analizadas por paciente después del alta hospitalaria fue de 4,39 ± 3,31. Noventa y siete pacientes (9,44%) presentaron DEV con una edad media al diagnóstico de 81,03 ± 5,43 años. En la ecocardiografía, el gradiente medio fue de 52,87 ± 17,67mmHg (con una variación de 19 a 81mmHg) y el máximo 88,42 ± 21,06mmHg (con una variación de 25 a 151mmHg). La mayoría de los pacientes (n = 48; 49,48%) presentaban tanto progresión de los gradientes como insuficiencia intraprotésica. Por el contrario, 9 pacientes (9,28%) tenían insuficiencia aórtica aislada. De estos 97 pacientes, 32 (32,99%) se encontraban totalmente asintomáticos en el momento del diagnóstico (tabla 4). Solo se reintervino a 29 (29,89%): 19 mediante valve-in-valve y 10 de forma quirúrgica.
Eventos durante el seguimiento y causas de muerte en pacientes con degeneración estructural valvular
| Eventos durante el seguimiento | |
| Muertes de origen cardiaco | 135 (13,13) |
| Muertes de origen no cardiaco | 144 (14,01) |
| Al menos un reingreso por causa cardiológica | 112 (10,89) |
| Infarto agudo de miocardio | 17 (1,65) |
| Accidente cerebrovascular | 42 (4,09) |
| Reintervención de cirugía abierta por: | |
| DEV | 10 (0,97) |
| Insuficiencia periprotésica | 2 (0,19) |
| Endocarditis | 22 (2,14) |
| Derivación aortocoronaria | 1 (0,10) |
| Otra válvula cardiaca | 5 (0,49) |
| Otros motivos | 4 (0,39) |
| Endocarditis | 30 (2,92) |
| DEV | 97 (9,44) |
| Grado funcional al diagnóstico de DEV | |
| NYHA I/IV | 32 (32,99) |
| NYHA II/IV | 29 (29,90) |
| NYHA III/IV | 31 (31,96) |
| NYHA IV/IV | 1 (1,03) |
| No valorable | 4 (4,12) |
| Causas de muerte en pacientes con DEV | |
| DEV como motivo directo | 20 (66,67) |
| Tumores | 3 (10,00) |
| Accidente cerebrovascular | 2 (6,67) |
| Proceso infeccioso | |
| Endocarditis | 3 (10,00) |
| Otro | 2 (6,67) |
DEV: degeneración estructural valvular; NYHA: New York Heart Association.
Los datos expresan n (%).
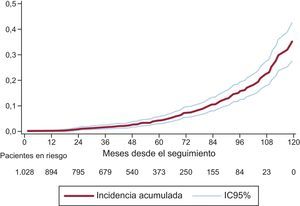
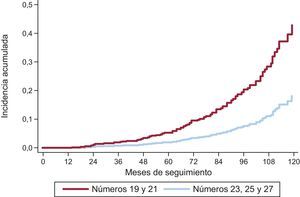
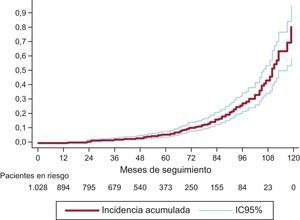
Utilizando el análisis de riesgos competitivos, el porcentaje de DEV a los 3 años fue del 1,59% (IC95%, 0,93-2,56); a los 5 años del 4,22% (IC95%, 2,96-5,81), y a los 8 años del 15,77% (IC95%, 12,46-19,43) (figura 3). La incidencia acumulada fue superior para las válvulas de tamaños pequeños (19 y 21mm). A los 3 años fue del 2,63% (IC95%, 1,53-4,20); a los 5 años del 6,43% (IC95%, 4,48-8,84), y a los 8 años del 20,06% (IC95%, 15,53-25,01). En la figura 4 se compara la incidencia de DEV entre las prótesis 19 o 21mm y el resto. Entre el 25% más joven (edad ≤ 74,11 años), el porcentaje de DEV a los 3, 5 y 8 años fue del 2,14% (IC95%, 0,81-4,64), del 5,75% (IC95%, –3,08 a –9,62) y del 22,33% (IC95%, 15,59-29,83).
Utilizando el análisis de KM (figura 5), la incidencia acumulada a los 3 años fue del 1,77% (IC95%, 1,05-2,98); a los 5 años del 5,19% (IC95%, 3,66-7,33), y a los 8 años del 27,36% (IC95%, 21,58-34,31). Se detectaron importantes diferencias entre ambos análisis (figura 2 del material suplementario).
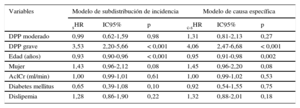
En el modelo de subdistribución de incidencia, el DPP grave (subhazard ratio [sHR] = 3,53; IC95%, 2,20-5,66; p < 0,001) y la edad (sHR = 0,93; IC95%, 0,90-0,96; p < 0,001) demostraron influir en la aparición de DEV. De forma similar, en el modelo de incidencia de causa específica, el DPP grave (causa-especificidad hazard ratio [c-sHR] = 4,06; IC95%, 2,47-6,68; p < 0,001) y la edad (c-sHR = 0,95; IC95%, 0,91-0,98; p = 0,002) demostraron ser factores de riesgo de DEV (tabla 5).
Resultados del modelo de subdistribución de incidencia y del modelo causa específica. Factores de riesgo de desarrollar degeneración estructural valvular
| Variables | Modelo de subdistribución de incidencia | Modelo de causa específica | ||||
|---|---|---|---|---|---|---|
| sHR | IC95% | p | c-sHR | IC95% | p | |
| DPP moderado | 0,99 | 0,62-1,59 | 0,98 | 1,31 | 0,81-2,13 | 0,27 |
| DPP grave | 3,53 | 2,20-5,66 | < 0,001 | 4,06 | 2,47-6,68 | < 0,001 |
| Edad (años) | 0,93 | 0,90-0,96 | < 0,001 | 0,95 | 0,91-0,98 | 0,002 |
| Mujer | 1,43 | 0,96-2,12 | 0,08 | 1,45 | 0,96-2,20 | 0,08 |
| AclCr (ml/min) | 1,00 | 0,99-1,01 | 0,61 | 1,00 | 0,99-1,02 | 0,53 |
| Diabetes mellitus | 0,65 | 0,39-1,08 | 0,10 | 0,92 | 0,54-1,55 | 0,75 |
| Dislipemia | 1,28 | 0,86-1,90 | 0,22 | 1,32 | 0,88-2,01 | 0,18 |
AclCr: aclaramiento de creatinina; DPP: desajuste paciente-prótesis; IC95%: intervalo de confianza del 95%; sHR: subhazard ratio; c-sHR: causa-especificidad hazard ratio.
Durante el seguimiento, 112 pacientes (10,89%) reingresaron por motivos cardiológicos, 42 pacientes (4,09%) con ictus y 17 (1,65%) con infarto de miocardio. Se volvió a intervenir mediante cirugía cardiaca a 63 pacientes (6,13%). El principal motivo fue la endocarditis (n = 22; 2,14%), seguida de la DEV (n = 10; 0,97%) (tabla 4).
De los 97 pacientes diagnosticados de DEV, 30 (30,92%) murieron: 10 (33,33%) por motivos no relacionados con la DEV y 20 (66,67%) como causa directa de su presencia; 5 después de cirugía o implante percutáneo de válvula aórtica, y 15 por insuficiencia cardiaca refractaria a tratamiento o muerte súbita (tabla del material suplementario).
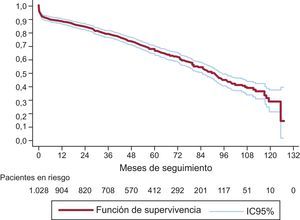
El análisis de KM demostró una supervivencia a los 3, 5 y 8 años del 79,31% (IC95%, 76,65-81,71), 67,69% (IC95%, 64,46-70,69) y 45,16% (IC95%, 40,62-49,59) respectivamente (figura 6).
El modelo de Cox demostró que la edad (HR = 1,03; IC95%, 1,01-1,06; p = 0,009), la diabetes mellitus (HR = 1,39; IC95%, 1,12-1,74; p = 0,003), la enfermedad pulmonar crónica (HR = 1,67; IC95%, 1,31-2,13; p < 0,001), la movilidad reducida (HR = 2,14; IC95%, 1,09-4,18; p = 0,027), el aclaramiento de creatinina (HR = 0,99; IC95%, 0,98-0,99; p = 0,001), la enfermedad vascular periférica (HR = 1,50; IC95%, 1,13-1,98; p = 0,005), la disfunción ventricular (HR = 1,53; IC95%, 1,18-1,97; p = 0,001) y la DEV (HR = 4,59; IC95%, 2,91-7,22; p < 0,001) eran factores de riesgo de fallecer durante el seguimiento.
DISCUSIÓNLa DEV es el mayor inconveniente de las prótesis biológicas. El principal hallazgo de este estudio es que el 4,2% de las prótesis Mitroflow analizadas han degenerado a los 5 años y el 15,8% a los 8 años. En tamaños pequeños (19 y 21mm), el porcentaje de prótesis con DEV es todavía mayor y alcanza el 6,4 y el 20,1% a los 5 y 8 años respectivamente.
Incidencia de degeneración estructural valvular y factores de riesgoSe ha observado una aceleración exponencial en la aparición de DEV a partir del quinto año de seguimiento (figura 3), lo que debe conducir a mantener una especial vigilancia al cumplirse este periodo. Esta aceleración se produce en todos los tamaños protésicos, aunque especialmente en las prótesis de tamaños pequeños (19 y 21mm).
No existe una definición estándar de DEV. Varios trabajos analizaron la supervivencia libre de DEV y definieron este evento como la reintervención por su causa19. En el presente estudio se encontró que solo el 30% de los pacientes con DEV se reintervinieron. Otros estudios encontraron porcentajes incluso menores5. En cualquier caso, la utilización de esta definición infraestima claramente su verdadera incidencia. Otros autores10 definieron la DEV de la misma forma que la estenosis aórtica grave sobre válvula nativa y obviaron que un DPP grave podría ajustarse perfectamente a esta definición.
Sénage et al.5, utilizando una novedosa y razonable definición de DEV, estudiaron a 617 pacientes con una prótesis Mitroflow implantada durante un periodo de seguimiento de 3,8 años. Su principal hallazgo fue una incidencia de DEV del 0,8 y el 8,4% a los 3 y 5 años, respectivamente. Nosotros, con 1.028 pacientes analizados durante un seguimiento medio de 4,1 años y utilizando su misma definición, encontramos una incidencia de DEV del 1,6, el 4,2 y el 15,8% a 3, 5 y 8 años respectivamente. Supone por tanto menor incidencia que la indicada por dichos autores5, aunque mayor de lo que podría parecer según lo publicado para otras bioprótesis. Así, Bourguignon et al.20 publicaron una supervivencia libre de DEV a los 10 años del 86,8%, Anselmi et al.21 del 98,5% y Celiento et al.19 del 100%. No obstante, utilizaron diferentes definiciones19–21, por lo que no es posible asegurar que la prótesis Mitroflow degenere más precozmente que otras.
El DPP se ha señalado como uno de los factores con mayor impacto en la aparición de DEV5,22. El presente estudio confirma este hecho, pero demuestra que el DPP moderado no tiene ningún impacto y que se restringe exclusivamente al grado grave. Paradójicamente, la prótesis Mitroflow se diseñó específicamente para reducir el porcentaje de pacientes con DPP3,4. En consecuencia, debe haber otros motivos que expliquen el elevado porcentaje de DEV. A pesar de especular con ellos, Sénage et al.5 reconocieron que su seguimiento, relativamente corto, les impedía extraer conclusiones. Mientras que una hipótesis sería la ausencia de tratamiento anticalcificante (en cuyo caso la incidencia de DEV aumentaría de forma exponencial a partir del quinto año), otra señalaría la presencia de un defecto esporádico estructural durante los primeros años de seguimiento (en cuyo caso la incidencia aumentaría de forma lineal). La curva de incidencia acumulada obtenida demuestra una aceleración exponencial en el riesgo de aparición de DEV a partir del quinto año del recambio valvular aórtico, apuntando a la primera hipótesis como principal responsable. No obstante, bajo nuestro punto de vista no se puede descartar la combinación de varios factores. Por una parte, la arquitectura de la prótesis (con los velos del pericardio montados externamente al stent) favorece el área valvular, pero puede conducir a que la presión se absorba fundamentalmente por los velos y no por el esqueleto del dispositivo. Por otra, flujos turbulentos propios del DPP pueden conducir a fibrosis y calcificación en una válvula no correctamente tratada con anticalcificantes.
Impacto de la degeneración estructural valvular sobre la mortalidadEste trabajo demuestra que, una vez que aparece la DEV, el riesgo de muerte se encuentra multiplicado por 4,5 y que en este momento constituye el principal factor pronóstico del paciente. Ante esta situación, parece obligatorio estrechar la vigilancia y convocar al equipo multidisciplinario con vistas a tomar una decisión medicoquirúrgica adecuada. Las guías europeas23 recomiendan intervenir a todos los pacientes con DEV sintomáticos y a los asintomáticos de bajo riesgo. En la presente serie solamente se intervino al 30% de los pacientes. Es posible que con una actitud más agresiva o una intervención más precoz se hubiera reducido el impacto de la DEV sobre la mortalidad. No obstante, demostrarlo excede los objetivos de este trabajo y debe investigarse en el futuro.
Eventos competitivosNinguno de los trabajos publicados4,5,8–12 sobre la DEV de la prótesis Mitroflow utilizó un análisis que tratara de forma adecuada los EC. Koller et al.24 demostraron la presencia de estos eventos en la inmensa mayoría de los estudios con seguimiento a largo plazo publicados en las revistas científicas con mayor factor de impacto. Sin embargo, no se trataron de forma adecuada; lo que condujo a extraer conclusiones clínicas erróneas. Como norma general, a mayor incidencia de EC, mayor es la sobreestimación producida al tratarlos como «censurados», y se ha demostrado que porcentajes de EC > 10% requieren análisis específicos que los consideren14.
Durante el seguimiento de pacientes cardiópatas y ancianos, como los intervenidos para implante de prótesis biológicas, el porcentaje de EC es elevado. Así, en la presente serie la edad media fue de 77 años y hubo casi un 40% de EC; lo que está en concordancia con otros trabajos publicados5,8–12.
Este análisis permite obtener resultados robustos en presencia de EC. Los resultados difieren notablemente de los obtenidos con la estimación de KM (figura 2del material suplementario), lo que resalta la necesidad de realizar un análisis adecuado.
LimitacionesEl seguimiento ecocardiográfico dependió del cardiólogo de cada paciente, hecho que produjo que hubiera varios intervalos de tiempo entre 2 ecocardiografías. Los datos son, por tanto, interval-censored y el mid-point imputation que se utilizó es, aunque sólida, una estimación. No obstante, la mayor parte de los pacientes presentaba al menos 1 ecocardiografía anual. Por otra parte, se comprobó que los pacientes fallecidos tuvieran una ecocardiografía realizada durante el año previo a su fallecimiento (todos menos 19). Sin embargo, considerar 1 año es aleatorio y no es posible asegurar que durante ese año el paciente no desarrollará DEV de forma asintomática.
Con un anillo aórtico, generalmente calcificado y pequeño, los pacientes ancianos constituyen una población susceptible de desarrollar DPP. Este hecho podría haber condicionado el porcentaje anormalmente elevado de DPP y DEV de la presente serie y debe tenerse en cuenta a la hora de extrapolar los resultados.
CONCLUSIONESUtilizando una definición basada en el aumento del gradiente transprotésico, la incidencia de DEV de la prótesis Mitroflow es superior a la indicada por otras series, especialmente para las de tamaños pequeños (19 y 21mm) o en pacientes con DPP grave. La aparición de esta complicación se acelera de forma exponencial a partir del quinto año del recambio valvular aórtico, lo que obliga al estricto seguimiento clínico y ecocardiográfico. En ausencia de un tratamiento precoz y eficaz, una vez que la DEV aparece, el riesgo de muerte del paciente se encuentra multiplicado por 4,5.
CONFLICTO DE INTERESESC. Morís es proctor de Corevalve/Medtronic.
- –
La prótesis aórtica Mitroflow es una válvula específicamente diseñada para mejorar el perfil hemodinámico de las prótesis biológicas. Se ha implantado en decenas de miles de pacientes con anillos pequeños y calcificados. Sin embargo, su diseño —junto con la ausencia de tratamiento anticalcificante— ha sembrado la duda sobre su durabilidad.
- –
En esta prótesis, la aparición de DEV se acelera exponencialmente a partir del quinto año. Una de cada 6 degenera a los 8 años de seguimiento y para tamaños pequeños (19 o 21mm) la degeneración alcanza a 1 de cada 5 prótesis. En el momento en que aparece esta complicación tardía, el riesgo de muerte se encuentra multiplicado por 4,5.
A Lola García (técnico de ecocardiografía), por su buen trabajo.