Full English text available from: www.revespcardiol.org/en
En un reciente artículo que publicamos en Revista Española de Cardiología, se explicó en qué consiste el análisis de coste-efectividad: por qué, cuándo, para qué y cómo puede utilizarse1. Para mejorar la toma de decisiones, de máxima importancia para la práctica de una cardiología moderna, presentamos 2 artículos sobre el tema. En este primer artículo, analizamos las decisiones clínicas y de gestión y las formas de priorizar las tecnologías médicas que debemos financiar y usar minimizando daños y maximizando la efectividad, la seguridad y la eficiencia.
LAS DECISIONES CLÍNICAS Y LA CALIDAD DE LA ATENCIÓNLo crucial antes de tomar una decisión preventiva, diagnóstica, terapéutica u organizativa es estimar y comparar los costes y las consecuencias (riesgos, beneficios, resultados en salud esperados) de todas las alternativas disponibles. Cuando los recursos son limitados (lo son, porque no podemos pagar todo lo que queremos hacer), es necesario priorizar las «mejores» alternativas. Las mejores son las que benefician más a más pacientes y perjudican a menos (las más efectivas y seguras) por unidad de recursos consumidos considerando sus expectativas y preferencias y las de la sociedad en su conjunto2–5.
Además de conocimiento clínico, estimar y comparar beneficios, riesgos y costes requiere conocimiento técnico y analítico en epidemiología, estadística y economía. Con frecuencia se carece de la evidencia científica deseada sobre la eficacia, la efectividad, la seguridad y los costes de las alternativas, y en no pocos casos no tenemos evidencia o no sabemos valorarla con rigor. Sobre esto último cabe hacer un diagnóstico diferencial entre incertidumbre e ignorancia médicas (medical ignorance y medical uncertainty). Stricto sensu, hay incertidumbre cuando se carece de información o esta es insuficiente (tratamiento del angiosarcoma del corazón o del adenocarcinoma de páncreas). Hay ignorancia cuando se desconoce la evidencia científica que existe (a veces se expresa como tratamientos o diagnósticos inapropiados)6–8.
Por otro lado, en las decisiones clínicas se incorporan juicios de valor social, que atañen a todos y expresan nuestras preferencias y expectativas sobre la salud, la atención médica y la forma de asignar y gestionar los recursos que tenemos (incluidas las de orden ético, moral, emocional e incluso religioso). Para tomar decisiones incorporando en ellas estas preferencias, además, hemos de deliberar más allá de las métricas y los análisis complejos9–13.
También hay variaciones tanto en la calidad de los estudios realizados para generar evidencia científica como en su interpretación. No todos tenemos las mismas opiniones ni preferencias ni emitimos los mismos juicios de valor. También varía, y muchas veces con discrepancias marcadas, la forma mediante la que cada clínico incorpora y procesa todo ello en sus decisiones médicas y el modo en que cada equipo gestor o de gobierno sanitario toma sus decisiones, asigna recursos y prioriza. A juzgar por los resultados en salud, unos lo hacen técnicamente mejor y de modo socialmente más deseable que otros7.
Lo anterior solo constituye un problema si produce variaciones en las decisiones clínicas que desembocan en diferentes resultados en salud: mejoras de distinto grado en unas personas y daño injustificado y evitable en otras. Los daños asociados con infradiagnósticos, sobrediagnósticos, infratratamientos y sobretratamientos ejemplifican las consecuencias no deseadas de estas variaciones injustificadas. Los atlas de variaciones de la práctica médica cuantifican, informan e ilustran estas variaciones. ¿Por qué, por ejemplo, las tasas de utilización ajustadas por edad, sexo y casuística de la tomografía computarizada, la resonancia magnética y la tomografía por emisión de positrones, de cardiología intervencionista, de artroplastia de cadera, de consumo de diferentes tipos de antibióticos o de cesáreas son hasta 10 y 20 veces más altas en unas zonas que en otras de un mismo país?7,14.
¿A QUIÉN AFECTAN LAS DECISIONES CLÍNICAS INDIVIDUALES?Las decisiones clínicas individuales nos afectan a todos. Imaginemos que en nuestro hospital se decide tratar aguda con tisagenlecleucel, el primer tratamiento autorizado (el pasado 31 de agosto por la Food and Drug Administration) con células CAR-T (linfocitos T con receptores de antígeno quiméricos) a los primeros 5 pacientes jóvenes con leucemia linfoblástica. El precio de la infusión única asciende a 475.000 dólares. Aunque parece ser eficaz en los primeros ensayos clínicos realizados (con pocos pacientes), la incertidumbre actual sobre su eficacia y su seguridad es notable15,16. Imaginemos también que se han de hacer obras de remodelación en 2 servicios, que en la unidad de cuidados intensivos quieren incorporar la oxigenación por membrana extracorpórea (ECMO), en cirugía general, el tratamiento de la carcinomatosis peritoneal con citorreducción e hipertermia, y en urología, un sistema de cirugía robotizada, para todo lo cual, además, se necesita contratar personal y prever gastos de aprendizaje y mantenimiento. Las normas dicen que el presupuesto del hospital no puede aumentarse. Si se decide incorporar estas nuevas tecnologías, ¿cuánta y qué actividad debería reducirse por ese monto si, como a otros servicios, al de cardiología le «tocara» reducir el gasto? Hematólogos, intensivistas y cardiólogos quieren ofrecer el mejor tratamiento disponible a sus pacientes y que estas decisiones no les perjudiquen.
Hay que maximizar la mejora de la salud que pueda conseguirse en el mayor número de personas con los recursos disponibles. Hoy mismo están ingresados pacientes que podrían beneficiarse de estos tratamientos. Pero cada día en el futuro inmediato habrá otros pacientes similares que hoy están sanos; nosotros podemos ser uno de ellos. La regla de gasto impide gastar más que el presupuesto asignado. Por ello, la decisión de un médico individual con un solo paciente influye en los demás que trata hoy y tratará mañana, en los que tratan los demás médicos hoy y en los que serán (seremos) sus pacientes en el futuro. Si se destinan recursos adicionales sin que se pueda reponerlos para pagar nuevas tecnologías con precios más o menos desproporcionados respecto a su valor terapéutico (con eficacia incremental escasa) o con eficacia menor que la de las existentes, unos pacientes hoy y algunos que lo serán mañana saldrán perjudicados. Los recursos que se destinan a un fin dejan de estar disponibles para otro fin.
David M. Eddy denominó a esta encrucijada «el conflicto», un conflicto entre el individuo y la sociedad: entre ese paciente individual mencionado («la primera posición», la llamó Eddy), los demás pacientes actuales de ese médico y otros clínicos, y los del resto de los integrantes de la sociedad, que hoy están sanos y serán pacientes suyos y de los otros en el futuro («la segunda posición»)17,18. Estos últimos y el gasto futuro son apenas visibles. Suelen reducirse a estadísticas, lo que disminuye la percepción del daño que puedan producir mañana las decisiones que se toman hoy. Estas decisiones quizás cambiarían si interiorizáramos estos hechos.
¿Y SI NO PODEMOS PAGAR TODO LO QUE QUEREMOS HACER?Cuando los recursos disponibles son insuficientes para satisfacer todas las necesidades justificadasm debemos priorizar. Desde una perspectiva macro, idealmente hay que garantizar las pensiones, subvencionar escuelas, financiar los nuevos medicamentos para la hepatitis C y tantos otros, construir el Corredor del Mediterráneo, reparar infraestructuras dañadas por el paso del tiempo, comprar cierto tipo de armamento para defensa, financiar la deuda, ayudar a países en desarrollo, invertir en I+D y un largo etcétera. Como los recursos no alcanzan para financiarlo todo, hay que priorizar, y priorizar bien, si se quiere maximizar la salud y el bienestar para el mayor número de personas con los recursos disponibles.
Nadie objetará que el fin último en sanidad (y en otros sectores próximos) es aumentar la salud de toda la población y contribuir así a mejorar el bienestar social. Las necesidades de toda índole de la población «compiten» entre sí por ser satisfechas. Lo queremos todo, pero no es posible, ni todas las necesidades percibidas son reales ni apremiantes. Tampoco es difícil acordar que se priorice a condición de que, con los recursos que tengamos, se haga de tal forma que se maximice el bienestar de cuantos más mejor, sin perjudicar mucho a unos y beneficiar solo un poco a pocos. El problema estriba en cómo hacerlo.
Las necesidades de salud son prioritarias y, por consiguiente, no deben dejar de satisfacerse a expensas de la satisfacción de otras necesidades de la población. Si invertimos en nuevas infraestructuras, dejamos de disponer de esos recursos para sanidad y para los restantes sectores, porque el presupuesto es limitado. En los planos meso y micro ocurre lo mismo. Si incorporamos en nuestro hospital 2 sistemas de cirugía robotizada, un acelerador de protones y la ECMO, los recursos invertidos dejarán de estar disponibles, por ejemplo, para financiar el tratamiento endovascular de la fuga paraprotésica mitral o los marcapasos sin cables y otras nuevas acciones de otros servicios.
Una de las claves de este reto macro, meso y micro estriba en abordarlo considerando el coste de oportunidad de las decisiones que tomemos al priorizar: los beneficios que obtendríamos si, en lugar de aumentar el gasto, por ejemplo, en infraestructuras, lo hiciéramos en la mejor alternativa disponible, fuese esta en sanidad, en medio ambiente, en I+D o en aviones de combate. Como toda decisión tiene su coste de oportunidad, si lo omitimos al tomar decisiones, más pronto o más tarde podemos tener problemas que impidan aumentar o mantener el bienestar de todos, porque dicho coste siempre es salud ganada o perdida5,13,19,20.
Con unas necesidades de salud dadas en cada momento, un presupuesto fijo, unas reglas de gasto y los párrafos anteriores in mente, podemos concluir que la decisión de incorporar una nueva tecnología médica (medicamento, aparato, prueba diagnóstica, intervención quirúrgica, programa de salud, nueva forma de organizar servicios, nuevo sistema de información o centro de evaluación de resultados…) en el conjunto de servicios y prestaciones financiados por el Sistema Nacional de Salud también tiene un coste de oportunidad.
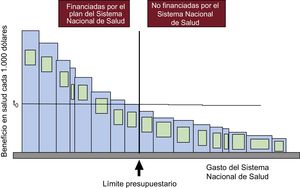
Fijémonos en la figura 1, proveniente de un artículo de uno de los padres de la economía de salud, Culyer, que representa su modelo (the bookshelf guide) para explicar el significado y el uso de los umbrales de coste-efectividad13,20. Cada barra representa una tecnología (medicamentos, pruebas diagnósticas, estrategias, programas, incluidos los de salud pública, veterinaria y medioambiental…). La anchura de cada una combina su coste, el de las tecnologías asociadas con ella (por ejemplo, el electrocardiograma, la prueba de esfuerzo y la coronariografía previos a la colocación de un stent y la medicación y los controles posteriores) y el número de pacientes tratados en un periodo determinado. Su altura es su efectividad por cada 1.000 euros (o la moneda que corresponda a cada país) gastados en ella, la inversa de su razón de coste-efectividad. Podría expresar también los años de vida ajustados por calidad de vida (AVAC) que se ganan por cada 1.000 euros invertidos, es decir, el inverso de su razón de coste-utilidad, definida en el artículo precedente1. De izquierda a derecha, las barras están ordenadas en orden decreciente según su efectividad-coste. Cuanto más a la izquierda, más salud producen por cada 1.000 euros gastados; cuando más a la derecha menos salud producen por cada 1.000 euros. La línea vertical central señala el presupuesto disponible, separa las financiadas (a su izquierda) de las no financiadas (las de su derecha). No hay más recursos para financiar las tecnologías situadas a la derecha de esta línea. El área de cada barra es la salud generada con cada tecnología para ese nivel de gasto. El área bajo el conjunto de barras a la izquierda de la línea de presupuesto es la salud generada por todo el sistema de salud al que pertenece esta figura con la atención sanitaria financiada con ese presupuesto.
Límite presupuestario (vertical) que separa las tecnologías financiadas de las no financiadas por el Sistema Nacional de Salud y umbral de efectividad coste (t0). Reproducido con permiso de Culyer et al.12.
En este caso, no cabe duda de que la priorización de las tecnologías médicas financiadas maximiza la salud que puede generarse con ese presupuesto disponible, porque no hay ninguna tecnología no financiada (a la derecha de la vertical) que sea más coste-efectiva que las financiadas, es decir, con barra más grande a la derecha de la vertical del presupuesto.
También en este caso, la decisión de financiar una tecnología más, esto es, incorporar a la izquierda de la vertical del presupuesto alguna de las tecnologías no financiadas hasta la fecha, primero obliga a reinvertir, a dejar de financiar alguna tecnología hasta la fecha financiada para poder financiar con los recursos liberados la que se incorpora, porque no hay más presupuesto13,20. Segundo, supone indefectiblemente pérdidas de salud (el coste de oportunidad de esta decisión), porque el área de cualquier barra de las tecnologías no financiadas que se desplace a la izquierda de la vertical del presupuesto es menor que la de la menos coste-efectiva de las financiadas (la contigua a la vertical a la izquierda, la que menos salud produce por cada 1.000 euros).
Las no financiadas no son tecnologías inefectivas o no coste-efectivas, sino solamente menos coste-efectivas que cualquiera de las financiadas, incluso que la menos coste-efectiva financiada con el presupuesto dado. Por ello este sistema concreto es eficiente. El umbral de coste-efectividad es la línea horizontal (t0). Este umbral es la razón de coste-efectividad o coste-utilidad de la tecnología menos coste-efectiva de todas las financiadas con ese presupuesto en ese periodo. Esto explica el significado del umbral de coste-efectividad como medida para priorizar desde el lado de la oferta, es decir, desde el de los servicios y prestaciones que puede financiar un sistema de salud con el presupuesto disponible: hasta el valor umbral y con el presupuesto disponible, se financia; por encima del umbral y del presupuesto, no1. Si el umbral es, supongamos, 24.000 euros por AVAC y la razón de coste-efectividad incremental de la nueva tecnología es 22.500 euros por AVAC, se financia; si fuese de 28.000 euros por AVAC, no. Haciéndolo así, el sistema es eficiente, alcanza la máxima efectividad y seguridad clínicas por cada 1.000 euros gastados, siempre, no lo olvidemos, con presupuesto limitado.
Por lo tanto, para financiar una nueva tecnología con este modelo de priorización, no importa su efectividad absoluta (respecto al placebo), sino la relativa o incremental (la comparada con la de la mejor alternativa disponible). Tampoco importa solo su coste relativo. Lo decisivo es la razón de coste-efectividad o de coste-utilidad incremental: la que resulta de dividir la diferencia entre su coste y el de la mejor tecnología alternativa por la diferencia entre su efectividad (o utilidad) y la de esa alternativa. Como este sistema de salud que usamos como ejemplo utiliza el umbral (y los hay que lo usan en realidad), la decisión de priorizar y financiar reside en comparar la razón de coste-efectividad incremental de la nueva tecnología candidata que queremos en la cartera de servicios con la del umbral. Recordemos, hasta el umbral y con el presupuesto disponible, se financia; por encima del umbral y del presupuesto, no1. Haciéndolo así, se es eficiente.
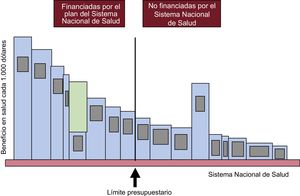
El sentido del umbral también se ilustra en la figura 23,20. Si financiamos tecnologías menos coste-efectivas (la quinta barra contando de izquierda a derecha entre las financiadas) que algunas no financiadas que son más coste-efectivas (como la de mayor área a la derecha del umbral)1, estamos perdiendo salud, exactamente la que representa el área cuadriculada de la quinta barra empezando a contar de izquierda a derecha. (Por ejemplo, si financiamos las tomografías computarizadas en todas las sospechas de pielonefritis, intervenimos esófagos e instalamos una sala de hemodinámica en todos los hospitales, disponemos de un servicio de cirugía cardiaca por cada 300.000 habitantes, hacemos una colonoscopia bienal a todos los varones y una mamografía a todas las mujeres mayores de 50 años, y una ecografía transuretral y una biopsia a todos los que tienen unos resultados del análisis de antígeno prostático específico de 6, y abrimos una unidad de trasplante hepático por cada 500.000 habitantes). Esta área es exactamente el coste de oportunidad de financiar esta tecnología: la ganancia en salud que conseguiríamos (o la pérdida de salud que evitaríamos) si reemplazáramos su financiación por la del área más grande no financiada de la derecha de la barra del presupuesto.
Pérdida de salud por una selección inadecuada de las tecnologías financiadas por el Sistema Nacional de Salud. Reproducido con permiso de Culyer et al.12.
Si se incluyen en la financiación nuevas tecnologías, se ganará salud si y solo si se cumplen 2 condiciones: primera, si estas son más coste-efectivas que la menos coste-efectiva financiada (si lo son más que el umbral) y, segunda, si al financiarlas se dejan de financiar las menos coste-efectivas para liberar recursos y dar cabida a las más coste-efectivas en el presupuesto fijo.
¿PODEMOS PRIORIZAR SIN DAÑAR?Es posible priorizar si dañar. Se estima que entre el 20 y el 30% de las tecnologías médicas que utilizamos en medicina en todo el mundo tienen bajo valor clínico: no son efectivas o seguras o son menos efectivas o seguras o menos coste-efectivas que la menos efectiva, segura y coste-efectiva incluida en la cartera de servicios, en todos los pacientes o solo en subgrupos de ellos, y también que las coste-efectivas que se utilizan de manera inadecuada, más aún si causan daño21–24. Estas tecnologías de bajo valor se conocen. En ellas se basan iniciativas de médicos de instituciones y sociedades científicas de prestigio: listas como el Do not do del NICE británico o el Choosing Wisely, las publicadas en revistas como Annals of Internal Medicine de pruebas diagnósticas e intervenciones de bajo valor, los atlas de variaciones de la práctica médica (que pueden indicar infrautilización o sobreutilización injustificadas) y entre ellos, los de variaciones de utilización de tecnologías de bajo valor, las listas de tecnologías candidatas a «reinversión» de varios países, todas con sus correlatos ya establecidos por algunas sociedades médicas y el Ministerio de Sanidad, Servicios Sociales e igualdad en España25–28.
Entender reinversión como recorte traduce desconocimiento. Desinvertir o reinvertir consiste en sentido estricto en un «proceso explícito mediante el cual se dejan de financiar de manera parcial o por completo medicamentos, dispositivos, aparatos o procedimientos con bajo valor (sin efectividad clínica, no coste-efectivos o cuya efectividad o eficiencia son marcadamente marginales o menores que las de otros disponibles), al tiempo que —esta ampliación semántica es clave— se promueven los de más alto valor clínico y, además, los recursos liberados se destinan a financiar estos últimos»21. La reinversión debe considerar que ciertas tecnologías solo son coste-efectivas en algunos subgrupos de pacientes.
¿Cuál es el problema, entonces? Que, por varios motivos conocidos —que no trataremos en este artículo—, estas recomendaciones se cumplen solo en parte o se incumplen, como ocurre en muchos países, aunque no en todos, a semejanza de lo poco que se siguen las recomendaciones de las agencias de evaluación, sociedades científicas, ministerios, centros universitarios de investigación prominentes y guías de práctica clínica.
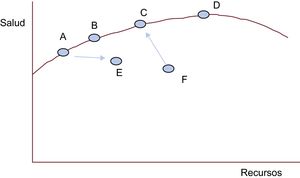
¿Se puede hacer más con menos? DependeVeamos la siguiente función de producción de salud (figura 3)29. Esta función es la representación de un modelo que utilizamos porque lo consideramos útil para que cada uno de nosotros sitúe intuitivamente nuestro centro asistencial respecto a dicha función y analice la validez de una afirmación usada a veces sin fundamento: menos es más.
Función de producción de salud. Elaborado a partir de Chandra et al.29.
El eje x representa todos los recursos utilizados por un sistema nacional, un servicio autonómico, el servicio de un hospital, un hospital o un centro de salud (cada punto) en producir la salud cuantificada en el eje y (aumento de la supervivencia, de la calidad o la esperanza de vida, reducción de la mortalidad o de la morbilidad, complicaciones, discapacidad…). La curva roja se conoce como frontera de posibilidades de producción. Esta curva representa los puntos en que los sistemas o servicios de salud o los centros asistenciales son más eficientes en la producción de salud (y) para cada nivel de recursos disponibles (x).
F produce menos salud de la que podría producir con sus recursos. Con mejor gestión y los mismos recursos podría aproximarse, ascender hacia la frontera, producir más salud, ser, en suma, más eficiente. Además, con menos recursos, F podría hacer más (desplazándose un poco hacia la izquierda y hacia C, como indica la flecha). No se puede pedir más a A, B, C y D con los recursos que tienen (en estos casos, menos no es más). Su eficiencia en la producción de salud es máxima con su modo de gestionar los recursos de que disponen. A y B solo podrían producir más salud si recibieran más recursos y mantuvieran su eficiencia (más es más). D también está en la frontera, como C, pero con muchos más recursos que C solo aumenta muy poco la producción de salud respecto a este. Esto es lo que significa que C es más coste-efectivo que D. Si A se desplaza a E, también será menos coste-efectivo (consume más recursos y produce menos salud). Si D recibe más recursos entrará en rendimientos marginales decrecientes: cuantos más recursos consuma, menos salud producirá. En este caso, más sí es menos.
Se puede priorizar de distintas formas. No pocos lo hacen de cualquier modo. Otros usan las herramientas descritas que permiten, cuando menos, ayudar a maximizar la efectividad, la seguridad y la eficiencia con los recursos disponibles y minimizando daños, siempre con la condición de que se garantice la adecuación en la utilización de las tecnologías médicas. En el siguiente artículo veremos cómo lo que hemos caracterizado como socialmente conveniente para la decisión clínica puede hacerse individualmente atractivo para los clínicos30.
CONFLICTO DE INTERESESNo se declara ninguno.