La insuficiencia cardiaca es la etapa final de muchas enfermedades cardiovasculares, como el infarto agudo de miocardio, y sigue siendo uno de los retos más atractivos para la medicina regenerativa debido a su alta incidencia y prevalencia. A lo largo de los últimos 20 años, la cardiomioplastia, basada en la administración aislada de células con capacidad regenerativa, ha focalizado la mayoría de estudios que han perseguido regenerar el corazón. No obstante, aunque esta terapia se ha mostrado factible en el ámbito clínico, el grado de regeneración del miocardio infartado y de mejoría de la función cardiaca es muy limitado. Ante tal escenario ha emergido la ingeniería tisular cardiaca como una novedosa tecnología basada en el uso de células con capacidad regenerativa, materiales biológicos y/o sintéticos, factores de crecimiento, diferenciación y proangiogénicos, y sistemas de registro online para inducir la regeneración de un órgano o tejido dañado. Un paso más, según algunos estudios pioneros realizados en animales, consiste en la generación de corazones bioartificiales de novo descelularizándolos y preservando sus estructuras de soporte para posteriormente repoblarlos con nuevo tejido muscular contráctil y vascular. Este nuevo abordaje comportaría, finalmente, el trasplante del corazón «reconstruido» restableciendo la función cardiaca del receptor.
Palabras clave
La insuficiencia cardiaca es la etapa final de muchas enfermedades cardiovasculares, como el infarto agudo de miocardio, y sigue siendo uno de los retos más atractivos para la medicina regenerativa actual debido a su alta incidencia y prevalencia1,2. Los pacientes con disfunción cardiaca progresiva muestran un alto riesgo de muerte súbita y, a pesar de los grandes avances de las últimas décadas, únicamente el trasplante cardiaco consigue restablecer completamente la función cardiaca (aunque su uso está limitado por el escaso número de donantes y no está exento de complicaciones). El infarto agudo de miocardio se produce cuando se interrumpe el aporte sanguíneo del corazón provocando una situación irreversible de isquemia miocárdica, pérdida de células musculares cardiacas (cardiomiocitos) y formación de una cicatriz no contráctil3. Por ello, es necesario desarrollar estrategias terapéuticas capaces de proporcionar las bases adecuadas para asegurar una rápida reconstrucción del tejido afectado y renovar eficazmente su capacidad contráctil.
A lo largo de los últimos 20 años, la terapia celular cardiaca (cardiomioplastia), basada en la administración aislada de células con capacidad regenerativa, ha focalizado la mayoría de estudios que han perseguido regenerar el corazón4–7. Los resultados obtenidos en los ensayos clínicos han demostrado que este procedimiento es seguro, aunque muestra un beneficio modesto en cuanto a incremento de la fracción de eyección. En la actualidad, siguen activos varios estudios con la finalidad de confirmar el beneficio clínico de la terapia celular.
Recientemente, se están abordando nuevos procedimientos basados en la combinación de células con capacidad regenerativa, factores de crecimiento proangiogénicos, matrices biológicas, polímeros sintéticos biocompatibles y sistemas de registro online mediante bioimplantes. Este conjunto de técnicas avanzadas recibe el nombre de ingeniería de tejidos8–12. Un paso más, según algunos estudios pioneros realizados en animales, sería generar corazones bioartificiales de novo descelularizándolos y preservando sus estructuras de soporte para repoblarlos con nuevo tejido muscular contráctil y vascular13. Este nuevo abordaje comportaría finalmente el trasplante del corazón «reconstruido» restableciendo la función cardiaca del receptor.
A lo largo de esta revisión analizaremos el estado de estas nuevas aproximaciones de ingeniería tisular, con sus ventajas y limitaciones. Como veremos, su valoración en conjunto nos permite seguir vislumbrando un futuro muy prometedor para la recuperación del miocardio disfuncional.
CARDIOMIOPLASTIA CELULARLa cardiomioplastia tiene como objetivo restaurar el miocardio dañado mediante la implantación aislada de células madre cardiomiogénicas y/o angiogénicas sobre el ventrículo disfuncional5. Los aspectos clave para esta estrategia terapéutica son la elección del tipo celular y la vía de administración más adecuadas.
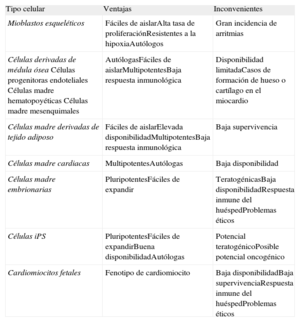
Células con potencial cardiorregenerativoUna fuente celular óptima debería: a) poderse expandir in vitro a gran escala; b) integrarse en el tejido dañado, y c) diferenciarse en nuevos cardiomiocitos acoplados electromecánicamente con el tejido huésped (tabla).
Ventajas e inconvenientes de las células implantadas
| Tipo celular | Ventajas | Inconvenientes |
| Mioblastos esqueléticos | Fáciles de aislarAlta tasa de proliferaciónResistentes a la hipoxiaAutólogos | Gran incidencia de arritmias |
| Células derivadas de médula óseaCélulas progenitoras endotelialesCélulas madre hematopoyéticasCélulas madre mesenquimales | AutólogasFáciles de aislarMultipotentesBaja respuesta inmunológica | Disponibilidad limitadaCasos de formación de hueso o cartílago en el miocardio |
| Células madre derivadas de tejido adiposo | Fáciles de aislarElevada disponibilidadMultipotentesBaja respuesta inmunológica | Baja supervivencia |
| Células madre cardiacas | MultipotentesAutólogas | Baja disponibilidad |
| Células madre embrionarias | PluripotentesFáciles de expandir | TeratogénicasBaja disponibilidadRespuesta inmune del huéspedProblemas éticos |
| Células iPS | PluripotentesFáciles de expandirBuena disponibilidadAutólogas | Potencial teratogénicoPosible potencial oncogénico |
| Cardiomiocitos fetales | Fenotipo de cardiomiocito | Baja disponibilidadBaja supervivenciaRespuesta inmune del huéspedProblemas éticos |
iPS: células madre pluripotentes inducidas.
En este contexto, se han obtenido células madre adultas procedentes de médula ósea, tejido adiposo, músculo esquelético, pulpa dental, sangre periférica, líquido amniótico y líquido sinovial14. Más concretamente, en el campo de la regeneración cardiaca, se han implantado mioblastos esqueléticos por su fácil aislamiento, alta tasa de proliferación y resistencia a la hipoxia15,16. Asimismo, se han testado distintas poblaciones celulares residentes en la médula ósea debido a su gran plasticidad hacia células de linaje cardiogénico y endotelial17: células progenitoras endoteliales18,19, células madre hematopoyéticas4 y células madre mesenquimales20. Como fuente alternativa de células madre mesenquimales, el tejido adiposo subcutáneo permite obtener gran cantidad de células21 que se han aplicado en ensayos clínicos con resultados atractivos22. Además, se han identificado células progenitoras con alto potencial cardiomiogénico y vasculogénico en el tejido adiposo que envuelve el corazón. La implantación de estas células mejora la función cardiaca y reduce el tamaño del infarto en los modelos de rata y ratón7.
Durante muchos años se pensó que el corazón de mamífero carecía de capacidad autorregenerativa. Este dogma se ha desvanecido debido, en parte, al hallazgo de las células madre cardiacas, residentes en el corazón, autorreplicantes y capaces de generar cardiomiocitos, células endoteliales y fibroblastos cardiacos23,24. Estas células se han identificado y aislado mediante los marcadores Sca-1, c-kit, ABCG2 y Islet-123–25 y a partir de la formación de cardioesferas procedentes de explantes de miocardio26. Tal hallazgo ha originado estrategias basadas en la activación de dichas células mediante factores de crecimiento que favorecen su supervivencia y migración celular26,27. Sin embargo, varios estudios han demostrado que las células madre cardiacas implantadas en modelos animales de infarto de miocardio se fusionan con los cardiomiocitos del receptor23,28.
Alternativamente, se han testado las células madre embrionarias debido a su gran capacidad de expansión y posterior diferenciación a cardiomiocitos, células endoteliales y fibroblastos cardiacos29,30. Para evitar el uso de este tipo de células no autólogas y la consecuente terapia inmunosupresora, se han desarrollado células madre pluripotentes inducidas a partir de tejidos somáticos humanos31,32. Como las células embrionarias, las células madre pluripotentes inducidas muestran ilimitada replicación y amplia capacidad de diferenciación. Otro tipo celular utilizado han sido los cardiomiocitos de origen fetal, células capaces de sobrevivir, proliferar y formar discos intercalares con el tejido huésped miocárdico33–35.
Vías de administración celularOtro aspecto determinante para la optimización de la cardiomioplastia es la vía de administración celular. Así, se han testado la inyección intramiocárdica mediante aproximación epicárdica por esternotomía36, la vía endomiocárdica37 y la ruta intracoronaria38. A pesar de que varios estudios abogan por la vía intracoronaria como la ruta que ofrece mayores índices de retención celular intramiocárdica39,40, dicha retención no supera el 10% y la mayoría de células administradas quedan anidadas en otros órganos o mueren41. Independientemente de la ruta de administración utilizada, la cardiomioplastia ha mostrado mejorías modestas sobre la función cardiaca y una limitada supervivencia de las células implantadas en el miocardio fibroso.
LimitacionesLos estudios en modelos animales basados en el uso de las células y vías de administración descritas anteriormente señalan a la cardiomioplastia como una técnica factible, segura y beneficiosa. No obstante, aunque esta terapia se ha mostrado también viable en el ámbito clínico, el grado de regeneración del miocardio infartado y de mejoría de la función cardiaca es muy limitado. Básicamente, se ha observado una escasa supervivencia de las células implantadas bajo las fuerzas mecánicas, y la hipoxia del tejido receptor impide desarrollar su efecto terapéutico42–45. Además, el número de células diferenciadas hacia nuevos cardiomiocitos es extremadamente bajo y al carecer de propiedades electromecánicas el tejido muscular regenerado resulta disfuncional. Por ejemplo, la elevada incidencia de arritmias debido a la falta de acoplamiento electromecánico ha desestimado el uso de mioblastos para tratar pacientes con disfunción cardiaca16,46. Por otro lado, el estado de indiferenciación de las células madre embrionarias genera su proliferación descontrolada dando lugar a formación de teratomas47, mientras que la obtención de células madre pluripotentes inducidas conlleva el uso de infecciones virales que podrían promover también activaciones oncogénicas indeseadas31,32.
Por todo lo expuesto anteriormente, se están desarrollando nuevos enfoques terapéuticos como la ingeniería de tejidos que revisamos detalladamente en las siguientes páginas.
INGENIERÍA TISULAR CARDIACA: BIOPRÓTESIS PARA EL MIOCARDIOLa ingeniería tisular cardiaca es una novedosa y compleja tecnología basada en el uso de combinaciones de células con capacidad regenerativa, materiales biológicos y/o sintéticos, factores de crecimiento, diferenciación y proangiogénicos, y sistemas de registro o monitorización online para inducir la regeneración de un órgano o tejido dañado. Los principales objetivos de la ingeniería tisular cardiaca consisten en generar matrices celulares, establecer acoplamiento celular electromecánico, avalar una función contráctil estable y una vascularización funcional9.
El corazón tiene unas propiedades funcionales dinámicas que requieren de una arquitectura tisular sofisticada con componentes celulares y extracelulares especializados48. Una de las características clave para actuar como motor circulatorio y satisfacer las demandas variables durante el reposo y el ejercicio reside en la arquitectura asimétrica de la banda miocárdica helicoidal49. Recientemente se ha descrito una participación más significativa de la matriz extracelular en los aspectos electromecánicos de lo que previamente se suponía50. El tejido cardiaco artificial ideal debe reproducir estas propiedades estructurales, mecánicas y electrofisiológicas óptimas para mantener viables las células trasplantadas, además de estimular la vasculogénesis en el propio tejido implantado. Así, el uso de materiales poliméricos naturales o sintéticos y de matrices biológicas, aplicados directamente sobre el área infartada o bien utilizados como matriz de soporte, constituye una alternativa a la cardiomioplastia celular.
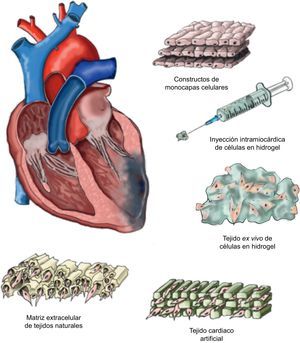
Tipos de matricesEl uso de una matriz, no necesariamente de origen biológico pero sí biocompatible, permite que las células administradas dispongan de una estructura de soporte estable que facilita una correcta localización y retención cerca del tejido que requiere de su efecto terapéutico. La estructura de dichas matrices debe cumplir ciertos requisitos «prácticos», como el mantenimiento de un flujo permanente de nutrientes y oxígeno entre las células dispuestas en su interior y el microambiente que las rodea, y facilitar una migración eficaz y la supervivencia dentro del tejido isquémico. Además, la matriz ideal debería ser biodegradable sin producir ningún producto tóxico, para poder ser finalmente reemplazada por nuevo tejido viable. A continuación se resumen algunos de los abordajes que se han estudiado en el marco de la ingeniería tisular cardiaca hasta la fecha, sin la pretensión de ser exhaustivos (fig. 1).
El cultivo celular en placas de polímeros sensibles a la temperatura permite el desprendimiento de monocapas celulares sin intervención enzimática51. Una vez obtenido el constructo, este se adhiere sobre la zona isquémica para favorecer la implantación intramiocárdica de las células que conforman la monocapa. Se ha reportado nueva formación de vasos sanguíneos y una mejoría funcional mediante la implantación de varias monocapas juntas de células mesenquimales de origen adiposo en el modelo de infarto de miocardio crónico murino52. Sin embargo, mediante el uso de monocapas superpuestas de cardiomiocitos neonatales, se ha observado la generación de uniones intercelulares que permiten una función contráctil y la propagación de señales dentro del propio constructo53. Además, si se intercalan distintas monocapas de células endoteliales se favorece la formación de nuevos vasos dentro de la zona isquémica. A pesar de los beneficios observados mediante el uso de monocapas celulares, dicha estrategia aún carece de carácter translacional, puesto que resulta inviable obtener un constructo de similares características que garantice los mismos resultados en el corazón humano.
Inyección intramiocárdica de células en hidrogelOtro abordaje se ha basado en el desarrollo de distintos tipos de hidrogeles naturales como MatrigelTM (laminina, colágeno tipo IV y heparán sulfato)54, colágeno55 o fibrina56, en los que se embebe la población celular terapéutica para su posterior inyección intramiocárdica. Aunque el efecto del hidrogel sobre la retención celular ha sido positivo54–56, la presión de inyección necesaria para su administración es demasiado elevada y provoca una alta mortalidad celular que disminuye notablemente sus posibles efectos terapéuticos. Asimismo, el uso de hidrogeles compuestos por materiales naturales causa un bajo control de sus propiedades fisicoquímicas y su degradación, además se trata de productos de difícil esterilización y purificación57. Alternativamente, se han desarrollado hidrogeles sintéticos como el polietilenglicol, el ácido poliláctico, el ácido poliláctico-co-glicólico, la policaprolactona, la poliacrilamida y el poliuretano que minimizan dichos inconvenientes58. Sin embargo, su potencial citotóxico está aún bajo estudio y la Food and Drug Administration ha aprobado solamente el uso de polietilenglicol, ácido poliláctico y ácido poliláctico-co-glicólico para aplicación clínica. Se ha demostrado también que el polietilenglicol sensible a las metaloproteinasas de matriz es un material que permite modular su elasticidad y sus parámetros biofísicos y bioquímicos implicados en la diferenciación cardiomiogénica de las células implantadas59. Un método alternativo es el uso de hidrogeles híbridos naturales/sintéticos que aporta las ventajas de ambos tipos de polímeros58.
Formación de tejido ex vivo de células en hidrogelCon el fin de resolver los inconvenientes que generan las inyecciones intramiocárdicas de hidrogeles, se ha estudiado una alternativa fundamentada en la creación de nuevo tejido ex vivo a partir células con potencial cardiovascular previamente incorporadas dentro del hidrogel. De este modo, 2 estudios recientes reportan la capacidad contráctil in vitro de estos constructos compuestos por cardiomiocitos embrionarios10 o neonatales11 de rata. Esta estrategia confiere un ambiente en 3 dimensiones que favorece los contactos intercelulares evitando el proceso de anoikis60 (muerte celular por ausencia de contacto intercelular) y permite la formación de una matriz extracelular propia por parte de las células del constructo61. Si bien es cierto que para avalar un desarrollo tisular óptimo estos nuevos constructos deben ser sometidos a un proceso de mecanoestimulación, o de lo contrario los cardiomiocitos tienden a morir62.
Tejido cardiaco artificialEl microambiente en el que residen las células regenerativas es determinante para el mantenimiento de sus propiedades básicas y su función. De hecho, estudios de microarrays han confirmado que la señalización y respuesta de estas células dependen, en gran medida, de sus interacciones con los componentes de la matriz extracelular en la que residen63. En consecuencia, la ingeniería tisular cardiaca está apostando por nuevas alternativas basadas en la formación de tejido cardiaco artificial funcional tridimensional. Por ejemplo se han desarrollado matrices muy semejantes en cuanto a propiedades fisicoquímicas a la matriz extracelular fisiológica a partir de materiales naturales, como el alginato64 o mezclas de colágeno10, o sintéticos, como el ácido poliláctico65 o el ácido poliglicólico66. Su principal ventaja es que se trata de materiales altamente maleables que permiten variar su forma y tamaño según las necesidades del individuo receptor. El estudio clínico MAGNUM (Myocardial Assistance by Grafting a New Bioartificial Upgraded Myocardium) ha utilizado una matriz de colágeno tipo I de dimensiones suficientes para cubrir completamente la cicatriz miocárdica. Este ensayo comparativo entre la cardiomioplastia aislada y la combinación de cardiomioplastia con ingeniería tisular concluye que esta nueva alternativa ofrece mejores resultados en cuanto a recuperación de función y el remodelado ventricular67. Sin embargo, la similitud de los tejidos cardiacos artificiales testados con la matriz extracelular cardiaca no es perfecta y las células implantadas no colonizan más que la superficie o unos pocos micrómetros de espesor61. Recientemente, se ha creado un consorcio europeo denominado RECATABI (REgeneration of CArdiac Tissue Assisted by Bioactive Implants)68 para el desarrollo de una plataforma de bioingeniería cardiaca donde se combinan biomateriales innovadores (un esqueleto elastomérico e hidrogel-PuraMatrixTM) para mejorar la administración, supervivencia, migración y proliferación de las células implantadas. Los resultados preliminares muestran cierto grado de diferenciación cardiomiogénica de las células implantadas y conexiones vasculares entre los constructos y el miocardio adyacente.
Matriz extracelular derivada de tejidos naturalesLa matriz extracelular está compuesta por proteínas funcionales y estructurales como colágeno, elastina, laminina, fibronectina, proteoglicanos y muchas otras glucoproteínas, combinadas y organizadas espacialmente entre sí según cada tipo de tejido69,70. Se conoce que participa en múltiples procesos y respuestas celulares, incluyendo la proliferación, diferenciación y migración71. Estas propiedades le otorgan atractivo potencial como estructura de soporte en técnicas de ingeniería tisular cardiaca para implantar células regenerativas que sustituyan al miocardio dañado. Además existe la posibilidad de que esta matriz extracelular implantada pueda sustituir la del tejido dañado, contribuyendo de manera más eficaz a su regeneración. Se ha conseguido aislar láminas de matriz extracelular a partir de una gran variedad de tejidos incluyendo válvulas cardiacas72–74, vasos sanguíneos75,76, piel77, nervios78, músculo esquelético79, tendones80, ligamentos81, submucosa de intestino delgado82, vejiga urinaria83 e hígado84.
Para su correcta aplicación, las láminas de matriz extracelular deben ser convenientemente separadas del tejido nativo, descelularizadas y, a menudo, desinfectadas, liofilizadas y esterilizadas85. Cabe considerar que este complejo procesado puede alterar la integridad y la arquitectura de la matriz. El uso de tejido animal como fuente de obtención, particularmente de tejido porcino, resuelve la escasez crítica de tejido humano para aplicaciones quirúrgicas86.
El protocolo ideal de descelularización de matrices naturales es aquel capaz de eliminar selectivamente los antígenos alogénicos y xenogénicos, así como todo el contenido celular y nuclear del tejido preservando su composición, propiedades fisiológicas, integridad mecánica de la matriz extracelular y estructura vascular87,88. Este proceso combina tratamientos físicos, químicos y enzimáticos específicos, según el tipo de tejido que se va a tratar79,83,89,90.
Numerosos estudios han demostrado que la implantación de matriz extracelular facilita el remodelado de distintos tipos de tejidos, tanto en modelos animales como en el ámbito clínico83,89,91–97. Experimentalmente, en distintos modelos animales se ha reportado la colonización de las matrices extracelulares implantadas por células tanto de linaje cardiomiogénico como endotelial evitándose así el proceso de remodelado ventricular98–101. Sin embargo, cuando se trata de una matriz extracelular de origen miocárdico, los resultados ya implican una mejoría en la función cardiaca con presencia de cardiomiocitos en la región del implante102. Publicaciones recientes han demostrado que el uso de matrices extracelulares miocárdicas con la preservación de su arquitectura tridimensional es una alternativa clave para facilitar el soporte y la diferenciación celular necesarios para favorecer el proceso de regeneración cardiaca13,103–109.
Acoplamiento celular electromecánico y función contráctilEn condiciones fisiológicas, el estiramiento mecánico de los cardiomiocitos está inducido por las señales eléctricas cardiacas y el acoplamiento entre el pulso eléctrico y las contracciones celulares, y es crucial para el desarrollo del miocardio14. Así, es de vital importancia que las técnicas de ingeniería tisular cardiaca garanticen un acoplamiento celular electromecánico y una función contráctil adecuadas dentro de los constructos generados. Con este fin se han diseñado estructuras de colágeno y MatrigelTM en forma de anillo colonizadas por cardiomiocitos neonatales de rata y sometidas a estimulación mecánica10. Tras su implantación sobre el miocardio isquémico de rata, estas estructuras anulares siguen siendo contráctiles de manera autónoma y son responsables de un incremento del grosor de la pared ventricular infartada y una mejoría de la función cardiaca. Otro abordaje se basa en la inducción de contracciones sincronizadas en la matriz celular mediante estimulación eléctrica110,111. Como resultado, los pulsos eléctricos dan lugar a una notable organización ultraestructural y acoplamiento celular de los cardiomiocitos residentes en la matriz. Como contrapartida, estos constructos contienen cardiomiocitos alogénicos y son demasiado pequeños para su aplicación clínica.
Recientemente se ha iniciado un estudio en el modelo porcino de infarto agudo de miocardio basado en la implantación de una matriz bioactiva con un sistema de monitorización online. Mediante impedancia eléctrica, este sistema permite valorar la progresión de la cicatriz cardiaca in situ y evaluar los cambios eléctricos que de ella se derivan112,113. Este nuevo abordaje permitirá, en un futuro, evaluar de forma no invasiva las mejorías funcionales que puedan obtenerse tras la administración celular mediante ingeniería tisular cardiaca.
Vascularización funcionalUno de los aspectos clave que persiguen las técnicas de ingeniería tisular cardiaca es promover fenómenos de vascularización dentro de la matriz bioartificial que permitan una difusión continua de nutrientes y oxígeno hacia su interior, y que, posteriormente, puedan favorecer la migración e incorporación de las células dentro del miocardio dañado. Se han probado distintas aproximaciones para garantizar este proceso. Por ejemplo, formando parte del constructo se han incluido distintos factores de crecimiento, como el factor de crecimiento endotelial vascular114 o el factor de crecimiento de fibroblastos de tipo básico115, para que estimulen la formación de estructuras vasculares a partir de las propias células madre mesenquimales116 y/o células progenitoras endoteliales117 del constructo, o bien se han añadido citocinas movilizadoras para que se incorporen células progenitoras endoteliales del propio receptor una vez realizada la implantación. En conjunto, este abordaje promueve la infiltración celular y la formación de vasos sanguíneos con resultados muy prometedores114–119. Otras alternativas incluyen el uso de biorreactores in vitro para mejorar la perfusión de oxígeno a través de las células implantadas dentro de la matriz previamente canalizada, para facilitar la migración de células progenitoras endoteliales hacia el interior de los constructos generados14.
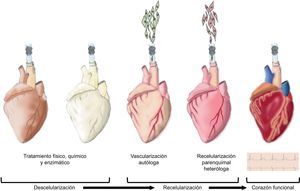
NEOORGANOGÉNESIS: CORAZÓN BIOARTIFICIALLos estudios de descelularización con matriz extracelular anteriormente comentados constituyen la prueba de concepto para la obtención de corazones descelularizados. Hasta la fecha, los procesos de descelularización por inmersión directa han sido suficientes para generar matrices de soporte a partir de distintos tejidos cardiovasculares, incluyendo la pared vascular120, el pericardio121,122 y las valvas valvulares123,124. En cambio, para poder descelularizar un corazón entero, se ha demostrado que la perfusión coronaria con detergentes es el método más eficaz. Así, en 2008, se consiguió descelularizar corazones cadavéricos de ratas, obteniendo una compleja matriz extracelular cardiaca con el árbol vascular preservado, válvulas competentes y la geometría intacta de las aurículas y los ventrículos13. Posteriormente, se recelularizaron estos constructos con células endoteliales (vascularización autóloga) y células cardiacas neonatales (recelularización heteróloga parenquimal) mediante perfusión coronaria en un biorreactor simulando la fisiología cardiaca y favoreciendo la maduración del órgano (fig. 2). Tras 8 días de incubación fisiológica y estimulación eléctrica se detectaron contracciones macroscópicas con una función de bomba equivalente al 2% del corazón adulto o al 25% de la función cardiaca de un feto de 16 semanas13.
Neorganogénesis: corazón bioartificial. Esquema gráfico de los diferentes pasos de la descelularización y recelularización de un corazón. Inicialmente la descelularización física, química y enzimática cuyo objetivo es la preservación de la matriz extracelular cardiaca y del árbol vascular. A continuación se induce la vascularización autóloga seguida de la recelularización parenquimal heteróloga para, finalmente, generar un nuevo corazón funcional.
Estudios más recientes han reportado la descelularización de corazones porcinos como modelo escalable al humano105,109. Un aspecto importante que hay que considerar en la aplicación de órganos enteros o matrices bioartificiales, es la necesidad de obtener una correcta vascularización sin la cual la viabilidad del constructo pueda verse comprometida. Este problema resulta especialmente crítico cuando el espesor de la matriz es superior a la barrera de difusión (unos 100μm), donde el suministro de oxígeno y nutrientes queda limitado y se acumulan subproductos celulares de desecho citotóxicos103,125. Con la descelularización de corazones enteros se ha conseguido mimetizar el tejido miocárdico vascularizado y repoblarlo con células a través de estructuras vasculares con cierto grado de preservación13,105,109. A pesar de su éxito, esta estrategia puede verse limitada con respecto a las tecnologías disponibles para la expansión de células a gran escala, particularmente de cardiomiocitos, necesaria para la repoblación de todo el órgano103,126. Todavía queda camino por recorrer hasta poder disponer de un corazón bioartificial para su uso en humanos. Sin embargo, un grupo de investigación español pionero en este campo está llevando a cabo, como primera prueba de concepto, el desarrollo de un corazón bioartificial mediante la descelularización de corazones humanos, y su posterior recelularización con células mesenquimales humanas y cardiomiocitos de origen murino127.
CONCLUSIONES Y PERSPECTIVAS DE FUTUROAunque los resultados de los estudios anteriormente mencionados son claramente esperanzadores y muchos han demostrado una mejoría notable en la función contráctil cardiaca, todavía quedan por definir muchas cuestiones. A día de hoy, el gran inconveniente en la mayoría de estudios de ingeniería tisular reside en la dificultad de extrapolación del modelo animal de rata/ratón al modelo porcino y, consecuentemente, al ámbito clínico. El tamaño del corazón humano hace que dichas aproximaciones sean inviables, tanto por las dimensiones de la matriz (debería ser de 10-50cm2 y de varios milímetros de grosor14) como por el número limitado de células que puedan llegar a ser implantadas.
Ante tal escenario, nuestro grupo de investigación ha diseñado una nueva técnica quirúrgica basada en la transposición de un pedículo adiposo autólogo de origen pericárdico sobre la superficie miocárdica isquémica. Esta nueva propuesta ofrece resultados muy prometedores en el modelo preclínico porcino de infarto de miocardio, puesto que el pedículo graso establece conexiones vasculares con el miocardio infartado128,129 y, como consecuencia, garantiza una mejoría funcional cardiaca en términos de fracción de eyección y volúmenes cardiacos128. Actualmente estamos incluyendo pacientes de manera prospectiva y aleatorizada (Clinicaltrials.gov NCT01473433) para valorar la efectividad y seguridad de este nuevo abordaje quirúrgico130. En el ámbito clínico, todavía son pocos los ensayos basados en la aplicación de la ingeniería tisular cardiaca. Otros 2 ensayos clínicos vigentes se basan en la inyección intramiocárdica de alginato (NCT01311791) o la administración intracoronaria de alginato sódico combinado con gluconato cálcico (NCT01226563), con el fin de generar una nueva matriz extracelular en el miocardio para que los progenitores cardiacos residentes en él migren y repueblen la cicatriz cardiaca.
Pese a los ingentes avances en el campo de la ingeniería tisular cardiaca, quedan por discernir múltiples cuestiones cruciales para restablecer completamente la función cardiaca y la vascularización del miocardio isquémico. Primero, es clave determinar qué tipo celular (células adultas, embrionarias o células madre pluripotentes inducidas; autólogas o heterólogas) es idóneo para obtener regeneración tisular. Segundo, se debe definir qué matriz (hidrogeles naturales o sintéticos, colágeno, ácido poliláctico, ácido poliláctico-co-glicólico, matriz extracelular) ofrece mejores condiciones para anidar la población celular y favorecer su retención y proliferación. Tercero, la existencia del acoplamiento celular electromecánico dentro de la matriz y del constructo con el tejido que hay que reparar es fundamental para restaurar la función cardiaca. Finalmente, la vascularización del constructo determinará su propia viabilidad e integración con el tejido receptor, además de convertirse en el aporte sanguíneo preciso para revertir la isquemia miocárdica.
FINANCIACIÓNRed de Terapia Celular - TerCel (RD12/0019/0029), Red Cardiovascular (RD12/0042/0047), European Comission 7th Framework Programme (RECATABI, NMP3-SL-2009-229239), Ministerio de Educación y Ciencia (SAF2011-30067-C02-01) y Fundació Marató TV3 (122232).
CONFLICTO DE INTERESESNinguno.