Hay muy poca evidencia sobre las tasas de trombosis del stent (TS) en pacientes que reciben tratamiento antiagregante plaquetario doble (TAPD) con ticagrelor o prasugrel. El objetivo de este estudio es analizar la incidencia y predictores de la TS tras un síndrome coronario agudo en pacientes que reciben TAPD con ticagrelor frente a prasugrel.
MétodosSe utilizaron datos del registro RENAMI (REgistry of New Antiplatelet therapy in patients with acute Myocardial Infarction), y se analizó en total a 4.123 pacientes con síndrome coronario agudo dados de alta con TAPD con ticagrelor o prasugrel en 11 centros de 6 países europeos. Se consideró como evento la TS confirmada en el primer año. Se realizó un análisis de riesgos competitivos mediante un modelo de regresión de Fine y Gray, siendo la muerte el evento competitivo.
ResultadosRecibieron TAPD con ticagrelor 2.604 pacientes y con prasugrel, 1.519; 41 pacientes (1,10%) presentaron TS, con incidencias acumuladas similares entre ticagrelor (1,21%) y prasugrel (0,90%). Los predictores independientes de la TS fueron: la edad (sHR = 1,03; IC95%, 1,01-1,06), la elevación del segmento ST (sHR = 2,24; IC95%, 1,22-4,14), el antecedente de infarto de miocardio (sHR = 2,56; IC95%, 1,19-5,49) y la creatinina sérica (sHR = 1,29; IC95%, 1,08-1,54).
ConclusionesLa TS es infrecuente en pacientes que reciben TAPD con ticagrelor y prasugrel. La edad avanzada, la elevación del segmento ST, el antecedente de infarto y la creatinina sérica son las variables que se asocian con mayor riesgo de TS.
Palabras clave
En los pacientes con síndrome coronario agudo (SCA) hay un exceso de activación plaquetaria. En estos pacientes, la terapia antiplaquetaria es vital para prevenir nuevos eventos isquémicos1. En los últimos años se han desarrollado nuevos agentes antiplaquetarios como el prasugrel y el ticagrelor. Ambos fármacos mostraron mayor eficacia en la reducción de la trombosis del stent (TS) en comparación con el clopidogrel2,3. Sin embargo, los datos disponibles sobre el impacto del uso de prasugrel y ticagrelor en la reducción de la TS proceden principalmente de resultados de ensayos clínicos, y es escasa la información de pacientes de la práctica clínica. Por otro lado, muy pocos estudios han comparado el beneficio terapéutico, en términos de reducción de la TS, de prasugrel frente a ticagrelor4–7.
El objetivo de este estudio es evaluar, desde un punto de vista descriptivo-analítico, la incidencia y los predictores de la TS en pacientes con SCA que reciben tratamiento antiagregante plaquetario doble (TAPD) con ácido acetilsalicílico más prasugrel o ticagrelor empleando datos de un registro internacional de pacientes sometidos a revascularización coronaria percutánea.
MÉTODOSPoblación de estudioEl RENAMI (REgistry of New Antiplatelet therapy in patients with acute Myocardial Infarction) es un registro retrospectivo, observacional, multicéntrico e internacional, en el que participaron voluntariamente 11 centros de 6 países europeos (España, Italia, Suiza, Grecia, Serbia y Reino Unido). Se trata de un registro no financiado cuyo objetivo era profundizar en el conocimiento sobre las complicaciones isquémicas y hemorrágicas de los pacientes con SCA tratados con TAPD con prasugrel o ticagrelor. Todos los centros participantes son hospitales universitarios de tercer nivel que disponían de sala de hemodinámica las 24 h, con registros clínicos internos sobre SCA. En cada uno de los centros participantes se incluyó a pacientes con SCA y estenosis coronarias ≥ 50% en el tronco de la coronaria izquierda y ≥ 70% en el resto del árbol coronario) sometidos consecutivamente a intervención coronaria percutánea (ICP) a los que se dio el alta con TAPD de ácido acetilsalicílico (100 mg/24 h) más prasugrel (10 mg/24 h) o con ácido acetilsalicílico (100 mg/24 h) más ticagrelor (90 mg/12 h), en cualquier momento entre enero de 2012 y enero de 2016. El diseño del registro RENAMI y los criterios de inclusión y exclusión se describen en detalle en el material suplementario. Las variables incluidas en el RENAMI se listan en la tabla 1 del material suplementario y los centros participantes, en la tabla 2 del material suplementario. Los SCA se clasificaron en infarto agudo de miocardio con elevación del segmento ST (IAMCEST), infarto agudo de miocardio (IAM) sin elevación del segmento ST y angina inestable, según las definiciones aceptadas en las guías de práctica clínica8-10. Los diagnósticos de IAM se basaron en la definición universal de IAM11. El diagnóstico de angina inestable se estableció en presencia de síntomas que lo indicaran o evidencia objetiva de isquemia miocárdica en la prueba de estrés, junto con la detección de una lesión culpable en la coronariografía.
Para el propósito del RENAMI, se diseñó una base de datos que incluyó retrospectivamente información acerca de variables clínicas, analíticas y angiográficas, así como datos relativos a mortalidad y eventos isquémicos y hemorrágicos. Los análisis del registro RENAMI corrieron a cargo de 2 investigadores del centro de coordinación (E. Abu-Assi y S. Raposeiras-Roubín). Todo ello se realizó según lo establecido en la Declaración de Helsinki y con la aprobación de los comités de ética locales.
En este estudio, de los 4.424 pacientes del registro RENAMI, se excluyó a los que no tenían disponible información sobre el tipo de stent implantado (n = 297) y a los que se implantó un stent farmacoactivo (SFA) de primera generación (n = 4). De modo que la cohorte final de estudio se compuso de 4.123 pacientes.
Objetivo, definición y seguimientoEl objetivo del estudio fue la TS en pacientes que recibían TAPD con ticagrelor o prasugrel, considerando como tal la trombosis confirmada según la definición del Academic Research Consortium (confirmación angiográfica o anatomopatológica)12. Las TS se clasificaron en precoces (las que ocurrían en el primer mes tras la ICP) y tardía (las que ocurrían entre 1 y 12 meses tras la ICP). Asimismo las TS precoces se subdividieron en agudas (primeras 24 h) y subagudas (entre los días 1 y 30). Las TS que tuvieron lugar en fase aguda antes de la administración de prasugrel o ticagrelor (caso de pacientes tratados inicialmente con TAPD con clopidogrel) se excluyeron de los eventos, ya que el objetivo era estudiar las TS de los pacientes en TAPD con ticagrelor o prasugrel. El tiempo de seguimiento se dio por finalizado en caso de que ocurrieran TS (n = 41), muerte (n = 72), suspensión/retirada de la TAPD antes del primer año tras la ICP (n = 382) o haber alcanzado los 12 meses de seguimiento.
En la tabla 3 del material suplementario se presenta el análisis de un objetivo combinado de muerte y/o TS. Dicho análisis secundario se realizó debido al reducido número de eventos registrados en forma de TS.
Los datos sobre el estado vital (vivo o muerto) y el evento (TS) se obtuvieron de los registros de datos clínicos hospitalarios, así como de registros administrativos (registros de estadísticas vitales, datos de alta hospitalaria y datos del departamento de urgencias), y se recurrió al contacto telefónico con los pacientes o sus familiares y los médicos de atención primaria en casos particulares de los que no se disponía de información.
Según el informe de la Sociedad Europea de Cardiología y la Asociación Europea de ICP13, se consideró SFA de nueva generación a todos los que surgieron después de los stents de primera generación, entendiéndose como stent de primera generación el CYPHER de sirolimus, el TAXUS de paclitaxel y el Endeavor de zotarolimus. Así, por SFA de nueva generación se entiende el XIENCE V (Abbott Vascular; Illinois, Estados Unidos) o Promus (Boston-Scientific; Massachusetts, Estados Unidos) con everolimus; el Resolute (Medtronic; Minnesota, Estados Unidos) con zotarolimus, el Yukon DES (Translumina GmbH; Hechingen, Alemania) con sirolimus y Nobori (Terumo, Japón) y Biomatrix (Biosensors, Singapore) con biolimus. También se consideraron SFA de nueva generación los stents bioabsorbibles.
Análisis estadísticoLas variables continuas se presentan en forma de media ± desviación estándar. Las variables discretas se expresan en porcentajes. Las variables continuas se compararon con la prueba de la t de Student y las discretas, con la prueba de la χ2 o la exacta de Fischer, según fuera necesario.
Para el estudio de los factores predictores de TS, se desarrolló un modelo de regresión de Fine y Gray para riesgos competitivos14, siendo la muerte el evento competitivo. Todas las variables que se asociaron (p < 0,10) con TS en el análisis univariable se incluyeron en un modelo multivariable. No hubo evidencia de incumplimiento del supuesto de riesgos proporcionales, comprobado mediante el estudio de la interacción de las covariables en los modelos con el tiempo: en ausencia de significación estadística (p > 0,05), se deduce que no se vulnera la hipótesis de riesgos proporcionales. Para dar cuenta de la potencial heterogeneidad que surge de la inclusión de centros de diferentes países de Europa, se incluyó un término de interacción en el modelo final a través de un análisis de agrupamiento no jerárquico por grupo (país). La capacidad predictiva del modelo final se calculó mediante el índice c, usando la función c-index de la extensión «pec» para R. Los resultados de expresaron como subhazard ratio (sHR) con su correspondiente intervalo de confianza del 95% (IC95%).
Las curvas de la función de incidencia acumulada se representaron gráficamente para ticagrelor y prasugrel, tras estimarse la curva de la función de incidencia acumulada mediante un modelo paramétrico flexible para riesgos competitivos15, ajustado por las variables que se asociaron (p < 0,10) con mayor incidencia de TS en el análisis univariable (tabla 1) y fueron: la edad, el antecedente de infarto de miocardio, la presentación como IAMCEST, la fracción de eyección del ventrículo izquierdo < 40% y la creatinina sérica.
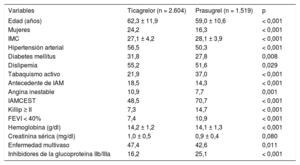
Características basales de la población de estudio, dividida según tomara doble antiagregación con ticagrelor o con prasugrel
| Variables | Ticagrelor (n = 2.604) | Prasugrel (n = 1.519) | p |
|---|---|---|---|
| Edad (años) | 62,3 ± 11,9 | 59,0 ± 10,6 | < 0,001 |
| Mujeres | 24,2 | 16,3 | < 0,001 |
| IMC | 27,1 ± 4,2 | 28,1 ± 3,9 | < 0,001 |
| Hipertensión arterial | 56,5 | 50,3 | < 0,001 |
| Diabetes mellitus | 31,8 | 27,8 | 0,008 |
| Dislipemia | 55,2 | 51,6 | 0,029 |
| Tabaquismo activo | 21,9 | 37,0 | < 0,001 |
| Antecedente de IAM | 18,5 | 14,3 | < 0,001 |
| Angina inestable | 10,9 | 7,7 | 0,001 |
| IAMCEST | 48,5 | 70,7 | < 0,001 |
| Killip ≥ II | 7,3 | 14,7 | < 0,001 |
| FEVI < 40% | 7,4 | 10,9 | < 0,001 |
| Hemoglobina (g/dl) | 14,2 ± 1,2 | 14,1 ± 1,3 | < 0,001 |
| Creatinina sérica (mg/dl) | 1,0 ± 0,5 | 0,9 ± 0,4 | 0,080 |
| Enfermedad multivaso | 47,4 | 42,6 | 0,011 |
| Inhibidores de la glucoproteína IIb/IIIa | 16,2 | 25,1 | < 0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IAMCEST; infarto agudo de miocardio con elevación del segmento ST; IMC: índice de masa corporal.
Los valores expresan porcentaje o media ± desviación estándar.
El análisis combinado de muerte y TS (figura del material suplementario) se ha realizado mediante un modelo de Cox; se compararon las curvas de ticagrelor y prasugrel mediante test de log rank y el método del tiempo medio de supervivencia restringido16.
Los análisis estadísticos se llevaron a cabo con Stata 13.1 y R versión 3.3.1. Se consideró resultado estadísticamente significativo si p < 0,05.
RESULTADOSCaracterísticas de la población de estudioEn la tabla 1 se muestran las características clínicas de la población de estudio, comparada por uso de ticagrelor y prasugrel. Como se puede apreciar, hay diferencias muy marcadas entre los patrones de prescripción de ambos fármacos.
En relación con la TAPD, el 63,2% (n = 2.604) recibieron ticagrelor y el 36,8% (n = 1.519), prasugrel. La media del tiempo de seguimiento fue 10,9 ± 2,9 meses. El 82,9% de los pacientes completaron los 12 meses de seguimiento con TAPD (el 94,4% > 6 meses; el 88,4% > 9 meses).
En relación con el tipo de stent, los metálicos se emplearon en el 29,2% de los pacientes (n = 1.205) y los SFA de nueva generación, en el 70,8% restante (n = 2.918). Dentro del grupo de pacientes tratados con SFA, solamente el 4,0% recibió stents bioabsorbibles (n = 117). El 24,8% recibió stents recubiertos de zotarolimus; el 24,4%, de everolimus; el 12,8%, de biolimus y el 3,1%, de sirolimus. Del 30,9% restante, se sabe que recibió SFA de nueva generación (no bioabsorbibles) sin especificarse el tipo de stent.
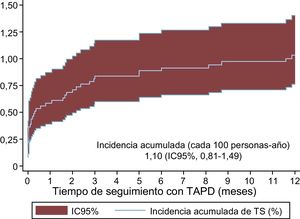
Incidencia de trombosis del stentDel total de 4.123 pacientes con SCA tratados con TAPD con ticagrelor y/o prasugrel, 41 presentaron una TS en el primer año (1,10/100 personas-año; IC95%, 0,81-1,49) (figura 1). El 58,6% del total de TS fueron precoces al ocurrir en el primer mes (el 36,6% en las primeras 24 h y el 22,0% entre el primer día y el primer mes). El 41,5% de las TS ocurrieron de forma tardía, entre el primer mes y el primer año.
En cuanto al tipo de stent, no hubo diferencias significativas entre las incidencias acumuladas de TS con los stents metálicos (0,83%; IC95%, 0,43-1,60) y con los SFA de nueva generación (1,20%; IC95%, 0,85-1,70). Respecto a los stents bioabsorbibles, los recibieron 127 pacientes, de los que solo 1 tuvo TS en el primer año.
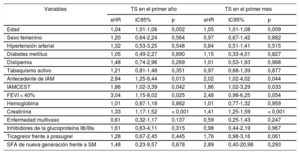
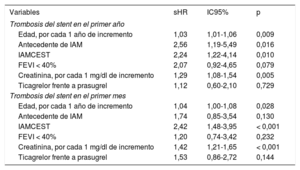
Predictores de la trombosis del stentLa tabla 2 muestra la asociación existente entre las variables clínicas analizadas y la mayor incidencia de TS en el primer año en el análisis univariable. Tras el análisis multivariable, resultaron predictores independientes de TS en el primer año la edad, el IAMCEST, el antecedente de IAM y la creatinina sérica (tabla 3). La capacidad discriminativa del modelo final fue buena, con un c-index de 0,70. Si nos limitamos a la TS en el primer mes, en el análisis univariable resultaron significativas las mismas variables (tabla 2). Sin embargo, tras el ajuste multivariable, únicamente resultaron predictores independientes de la TS precoz la edad, el IAMCEST y la creatinina sérica (tabla 3).
Análisis univariable de las trombosis del stent en el primer año y en el primer mes
| Variables | TS en el primer año | TS en el primer mes | ||||
|---|---|---|---|---|---|---|
| sHR | IC95% | p | sHR | IC95% | p | |
| Edad | 1,04 | 1,01-1,06 | 0,002 | 1,05 | 1,01-1,08 | 0,009 |
| Sexo femenino | 1,20 | 0,64-2,24 | 0,564 | 0,97 | 0,67-1,42 | 0,882 |
| Hipertensión arterial | 1,32 | 0,53-3,25 | 0,548 | 0,84 | 0,51-1,41 | 0,515 |
| Diabetes mellitus | 1,05 | 0,49-2,27 | 0,890 | 1,15 | 0,33-4,01 | 0,827 |
| Dislipemia | 1,48 | 0,74-2,96 | 0,269 | 1,01 | 0,53-1,93 | 0,968 |
| Tabaquismo activo | 1,21 | 0,81-1,48 | 0,351 | 0,97 | 0,68-1,39 | 0,877 |
| Antecedente de IAM | 2,84 | 1,25-6,44 | 0,013 | 2,02 | 1,02-4,02 | 0,044 |
| IAMCEST | 1,86 | 1,02-3,39 | 0,042 | 1,86 | 1,02-3,29 | 0,033 |
| FEVI < 40% | 3,04 | 1,15-8,02 | 0,025 | 2,48 | 0,98-6,25 | 0,054 |
| Hemoglobina | 1,01 | 0,87-1,18 | 0,862 | 1,01 | 0,77-1,32 | 0,959 |
| Creatinina | 1,33 | 1,17-1,52 | < 0,001 | 1,41 | 1,25-1,59 | < 0,001 |
| Enfermedad multivaso | 0,61 | 0,32-1,17 | 0,137 | 0,59 | 0,25-1,43 | 0,247 |
| Inhibidores de la glucoproteína IIb/IIIa | 1,61 | 0,63-4,11 | 0,315 | 0,98 | 0,44-2,19 | 0,967 |
| Ticagrelor frente a prasugrel | 1,28 | 0,67-2,45 | 0,445 | 1,76 | 0,98-3,16 | 0,061 |
| SFA de nueva generación frente a SM | 1,48 | 0,23-9,57 | 0,678 | 2,89 | 0,40-20,98 | 0,293 |
FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; SFA: stent farmacoactivo; sHR: subhazard ratio; SM: stent metálico; TS: trombosis del stent.
Análisis multivariable para la predicción de la trombosis del stent en el primer año y particularmente en el primer mes
| Variables | sHR | IC95% | p |
|---|---|---|---|
| Trombosis del stent en el primer año | |||
| Edad, por cada 1 año de incremento | 1,03 | 1,01-1,06 | 0,009 |
| Antecedente de IAM | 2,56 | 1,19-5,49 | 0,016 |
| IAMCEST | 2,24 | 1,22-4,14 | 0,010 |
| FEVI < 40% | 2,07 | 0,92-4,65 | 0,079 |
| Creatinina, por cada 1 mg/dl de incremento | 1,29 | 1,08-1,54 | 0,005 |
| Ticagrelor frente a prasugrel | 1,12 | 0,60-2,10 | 0,729 |
| Trombosis del stent en el primer mes | |||
| Edad, por cada 1 año de incremento | 1,04 | 1,00-1,08 | 0,028 |
| Antecedente de IAM | 1,74 | 0,85-3,54 | 0,130 |
| IAMCEST | 2,42 | 1,48-3,95 | < 0,001 |
| FEVI < 40% | 1,20 | 0,74-3,42 | 0,232 |
| Creatinina, por cada 1 mg/dl de incremento | 1,42 | 1,21-1,65 | < 0,001 |
| Ticagrelor frente a prasugrel | 1,53 | 0,86-2,72 | 0,144 |
FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; sHR: subhazard ratio.
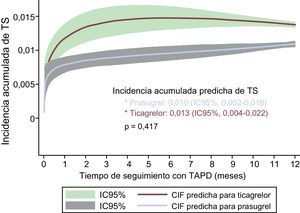
La incidencia acumulada de la TS observada en el primer año con ticagrelor fue del 1,21% (IC95%, 0,53-1,56) y con prasugrel, del 0,90% (IC95%, 0,84-1,76). No hubo diferencias estadísticas entre ambos fármacos en lo que respecta al riesgo de TS en el primer año (ticagrelor frente a prasugrel, sHR = 1,29; IC95%, 0,67-2,45; p = 0,445). En la figura 2 se muestran las curvas ajustadas de la incidencia acumulada de TS estimada con ticagrelor y prasugrel en el primer año. En cuanto a las TS en el primer mes, tampoco hubo diferencias significativas entre ticagrelor y prasugrel (el 0,7 frente al 0,4%; p = 0,144).
Incidencia acumulada de TS estimada según el tipo de antiagregante, tras ajuste por edad, antecedente de infarto de miocardio, presentación como infarto de miocardio con elevación del segmento ST, fracción de eyección del ventrículo izquierdo < 40% y creatinina sérica. CIF: curva de la función de la incidencia acumulada; IC95%: intervalo de confianza del 95%; TAPD: tratamiento antiagregante plaquetario doble; TS: trombosis del stent.
No se encontró asociación alguna del riesgo de TS con ticagrelor frente a prasugrel ni con los pacientes tratados con stents metálicos (ticagrelor frente a prasugrel, sHR = 1,40; IC95%, 0,35-5,56; p = 0,635) ni con los tratados con SFA de nueva generación (sHR = 1,23; IC95%, 0,58-2,58; p = 0,587).
DISCUSIÓNLos hallazgos más interesantes de este estudio se pueden resumir en 4 puntos: a) la incidencia de TS en los pacientes con SCA que recibieron TAPD con ticagrelor o prasugrel es baja, y el mayor riesgo se da en el primer mes; b) la edad, el antecedente de infarto, la presentación como IAMCEST y la función renal son los principales predictores de TS en los pacientes tratados con ticagrelor y prasugrel; c) en los pacientes que recibieron TAPD con ticagrelor y prasugrel, no se encontraron diferencias de riesgo de TS entre los stents metálicos y los SFA de nueva generación, y d) en general no hubo diferencias entre prasugrel y ticagrelor en cuanto al riesgo de TS en el primer año, aunque son necesarios estudios de mayor potencia para comparar con precisión ambos fármacos en este sentido.
La incidencia anual de TS es muy variable y muy dependiente de la interacción de diferentes factores, como el tipo de población de estudio (con o sin SCA), el tipo de antiagregante empleado (clopidogrel o los nuevos inhibidores del P2Y12) y el tipo de stent (stents metálicos, SFA de primera generación, SFA de nueva generación, SFA bioabsorbibles)17–19. Así, oscila entre el 0,5 y el 1,5% en el primer año y un 50-70% ocurre en el primer mes20,21, datos similares a los nuestros. El presente estudio se centra en una población contemporánea de pacientes con SCA (más del 50% con IAMCEST) todos ellos tratados con TAPD con ticagrelor (63,2%) o prasugrel (36,8%) y recibieron stent metálico (29,2%) o SFA de nueva generación (70,8%). En este contexto poblacional, se indican las incidencias de TS en pacientes con TAPD en curso (ya que el fin de esta era motivo de censura en el seguimiento, como se explica en «Métodos»), lo cual es uno de los puntos fuertes de este estudio. Esto es realmente interesante, pues se presenta un escenario ideal para mitigar la TS: tratamiento con stents que no sean SFA de primera generación y TAPD con los nuevos y más potentes inhibidores del P2Y12. En este grupo poblacional se presenta una incidencia acumulada de TS en el primer año del 1,1% (del 0,6% en el primer mes), pese a tratarse de pacientes que reciben TAPD con ticagrelor o prasugrel. Esto traduce la complejidad de la TS en cuanto a su fisiopatología, ya que intervienen múltiples factores interrelacionados, aparte de la TAPD. Así, en el registro PESTO (Morphological Parameters Explaining Stent Thrombosis), se observó mediante tomografía de coherencia óptica una anormalidad mecánica del stent implantado en el 97% de los pacientes con TS22. Recientemente, un estudio de Cuesta et al.23 también demostró mediante tomografía de coherencia óptica que el mecanismo predominante en el 39% de las TS precoces es la malaposición del stent.
En cuanto a la predicción del riesgo de TS, resultaron predictores independientes de TS en pacientes en tratamiento con TAPD con ticagrelor o prasugrel la elevación persistente del segmento ST, el antecedente de IAM y la insuficiencia renal. Estos factores son comunes a otros estudios y traducen situaciones de mayor trombogenicidad (IAMCEST, IAM recurrente, disfunción ventricular) y coagulopatías (edad, insuficiencia renal)24–27.
Respecto al tipo de antiagregante, tanto del ticagrelor como del prasugrel, se demostró en sus ensayos clínicos pivotales una marcada reducción de las TS en comparación con el clopidogrel. En el estudio PLATO se observó una reducción de la incidencia a 1 año de TS confirmada del 33% con ticagrelor respecto a clopidogrel (el 1,93 frente al 1,37%; hazard ratio [HR] = 0,67; IC95%, 0,50-0,90; p = 0,009)2, que se confirmó después en el SWEDEHEART28. En el estudio TRITON, la incidencia a 15 meses de TS confirmada pasó del 2,2% en el grupo de clopidogrel al 1,1% en el de prasugrel3. Sobre población de la «vida real», es decir, más allá de la incluida en los ensayos clínicos, hasta ahora se dispone de datos indirectos procedentes de muy pocos registros4–7. En nuestro estudio, no se encontraron diferencias estadísticamente significativas entre ambos fármacos (ticagrelor y prasugrel) en la incidencia acumulada de TS al año (el 1,2% con ticagrelor, el 0,9% con prasugrel) ni a los 30 días (el 0,7% con ticagrelor, el 0,4% con prasugrel). Aunque hasta la fecha había poca evidencia sobre la verdadera incidencia de TS con prasugrel y ticagrelor en el contexto de un SCA, los datos obtenidos concuerdan con los publicados de los estudios más recientes. En el estudio PRAGUE6, en el contexto del IAMCEST, la incidencia de TS confirmada a 1 mes fue del 0,9% con ticagrelor y el 0,5% con prasugrel, que tampoco es significativa estadísticamente, limitada por el pequeño tamaño muestral (634 pacientes con prasugrel y 596 con ticagrelor). Previamente, Larmore et al.5 publicaron datos de un registro estadounidense de pacientes con SCA, con un tamaño muestral considerable (13.134 pacientes con prasugrel y 2.964 con ticagrelor). Esos autores observaron tasas de TS a 30 días del 0,7% con ticagrelor y el 0,3% con prasugrel, con asociación estadísticamente significativa a favor de prasugrel en el análisis univariable, aunque tras el emparejamiento por puntuación de propensión ese beneficio se diluyó (riesgo relativo = 0,56; IC95%, 0,26-1,20; p = 0,131). Así pues, dada la concordancia de los datos entre los diferentes estudios, parece razonable plantear si la ausencia de significación estadística entre ticagrelor y prasugrel para la TS se debe a un problema de potencia de los diferentes estudios (para que una diferencia como la obtenida fuese significativa con una incidencia de TS similar a la que nosotros indicamos, con IC95% y potencia del 80%, el tamaño muestral necesario sería superior a 14.000 pacientes) o a las diferencias en las características basales entre los pacientes tratados con ticagrelor y con prasugrel. Esto lleva a generar una hipótesis de trabajo interesante para próximos estudios, con vistas a determinar si efectivamente el prasugrel frente al ticagrelor disminuye el riesgo de TS, sobre todo de TS precoz. Aunque esta depende mucho de variables del procedimiento, se sabe que la reactividad plaquetaria residual pese al tratamiento se ha asociado con un marcado aumento del riesgo de TS precoz. De hecho, el factor que por sí solo se asocia con mayor riesgo de TS precoz es la ausencia de inhibición del receptor P2Y12 plaquetario29. Sin embargo, las comparaciones entre ambos fármacos en cuanto a inhibición plaquetaria fueron similares, incluso mejor con ticagrelor30–33, por lo que, desde el punto de vista farmacodinámico, es difícil de entender.
En relación con el tipo de stent, en este estudio no se encontraron diferencias entre ticagrelor y prasugrel en las tasas de TS de los pacientes tratados con stents metálicos o SFA de nueva generación. La evidencia actual que compara ambos tipos de stent muestra resultados equivalentes o incluso favorables a los SFA de nueva generación en cuanto a trombogenicidad34,35, si bien se basa en población que, en su gran mayoría, recibió TAPD con clopidogrel, cuya inhibición plaquetaria es más lenta y variable que la producida por el ticagrelor y el prasugrel. Se ha propuesto que los revestimientos con polímeros más biocompatibles de los nuevos SFA pueden reducir la trombogenicidad asociada con la interacción entre la sangre y el stent36, pero poco se sabe de la interacción entre el tipo de stent y el tipo de antiagregante plaquetario. En este sentido, el estudio aporta nueva información, al indicar tasas de TS en pacientes que tomaban TAPD con ticagrelor o prasugrel en función del tipo de stent (metálico o SFA de nueva generación) que se les implantó. En nuestro registro, no se han encontrado diferencias significativas entre stent metálico y SFA de nueva generación, si bien es cierto que el estudio no estaba diseñado para tal fin.
LimitacionesLas 2 principales limitaciones del estudio radican en su naturaleza retrospectiva y en el tamaño muestral. El hecho de ser un estudio retrospectivo conlleva las limitaciones inherentes a este tipo de estudios. Concretamente las comparaciones realizadas entre el ticagrelor y el prasugrel o entre stents metálicos y SFA se deben interpretar con cautela, por la posible interacción de variables de confusión no medidas, ya que no es un estudio aleatorizado y dichos tratamientos están a discreción del médico responsable del paciente. Por ejemplo, en el RENAMI no se aporta información sobre las características angiográficas, que tienen un papel importante sobre todo en la TS precoz del stent, como el flujo TIMI (Thrombolysis In Myocardial Infarction) tras la ICP, el diámetro/longitud del stent, la disección coronaria residual no tratada, la alta carga trombótica residual, etc. Tampoco se dispone de información sobre a cuántos pacientes se realizaron pruebas de imagen intracoronaria tras la ICP para comprobar la correcta expansión del stent. Por otro lado, el tamaño muestral del estudio, con un total de 4.123 pacientes, es insuficiente para llegar a conclusiones robustas, dada la escasa frecuencia del evento en estudio (TS), como ya se comentó. Sin embargo, dadas la alta letalidad que supone la TS y la escasa evidencia científica disponible sobre dicho evento en pacientes en TAPD con ticagrelor o prasugrel, el presente estudio —aun con un enfoque más descriptivo que analítico— tiene interés científico a la hora de generar hipótesis para estudios científicos posteriores (ensayos clínicos o metanálisis).
CONCLUSIONESLa TS fue infrecuente entre los pacientes que tomaban TAPD con ticagrelor o prasugrel. Se identificaron 4 predictores independientes que se asociaron con mayor riesgo de TS: el antecedente de infarto, la presentación en forma de IAMCEST, la edad y la creatinina sérica. El tipo de antiagregante y el tipo de stent no se asociaron con mayor riesgo de TS en el presente estudio. Se necesitan diseños con mayor potencia para realizar estudios comparativos entre el prasugrel y el ticagrelor en referencia a la protección contra la TS.
CONFLICTO DE INTERESESE. Abu-Assi es Editor Asociado de Revista Española de Cardiología.
- –
La TS es una complicación temida tras la revascularización coronaria percutánea, por su alta letalidad. Sin embargo actualmente, con el empleo de stents metálicos y SFA de nueva generación, su incidencia es realmente infrecuente. Por otro lado, se ha demostrado una reducción de la tasa de TS tanto con el ticagrelor como con el prasugrel en comparación con el clopidogrel.
- –
Más allá de los ensayos clínicos (PLATO y TRITON-TIMI), poco se sabe acerca de la incidencia y los predictores de TS en pacientes que reciben TAPD con ticagrelor o prasugrel. Este estudio analiza tanto la incidencia como los predictores de TS tras un SCA en pacientes que tomaban TAPD con ácido acetilsalicílico y ticagrelor o ácido acetilsalicílico y prasugrel tras la revascularización percutánea con stents metálicos o SFA de nueva generación.