En general, la oclusión percutánea de la orejuela de la aurícula izquierda (OAI) se guía por ecocardiografía transesofágica (ETE) bidimensional (2D) y fluoroscopia. Sin embargo, determinar el tamaño adecuado de los dispositivos requeridos sigue siendo una etapa difícil de este procedimiento. Es más, cualquier avance que permitiera minimizar la manipulación en el interior de la OAI y facilitar el proceso de implante sería bien recibido1.
Los modelos cardiacos tridimensionales (3D) personalizados generados mediante impresión 3D permiten disponer de réplicas de la anatomía humana basadas en técnicas de imagen como la tomografía computarizada multicorte, la resonancia magnética y la ecocardiografía 3D. Esta nueva tecnología tiene importantes repercusiones en muchas especialidades médicas, y la literatura le está prestando cada vez más atención2,3. Los modelos físicos de la oclusión de la OAI tienen especial interés, ya que la anatomía es compleja; incluso con las técnicas de imagen más modernas, resulta difícil valorar las interacciones entre el dispositivo y la orejuela4.
Se presenta nuestra experiencia preliminar con modelos de impresión 3D de la OAI personalizados, con los siguientes objetivos: a) apreciar mejor la anatomía, la localización y las relaciones de la OAI; b) facilitar la determinación del tamaño del dispositivo adecuado, y c) optimizar la planificación de la oclusión de la OAI.
En este análisis inicial, se incluyó a 10 pacientes con fibrilación auricular y una indicación clínica para la oclusión de la OAI. Para estos 10 pacientes, se segmentaron las imágenes de tomografía computarizada multicorte (con el programa gratuito ITK-PANS) y se crearon mallas 3D para la impresión 3D (220°C; 10mm/s; 0,1mm de altura de capa; 0,8mm de grosor de la pared) con un método ya establecido3 (figura 1).
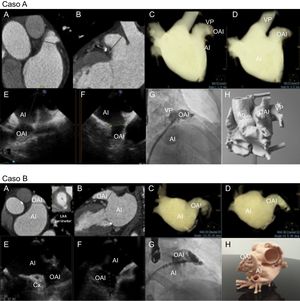
Exploraciones de imagen multimodales de la OAI en los casos A y B. A y B: mediciones cardiacas mediante tomografía computarizada. C y D: obtención mediante tomografía computarizada del volumen de la aurícula izquierda en las proyecciones de trabajo. E y F: proyecciones de la ecocardiografía transesofágica (45° y 135°) que muestran la zona de implante. G: proyección fluoroscópica craneal oblicua anterior derecha. H: modelo de impresión tridimensional. AI: aurícula izquierda; Ao: aorta; Cx: circunfleja; OAI: orejuela de la aurícula izquierda; VP: vena pulmonar.
Cada modelo de OAI tuvo un coste de producción de 500 euros y se tardó de 24 a 48h en elaborarlo. Los modelos impresos se utilizaron entonces en la fase de formación/ensayo. Se desplegaron dispositivos de oclusión de la OAI caducados en esta zona de unión para determinar: a) dispositivo ideal; b) tamaño apropiado del dispositivo, y c) diversas orientaciones dentro de la OAI que conducían al éxito o al fracaso de la oclusión percutánea. Se determinaron la idoneidad del dispositivo mediante el examen visual de la deformación anatómica (en un trasfondo de OAI especificado) y la viabilidad de la aplicación, en un modelo auricular 3D flexible (figura 2).
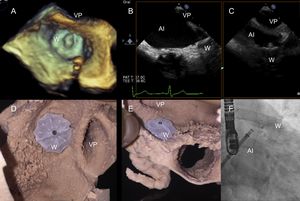
Fase de ensayo ex vivo y resultado final de la oclusión de la orejuela de la aurícula izquierda. A: ecocardiografía transesofágica tridimensional. B y C: ecocardiografía transesofágica bidimensional. D y E: modelo de impresión tridimensional. F: proyección fluoroscópica craneal oblicua anterior derecha. AI: aurícula izquierda; VP: vena pulmonar; W: dispositivo de Watchman.
Según se observó, los diámetros medios de la OAI mostraban alto grado de correlación en las comparaciones de las técnicas de imagen: tomografía computarizada frente a ETE 2D (coeficiente de correlación de Pearson [r]=0,98; p<0,0001), fluoroscopia frente a ETT 2D (r=0,92; p<0,0001) y tomografía computarizada frente a fluoroscopia (r=0,96; p<0,0001). Sin embargo, los valores medios generados con la ETE 2D (21,9±3,8 mm) y la fluoroscopia (22,2±3,7 mm) fueron significativamente inferiores a los registrados con la tomografía computarizada (23,1±3,8 mm; p<0,001 y p=0,02 respectivamente). No obstante, todos los tamaños de dispositivo establecidos mediante la impresión 3D reflejaron plenamente los obtenidos en realidad, sin fuga circunferencial alguna. No se registraron eventos adversos en el seguimiento a los 30 días.
Es de destacar que Budge et al.1 han descrito una correlación similar entre las mediciones de la OAI realizadas con tomografía computarizada multicorte y con ETE 2D. Por otra parte, Otton et al.5 han mostrado que es posible obtener aproximaciones exactas del tamaño del dispositivo (que se subestima con la ETE) con modelos de impresión 3D. Por último, Pellegrino et al.6 han documentado 2 casos de dispositivos del tamaño exacto e implantados de manera óptima basándose en un modelo de impresión 3D (las estimaciones de la ETE y de la fluoroscopia fueron también bajas).
Desde nuestro punto de vista, la elaboración de modelos físicos de impresión 3D personalizados es muy prometedora respecto a la determinación del tamaño adecuado del dispositivo en circunstancias difíciles, la información aportada sobre las interrelaciones anatómicas de la OAI y las estrategias técnicas viables específicas para el dispositivo. También tiene un potencial en la correspondiente formación de los profesionales, al esclarecer los objetivos y las limitaciones de la oclusión de la OAI. Por otra parte, se necesitan más estudios clínicos para validar sus usos y las cuestiones logísticas son motivo de cierta preocupación. Aunque los modelos cardiacos 3D y la tecnología de impresión 3D hoy tienen mayor difusión y son más asequibles, la dedicación de tiempo, dinero y esfuerzo que requieren continúan siendo un obstáculo para su uso clínico cotidiano.
FINANCIACIÓNPara este estudio se recibió financiación de St. Jude Medical, Inc. (Minnesota, Estados Unidos). El patrocinador no intervino en modo alguno en el diseño del estudio, la obtención, el análisis y la interpretación de los datos ni en la redacción del artículo. Esta investigación fue financiada conjuntamente por el Instituto de Salud Carlos III, subvención de investigación del FIS número PI14/00180 del Ministerio de Ciencia e Innovación de España.
CONFLICTO DE INTERESESI. Cruz-González es supervisor clínico de St. Jude Medical y Boston Scientific.
Agradecemos a los Dre. Israel Valverde, Xavier Freixa y Oscar Alcade su colaboración voluntaria y la revisión de este estudio.