Hay escasa información sobre la utilización del implante valvular aórtico transcatéter en pacientes con estenosis aórtica grave y aorta de porcelana. El objetivo primario del estudio es analizar la mortalidad total tras el implante de una válvula percutánea CoreValve® en pacientes con estenosis aórtica grave, con y sin aorta de porcelana.
MétodosEstudio multicéntrico, observacional y prospectivo. Se implantó una válvula aortica percutánea a 449 pacientes con estenosis aórtica grave calcificada en tres hospitales. De ellos, 36 (8%) reunían criterios de aorta de porcelana. El objetivo primario fue la mortalidad total a 2 años.
ResultadosEl grupo con aorta de porcelana presentó con mayor frecuencia arteriopatía extracardiaca (11 [30,6%] frente a 49 [11,9%]; p = 0,002), revascularización coronaria previa (15 [41,7%] frente a 98 [23,7%]; p = 0,017) y dislipemia (26 [72,2%] frente a 186 [45%]; p = 0,02). En este grupo se utilizó con mayor frecuencia anestesia general (15 [41,7%] frente a 111 [16,9%]; p = 0,058) y acceso axilar (9 [25%] frente a 34 [8,2%]; p = 0,004). El porcentaje de éxito del procedimiento (el 94,4 frente al 97,3%; p = 0,28) y la incidencia de complicaciones (7 [19,4%] frente a 48 [11,6%]; p = 0,20) fueron similares en ambos grupos. No hubo diferencias estadísticamente significativas en el objetivo primario a los 24 meses de seguimiento (8 [22,2%] frente a 66 [16%]; p = 0,33). La presencia de complicaciones durante el implante (hazard ratio = 2,6; intervalo de confianza del 95%, 1,5-4,5; p = 0,001) fue la única variable predictora del objetivo primario.
ConclusionesEl implante percutáneo con la prótesis autoexpandible CoreValve® en pacientes con estenosis aórtica y aorta de porcelana rechazados para cirugía de recambio valvular, es factible y seguro.
Palabras clave
La estenosis valvular aórtica es la lesión valvular cardiaca más frecuente en el mundo occidental. La principal etiología es la degenerativa y su incidencia está en continuo aumento debido al incremento en la esperanza de vida1–3. En los últimos años, el implante transcatéter de prótesis valvular aórtica (TAVI) se ha consolidado como una alternativa segura y eficaz al tratamiento quirúrgico de la estenosis valvular aórtica grave sintomática en pacientes con contraindicación o elevado riesgo quirúrgico4–8. El amplio desarrollo y la constante innovación de esta técnica hacen que el TAVI suponga una alternativa que abre el horizonte a nuevas indicaciones9.
Para la evaluación del riesgo quirúrgico de estos pacientes se utilizan escalas validadas; las más empleadas son el EuroSCORE (European system for cardiac operative risk evaluation) y el STS (Society of Thoracic Surgeons)2–9, pero hay algunas características clínicas, entre las que se encuentra la aorta de porcelana (AoP), que estas escalas de evaluación no consideran2,10.
Los pacientes con esta afección frecuentemente no son candidatos a tratamiento quirúrgico por la elevada complejidad técnica y la elevada tasa de complicaciones, especialmente cerebrovasculares embólicas11.
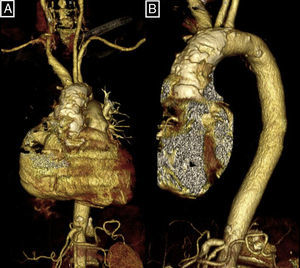
La AoP es una enfermedad estructural de la pared aórtica definida como la calcificación extensa y circunferencial de la aorta torácica (fig. 1), determinada mediante tomografía computarizada o fluoroscopia11,12.
La frecuencia de presentación de AoP en pacientes con estenosis aórtica tratados con TAVI es variable, entre el 10 y el 35%2,12; la AoP y los malos accesos vasculares son las dos razones principales para indicar el acceso transapical en el TAVI13.
El conducto apicoaórtico y el implante quirúrgico de prótesis valvular aórtica «sin suturas» son dos alternativas quirúrgicas, de eficacia no demostrada, al tratamiento clásico de la estenosis aórtica con AoP concomitante14,15. En ocasiones, la AoP puede pasar inadvertida y ser un hallazgo intraoperatorio una vez realizada la esternotomía16–18.
Hay escasa información sobre los resultados del TAVI en pacientes con AoP, y lo publicado se limita a casos clínicos o series cortas11,13,16,19. Aunque la mayoría de las series publicadas de TAVI incluyen a pacientes con AoP, este aspecto no se ha estudiado de manera específica2,11,13.
El objetivo de este estudio es presentar los resultados de mortalidad total obtenidos con el TAVI en pacientes con estenosis aórtica grave sintomática y AoP y compararlos con los obtenidos en pacientes sin esta afección de la pared aórtica.
MÉTODOSEstudio multicéntrico, observacional y prospectivo. Desde diciembre de 2007 hasta abril de 2012, se incluyeron en el estudio los datos de todos los pacientes con estenosis aórtica grave sintomática tratados mediante TAVI en tres centros españoles: Hospital Universitario Virgen de la Victoria de Málaga (233 pacientes, 19 con AoP), Hospital Clínico Universitario de Santiago de Compostela (101 pacientes, 9 con AoP) y Hospital Universitario Central de Asturias (115 pacientes, 8 con AoP).
Las variables clínicas, de procedimiento y del seguimiento se recogieron según un protocolo preespecificado común a los tres centros y se incluyeron después en una base de datos centralizada específicamente diseñada para este estudio. El seguimiento se llevó a cabo mediante visita presencial en la consulta de cardiología.
Todos los pacientes tenían estenosis aórtica grave sintomática. Los criterios adicionales de inclusión fueron: área valvular aórtica < 1 cm2 (< 0,6 cm2/m2); anillo valvular aórtico comprendido entre 20 y 27mm; diámetro de aorta ascendente a nivel de la unión sinotubular ≤ 40 (prótesis de 26 mm) o ≤ 43 mm (prótesis de 29 mm).
Cada caso fue evaluado por un equipo multidisciplinario formado por cardiólogos clínicos, intervencionistas y cirujanos cardiacos encargado de determinar la indicación del tratamiento mediante TAVI. Este equipo también fue el encargado de confirmar la existencia de AoP y sentar el criterio de inoperabilidad por AoP entre, al menos, dos cirujanos cardiacos miembros del equipo de decisión. El diagnostico de AoP se realizó mediante tomografía computarizada (presencia de calcificación circunferencial de la aorta ascendente) o fluoroscopia (presencia de calcificación difusa y general de las paredes de la aorta ascendente en al menos dos proyecciones ortogonales)2,4,5,10,12,13,17. Hubo 2 pacientes remitidos para TAVI tras una esternotomía por presencia de AoP que impedía el pinzamiento aórtico.
Antes del implante, en todos los casos se realizaron las siguientes exploraciones: coronariografía, aortografía de aorta ascendente, angiografía del territorio iliofemoral y ecocardiogramas transtorácico y transesofágico. La tomografía computarizada con contraste se realizó a criterio del grupo evaluador. Para la evaluación del riesgo quirúrgico se utilizó la escala de riesgo EuroSCORE logístico.
ProcedimientoLa prótesis utilizada fue la CoreValve ReValving System® de Medtronic (tamaños 26 y 29 mm). El implante se realizó en el laboratorio de hemodinámica, con anestesia general o local en combinación con sedación profunda, según el criterio del anestesista responsable del procedimiento. Se administró cobertura antibiótica profiláctica con cefalosporinas, o vancomicina en caso de alergia a los betalactámicos, a todos los pacientes. El acceso vascular se realizó por vía femoral o axilar cuando el eje iliofemoral no lo permitía. Los detalles de la técnica del implante y el manejo hospitalario de los pacientes se han descrito previamente7,8. Se dio seguimiento a todos los pacientes al cabo de 30 días y después cada 6 meses. Para el análisis de los resultados se utilizaron las definiciones de consenso del VARC (Valve Academic Research Consortium)20.
Objetivo principalEvaluar la mortalidad total de los pacientes con estenosis aórtica grave con y sin AoP tratados con TAVI de una prótesis CoreValve®.
DefinicionesÉxito del procedimiento: implante correcto y normofuncionante de la prótesis (valorado por angiografía y ecocardiograma), en ausencia de muerte durante el procedimiento.
Complicaciones vasculares: disección aórtica, rotura del anillo aórtico, fallo del dispositivo de cierre percutáneo, rotura iliaca o femoral.
Hemorragia que amenaza la vida: aquella que se produce en órgano crítico o que causa shock hipovolémico o con caída > 5 g de hemoglobina o que precisa transfusión de más de cuatro unidades de sangre.
Mortalidad total: muerte por cualquier causa ocurrida durante el seguimiento.
Mortalidad cardiovascular: aquella que cumple alguno de los siguientes criterios: cualquier muerte debida a causa cardiaca, muerte inesperada o de causa desconocida, muerte en relación con una complicación o por tratamiento de una complicación del procedimiento y muerte debida a causa vascular no coronaria.
Mortalidad al mes: muerte por cualquier causa ocurrida durante los 30 días posteriores al procedimiento, derivada directamente de complicaciones del procedimiento o como tratamiento de alguna de ellas.
Análisis estadísticoComprobamos la normalidad de las variables mediante la prueba de Kolmogorov-Smirnov. Los datos se expresan como media ± desviación estándar en el caso de variables continuas y como número y porcentaje en caso de variables categóricas. Los datos se presentan comparando los dos grupos: con y sin AoP. Las variables cuantitativas continuas se compararon mediante prueba de la t de Student o la de la U de Mann-Whitney y las proporciones, mediante la prueba de la χ2. Se realizó un análisis multivariable para analizar los predictores independientes del objetivo primario del estudio (mortalidad total a los 2 años) mediante un análisis de supervivencia de Cox que incluyó la edad, el sexo, la presencia de AoP y las variables asociadas a mortalidad con p < 0,2 en el análisis univariable. Realizamos un estudio de supervivencia mediante análisis de Kaplan-Meier. Se utilizó un log rank test para comparar la supervivencia entre los grupos con y sin AoP. Se empleó el programa estadístico SPSS versión 20 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSCaracterísticas de la poblaciónEntre diciembre de 2007 y abril de 2012, se trató consecutivamente a 449 pacientes con estenosis aórtica grave calcificada mediante el implante de una prótesis CoreValve® (233 en el Hospital Clínico Virgen de la Victoria de Málaga, 115 en el Hospital Universitario Central de Asturias y 101 en el Hospital Clínico Universitario de Santiago de Compostela). De ellos, 36 (8%) cumplían los criterios para el diagnostico de AoP (19, 8 y 9 de cada hospital respectivamente). El 100% de los diagnósticos se realizó mediante fluoroscopia y se realizó tomografía computarizada en el 6% de los casos en que no había AoP y en el 25% de los casos de AoP.
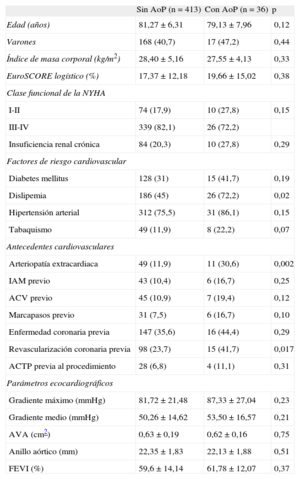
En la tabla 1 pueden verse las características basales de la población. La presencia de arteriopatía extracardiaca fue más frecuente en el grupo con AoP (11 [30,6%] frente a 49 [11,9%]; p = 0,002), así como la revascularización coronaria previa (15 [41,7%] frente a 98 [23,7%]; p = 0,017) y el antecedente de dislipemia (26 [72,2%] frente a 186 [45%]; p = 0,02). Las demás variables clínicas y ecocardiográficas analizadas no mostraron diferencias significativas entre ambos grupos.
Características basales de la muestra (n = 449)
| Sin AoP (n = 413) | Con AoP (n = 36) | p | |
| Edad (años) | 81,27 ± 6,31 | 79,13 ± 7,96 | 0,12 |
| Varones | 168 (40,7) | 17 (47,2) | 0,44 |
| Índice de masa corporal (kg/m2) | 28,40 ± 5,16 | 27,55 ± 4,13 | 0,33 |
| EuroSCORE logístico (%) | 17,37 ± 12,18 | 19,66 ± 15,02 | 0,38 |
| Clase funcional de la NYHA | |||
| I-II | 74 (17,9) | 10 (27,8) | 0,15 |
| III-IV | 339 (82,1) | 26 (72,2) | |
| Insuficiencia renal crónica | 84 (20,3) | 10 (27,8) | 0,29 |
| Factores de riesgo cardiovascular | |||
| Diabetes mellitus | 128 (31) | 15 (41,7) | 0,19 |
| Dislipemia | 186 (45) | 26 (72,2) | 0,02 |
| Hipertensión arterial | 312 (75,5) | 31 (86,1) | 0,15 |
| Tabaquismo | 49 (11,9) | 8 (22,2) | 0,07 |
| Antecedentes cardiovasculares | |||
| Arteriopatía extracardiaca | 49 (11,9) | 11 (30,6) | 0,002 |
| IAM previo | 43 (10,4) | 6 (16,7) | 0,25 |
| ACV previo | 45 (10,9) | 7 (19,4) | 0,12 |
| Marcapasos previo | 31 (7,5) | 6 (16,7) | 0,10 |
| Enfermedad coronaria previa | 147 (35,6) | 16 (44,4) | 0,29 |
| Revascularización coronaria previa | 98 (23,7) | 15 (41,7) | 0,017 |
| ACTP previa al procedimiento | 28 (6,8) | 4 (11,1) | 0,31 |
| Parámetros ecocardiográficos | |||
| Gradiente máximo (mmHg) | 81,72 ± 21,48 | 87,33 ± 27,04 | 0,23 |
| Gradiente medio (mmHg) | 50,26 ± 14,62 | 53,50 ± 16,57 | 0,21 |
| AVA (cm2) | 0,63 ± 0,19 | 0,62 ± 0,16 | 0,75 |
| Anillo aórtico (mm) | 22,35 ± 1,83 | 22,13 ± 1,88 | 0,51 |
| FEVI (%) | 59,6 ± 14,14 | 61,78 ± 12,07 | 0,37 |
ACTP: angioplastia transluminal percutánea; ACV: accidente cerebrovascular; AoP: aorta de porcelana; AVA: área valvular aórtica; EuroSCORE: European system for cardiac operative risk evaluation score; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; NYHA: New York Heart Association.
Los datos expresan n (%) o media ± desviación estándar.
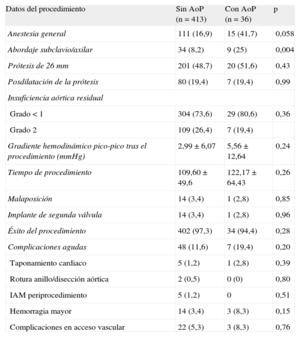
Los datos del procedimiento se muestran en la tabla 2. Se utilizó anestesia general con mayor frecuencia en los pacientes con AoP (15 [41,7%] frente a 111 [16,9%]; p = 0,058), así como el abordaje axilar (9 [25%] frente a 34 [8,2%]; p = 0,004). La prótesis más empleada fue la de 26 mm en ambos grupos, y la duración del procedimiento no mostró diferencias significativas, aunque fue superior en el grupo con AoP. El porcentaje de éxito en el procedimiento fue similar en ambos grupos (el 97,3 frente al 94%). No hubo diferencias en el porcentaje de malaposición valvular. No se observaron diferencias significativas en ninguna de las complicaciones derivadas del procedimiento (7 [19,4%] frente a 48 [11,6%]; p = 0,20). No se realizó ninguna conversión del procedimiento a cirugía convencional. Las demás complicaciones no mostraron diferencias significativas.
Datos del procedimiento y complicaciones agudas
| Datos del procedimiento | Sin AoP (n = 413) | Con AoP (n = 36) | p |
| Anestesia general | 111 (16,9) | 15 (41,7) | 0,058 |
| Abordaje subclavio/axilar | 34 (8,2) | 9 (25) | 0,004 |
| Prótesis de 26 mm | 201 (48,7) | 20 (51,6) | 0,43 |
| Posdilatación de la prótesis | 80 (19,4) | 7 (19,4) | 0,99 |
| Insuficiencia aórtica residual | |||
| Grado < 1 | 304 (73,6) | 29 (80,6) | 0,36 |
| Grado 2 | 109 (26,4) | 7 (19,4) | |
| Gradiente hemodinámico pico-pico tras el procedimiento (mmHg) | 2,99 ± 6,07 | 5,56 ± 12,64 | 0,24 |
| Tiempo de procedimiento | 109,60 ± 49,6 | 122,17 ± 64,43 | 0,26 |
| Malaposición | 14 (3,4) | 1 (2,8) | 0,85 |
| Implante de segunda válvula | 14 (3,4) | 1 (2,8) | 0,96 |
| Éxito del procedimiento | 402 (97,3) | 34 (94,4) | 0,28 |
| Complicaciones agudas | 48 (11,6) | 7 (19,4) | 0,20 |
| Taponamiento cardiaco | 5 (1,2) | 1 (2,8) | 0,39 |
| Rotura anillo/disección aórtica | 2 (0,5) | 0 (0) | 0,80 |
| IAM periprocedimiento | 5 (1,2) | 0 | 0,51 |
| Hemorragia mayor | 14 (3,4) | 3 (8,3) | 0,15 |
| Complicaciones en acceso vascular | 22 (5,3) | 3 (8,3) | 0,76 |
AoP: aorta de porcelana; IAM: infarto agudo de miocardio.
Los datos expresan n (%) o media ± desviación estándar.
No se encontraron diferencias entre los grupos sin y con AoP en la mortalidad tanto hospitalaria (21 [5,1%] frente a 2 [5,6%]; p = 0,96) como al cabo de 30 días (22 [5,3%] frente a 2 [5,6%]; p = 0,95).
La mortalidad hospitalaria (n = 21) en el grupo sin AoP se desglosa de la siguiente forma: 3 por insuficiencia cardiaca, 5 por fallo multiorgánico, 3 por parada cardiorrespiratoria en asistolia, 1 por insuficiencia renal aguda grave, 1 hemorragia pulmonar, 2 por isquemia mesentérica, 1 perforación, 1 rotura cardiaca, 1 hemorragia vascular fatal, 1 accidente cerebrovascular y 2 por sepsis. En el grupo con AoP, la mortalidad hospitalaria (n = 2) se debió a 1 hemotórax masivo y 1 insuficiencia cardiaca.
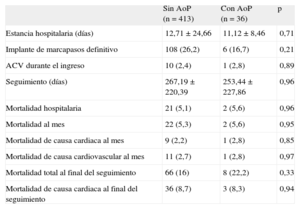
Objetivo primario del estudioLos datos del seguimiento se consiguieron de todos los pacientes. La mediana de seguimiento fue 241 [intervalo intercuartílico, 34,5-434] días. No hubo diferencias entre ambos grupos en los periodos de seguimiento (tabla 3). La mortalidad total fue 74 pacientes (16,5%), sin diferencias estadísticamente significativas entre los grupos sin y con AoP (8 [22%] frente a 66 [16%]; p = 0,33).
Datos de seguimiento
| Sin AoP (n = 413) | Con AoP (n = 36) | p | |
| Estancia hospitalaria (días) | 12,71 ± 24,66 | 11,12 ± 8,46 | 0,71 |
| Implante de marcapasos definitivo | 108 (26,2) | 6 (16,7) | 0,21 |
| ACV durante el ingreso | 10 (2,4) | 1 (2,8) | 0,89 |
| Seguimiento (días) | 267,19 ± 220,39 | 253,44 ± 227,86 | 0,96 |
| Mortalidad hospitalaria | 21 (5,1) | 2 (5,6) | 0,96 |
| Mortalidad al mes | 22 (5,3) | 2 (5,6) | 0,95 |
| Mortalidad de causa cardiaca al mes | 9 (2,2) | 1 (2,8) | 0,85 |
| Mortalidad de causa cardiovascular al mes | 11 (2,7) | 1 (2,8) | 0,97 |
| Mortalidad total al final del seguimiento | 66 (16) | 8 (22,2) | 0,33 |
| Mortalidad de causa cardiaca al final del seguimiento | 36 (8,7) | 3 (8,3) | 0,94 |
ACV: accidente cardiovascular; AoP: aorta de porcelana.
Los datos expresan n (%) o media ± desviación estándar.
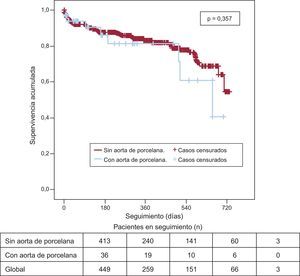
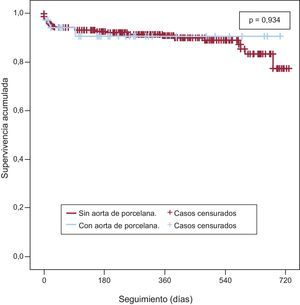
El análisis de supervivencia estimado por el método de Kaplan-Meier muestra una curva de supervivencia al cabo de 2 años (fig. 2) sin diferencias estadísticamente significativas entre los grupos (p = 0,35), con supervivencia del 40,7% (supervivencia media, 544 ± 47 días; intervalo de confianza del 95% [IC95%], 452-638 días) en el grupo con AoP y del 54,8% en el grupo sin AoP (supervivencia media, 593 ± 14 días; IC95%, 565-622 días). Tampoco aparecieron diferencias en la mortalidad de causa cardiaca (fig. 3). Las tablas 4 y 5 muestran los análisis univariable y multivariable con los predictores del objetivo primario del estudio. La presencia de alguna complicación aguda durante el implante (odds ratio = 2,6; IC95%, 1,5-4,5; p = 0,001) fue la única variable predictora de mortalidad.
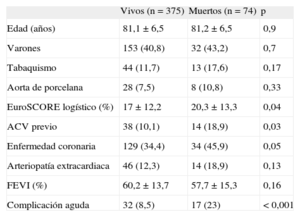
Análisis univariable en el que se muestran las variables que se asociaron con la mortalidad de manera estadísticamente significativa o con tendencia, junto con la edad, el sexo y la presencia de aorta de porcelana (n = 449)
| Vivos (n = 375) | Muertos (n = 74) | p | |
| Edad (años) | 81,1 ± 6,5 | 81,2 ± 6,5 | 0,9 |
| Varones | 153 (40,8) | 32 (43,2) | 0,7 |
| Tabaquismo | 44 (11,7) | 13 (17,6) | 0,17 |
| Aorta de porcelana | 28 (7,5) | 8 (10,8) | 0,33 |
| EuroSCORE logístico (%) | 17 ± 12,2 | 20,3 ± 13,3 | 0,04 |
| ACV previo | 38 (10,1) | 14 (18,9) | 0,03 |
| Enfermedad coronaria | 129 (34,4) | 34 (45,9) | 0,05 |
| Arteriopatía extracardiaca | 46 (12,3) | 14 (18,9) | 0,13 |
| FEVI (%) | 60,2 ± 13,7 | 57,7 ± 15,3 | 0,16 |
| Complicación aguda | 32 (8,5) | 17 (23) | < 0,001 |
ACV: accidente cardiovascular; EuroSCORE: European system for cardiac operative risk evaluation score; FEVI: fracción de eyección del ventrículo izquierdo.
Los datos expresan n (%) o media ± desviación estándar.
Análisis multivariable con los predictores de mortalidad
| HR (IC95%) | p | |
| Complicación aguda | 2,6 (1,5-4,5) | 0,001 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Las variables edad, sexo, aorta de porcelana, EuroSCORE logístico, presencia de enfermedad coronaria, tabaquismo, accidente cerebrovascular previo, arteriopatía extracardiaca o fracción de eyección del ventrículo izquierdo no fueron predictoras del objetivo primario del estudio.
El hallazgo fundamental de nuestro estudio es que, para los pacientes con estenosis aórtica grave excluidos de cirugía por AoP, el implante percutáneo de la válvula aórtica CoreValve® es seguro, factible y con tasas de éxito y complicaciones similares a las de los pacientes sin esta afección de la aorta. Se trata de la mayor serie comunicada hasta el momento de pacientes con estenosis aórtica grave y AoP tratados con TAVI.
La combinación de AoP y estenosis aórtica hace que la cirugía de recambio valvular aórtico presente problemas técnicos y tenga importante repercusión en la morbimortalidad21–27.
Todos los pacientes de nuestra serie fueron excluidos por un grupo multidisciplinario, por el alto riesgo quirúrgico y la presencia de AoP. Respecto al riesgo quirúrgico de estos pacientes, la escala más empleada en nuestro medio es el EuroSCORE, y no considera la AoP entre sus ítems, por lo que la valoración del riesgo quirúrgico por este método no se ajusta al riesgo quirúrgico real de estos pacientes.
La indicación más frecuente en nuestro medio para tratamiento con TAVI continúa siendo por EuroSCORE elevado, hecho este que queda de manifiesto también en nuestro trabajo. En nuestra serie, el EuroSCORE fue similar en ambos grupos, similar a los de otros trabajos multicéntricos publicados recientemente7,8,28 e inferior a las cifras de trabajos más antiguos2,4–6.
La prevalencia de AoP en el TAVI es muy variable y oscila entre el 10 y el 35%. Esto podría explicarse por la elevada variabilidad en los criterios aplicados para el diagnóstico de la AoP2,5,11–13. La prevalencia de AoP encontrada en nuestra serie es inferior a la registrada en otros trabajos2,11,29. Esto se podría deber a que nuestro estudio se realizó en tres centros con uniformidad de criterios en la definición de AoP, importante volumen de actividad y experiencia con el TAVI.
En nuestra serie se observa una mayor utilización del abordaje axilar en el grupo de pacientes con AoP, que podría estar relacionada con la mayor prevalencia de enfermedad vascular extracardiaca en estos pacientes (el 30,6 frente al 11,9%). Esto también podría explicar el bajo porcentaje de complicaciones vasculares del grupo con AoP. En los últimos años se han publicado diferentes trabajos que abogan por la seguridad y la eficacia de emplear la vía de abordaje axilar para el tratamiento con TAVI en casos con mal acceso femoral29,30.
El éxito del procedimiento fue similar en ambos grupos. Estos resultados confirman los obtenidos en algunas series previas de TAVI que incluyeron a pacientes con AoP2,7,8,28,31,32. Trabajos previos2,11,12 habían apuntado la posibilidad, no confirmada, de que pudiera haber mayor tendencia a la malaposición valvular en los pacientes con AoP sometidos a TAVI. En nuestra serie no se ha observado esta situación.
El implante de marcapasos fue la complicación más frecuente en nuestro estudio, pero similar en ambos grupos, con y sin AoP. Este dato resulta concordante con los demás trabajos realizados con este dispositivo7,8. Como ya se ha apuntado en otros trabajos, esta complicación parece relacionada fundamentalmente con la implantación baja de la prótesis y la presencia de alteraciones de la conducción previas o bloqueo de la rama derecha33–35.
En este estudio se han considerado solamente los accidentes cerebrovasculares con repercusión clínica. La incidencia de esta complicación ha sido muy baja y similar en pacientes con y sin AoP. Es posible que una valoración neurológica independiente y sistemática y la utilización de técnicas de imagen de alta resolución inmediatamente después del TAVI pudieran haber aumentado la frecuencia de alteraciones de la perfusión cerebral con escasa expresión clínica36–38.
La mortalidad encontrada al mes de seguimiento también fue baja y sin diferencias entre grupos. Como en series previas de TAVI7,8,28,32, la causa fundamental de muerte en el primer mes son las complicaciones derivadas del procedimiento. En cualquier caso, la mortalidad es inferior a la estimada al aplicar el algoritmo del EuroSCORE logístico38,39. El seguimiento a largo plazo muestra que la supervivencia no difiere significativamente entre los grupos. La función de supervivencia en nuestro estudio es superponible a otros trabajos con diseño similar, pero que utilizan acceso transapical en pacientes con grave calcificación de aorta ascendente11.
Los resultados generales de este trabajo muestran que el tratamiento con TAVI se podría considerar una alternativa terapéutica a la cirugía convencional o a las alternativas quirúrgicas mediante canulación axilar, conducto apicoaórtico o sustitución de la aorta ascendente14,40–42.
LimitacionesEl número de pacientes incluidos es escaso y el periodo de seguimiento es corto, por lo que el estudio podría no presentar suficiente potencia estadística para detectar diferencias en la incidencia de algunas complicaciones. Aunque se han utilizado los criterios del VARC para el análisis de las complicaciones cerebrovasculares, no se hizo un estudio neurológico sistemático, por lo que la frecuencia de esta complicación podría estar subestimada.
Los datos presentados hacen referencia a los resultados de tres centros de alto volumen y experiencia en el implante de la válvula CoreValve®, por lo que podrían no ser extrapolables a escenarios en los que el volumen fuera menor o con dispositivos diferentes.
CONCLUSIONESEl implante percutáneo del dispositivo CoreValve® en pacientes con AoP, rechazados para cirugía de recambio valvular, es factible y seguro y los resultados obtenidos no difieren de los de pacientes sin esta afección aórtica.
Nuestros resultados indican que para los pacientes con estenosis aórtica grave y AoP, clásicamente asociados a un alto riesgo quirúrgico, el TAVI es una opción terapéutica atractiva.