Los pacientes con enfermedad autoinmunitaria (EAI) tienen peor pronóstico a corto plazo tras un síndrome coronario agudo (SCA)1–3. Son necesarios estudios en nuestro medio que analicen sus posibles causas y el pronóstico a largo plazo tras el alta hospitalaria.
Se presenta un estudio observacional retrospectivo de pacientes ingresados en un hospital terciario por SCA, desde enero de 2011 a febrero de 2016, siguiendo los principios de la Declaración de Helsinki y tras aprobación por el Comité Ético del hospital.
El objetivo principal es determinar la influencia pronóstica de la EAI en la aparición de muerte en general y hemorragia mayor según el Bleeding Academic Research Consortium4, tipos 3 a 5, y en el evento combinado de infarto agudo de miocardio no fatal e ictus. Se seleccionó a los pacientes vivos al alta con un mínimo de 1 año de seguimiento (n = 1.742), y se registraron los eventos mediante llamada telefónica o historia clínica. El objetivo secundario es determinar las características, la presentación y el tratamiento del SCA de los pacientes con y sin EAI, para lo cual se analiza a la población total (n = 2.236).
El efecto de la EAI se calculó mediante regresión de Cox ajustada por edad, diabetes mellitus, fibrilación auricular, vasculopatía periférica, enfermedad cerebrovascular, neoplasia, enfermedad pulmonar obstructiva crónica, Killip al ingreso ≥ 2, frecuencia cardiaca, presión arterial sistólica, hemoglobina, troponina T, filtrado glomerular, enfermedad de tronco coronario y/o de 3 vasos y función ventricular. Se estimó la incidencia acumulada de los eventos según el método de Kaplan-Meier y el log-rank test para las comparaciones.
Entre los pacientes con SCA había 74 EAI (prevalencia del 3,3%), de las cuales las más prevalentes eran la artritis reumatoide (24 casos), las espondiloartritis (14 casos) y la enfermedad inflamatoria intestinal (10). El tiempo de evolución fue una mediana de 10 [4-14] años. Un 70% recibía tratamiento corticoideo; un 50%, fármacos modificadores de la enfermedad/inmunosupresores; un 22%, antiinflamatorios y un 8%, tratamiento biológico.
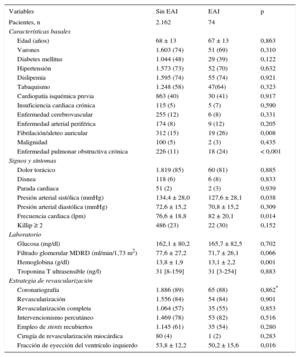
Hubo mayor prevalencia de fibrilación auricular y enfermedad pulmonar obstructiva en pacientes con EAI así como en la presión arterial sistólica, frecuencia cardiaca, hemoglobina y fracción de eyección. En ambos grupos se realizó coronariografía y revascularización a un elevado porcentaje de los casos (el 84% en ambos; p = 0,901), preferentemente percutánea. Se encontró revascularización completa en porcentajes similares, así como cifras similares en el uso de stents farmacoactivos (tabla). Hubo mayor enfermedad de tronco común y/o de 3 vasos en pacientes sin EAI (el 21 frente al 11%; p = 0,043).
Diferencias en las características basales, presentación y pruebas complementarias en función de la presencia de enfermedades autoinmunitarias
| Variables | Sin EAI | EAI | p |
|---|---|---|---|
| Pacientes, n | 2.162 | 74 | |
| Características basales | |||
| Edad (años) | 68 ± 13 | 67 ± 13 | 0,863 |
| Varones | 1.603 (74) | 51 (69) | 0,310 |
| Diabetes mellitus | 1.044 (48) | 29 (39) | 0,122 |
| Hipertensión | 1.573 (73) | 52 (70) | 0,632 |
| Dislipemia | 1.595 (74) | 55 (74) | 0,921 |
| Tabaquismo | 1.248 (58) | 47(64) | 0,323 |
| Cardiopatía isquémica previa | 863 (40) | 30 (41) | 0,917 |
| Insuficiencia cardiaca crónica | 115 (5) | 5 (7) | 0,590 |
| Enfermedad cerebrovascular | 255 (12) | 6 (8) | 0,331 |
| Enfermedad arterial periférica | 174 (8) | 9 (12) | 0,205 |
| Fibrilación/aleteo auricular | 312 (15) | 19 (26) | 0,008 |
| Malignidad | 100 (5) | 2 (3) | 0,435 |
| Enfermedad pulmonar obstructiva crónica | 226 (11) | 18 (24) | < 0,001 |
| Signos y síntomas | |||
| Dolor torácico | 1.819 (85) | 60 (81) | 0,885 |
| Disnea | 118 (6) | 6 (8) | 0,833 |
| Parada cardiaca | 51 (2) | 2 (3) | 0,939 |
| Presión arterial sistólica (mmHg) | 134,4 ± 28,0 | 127,6 ± 28,1 | 0,038 |
| Presión arterial diastólica (mmHg) | 72,6 ± 15,2 | 70,8 ± 15,2 | 0,309 |
| Frecuencia cardiaca (lpm) | 76,6 ± 18,8 | 82 ± 20,1 | 0,014 |
| Killip ≥ 2 | 486 (23) | 22 (30) | 0,152 |
| Laboratorio | |||
| Glucosa (mg/dl) | 162,1 ± 80,2 | 165,7 ± 82,5 | 0,702 |
| Filtrado glomerular MDRD (ml/min/1,73 m2) | 77,6 ± 27,2 | 71,7 ± 26,1 | 0,066 |
| Hemoglobina (g/dl) | 13,8 ± 1,9 | 13,1 ± 2,2 | 0,001 |
| Troponina T ultrasensible (ng/l) | 31 [8-159] | 31 [3-254] | 0,883 |
| Estrategia de revascularización | |||
| Coronariografía | 1.886 (89) | 65 (88) | 0,862* |
| Revascularización | 1.556 (84) | 54 (84) | 0,901 |
| Revascularización completa | 1.064 (57) | 35 (55) | 0,853 |
| Intervencionismo percutáneo | 1.469 (78) | 53 (82) | 0,516 |
| Empleo de stents recubiertos | 1.145 (61) | 35 (54) | 0,280 |
| Cirugía de revascularización miocárdica | 80 (4) | 1 (2) | 0,283 |
| Fracción de eyección del ventrículo izquierdo | 53,8 ± 12,2 | 50,2 ± 15,6 | 0,016 |
EAI, enfermedades autoinmunitarias; MDRD, Modification of Diet in Renal Disease 4.
Salvo otra indicación, los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Hubo una tendencia a mayor prescripción de clopidogrel como segundo antiagregante en pacientes con EAI (el 81 frente al 71%; p = 0,079). En el uso del resto de los fármacos de prevención secundaria, no se encontraron diferencias (p > 0,1 para todas las comparaciones).
Tras un seguimiento de 397 [375-559] días, los pacientes con EAI presentaron mayor tasa de mortalidad tras el alta (el 25,8 frente al 10,9%; log-rank test, p = 0,001) (figura A). De las 15 muertes de pacientes con EAI, 11 fueron de causa cardiovascular (7 muertes súbitas y 4 por infarto agudo de miocardio). Las hemorragias mayores presentaron una tendencia a ser más frecuentes en pacientes con EAI (el 10,3 frente al 4,2%; log-rank test, p = 0,089), y casi un 70% era de origen gastrointestinal (figura B).
La EAI resulta ser factor independiente de riesgo de muerte tras el alta (hazard ratio ajustada [HRa] = 1,95; intervalo de confianza del 95% [IC95%], 1,05-3,62; p = 0,035). Hubo tendencia a mayor riesgo de hemorragias mayores (HRa = 2,35; IC95%, 1,0-6,9; p = 0,055). La HRa para ictus y reinfarto fue 1,66 (IC95%, 0,77-3,61; p = 0,200).
Nuestra serie aporta información relevante acerca del pronóstico a largo plazo tras un seguimiento de más de 1 año, no indicado previamente1-3. La mayoría de las muertes de pacientes con EAI eran de origen cardiovascular, por lo que persiste cierta vulnerabilidad tras un SCA pese a un tratamiento y presentación clínica similares. Además son vulnerables a las hemorragias. Recientemente se ha demostrado que una combinación de factores de riesgo clásicos, de carga aterosclerótica y de extensión de la enfermedad coronaria, identifica al paciente con riesgo a largo plazo tras un SCA, pero su capacidad predictiva es moderada5. Por otro lado, la predicción del riesgo hemorrágico a largo plazo es deficiente6. A la luz de nuestros resultados, la EAI debería contemplarse como una comorbilidad que ayude a la estratificación general de nuestros pacientes tras un SCA.
El escaso número de pacientes con EAI ha hecho que decidamos analizarlas en conjunto, con lo que resulta un grupo heterogéneo. Otra limitación es que se recogió el tipo de tratamiento específico al ingreso del SCA, y no de los años previos, lo que habría reflejado mejor su influencia temporal.