El daño renal agudo (DRA) ocurre con frecuencia tras el implante percutáneo de válvula aórtica (TAVI) y se asocia con una mayor mortalidad. Sin embargo, el impacto del DRA en la evolución a largo plazo continúa siendo controvertida. Por dicho motivo se evalúa el impacto del DRA el resultado a corto y largo plazo tras el TAVI usando los criterios Valve Academic Research Consortium 2.
MétodosSe incluyeron 794 pacientes consecutivos con estenosis aórtica grave en un registro multicéntrico brasileño. Para la identificación de los predictores de DRA se utilizó el análisis de regresión logística. La supervivencia a 4 años se determinó mediante las curvas de Kaplan-Meier y para determinar el impacto del DRA en la mortalidad entre los supervivientes a 12 meses se usó un análisis de punto de referencia ajustado.
ResultadosLa incidencia de DRA tras el TAVI fue del 18%. Los predictores independientes de DRA fueron: edad, diabetes mellitus, hemorragia mayor o amenazante para la vida y la malaposición valvular. El DRA se asoció independientemente con un riesgo mayor de muerte total (HR ajustada = 2,8; IC95%, 2,0-3,9; p < 0,001) y cardiovascular (HR ajustada = 2,9; IC95%, 1,9-4,4; p < 0,001) durante el periodo de seguimiento completo. Sin embargo, cuando se consideró solo los supervivientes a 12 meses, no hubo diferencias en ambos objetivos clínicos (HR ajustada = 1,2; IC95%, 0,5-2,4; p = 0,71, y HR = 0,7; IC95%, 0,2-2,1; p = 0,57, respectivamente).
ConclusionesEl DRA es una complicación frecuente tras el TAVI. La edad avanzada, la diabetes, la hemorragia mayor o amenazante para la vida y la malaposición valvular eran factores predictivos de DRA. El DRA se asoció con el pronóstico a corto y largo plazo, sin embargo, el impacto del DRA sobre la mortalidad se limitó al primer año tras el TAVI.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) está actualmente bien establecido como tratamiento para los pacientes con estenosis aórtica grave sintomática que tienen un riesgo quirúrgico prohibitivo, alto o intermedio1–7. Con frecuencia se observa daño renal agudo (DRA) tras el TAVI, con tasas que oscilan entre el 3 y el 50% según la definición que se utilice8–16.
La aparición de un DRA tras el TAVI se ha asociado con comorbilidades, la administración de medio de contraste, la necesidad de un ritmo rápido y la consiguiente hipotensión17 y la aparición de complicaciones tras la intervención, como hemorrágicas y vasculares13.
El DRA tras el TAVI se asocia con peor resultado a corto y medio plazo9 y una hospitalización prolongada, con el consiguiente aumento de los costes económicos para el sistema de asistencia sanitaria18,19. Sin embargo, la evidencia existente es contradictoria respecto a las repercusiones del DRA en los resultados clínicos a largo plazo10,13. Además, en estudios previos se han utilizado definiciones del DRA heterogéneas, y solo se han evaluado los resultados clínicos a corto y medio plazo9,10. La inmensa mayoría de los estudios previos han dicotomizado el DRA como presente o ausente, sin estratificar esta complicación en sus diferentes estadios, a pesar de que algunos estudios han indicado que los riesgos de muerte y de complicaciones aumentan con la mayor gravedad del DRA19,20. El objetivo de este estudio es evaluar las repercusiones clínicas del DRA y sus diferentes estadios en los resultados clínicos a corto y largo plazo del TAVI utilizando los criterios del Valve Academic Research Consortium 2 (VARC-2)21 y también identificar los factores independientes predictivos de DRA después del TAVI, en un intento de definir mejor la evaluación del riesgo de esta población cada vez más amplia.
MÉTODOSPoblación del estudioEntre enero de 2008 y enero de 2015, se trató con TAVI y se incluyó en un registro multicéntrico de Brasil a 819 pacientes consecutivos con estenosis aórtica grave sintomática22. Participaron en el estudio 22 centros de diferentes regiones de Brasil. De cada paciente se obtuvieron datos relativos a las características iniciales, la información sobre la intervención y los datos de seguimiento, y se registraron en un formulario de recogida de datos a través de Internet, especialmente diseñado para este registro. Para determinar mejor los factores predictivos y el valor pronóstico del DRA tras el TAVI, se excluyó a 25 pacientes que fallecieron en las 24 h siguientes a la intervención. Finalmente, se incluyó en el análisis a 794 pacientes. Se obtuvo el consentimiento informado por escrito de los pacientes, incluidos prospectivamente. El protocolo del estudio se aplicó según lo establecido en la Declaración de Helsinki y recibió la aprobación del comité de ética de investigación de cada centro participante.
IntervenciónSe utilizó la prótesis autoexpandible CoreValve (Medtronic; Minneapolis, Minnesota, Estados Unidos), la expandible con balón SAPIEN XT (Edwards Lifesciences; Irvine, California, Estados Unidos) o la Inovare (Braile Biomédica; São José do Rio Preto, São Paulo, Brasil). Las intervenciones de TAVI se realizaron según técnicas estándares. El tipo de anestesia usado y la vía de acceso se dejaron al criterio del operador. La vía de abordaje vascular de primera elección fue la transfemoral. Cuando la vía transfemoral no era viable, se utilizaron los abordajes transapical o transarterial (transubclavio, transaórtico directo, transapical o transcarotídeo) según la preferencia del equipo cardiológico multidisciplinario.
Objetivos clínicos y definicionesSe dio seguimiento a todos pacientes y un comité independiente validó todos los eventos adversos («adjudicación»), según las definiciones del VARC-2. La definición del DRA se basó en los criterios de la AKIN (Acute Kidney Injury Network), de la siguiente forma: estadio 1 (aumento de la creatinina sérica a un 150-199% del valor inicial o aumento de 0,3mg/dl o diuresis <0,5ml/kg/h durante más de 6 pero menos de 12 h); estadio 2 (aumento de la creatinina sérica al 200-299% del valor inicial o diuresis <0,5ml/kg/h durante más de 12 pero menos de 24 h); estadio 3 (aumento de la creatinina sérica a> 300% del valor inicial o creatinina sérica> 4,0mg/dl con un incremento agudo ≥ 0,5mg/dl o diuresis <0,3ml/kg/h durante más de 24 h o anuria durante más de 12 h o terapia sustitutiva renal). La creatinina sérica inicial se determinó al ingreso en el hospital, antes de la intervención y luego 1 vez al día durante 1 semana o menos si el paciente era dado de alta antes. En comparación con las definiciones originales del VARC, el periodo para el diagnóstico del DRA se amplió de 72 h a 7 días. La enfermedad renal crónica se definió como una tasa de filtrado glomerular estimada <60 ml/min. La definición de la mala aposición de la válvula incluyó la migración valvular, la embolización de la válvula y su despliegue ectópico21. El éxito del dispositivo se definió como la ausencia de mortalidad de la intervención y la colocación correcta de una sola válvula cardiaca protésica en una posición anatómica adecuada y con el funcionamiento planeado (gradiente valvular aórtico medio <20mmHg y ausencia de insuficiencia valvular aórtica moderada o grave)21. En el presente estudio se aportan datos sobre los resultados clínicos a los 30 días, al año, durante todo el periodo de seguimiento (de hasta 4 años) y a partir de 1 año de seguimiento (análisis de referencia).
Análisis estadísticoSe presentan las características clínicas basales y de la intervención en la población del estudio según el estado del DRA. Las variables continuas se presentan en forma de media±desviación estándar o de mediana [intervalo intercuartílico] y se compararon con la prueba de la t de Student o la prueba de la U de Mann-Whitney según procediera. Las variables discretas se presentan mediante frecuencias y porcentajes y se compararon con la prueba de la χ2 de Pearson.
Se elaboraron curvas de Kaplan-Meier de supervivencia empleando los diferentes estadios de DRA como umbrales, y los resultados se compararon mediante el test de log rank. Tras haber asociado el DRA con múltiples factores, incluidas las comorbilidades de los pacientes, la propia intervención y las complicaciones de esta, se utilizó un análisis de la supervivencia con punto temporal de referencia (análisis tipo landmark) para explorar las repercusiones clínicas del DRA en los resultados a corto y largo plazo a partir de 30 días y 1 año tras la intervención índice respectivamente. Se utilizaron modelos de riesgos proporcionales de Cox para evaluar las repercusiones del DRA en la mortalidad por cualquier causa y de causa cardiovascular. Se seleccionaron las variables con p <0,2 en el análisis bivariable y todas las variables con p <0,05 se mantuvieron en el modelo. Se incluyeron las siguientes variables en los modelos: edad, sexo, clase funcional de la New York Heart Association, enfermedad pulmonar obstructiva crónica, enfermedad vascular periférica, valvuloplastia con balón aórtico, fracción de eyección del ventrículo izquierdo, insuficiencia mitral moderada o grave, hipertensión pulmonar, vía de acceso (femoral o no femoral), ecocardiografía transesofágica, predilatación, DRA, infarto de miocardio, ictus, hemorragia importante o con peligro para la vida, complicación vascular importante y mala aposición valvular.
Se utilizó un análisis de regresión logística escalonada, con la inclusión de todas las variables con p <0,2 en el análisis univariable, para identificar los factores predictivos del DRA y de la mortalidad a 30 días por cualquier causa y por causa cardiovascular. Se evaluaron las siguientes variables: edad, enfermedad renal crónica, índice de masa corporal, diabetes mellitus, enfermedad vascular periférica, hipertensión sistémica, aorta de porcelana, uso de diuréticos, volumen de medio de contraste, aclaramiento de creatinina, mala aposición de la válvula, hemorragia importante o con peligro para la vida y complicaciones vasculares importantes. Todas las pruebas estadísticas fueron bilaterales, y se estableció un nivel de significación estadística de p <0,05. Todos los análisis estadísticos se realizaron con el programa informático estadístico SPSS versión 20.0.
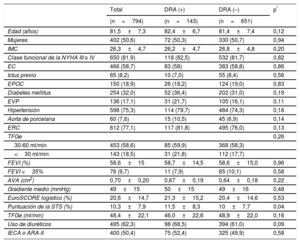
RESULTADOSCaracterísticas clínicas basalesLas características iniciales de la población del estudio se muestran en la tabla 1. La media de edad general fue 81,5±7,3 años; el 50,6% eran mujeres, el 32,0% eran diabéticos, la media de la puntuación de la Society of Thoracic Surgeons era de 10,3±7,9 y la media del EuroSCORE, 20,6±14,7. La media de la fracción de eyección del ventrículo izquierdo fue del 58,6±15% y la media del gradiente aórtico, 49±15mmHg. La tasa de filtrado glomerular estimada antes de la intervención era 48,4±22,1ml/min y el 77,1% de los pacientes tenían enfermedad renal crónica.
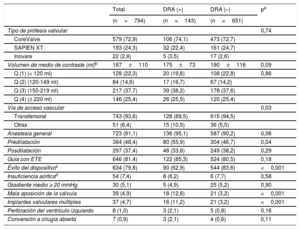
Características clínicas basales de la población en estudio según el estado del DRA
| Total | DRA (+) | DRA (–) | p* | |
|---|---|---|---|---|
| (n=794) | (n=143) | (n=651) | ||
| Edad (años) | 81,5±7,3 | 82,4±6,7 | 81,4±7,4 | 0,12 |
| Mujeres | 402 (50,6) | 72 (50,3) | 330 (50,7) | 0,94 |
| IMC | 26,3±4,7 | 26,2±4,7 | 26,8±4,8 | 0,20 |
| Clase funcional de la NYHA III o IV | 650 (81,9) | 118 (82,5) | 532 (81,7) | 0,82 |
| EC | 466 (58,7) | 83 (58) | 383 (58,8) | 0,86 |
| Ictus previo | 65 (8,2) | 10 (7,0) | 55 (8,4) | 0,56 |
| EPOC | 150 (18,9) | 26 (18,2) | 124 (19,0) | 0,83 |
| Diabetes mellitus | 254 (32,0) | 52 (36,4) | 202 (31,0) | 0,19 |
| EVP | 136 (17,1) | 31 (21,7) | 105 (16,1) | 0,11 |
| Hipertensión | 598 (75,3) | 114 (79,7) | 484 (74,3) | 0,18 |
| Aorta de porcelana | 60 (7,6) | 15 (10,5) | 45 (6,9) | 0,14 |
| ERC | 612 (77,1) | 117 (81,8) | 495 (76,0) | 0,13 |
| TFGe | 0,26 | |||
| 30-60 ml/min | 453 (58,6) | 85 (59,9) | 368 (58,3) | |
| <30 ml/min | 143 (18,5) | 31 (21,8) | 112 (17,7) | |
| FEVI (%) | 58,6±15 | 58,7±14,5 | 58,6±15,0 | 0,96 |
| FEVI <35% | 76 (9,7) | 11 (7,9) | 65 (10,1) | 0,58 |
| AVA (cm2) | 0,70±0,20 | 0,67±0,19 | 0,64±0,18 | 0,22 |
| Gradiente medio (mmHg) | 49±15 | 50±15 | 49±16 | 0,48 |
| EuroSCORE logístico (%) | 20,6±14,7 | 21,3±15,2 | 20,4±14,6 | 0,53 |
| Puntuación de la STS (%) | 10,3±7,9 | 11,5±8,3 | 10±7,7 | 0,04 |
| TFGe (ml/min) | 48,4±22,1 | 46,0±22,6 | 48,9±22,0 | 0,16 |
| Uso de diuréticos | 495 (62,3) | 98 (68,5) | 394 (61,0) | 0,09 |
| IECA o ARA-II | 400 (50,4) | 75 (52,4) | 325 (49,9) | 0,58 |
ARA-II: antagonistas del receptor de la angiotensina II; AVA: área valvular aórtica; DRA: daño renal agudo; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; EVP: enfermedad vascular periférica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%) o media±desviación estándar.
La incidencia de DRA tras el TAVI fue del 18% (143/794). De estos pacientes, el 11,1% (88) se clasificó como DRA en estadio 1, el 2,4% (19) en estadio 2 y el 4,5% (36) en estadio 3. Las características demográficas de los pacientes con y sin DRA eran similares (tabla 1). La única excepción fue la puntuación de la Society of Thoracic Surgeons, más alta entre los pacientes con DRA (11,5±8,3 frente a 10±7,7; p=0,04). La estancia hospitalaria fue significativamente mayor para los pacientes con DRA (19,3±29,1 frente a 11,2±20,9 días; p <0,001).
Características de la intervención y complicacionesEn la mayoría de los pacientes (93,6%), el TAVI se realizó por vía femoral y con anestesia general, y el dispositivo más utilizado fue el CoreValve (72,9%). Las características de la intervención se muestran en la tabla 2. Se observaron mayores prevalencias de la vía de acceso no femoral y de la predilatación en los pacientes que sufrieron DRA. La media del volumen total de medio de contraste usado fue 187±110ml, con una tendencia no significativa a usar menos contraste en el grupo con DRA (175±73 frente a 190±116 ml; p=0,09). Sin embargo, la cantidad de medio de contraste utilizada fue mayor en los pacientes con mala aposición valvular (276±219 frente a 183±100 ml; p=0,028) que en los pacientes sin mala aposición.
Características de la intervención y complicaciones según el estado del DRA
| Total | DRA (+) | DRA (–) | pa | |
|---|---|---|---|---|
| (n=794) | (n=143) | (n=651) | ||
| Tipo de prótesis valvular | 0,74 | |||
| CoreValve | 579 (72,9) | 106 (74,1) | 473 (72,7) | |
| SAPIEN XT | 193 (24,3) | 32 (22,4) | 161 (24,7) | |
| Inovare | 22 (2,8) | 5 (3,5) | 17 (2,6) | |
| Volumen de medio de contraste (ml)b | 187±110 | 175±73 | 190±116 | 0,09 |
| Q (1) (< 120 ml) | 128 (22,3) | 20 (19,6) | 108 (22,8) | 0,86 |
| Q (2) (120-149 ml) | 84 (14,6) | 17 (16,7) | 67 (14,2) | |
| Q (3) (150-219 ml) | 217 (37,7) | 39 (38,2) | 178 (37,6) | |
| Q (4) (≥ 220 ml) | 146 (25,4) | 26 (25,5) | 120 (25,4) | |
| Vía de acceso vascular | 0,03 | |||
| Transfemoral | 743 (93,6) | 128 (89,5) | 615 (94,5) | |
| Otras | 51 (6,4) | 15 (10,5) | 36 (5,5) | |
| Anestesia general | 723 (91,1) | 136 (95,1) | 587 (90,2) | 0,06 |
| Predilatación | 384 (48,4) | 80 (55,9) | 304 (46,7) | 0,04 |
| Posdilatación | 297 (37,4) | 48 (33,6) | 249 (38,2) | 0,29 |
| Guía con ETE | 646 (81,4) | 122 (85,3) | 524 (80,5) | 0,18 |
| Éxito del dispositivoc | 634 (79,8) | 90 (62,9) | 544 (83,6) | <0,001 |
| Insuficiencia aórticad | 54 (7,4) | 8 (6,2) | 6 (7,7) | 0,58 |
| Gradiente medio ≥ 20 mmHg | 30 (5,1) | 5 (4,9) | 25 (5,2) | 0,90 |
| Mala aposición de la válvula | 39 (4,9) | 18 (12,6) | 21 (3,2) | <0,001 |
| Implantes valvulares múltiples | 37 (4,7) | 16 (11,2) | 21 (3,2) | <0,001 |
| Perforación del ventrículo izquierdo | 8 (1,0) | 3 (2,1) | 5 (0,8) | 0,16 |
| Conversión a cirugía abierta | 7 (0,9) | 3 (2,1) | 4 (0,6) | 0,11 |
DRA: daño renal agudo; ETE: ecocardiografía transesofágica; Otras: transapical y transarterial; Q: cuartiles.
Los valores expresan n (%) o media±desviación estándar.
El porcentaje de éxitos del dispositivo fue inferior y la mala aposición de la válvula se observó con más frecuencia en los pacientes que sufrieron DRA tras el TAVI (tabla 2).
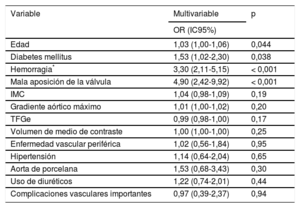
Factores predictivos del daño renal agudoEn el análisis multivariable, los factores independientes predictivos de DRA fueron la edad, la diabetes mellitus, la hemorragia importante o con peligro para la vida y la mala aposición de la válvula (tabla 3); esta fue el factor predictivo más potente (odds ratio [OR]=4,90; intervalo de confianza del 95% [IC95%], 2,42-9,92; p <0,001).
Factores multivariables predictivos de DRA en pacientes sometidos a TAVI
| Variable | Multivariable | p |
|---|---|---|
| OR (IC95%) | ||
| Edad | 1,03 (1,00-1,06) | 0,044 |
| Diabetes mellitus | 1,53 (1,02-2,30) | 0,038 |
| Hemorragia* | 3,30 (2,11-5,15) | < 0,001 |
| Mala aposición de la válvula | 4,90 (2,42-9,92) | < 0,001 |
| IMC | 1,04 (0,98-1,09) | 0,19 |
| Gradiente aórtico máximo | 1,01 (1,00-1,02) | 0,20 |
| TFGe | 0,99 (0,98-1,00) | 0,17 |
| Volumen de medio de contraste | 1,00 (1,00-1,00) | 0,25 |
| Enfermedad vascular periférica | 1,02 (0,56-1,84) | 0,95 |
| Hipertensión | 1,14 (0,64-2,04) | 0,65 |
| Aorta de porcelana | 1,53 (0,68-3,43) | 0,30 |
| Uso de diuréticos | 1,22 (0,74-2,01) | 0,44 |
| Complicaciones vasculares importantes | 0,97 (0,39-2,37) | 0,94 |
DRA: daño renal agudo; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; OR: odds ratio; TAVI: implante percutáneo de válvula aórtica; TFGe: tasa de filtrado glomerular estimada.
A los 30 días, los pacientes con DRA tenían mayores tasas de mortalidad por cualquier causa (el 21 frente al 2,9%; OR=7,84; IC95%, 3,70-16,58; p <0,001) y de mortalidad cardiovascular (el 18,2 frente al 2,3%; OR=8,55; IC95%, 3,80-19,38; p <0,001) que los pacientes sin DRA. Al utilizar un modelo de regresión logística ajustado, el DRA continuó mostrando una asociación independiente con la mortalidad a 30 días por cualquier causa (OR=2,71; IC95%, 1,53-4,79; p=0,001) y de causa cardiovascular (OR=2,43; IC95%, 1,32-4,46; p=0,004).
En los pacientes con DRA, la mortalidad por cualquier causa a 30 días fue del 9,1% (OR=3,33; IC95%, 1,41-7,85) de los que se encontraban en el estadio 1, el 36,8% (OR=19,40; IC95%, 6,87-54,78) de los que estaban en estadio 2 y el 41,7% (OR=23,76; IC95%, 10,63-53,12) de aquellos en estadio 3 (p <0,001) y la mortalidad de causa cardiovascular a 30 días fue del 5,7% (OR=2,55; IC95%, 0,91-7,21), el 36,8% (OR=24,73; IC95%, 8,54-71,64) y el 38,9% (OR=26,98; IC95%, 11,61-62,71) respectivamente (p <0,001).
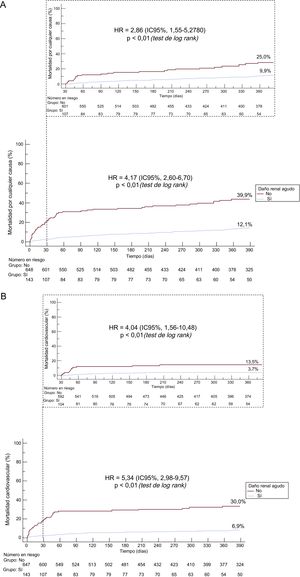
En el seguimiento realizado al año, se observaron mayores tasas de mortalidad por cualquier causa (hazard ratio [HR]=4,17; IC95%, 2,60-6,70; p <0,001) y de mortalidad cardiovascular (HR=5,34; IC95%, 2,98-9,57; p <0,001) en los pacientes con DRA que en aquellos sin DRA (figura 1).
Curvas de Kaplan-Meier para la mortalidad por cualquier causa (A) y de causa cardiovascular (B) según el daño renal agudo durante el primer año de seguimiento y en el análisis de punto de referencia sin ajustar con un seguimiento iniciado a los 30 días de la mortalidad por cualquier causa (A) y de causa cardiovascular (B). HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Al considerar solo a los pacientes que habían sobrevivido a los 30 días en el análisis de punto de referencia ajustado, el DRA continuó mostrando asociación con mayor riesgo de mortalidad por cualquier causa (HR=2,86; IC95%, 1,55-5,28; p <0,001) y de mortalidad cardiovascular (HR=4,04; IC95%, 1,56-10,48; p <0,001) (figura 1).
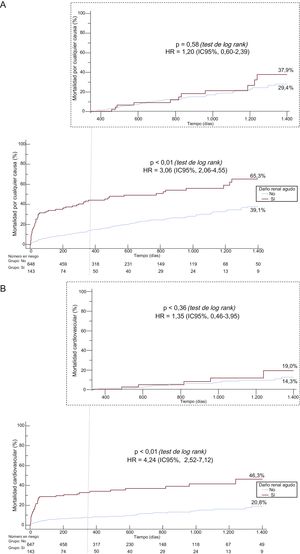
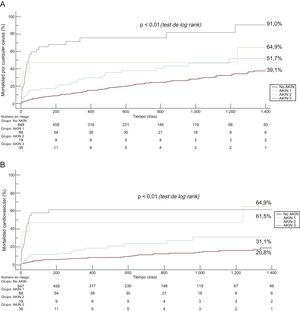
Resultados a largo plazoLa presencia de un DRA se asoció con un aumento al triple en el riesgo de mortalidad por cualquier causa (HR=3,06; IC95%, 2,06-4,55; p <0,001) y un aumento al cuádruple del riesgo de mortalidad de causa cardiovascular (HR=4,24; IC95%, 2,52-7,12; p <0,001) a los 4 años de seguimiento (figura 2). Es importante señalar que se observó un aumento gradual en la mortalidad por cualquier causa y de causa cardiovascular en los sucesivos estadios de DRA a lo largo de todo el periodo de seguimiento (figura 3). El DRA siguió mostrando asociación independiente con la mortalidad por cualquier causa (HR ajustada [HRa]=2,8; IC95%, 2,0-3,9; p <0,001) y la de causa cardiovascular (HRa=2,9; IC95%, 1,9-4,4; p <0,001), tras un ajuste respecto a las posibles variables de confusión (tabla 4).
Curvas de Kaplan-Meier para la mortalidad por cualquier causa (A) y de causa cardiovascular (B) según el daño renal agudo durante todo el periodo de seguimiento y en el análisis de punto de referencia sin ajustar iniciado en el seguimiento a 1 año de la mortalidad por cualquier causa (A) y de causa cardiovascular (B). HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Factores predictivos de mortalidad por cualquier causa y de causa cardiovascular a largo plazo
| Modelos | Variables | HR (IC95%) | p |
|---|---|---|---|
| Mortalidad por cualquier causa | |||
| DRA | 2,8 (2,0-3,9) | 0,001 | |
| EPOC | 2,33 (1,6-3,3) | 0,001 | |
| Valvuloplastia aórtica con balón | 2,2 (1,34-3,6) | 0,002 | |
| Clase funcional de la NYHA III o IV | 2,0 (1,18-3,4) | 0,001 | |
| Ictus importante | 1,98 (1,3-3,0) | 0,002 | |
| Hemorragia mayor o con peligro para la vida | 1,95 (1,4-2,8) | 0,01 | |
| Mortalidad cardiovascular | |||
| DRA | 2,9 (1,9-4,4) | < 0,001 | |
| Ictus importante | 3,1 (1,9-4,9) | < 0,001 | |
| Mala aposición de la válvula | 2,7 (1,5-4,7) | 0,001 | |
| Complicaciones vasculares mayores | 2,5 (1,6-4,2) | < 0,001 | |
| Clase funcional de la NYHA III o IV | 2,3 (1,1-4,7) | 0,028 | |
| EPOC | 1,8 (1,1-2,8) | 0,008 | |
| EVP | 1,8 (1,1-2,8) | 0,013 | |
| Sexo femenino | 0,65 (0,44-0,97) | 0,035 | |
DRA: daño renal agudo; EPOC: enfermedad pulmonar obstructiva crónica; EVP: enfermedad vascular periférica; HR: hazard ratio; IC95%: intervalo de confianza del 95%; NYHA: New York Heart Association.
Sin embargo, al considerar solo a los supervivientes a los 12 meses (428/794) en el análisis de punto de referencia ajustado, no se observaron diferencias en la mortalidad por cualquier causa (HR=1,20; IC95%, 0,60-2,39; p=0,58) ni en la mortalidad cardiovascular (HR=1,35; IC95%, 0,46-3,95; p=0,4) entre los pacientes con y sin DRA (figura 2). Incluso después de un ajuste respecto a covariables importantes, el DRA no se asoció con valores más altos de mortalidad por cualquier causa (HRa=1,2; IC95%, 0,5-2,6; p=0,71) y de causa cardiovascular (HRa=0,7; IC95%, 0,2-2,1; p=0,57).
DISCUSIÓNEste estudio obtuvo 3 resultados principales: a) la edad, la diabetes mellitus, la hemorragia importante o con peligro para la vida y la mala aposición de la válvula fueron factores independientes predictivos de DRA; b) el DRA se asoció con aumento de la mortalidad por cualquier causa y de causa cardiovascular tanto a corto como a largo plazo, con un incremento escalonado de la mortalidad según aumenta la gravedad del DRA, y c) sin embargo, en el análisis de punto de referencia ajustado con inicio en el seguimiento a 1 año, el DRA no se asoció con peor resultado, lo cual indica que su repercusión negativa en los resultados se limita al primer año tras el TAVI.
En este estudio, el DRA fue una complicación frecuente (18%) después del TAVI, lo cual coincide con lo indicado por 2 metanálisis previos9,15. Sin embargo, ninguno de ellos incluyó estudios en los que se utilizaran los criterios VARC-2 actualizados, que amplían el tiempo para el diagnóstico del DRA de 72 h a 7 días después del TAVI. Koifman et al.23 mostraron que había una discrepancia de alrededor de un 10% entre las definiciones de la AKIN y las de RIFLE (Riesgo, Daño, Fallo, Pérdida, Estadio terminal), lo cual indica que el DRA tras la intervención puede diagnosticarse erróneamente según la definición que se emplee, sobre todo teniendo en cuenta que las máximas concentraciones de creatinina suelen darse después de transcurridas 72 h de la intervención13,17,23.
En consonancia con estudios previos, el nuestro indica que el TAVI no transfemoral se asocia con aumento del riesgo de DRA12,17,24,25. Creemos que esta asociación está relacionada con la mayor frecuencia de complicaciones vasculares mayores, hemorragias y necesidad de transfusión de sangre que se da con el empleo de los abordajes alternativos transarterial o transapical y son factores de riesgo de DRA25,26.
La edad, la diabetes mellitus y la hemorragia con peligro para la vida son factores de riesgo bien conocidos de que se produzca DRA después de un TAVI10,17,27–29. Sin embargo, hasta donde nosotros sabemos, esta es la primera vez que se pone de manifiesto que la mala aposición de la válvula es un factor independiente predictivo de DRA. Se propone que a esta asociación pueden subyacer los siguientes factores. Primero, la cantidad de medio de contraste utilizada en los pacientes con mala aposición de la válvula fue, en promedio, un 50% superior. En segundo lugar, la mayor duración de la intervención, los periodos más largos de marcapasos ventricular y la inestabilidad hemodinámica persistente pueden causar un síndrome de respuesta inflamatoria sistémica, que parece ser un factor predictivo de DRA y se asocia con un resultado desfavorable24,30,31. Se puede especular con la posibilidad de que los dispositivos de segunda generación, algunos plenamente reposicionables y retirables32,33, reduzcan la incidencia de la mala aposición valvular y, por consiguiente, del DRA posterior a la intervención. Además, el menor perfil de los sistemas de aplicación más recientes probablemente reduzca las tasas de complicaciones vasculares y hemorrágicas y, por lo tanto, podría reducir también la incidencia de DRA.
Nuestros resultados apuntan a que el DRA se asocia con mayor mortalidad por cualquier causa y de causa cardiovascular en el seguimiento a corto (análisis de punto de referencia ajustado a 30 días) y a largo plazo. Sin embargo, en un análisis tipo landmark ajustado exploratorio, iniciado al año de seguimiento, no se observaron diferencias en las tasas de mortalidad por cualquier causa ni en las de causa cardiovascular al comparar a los pacientes con y sin DRA. Un estudio de Généreux et al.13 puso de relieve que un DRA significativo (estadios 2 o 3) se asocia con aumento de la mortalidad por cualquier causa a corto plazo, pero no tras un análisis tipo landmark a los 30 días. De igual modo, Barbanti et al.10 no observaron una repercusión significativa del DRA en la mortalidad de causa cardiovascular después de los 30 días. Así pues, nuestro estudio aporta una nueva perspectiva por cuanto pone de manifiesto que la principal repercusión negativa del DRA en la mortalidad se limita al primer año después de la intervención.
Es importante señalar que nuestros resultados indican que todos los estadios de DRA (1, 2 y 3) se asociaron con aumento de la mortalidad por cualquier causa y de causa cardiovascular tanto a corto como a largo plazo, con un incremento escalonado de la mortalidad según aumenta la gravedad del DRA. Esto coincide con resultados previos que indican que incluso un pequeño aumento de las concentraciones de creatinina (≥ 0,3 mg/dl) se asocia con peor pronóstico11,26. Esta observación resalta la importancia clínica de adoptar medidas preventivas contra el DRA tras la intervención en una población de alto riesgo formada por pacientes ancianos a los que se practica un TAVI.
LimitacionesNuestro estudio tiene varias limitaciones. En primer lugar, cada centro registró sus datos, por lo que la presencia de DRA podría haberse infranotificado, puesto que la verificación con los documentos fuente originales en los centros se realizó aleatoriamente solo en un 20% de los casos. Segundo, es posible que se diera de alta a algunos pacientes antes de que transcurrieran 7 días; no obstante, en nuestra población solo se dio de alta antes de ese plazo a un 1% de los pacientes. Tercero, aunque se introdujo un ajuste apropiado para las diferencias en las características iniciales, no se puede descartar factores de confusión no medidos y no es posible establecer una relación de causa-efecto entre el DRA y los resultados.
CONCLUSIONESEl DRA es una complicación frecuente tras el TAVI. La edad avanzada, la diabetes, las hemorragias mayores o con peligro para la vida y la mala aposición de la válvula son factores independientes predictivos de DRA. El DRA se asocia con mortalidad por cualquier causa y de causa cardiovascular, con un aumento escalonado según se incrementa la gravedad del DRA. Sin embargo, las principales repercusiones del DRA en la mortalidad se limitan al primer año tras el TAVI. Nuestros resultados indican que debe hacerse todo lo posible por identificar a los pacientes en riesgo, reducir las complicaciones de la intervención y adoptar medidas preventivas contra el DRA tras la intervención.
FINANCIACIÓNSociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista, São Paulo-SP, Brasil.
CONFLICTO DE INTERESESF.S. de Brito Jr, D.A. Siqueira y M.A. Perin son proctors de Edwards LifeSciences y Medtronic. L.A. Carvalho y R. Sarmento-Leite son proctors de Medtronic.
- –
Con frecuencia se observa DRA tras el TAVI, y se asocia con peor resultado a corto y medio plazo. Sin embargo, la evidencia existente es contradictoria respecto a las repercusiones del DRA en los resultados clínicos a largo plazo.
- –
Una nueva perspectiva, por cuanto pone de manifiesto que la principal repercusión negativa del DRA en la mortalidad se limita al primer año tras la intervención.
Los autores agradecen el trabajo experto de Patrícia O. Guimarães y Felipe N. Albuquerque, por su revisión externa del manuscrito, y dan las gracias a Teresa C.D.C. Nascimento, coordinador del estudio, y Rogério R. Prado por su apoyo estadístico.