La trombosis de stent (TS) es una complicación grave tras la angioplastia coronaria, y la ecografía intravascular es una herramienta capaz de discernir las causas. El objetivo es comparar los hallazgos por ecografía intravascular entre stents metálicos (SM) y stents farmacoactivos (SFA) en pacientes con TS tardía (de 31 días a 1 año) o muy tardía (>1año).
MétodosSe incluyó a 114 pacientes (el 45,5% con SM y el 54,5% con SFA) de un total de 250 consecutivos con TS tardía o muy tardía en 7 hospitales españoles. Se realizó una ecografía intravascular, que se analizó posteriormente para detectar la presencia de malaposición, infraexpansión y neoateroesclerosis.
ResultadosEl tiempo hasta la TS fue de 4,0 años en los SM y 3,4 años en los SFA (p = 0,04). La malaposición fue similar en ambos grupos (el 36,5 frente al 46,8%; p = 0,18), aunque numéricamente menor en los SM con trombosis muy tardía (el 26,6 frente al 48,0%; p = 0,07). La infraexpansión se observó de manera similar en ambos grupos (el 13,5 frente al 11,3%; p = 0,47). La neoateroesclerosis solo se observó en TS muy tardías y fue más prevalente en los SM (22,9%) que en los SFA (6,0%; p = 0,02). A los 2,9 años de seguimiento, las muertes cardiacas eran 0 frente a 6,9% respectivamente (p = 0,06) y las recurrencias de TS se produjeron en el 4,0 frente al 5,2% (p = 0,60).
ConclusionesLa malaposición es el hallazgo más frecuente en los pacientes con TS tardía y muy tardía, más prevalente en los SFA con TS muy tardías. Sin embargo, la neoateroesclerosis se observó únicamente en pacientes con TS muy tardías, y principalmente en SM.
Palabras clave
La trombosis del stent (TS) es una complicación infrecuente pero implica un peligro para la vida y da lugar a infarto de miocardio con elevación del segmento ST en la mayoría de los pacientes. La mortalidad oscila entre un 20 y un 40%1,2. Las TS tardía y muy tardía definitivas se definen como la presencia de un trombo en el stent por angiografía o anatomía patológica que se produce después del primer mes tras la intervención coronaria percutánea (ICP) índice3. La incidencia de la TS se ha reducido en los últimos años debido a la aparición de stents farmacoactivos (SFA) de nueva generación y el uso de los tratamientos antitrombóticos actuales4–6.
La etiología de la TS suele ser multifactorial7. La ecografía intravascular (IVUS) es una técnica de imagen intracoronaria que permite caracterizar el remodelado de la pared vascular e identificar la mayoría de las causas de TS, como la incompleta aposición del stent/strut persistente o tardía, la infraexpansión y la neoateroesclerosis. La IVUS puede predecir también los eventos cardiovasculares en el seguimiento de los pacientes tratados con una ICP guiada por esta técnica8. Las guías actuales de revascularización miocárdica recomiendan el uso de técnicas de imagen intravascular para detectar los problemas mecánicos relacionados con el stent (clase IIa, nivel de evidencia C)9. La evaluación de las causas de la TS puede ser útil para facilitar la elección de la mejor estrategia de tratamiento para cada caso. El tratamiento mediante angioplastia con balón, sin implante de stent adicional, se ha asociado con una mayor resolución de la malaposición y la infraexpansión del stent en comparación con lo que se produce con el implante de stents adicionales tras evaluar con IVUS los resultados postratamiento. En cambio, los pacientes con neoateroesclerosis podrían beneficiarse del implante de un stent adicional10.
Se sabe poco sobre las diferencias en prevalencia, cronología y causas de la TS tardía y muy tardía entre los stents metálicos (SM) y los SFA. El objetivo de este estudio es comparar las características clínicas y angiográficas y los hallazgos por IVUS entre los SM y los SFA en pacientes con TS definitiva tardía o muy tardía.
MÉTODOSCaracterísticas de la población y del procedimientoSe incluyó prospectivamente a todos los pacientes con una TS angiográfica tardía o muy tardía (≥ 1 mes) en 7 centros de España, entre enero de 2008 y diciembre de 2012. Las TS tardías son las que se producen entre 31 días y 1 año después del implante del stent, mientras que las TS muy tardías son las que aparecen pasado más de 1 año3. Todos los centros participantes en el estudio son centros de alto volumen (> 500 ICP/año) con gran uso de IVUS para las ICP complejas11. En total, 250 pacientes elegibles consecutivos presentaron una TS definitiva tardía o muy tardía, según la definición del Academic Research Consortium (el 0,69% del total de ICP realizadas por todos los centros participantes en el estudio). De este total, se examinaron mediante IVUS 117 lesiones en 116 pacientes. De estos pacientes, se excluyó del análisis a 3 por falta de información sobre el tipo de stent implantado. El diagrama de flujo de los pacientes se muestra en la figura 1. La mayoría de los pacientes excluidos son los que requirieron asistencia médica fuera de las horas de trabajo ordinarias o estaban hemodinámicamente inestables. Este estudio fue autorizado por los comités de ética locales de todos los centros participantes y se llevó a cabo cumpliendo lo establecido en la Declaración de Helsinki. Se obtuvo el consentimiento informado por escrito de todos los pacientes.
La ICP se llevó a cabo según la práctica clínica habitual en cada centro participante y el tratamiento de la TS se dejó a criterio del operador tras la evaluación on-line de las imágenes de IVUS.
Adquisición y análisis de la ecografía intravascularLa IVUS se realizó tras restablecer un flujo Thrombolysis in Myocardial Infarction (TIMI) ≥ 2 mediante aspiración del trombo o angioplastia percutánea con balón. La adquisición de la IVUS se llevó a cabo con el catéter Atlantis 40 MHz (Boston Scientific; Marlborough, Massachusetts, Estados Unidos).
La adquisición de las imágenes se realizó con un transductor con sistema de retirada automático con una velocidad de retirada de 0,5 mm/s, excepto en 1 centro donde fue de 1 mm/s. Las imágenes se digitalizaron para su posterior análisis off-line.
Dos analistas experimentados realizaron el análisis off-line de la IVUS, enmascarados al tipo de stent implantado a los pacientes, utilizando un programa informático de análisis cuantitativo de la IVUS (QIvus 3.0, Medis; Leiden, Países Bajos). Todos los análisis se realizaron en un laboratorio central de España (BARCICORE-lab, Barcelona, España). El segmento del stent se definió por sus bordes. Los segmentos de referencia proximal y distal se definieron como los 5 mm proximales y distales al stent siempre que fuera posible.
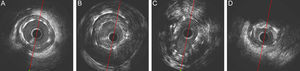
Antes del análisis cuantitativo, se pidió a los 2 analistas que evaluaran cualitativamente la IVUS adquirida e identificaran 5 hallazgos, malaposición, aneurismas, fractura del stent, infraexpansión del stent y neoateroesclerosis. La malaposición se definió como al menos 1 strut metálico separado de la pared vascular sin la presencia de una rama lateral. Los aneurismas se definieron como lesiones que incluían todas las capas de la pared vascular con membrana elástica externa y un área luminal más de un 50% superior que la del segmento de referencia proximal12,13. La fractura del stent se definió como la presencia de un segmento de 0,5 mm sin struts dentro del segmento del stent. La infraexpansión del stent se definió como un área mínima del stent ≤ 80% del área luminal de referencia. La neoateroesclerosis se definió como la clara presencia de una placa en el stent con características ecogénicas de lípidos o calcio14,15. Se muestran ejemplos de cada uno de estos hallazgos de IVUS en la figura 2.
Las mediciones cuantitativas de la luz, el stent, el vaso (membrana elástica interna), la malaposición y las áreas de neoíntima se realizaron con los métodos habituales12,16. El área luminal de referencia se obtuvo por la media del área luminal máxima medida en los segmentos de 5 mm proximales y distales12.
Seguimiento clínicoLos eventos adversos cardiacos mayores en el seguimiento se definieron como muerte, TS recurrente o revascularización de la lesión diana. La información sobre los eventos clínicos y el seguimiento se obtuvo mediante entrevistas telefónicas con los pacientes o sus familiares, así como de las historias clínicas hospitalarias.
Análisis estadísticoEl análisis estadístico se realizó con el programa informático SPSS, versión 20.0 (IBM Corp Armonk; Nueva York, Estados Unidos). Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de todas las variables continuas. Las variables continuas se presentan en forma de media ± 1 desviación estándar o intervalo intercuartílico cuando la distribución no es normal. Las variables discretas se expresan en forma de número y porcentaje. Con los datos de distribución normal, se utilizó la prueba de la t de Student para evaluar las diferencias en las variables continuas entre los grupos tratados con SFA y con SM. Para las variables de distribución no normal, se utilizó la prueba de Wilcoxon. Las comparaciones entre variables discretas se realizaron con la prueba de la χ2. Las curvas de supervivencia libre de eventos se generaron con un análisis de Kaplan-Meier, y las curvas de supervivencia de los distintos grupos se compararon mediante log-rank test. Se consideró significativo un valor de p bilateral < 0,05.
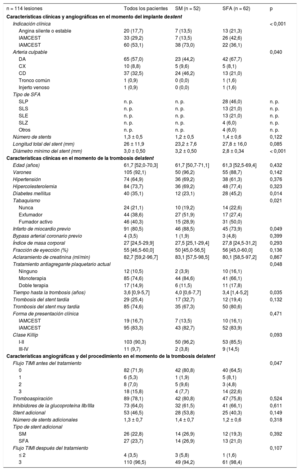
RESULTADOSCaracterísticas clínicas y angiográficas iniciales en el momento del implante del stentSe incluyeron en el estudio 114 lesiones en 113 pacientes con TS tardía o muy tardía: 52 (45,5%) se dieron en SM y 62 (54,5%), en SFA. Las características basales clínicas, angiográficas y del procedimiento se muestran en la tabla 1. Los SM se utilizaron con más frecuencia en pacientes con infarto agudo de miocardio con elevación del segmento ST (el 73,1 frente al 36,1%; p < 0,01) y en la arteria coronaria derecha (el 46,2 frente al 21,0%; p = 0,04) en el procedimiento inicial. El diámetro mínimo del stent fue mayor en el grupo de SM que en el de SFA (3,2 ± 0,5 frente a 2,8 ± 0,4 mm; p < 0,01). Se utilizaron SFA de primera generación en el 67% de los pacientes del grupo de SFA.
Características clínicas, angiográficas y del procedimiento
| n = 114 lesiones | Todos los pacientes | SM (n = 52) | SFA (n = 62) | p |
|---|---|---|---|---|
| Características clínicas y angiográficas en el momento del implante destent | ||||
| Indicación clínica | < 0,001 | |||
| Angina silente o estable | 20 (17,7) | 7 (13,5) | 13 (21,3) | |
| IAMCEST | 33 (29,2) | 7 (13,5) | 26 (42,6) | |
| IAMCEST | 60 (53,1) | 38 (73,0) | 22 (36,1) | |
| Arteria culpable | 0,040 | |||
| DA | 65 (57,0) | 23 (44,2) | 42 (67,7) | |
| CX | 10 (8,8) | 5 (9,6) | 5 (8,1) | |
| CD | 37 (32,5) | 24 (46,2) | 13 (21,0) | |
| Tronco común | 1 (0,9) | 0 (0,0) | 1 (1,6) | |
| Injerto venoso | 1 (0,9) | 0 (0,0) | 1 (1,6) | |
| Tipo de SFA | ||||
| SLP | n. p. | n. p. | 28 (46,0) | n. p. |
| SLS | n. p. | n. p. | 13 (21,0) | n. p. |
| SLE | n. p. | n. p. | 13 (21,0) | n. p. |
| SLZ | n. p. | n. p. | 4 (6,0) | n. p. |
| Otros | n. p. | n. p. | 4 (6,0) | n. p. |
| Número de stents | 1,3 ± 0,5 | 1,2 ± 0,5 | 1,4 ± 0,6 | 0,122 |
| Longitud total del stent (mm) | 26 ± 11,9 | 23,2 ± 7,6 | 27,8 ± 16,0 | 0,085 |
| Diámetro mínimo del stent (mm) | 3,0 ± 0,50 | 3,2 ± 0,50 | 2,8 ± 0,34 | < 0,001 |
| Características clínicas en el momento de la trombosis delstent | ||||
| Edad (años) | 61,7 [52,0-70,3] | 61,7 [50,7-71,1] | 61,3 [52,5-69,4] | 0,432 |
| Varones | 105 (92,1) | 50 (96,2) | 55 (88,7) | 0,142 |
| Hipertensión | 74 (64,9) | 36 (69,2) | 38 (61,3) | 0,376 |
| Hipercolesterolemia | 84 (73,7) | 36 (69,2) | 48 (77,4) | 0,323 |
| Diabetes mellitus | 40 (35,1) | 12 (23,1) | 28 (45,2) | 0,014 |
| Tabaquismo | 0,021 | |||
| Nunca | 24 (21,1) | 10 (19,2) | 14 (22,6) | |
| Exfumador | 44 (38,6) | 27 (51,9) | 17 (27,4) | |
| Fumador activo | 46 (40,3) | 15 (28,9) | 31 (50,0) | |
| Infarto de miocardio previo | 91 (80,5) | 46 (88,5) | 45 (73,9) | 0,049 |
| Bypass arterial coronario previo | 4 (3,5) | 1 (1,9) | 3 (4,8) | 0,399 |
| Índice de masa corporal | 27 [24,5-29,9] | 27,5 [25,1-29,4] | 27,8 [24,5-31,2] | 0,293 |
| Fracción de eyección (%) | 55 [46,5-60,0] | 50 [45,0-56,5] | 56 [45,0-60,0] | 0,136 |
| Aclaramiento de creatinina (ml/min) | 82,7 [59,2-96,7] | 83,1 [57,5-98,5] | 80,1 [58,5-97,2] | 0,867 |
| Tratamiento antiagregante plaquetario actual | 0,048 | |||
| Ninguno | 12 (10,5) | 2 (3,9) | 10 (16,1) | |
| Monoterapia | 85 (74,6) | 44 (84,6) | 41 (66,1) | |
| Doble terapia | 17 (14,9) | 6 (11,5) | 11 (17,8) | |
| Tiempo hasta la trombosis (años) | 3,6 [0,9-5,7] | 4,0 [0,6-7,7] | 3,4 [1,4-5,2] | 0,035 |
| Trombosis del stent tardía | 29 (25,4) | 17 (32,7) | 12 (19,4) | 0,132 |
| Trombosis del stent muy tardía | 85 (74,6) | 35 (67,3) | 50 (80,6) | |
| Forma de presentación clínica | 0,471 | |||
| IAMCEST | 19 (16,7) | 7 (13,5) | 10 (16,1) | |
| IAMCEST | 95 (83,3) | 43 (82,7) | 52 (83,9) | |
| Clase Killip | 0,093 | |||
| I-II | 103 (90,3) | 50 (96,2) | 53 (85,5) | |
| III-IV | 11 (9,7) | 2 (3,8) | 9 (14,5) | |
| Características angiográficas y del procedimiento en el momento de la trombosis delstent | ||||
| Flujo TIMI antes del tratamiento | 0,047 | |||
| 0 | 82 (71,9) | 42 (80,8) | 40 (64,5) | |
| 1 | 6 (5,3) | 1 (1,9) | 5 (8,1) | |
| 2 | 8 (7,0) | 5 (9,6) | 3 (4,8) | |
| 3 | 18 (15,8) | 4 (7,7) | 14 (22,6) | |
| Tromboaspiración | 89 (78,1) | 42 (80,8) | 47 (75,8) | 0,524 |
| Inhibidores de la glucoproteína IIb/IIIa | 73 (64,0) | 32 (61,5) | 41 (66,1) | 0,611 |
| Stent adicional | 53 (46,5) | 28 (53,8) | 25 (40,3) | 0,149 |
| Número de stents adicionales | 1,3 ± 0,7 | 1,4 ± 0,7 | 1,2 ± 0,6 | 0,318 |
| Tipo de stent adicional | ||||
| SM | 26 (22,8) | 14 (26,9) | 12 (19,3) | 0,392 |
| SFA | 27 (23,7) | 14 (26,9) | 13 (21,0) | |
| Flujo TIMI después del tratamiento | 0,107 | |||
| ≤ 2 | 4 (3,5) | 3 (5,8) | 1 (1,6) | |
| 3 | 110 (96,5) | 49 (94,2) | 61 (98,4) | |
CD: arteria coronaria derecha; CX: arteria circunfleja; DA: arteria descendente anterior; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMCEST: infarto agudo de miocardio sin elevación del segmento ST; n. p.: no procede; SFA: stents farmacoactivos; SLE: stent liberador de everolimus; SLS: stent liberador de paclitaxel; SLS: stent liberador de sirolimus; SLZ: stent liberador de zotarolimus; SM: stents metálicos; TIMI: Thrombolysis In Myocardial Infarction;.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En general, la TS se produjo una mediana de 3,6 (intervalo, 0,9-5,7) años después de la ICP inicial. Sin embargo, la TS ocurrió más tardíamente en el grupo de SM (4,0 [intervalo, 0,6-7,7] años) que en el de SFA (3,4 [1,4-5,2] años; p = 0,04). La forma de presentación clínica en el momento de la TS fue un infarto agudo de miocardio con elevación del segmento ST en el 83,3% de los pacientes y un infarto agudo de miocardio sin elevación del segmento ST en el 16,7%, sin diferencias significativas entre los grupos de tratamiento.
Las características clínicas en el momento de la TS fueron similares con los 2 tipos de stent, excepto por la diabetes mellitus (el 23,1% del grupo de SM frente al 45,2% del grupo de SFA; p = 0,01), el tabaquismo (28,9% de fumadores actuales en el grupo de SM frente al 50,0% en el de SFA; p = 0,02) y los antecedentes de infarto de miocardio previo (el 88,5 frente al 73,9%; p = 0,05). La mayoría de los pacientes (74,6%) recibían 1 solo fármaco antiagregante en el momento del ingreso. El 10,5% no recibía ningún fármaco antiagregante, y este porcentaje era superior entre los pacientes del grupo de SFA (16,1%) que en los del grupo de SM (3,9%; p = 0,05).
En el momento de la TS, los pacientes tratados con SM presentaban con más frecuencia una oclusión completa del vaso diana con un flujo TIMI 0 antes del tratamiento (el 80,8 frente al 64,5%; p = 0,05). Se trató con implante de un stent adicional un total de 53 lesiones (46,5%), y hubo una diferencia numérica entre los grupos (el 53,8 frente al 40,3%; p = 0,15).
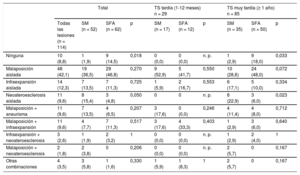
Hallazgos de la ecografía intravascularLos hallazgos cualitativos de la IVUS, incluidas todas las posibles combinaciones de los hallazgos ecográficos predeterminados, se resumen en la tabla 2. Se adquirió la IVUS de todos los pacientes antes del tratamiento. En 10 pacientes (8,6%), no se observó ninguno de los hallazgos cualitativos de la IVUS predefinidos: el 1,9% del grupo de SM frente al 14,5% del grupo de SFA (p = 0,02).
Hallazgos cualitativos de la ecografía intravascular
| Total | TS tardía (1-12 meses) n = 29 | TS muy tardía (≥ 1 año) n = 85 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Todas las lesiones (n = 114) | SM (n = 52) | SFA (n = 62) | p | SM (n = 17) | SFA (n = 12) | p | SM (n = 35) | SFA (n = 50) | p | |
| Ninguna | 10 (8,8) | 1 (1,9) | 9 (14,5) | 0,018 | 0 (0,0) | 0 (0,0) | n. p. | 1 (2,9) | 9 (18,0) | 0,033 |
| Malaposición aislada | 48 (42,1) | 19 (36,5) | 29 (46,8) | 0,270 | 9 (52,9) | 5 (41,7) | 0,550 | 10 (28,6) | 24 (48,0) | 0,072 |
| Infraexpansión aislada | 14 (12,3) | 7 (13,5) | 7 (11,3) | 0,725 | 1 (5,9) | 2 (16,7) | 0,553 | 6 (17,1) | 5 (10,0) | 0,334 |
| Neoateroesclerosis aislada | 11 (9,6) | 8 (15,4) | 3 (4,8) | 0,050 | 0 | 0 | n. p. | 8 (22,9) | 3 (6,0) | 0,023 |
| Malaposición + aneurisma | 11 (9,6) | 7 (13,5) | 4 (6,5) | 0,207 | 3 (17,6) | 0 (0,0) | 0,246 | 4 (11,4) | 4 (8,0) | 0,712 |
| Malaposición + infraexpansión | 11 (9,6) | 4 (7,7) | 7 (11,3) | 0,517 | 3 (17,6) | 4 (33,3) | 0,403 | 1 (2,9) | 3 (6,0) | 0,640 |
| Infraexpansión + neoateroesclerosis | 3 (2,6) | 1 (1,9) | 2 (3,2) | 1 | 0 (0,0) | 0 (0,0) | n. p. | 1 (2,9) | 2 (4,0) | 1 |
| Malaposición + neoateroesclerosis | 2 (1,8) | 2 (3,8) | 0 | 0,206 | 0 (0,0) | 0 (0,0) | n. p. | 2 (5,7) | 0 | 0,167 |
| Otras combinaciones | 4 (3,5) | 3 (5,8) | 1 (1,6) | 0,330 | 1 (5,9) | 1 (8,3) | 1 | 2 (5,7) | 0 | 0,167 |
n. p.: no procede; SFA: stents farmacoactivos; SM: stents metálicos; TS: trombosis del stent.
Los valores expresan n (%).
Se observó una malaposición aislada en 48 (42,1%) pacientes, una infraexpansión aislada en 14 (12,3%) y una neoateroesclerosis aislada en 11 (9,6%). Tan solo hubo 1 caso de fractura del stent (0,9%), en un paciente del grupo de SFA. La malaposición aislada fue numéricamente inferior en el grupo de SM que en el de SFA (el 36,5 frente al 46,8%; p = 0,18). Al analizar únicamente a los pacientes con TS muy tardía, la malaposición aislada fue un 20% inferior entre los pacientes tratados con SM (el 28,6 frente al 48,0%; p = 0,07). La combinación de malaposición y aneurisma tendió a darse más en el grupo de SM (el 13,5 frente al 6,5%; p = 0,17). La neoateroesclerosis aislada se observó exclusivamente en pacientes con TS muy tardía y fue más frecuente en el grupo de SM (el 15,4 frente al 4,8%; p = 0,05).
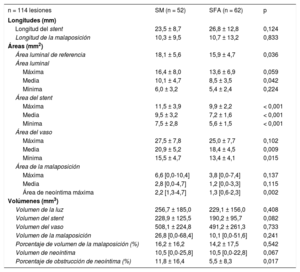
Los datos cuantitativos de la IVUS se resumen en la tabla 3. Se observaron diferencias en el área luminal media (10,1 ± 4,7 frente a 8,5 ± 3,5 mm2; p = 0,04), el área media del stent (9,5 ± 3,2 frente a 7,2 ± 1,6 mm2; p < 0,01) y el área media del vaso (20,9 ± 5,2 frente a 18,4 ± 4,5 mm2; p = 0,01), y las áreas eran significativamente mayores en el grupo de SM que en el de SFA. Las longitudes de malaposición fueron similares entre los SM (10,3 ± 9,5 mm) y los SFA (10,7 ± 13,2 mm; p = 0,83). Sin embargo, el área máxima de malaposición fue numéricamente mayor en el grupo de SM (6,6 [intervalo, 0-10,4] mm2) que en el grupo de SFA (3,8 [0-7,4] mm2; p = 0,14).
Hallazgos cuantitativos de la ecografía intravascular
| n = 114 lesiones | SM (n = 52) | SFA (n = 62) | p |
|---|---|---|---|
| Longitudes (mm) | |||
| Longitud del stent | 23,5 ± 8,7 | 26,8 ± 12,8 | 0,124 |
| Longitud de la malaposición | 10,3 ± 9,5 | 10,7 ± 13,2 | 0,833 |
| Áreas (mm2) | |||
| Área luminal de referencia | 18,1 ± 5,6 | 15,9 ± 4,7 | 0,036 |
| Área luminal | |||
| Máxima | 16,4 ± 8,0 | 13,6 ± 6,9 | 0,059 |
| Media | 10,1 ± 4,7 | 8,5 ± 3,5 | 0,042 |
| Mínima | 6,0 ± 3,2 | 5,4 ± 2,4 | 0,224 |
| Área del stent | |||
| Máxima | 11,5 ± 3,9 | 9,9 ± 2,2 | < 0,001 |
| Media | 9,5 ± 3,2 | 7,2 ± 1,6 | < 0,001 |
| Mínima | 7,5 ± 2,8 | 5,6 ± 1,5 | < 0,001 |
| Área del vaso | |||
| Máxima | 27,5 ± 7,8 | 25,0 ± 7,7 | 0,102 |
| Media | 20,9 ± 5,2 | 18,4 ± 4,5 | 0,009 |
| Mínima | 15,5 ± 4,7 | 13,4 ± 4,1 | 0,015 |
| Área de la malaposición | |||
| Máxima | 6,6 [0,0-10,4] | 3,8 [0,0-7,4] | 0,137 |
| Media | 2,8 [0,0-4,7] | 1,2 [0,0-3,3] | 0,115 |
| Área de neoíntima máxima | 2,2 [1,3-4,7] | 1,3 [0,6-2,3] | 0,002 |
| Volúmenes (mm3) | |||
| Volumen de la luz | 256,7 ± 185,0 | 229,1 ± 156,0 | 0,408 |
| Volumen del stent | 228,9 ± 125,5 | 190,2 ± 95,7 | 0,082 |
| Volumen del vaso | 508,1 ± 224,8 | 491,2 ± 261,3 | 0,733 |
| Volumen de la malaposición | 26,8 [0,0-68,4] | 10,1 [0,0-51,6] | 0,241 |
| Porcentaje de volumen de la malaposición (%) | 16,2 ± 16,2 | 14,2 ± 17,5 | 0,542 |
| Volumen de neoíntima | 10,5 [0,0-25,8] | 10,5 [0,0-22,8] | 0,067 |
| Porcentaje de obstrucción de neoíntima (%) | 11,8 ± 16,4 | 5,5 ± 8,3 | 0,017 |
SFA: stents farmacoactivos; SM: stents metálicos.
Salvo otra indicación, los valores expresan media ± desviación estándar o mediana [intervalo intercuartílico].
El área máxima de neoíntima también fue mayor en el grupo de SM (2,2 [1,3-4,7] mm2) que en el de SFA (1,3 [0,6-2,3] mm2; p < 0,01). El porcentaje de obstrucción de neoíntima, definido como el volumen de neoíntima dividido por el volumen de stent, también fue significativamente mayor en el grupo de SM (el 11,8% ± 16,4% frente al 5,5% ± 8,3%; p = 0,02).
Resultados clínicosSe obtuvieron datos clínicos de 107 pacientes (94,7%), con una mediana de seguimiento de 2,9 (intervalo, 1,9-4,9) años. Durante el seguimiento, se produjeron 11 muertes (10,3%): 2 (4,0%) en el grupo de SM y 9 (15,5%) en el de SFA (p = 0,06). Tan solo 4 muertes (3,7%) fueron por causas cardiacas o desconocidas: 0 en el grupo de SM y 4 (6,9%) en el de SFA (p = 0,06). Se observó revascularización de la lesión diana en un total de 6 pacientes (5,1%): 2 (4,0%) del grupo de SM y 4 (6,9%) del de SFA (p = 0,42). Se produjeron TS recurrentes definitivas o probables en 5 pacientes (4,7%): 2 (4,0%) en el grupo de SM y 3 (5,2%) en el de SFA (p = 0,60). Todos los pacientes con TS recurrente ya habían presentado malaposición en el momento de la primera TS. El tratamiento de la primera TS había sido angioplastia con balón sin implante de stent adicional en 1 paciente e implante de stent adicional en 4. Inmediatamente después de la ICP de la primera TS, la IVUS mostró malaposición persistente en 4 pacientes (80,0%). La forma de presentación clínica de la TS recurrente fue un infarto agudo de miocardio con elevación del segmento ST en 2 pacientes, un infarto agudo de miocardio sin elevación del segmento ST en 2 y muerte súbita en 1 paciente. En la figura 3 se muestran las curvas de supervivencia de Kaplan-Meier para la muerte cardiaca, la revascularización de la lesión diana y la TS recurrente definitiva o probable. Estas muestran similares resultados clínicos en los 2 grupos de tratamiento por lo que respecta a los eventos cardiacos mayores adversos en el seguimiento.
DISCUSIÓNLos principales resultados del presente estudio son: a) en los pacientes con TS tardía o muy tardía, la IVUS identificó un gran número con TS de causas mecánicas; b) la malaposición es el hallazgo más frecuente en los pacientes con TS tardía o muy tardía, más del 60% de los pacientes y más frecuentemente en el grupo de SFA; c) la neoateroesclerosis se observó únicamente en los pacientes con TS muy tardía y fue más frecuente en el grupo de SM, y d) los pacientes con TS tardía o muy tardía tratados con estrategias guiadas por IVUS mostraron en el seguimiento a medio plazo unos resultados clínicos favorables con ambos tipos de stent.
Según nuestro conocimiento, este es el estudio más amplio que haya analizado por IVUS las diferencias existentes entre los SM y los SFA en pacientes con TS tardía o muy tardía. Es bien sabido que las causas de la TS son multifactoriales e incluyen factores relacionados con el paciente, del procedimiento, del tratamiento antiagregante plaquetario y específicos de cada dispositivo. Se ha descrito que las causas mecánicas de la TS temprana (< 1 mes) suelen deberse a una infraexpansión del stent, la presencia de una disección residual y al mal flujo TIMI al final de la intervención17. En cambio, el retraso en la cicatrización del vaso, el remodelado positivo del vaso con una malaposición adquirida tardíamente, la respuesta neointimal excesiva y la neoateroesclerosis se han asociado con la TS tardía y muy tardía18–21. La ICP guiada por IVUS se asocia con mejor resultado clínico en el seguimiento. Un reciente metanálisis que incluyó a más de 25.000 pacientes puso de manifiesto que la ICP guiada por IVUS se asoció con menor riesgo de muerte, infarto de miocardio, revascularización de lesión diana y TS después del implante de un SFA22.
La malaposición es el hallazgo más frecuente en los pacientes con TS23–25. Sin embargo, su importancia continúa siendo objeto de controversia, en especial por lo que respecta a la extensión que llega a ser clínicamente relevante y puede contribuir a que se produzca una TS recurrente25. Se sabe que la incidencia de la malaposición es superior con los SFA que con los SM en pacientes sin eventos evaluados con IVUS a los 6-9 meses26. En ese estudio, los pacientes con malaposición tuvieron mayor riesgo de TS tardía o muy tardía en el seguimiento26. Kosonen et al.27 observaron malaposición en el 50% de los pacientes con TS muy tardía evaluados mediante IVUS, con una prevalencia significativamente superior en los pacientes tratados con SFA. En el mismo estudio, la malaposición fue más extensa en el grupo de SFA, con mayores área máxima y longitud de la malaposición27. En el presente estudio, la malaposición también es el hallazgo más común en los pacientes con TS, tanto en el grupo de SFA como en el de SM. La proporción de pacientes con malaposición fue numéricamente superior en el grupo de SFA, especialmente en los pacientes con TS muy tardía. No obstante, no hubo diferencias significativas entre los grupos por lo que respecta a la longitud, el área o el volumen de la malaposición.
La aposición incompleta del stent puede ser persistente, debido a la inadecuada implantación del stent, o adquirida por remodelado positivo del vaso o disolución del trombo después de la ICP. Guo et al.28 describieron malaposición en un 30-40% de los pacientes inmediatamente después de la ICP primaria realizada con un SFA o un SM. En un 40% de estos casos, la malaposición se resolvió a los 13 meses. La incidencia de malaposición tardía fue mayor en los SFA que en los SM, pero en ese estudio no se produjeron muertes o TS relacionadas con la malaposición.
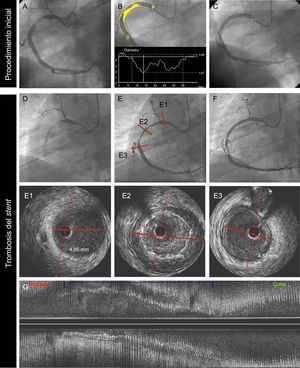
La presencia de aneurismas coronarios también se ha asociado con la TS29. En nuestro estudio, la combinación de malaposición y aneurismas fue numéricamente superior en el grupo de SM (el 13,5 frente al 6,5%), pero esta diferencia no alcanzó significación estadística. Este hallazgo puede explicarse por la preferencia de los operadores por implantar un SM en los vasos grandes que no son adecuados para una aposición óptima del stent. En la figura 4 se muestra un ejemplo de un paciente con una TS muy tardía en un SM implantado en una arteria coronaria derecha grande.
Trombosis muy tardía de un SM causada por un probable remodelado vascular positivo, en un varón de 69 años con infarto agudo de miocardio sin elevación del segmento ST. La angiografía basal (A, B y C) mostró una lesión trombótica en la arteria coronaria derecha proximal (A). B: la angiografía coronaria cuantitativa mostró un diámetro de referencia del vaso de 4,84 mm; P y D son, respectivamente, los diámetros de referencia proximal y distal del vaso. C: se trató al paciente con un SM de 4,5 × 38 mm. D: a los 18 meses, el paciente presentó una TS muy tardía; la angiografía mostró una oclusión trombótica de la arteria. E: se restableció el flujo tras aspiración del trombo. La imagen de IVUS (E1, E2, E3, G) mostró unos diámetros luminal de referencia proximal y distal de 4,9 mm (E1, E3); el segmento tratado con el stent mostró un probable remodelado positivo del vaso (diámetro luminal de 6,9mm) con una gran malaposición (E2 y G: vistas axial y longitudinal respectivamente). Se trató al paciente con un balón no distensible de 6,0 × 15 mm. IVUS: ecografía intravascular; SM: stent metálico; TS: trombosis del stent.
El presente estudio pone de manifiesto que la proliferación neointimal y la neoateroesclerosis fueron significativamente más frecuentes en las TS del grupo de SM. Lee et al.30 describieron rotura de la neoíntima en el stent en el 100% de los casos de TS muy tardía en SM y el 43,5% de los casos de TS muy tardía en SFA; Pesarini et al.31 observaron rotura de la placa en el 78 frente al 8% de los pacientes con TS tardía o muy tardía respectivamente. Kang et al.32 observaron placas de neoateroesclerosis en el 70% de 33 casos de TS muy tardía en SFA y SM evaluados con tomografía de coherencia óptica. Esta discrepancia entre la IVUS y la tomografía de coherencia óptica puede explicarse por la baja resolución axial de aquella, lo que dificulta caracterizar el tejido neointimal dentro del stent y determinar la cantidad de placa existente32. La tomografía de coherencia óptica es la mejor técnica de imagen para evaluar la endotelización de los struts, la malaposición, la infraexpansión del stent y la neoateroesclerosis33. Sin embargo, en pacientes con TS, la presencia de trombo persistente puede dificultar la evaluación de estos parámetros y, en la mayoría de los casos, la tomografía de coherencia óptica no permite evaluar la membrana elástica externa y la reacción de la pared del vaso.
LimitacionesPara empezar, se trata de un estudio observacional; todas las comparaciones presentadas corresponden tan solo a observaciones generadoras de hipótesis. Segundo, puede haber un sesgo de inclusión, puesto que se exploró con IVUS solo al 50% de los pacientes con TS que acudieron a nuestros centros; la mayoría de los pacientes excluidos ingresaron fuera del horario laboral ordinario o no fueron evaluados con IVUS debido a su inestabilidad hemodinámica; la exclusión de ese grupo de pacientes de alto riesgo podría haber influido en los resultados del estudio. Además, se utilizaron SFA de primera generación en el 67% de los pacientes del grupo de SFA. Así pues, serán necesarios nuevos estudios para ampliar estos resultados a los SFA de nueva generación. Por último, la IVUS no se realizó en procedimiento inicial; por consiguiente, no se puede diferenciar la malaposición persistente de la adquirida.
CONCLUSIONESLa exploración por IVUS de los pacientes con TS tardía o muy tardía ha permitido identificar un gran número de casos de TS de causas mecánicas. Se observan diferencias en las causas mecánicas de TS entre los SM y los SFA según los hallazgos de la IVUS. La malaposición es el hallazgo más frecuente en los pacientes con TS y se observa con mayor frecuencia en los pacientes con TS muy tardía en un SFA. En cambio, la neoateroesclerosis se observó exclusivamente en los pacientes con TS muy tardía, y fue más frecuente en aquellos con SM. Los pacientes con TS tardía o muy tardía tratados con intervencionismo guiado por IVUS presentaron unos resultados clínicos favorables en el seguimiento a medio plazo. Por consiguiente, conocer las causas podría conllevar un mejor tratamiento de la TS.
CONFLICTO DE INTERESESA. Sánchez-Recalde es editor asociado de Revista Española de Cardiología.
- –
Es bien sabido que las causas de la TS son multifactoriales. La IVUS es una técnica de imagen intracoronaria que permite diferenciar la mayoría de las causas de TS, como la malaposición, la infraexpansión y la neoateroesclerosis.
- –
No obstante, son pocos los estudios que hayan evaluado las diferencias en los hallazgos por IVUS entre los SM y los SFA en la TS tardía o muy tardía. Además, la incidencia de los principales hallazgos de la IVUS evaluados difieren entre ellos.
- –
Un estudio previo indicó que el tratamiento de la TS guiado por IVUS se asoció con mejor resultado clínico. Por consiguiente, la evaluación mediante IVUS de las causas mecánicas de la TS puede mejorar el diagnóstico y facilitar la elección de la mejor estrategia de tratamiento para cada paciente.
- –
Este es el estudio más amplio hasta la fecha que haya analizado las diferencias por IVUS entre los SM y los SFA en pacientes con una TS tardía o muy tardía.
- –
Este estudio muestra que la malaposición es el hallazgo más frecuente en todas las TS y principal contribuyente a las TS en SFA, mientras que la neoateroesclerosis se observa principalmente en la TS en SM. Estos resultados indican que en el desarrollo de las TS subyacen mecanismos diferentes en función del tipo de stent.
- –
Los pacientes con TS tardía o muy tardía tratados con estrategias guiadas por IVUS tienen resultados clínicos favorables.