Durante la gestación normal se producen cambios hormonales, se establece la circulación uteroplacentaria, se incrementa el volumen plasmático, disminuyen las resistencias vasculares periféricas y se producen modificaciones que favorecen la hipercoagulabilidad. Todo ello favorece la aparición de semiología cardiovascular, haciendo que el diagnóstico diferencial con la existencia de cardiopatía subyacente sea a la vez fundamental y complejo. Además, estos cambios fisiológicos aumentan el riesgo de complicaciones maternofetales en las mujeres con cardiopatía.Se considera que la cardiopatía en el embarazo es la primera causa de morbimortalidad materna de causa no obstétrica. Las cardiopatías reumática y congénitas son, hoy día, las más frecuentes en la mujer embarazada, seguidas por la hipertensión arterial, la cardiopatía isquémica y las arritmias. En general, la enfermedad cardíaca tiende a empeorar con el tiempo, por lo que las mujeres con cualquier tipo de cardiopatía que deseen tener niños deberían hacerlo lo antes posible. La mayoría de las pacientes con cardiopatía no tienen problemas para llevar a término un embarazo. Las excepciones a esta regla son las pacientes en grado funcional III-IV con severo compromiso de la función cardíaca, la hipertensión pulmonar de cualquier origen, las cardiopatías congénitas con cianosis y grado funcional III-IV, el síndrome de Marfan, las lesiones obstructivas izquierdas severas sintomáticas o asintomáticas con datos de disfunción sistólica, las portadoras de válvulas cardíacas artificiales y las mujeres con antecedentes de miocardiopatía asociada al embarazo, en las cuales debe desaconsejarse el embarazo o, en caso de producirse, puede recomendarse su interrupción, asumiendo los problemas éticos que se generan a la embarazada y al médico. Las cardiopatías más graves conllevan una elevada incidencia de aborto espontáneo, y en las cardiopatías congénitas debe valorarse el riesgo asociado de herencia. La intervención médica debe iniciarse precozmente, antes de la concepción, incluyendo la información respecto a las posibles repercusiones sobre la cardiopatía materna y el feto.
Palabras clave
Embarazo
Cardiopatía
Guías clínicas
MODIFICACIONES CARDIOVASCULARES EN EL EMBARAZO
Las principales modificaciones de los parámetros cardiovasculares durante el período gestacional son debidas a cambios hormonales, a la presencia de la circulación uteroplacentaria y al incremento del tamaño del útero. Todos los cambios que a continuación se describen se iniciarían en una fase muy precoz del embarazo, haciéndose más evidentes conforme transcurre éste y adquiriendo en el tercer trimestre su máxima expresión.
En el segundo mes se inicia un progresivo incremento del volumen plasmático, más veloz en la primera mitad del embarazo y que al final del tercer trimestre puede llegar a suponer hasta un 50% respecto del que existía basalmente. Es debido sobre todo a la relajación de la musculatura lisa vascular ante factores endoteliales, como la prostaciclina y los estrógenos circulantes, a la resistencia a la angiotensina II y a la retención hidrosalina relacionada con las concentraciones de hormonas sexuales.
Aunque están incrementados tanto el volumen plasmático como la masa celular sanguínea, ésta lo está en menor amplitud, lo que explica la anemia «dilucional» de estas mujeres. El incremento del volumen plasmático es mayor en los embarazos múltiples y a partir de la primera gestación.
El gasto cardíaco (GC) se incrementa progresivamente hasta en un 30-50% hacia las semanas 24-26 y luego se mantiene estable hasta finales del embarazo. Es entonces posible que aparezcan cuadros bruscos de descenso del GC e hipotensión por el efecto de la compresión que el útero grávido ejerce sobre la vena cava inferior en la posición de decúbito supino. El aumento del GC se produce principalmente a expensas de un mayor volumen sistólico por un mayor acortamiento de las fibras miocárdicas, dado que la frecuencia cardíaca sólo aumenta en un 10-15%.
En el embarazo asistimos a un descenso de las resistencias vasculares periféricas, tanto por acción hormonal como por el efecto «fístula» que supone la existencia de la circulación uteroplacentaria. Esto implica una disminución de la presión arterial sistémica más evidente a lo largo del segundo trimestre y menos llamativa a finales de la gestación. La disminución algo mayor de la presión diastólica hace posible cierto aumento de la presión diferencial. Las presiones pulmonares no varían significativamente, pues el aumento del GC y del volumen plasmático contrarrestan el descenso que se produce en las resistencias vasculares pulmonares.
Finalmente, existe cierto estado de hipercoagulabilidad con una mayor viscosidad plasmática, aumentada presencia de factores de coagulación II, VII, VIII, IX y X, mayores concentraciones de fibrinógeno sérico, mayor turnover plaquetario y una actividad fibrinolítica plasmática disminuida.
SEMIOLOGÍA CARDIOVASCULAR DURANTE LA GESTACIÎN
Durante la gestación normal pueden aparecer síntomas y signos sugestivos de enfermedad cardíaca, como la disminución de la tolerancia al esfuerzo con disnea y fatigabilidad, la aparición de edemas en las extremidades inferiores, sensación de palpitaciones y mareos o incluso cuadros sincopales cuya distinción de los síntomas cardiológicos graves es fundamental. La dilatación del lecho venoso periférico, la compresión de la cava inferior y el aumento del volumen de agua total son causa de edemas en tres cuartas partes de las mujeres embarazadas sin cardiopatía. Asimismo, las variaciones normales de la presión arterial y la frecuencia cardíaca antes mencionadas, el aumento de las ondas de pulso venoso y arterial, un impulso sistólico precordial más enérgico de lo habitual y la auscultación de soplos o cambios en los ruidos cardíacos normales pueden hacer necesario descartar la presencia de alguna cardiopatía. Es frecuente escuchar un primer ruido intenso por la taquicardia y una contractilidad aumentada; un tercer ruido cardíaco por la mayor velocidad del llenado ventricular y un soplo mesosistólico en el foco pulmonar por el hiperaflujo son igualmente fisiológicos. El flujo acelerado en la salida de los troncos supraaórticos es el causante del soplo mesosistólico supraclavicular audible en algunas gestantes. El aumento del retorno venoso provoca el «hum» venoso en las yugulares, que desaparece típicamente al comprimirlas.
Finalmente, es conocido el soplo mamario, que puede auscultarse en ambos senos por la hipervascularización que presentan al final del embarazo y en la lactancia.
De igual modo, en este período pueden sufrir variaciones los signos auscultatorios típicos de algunas cardiopatías. Se hacen habitualmente más audibles la estenosis mitral y la estenosis de sigmoideas aórticas y pulmonares, por el aumento del gasto y frecuencia cardíaca existentes. Sin embargo, los soplos del prolapso mitral y las regurgitaciones mitral y aórtica pueden ser menos audibles por la taquicardia, el descenso de las resistencias vasculares y el aumento de volúmenes ventriculares.
En cuanto a las exploraciones complementarias, el electrocardiograma suele reflejar la horizontalización del corazón, con un eje eléctrico desviado a la izquierda, puede demostrar alteraciones de la repolarización ventricular habitualmente inespecíficas, extrasistolia supraventricular o ventricular de variable densidad y en algunas gestantes se advierten distintos grados de bloqueo auricular de tipo Wenckebach. En la radiografía de tórax se observa con frecuencia un aumento del índice cardiotorácico debido a la horizontalización del corazón y a un ligero incremento de los volúmenes ventriculares. Puede aparecer más prominente el cono pulmonar por la hiperlordosis de la embarazada. El ecocardiograma refleja en algunos casos un aumento del diámetro y volumen telediastólico del ventrículo izquierdo (VI).
RIESGOS QUE PUEDE REPRESENTAR EL EMBARAZO PARA LA MADRE Y PARA EL HIJO EN RELACIÎN CON LA CARDIOPATÍA
La cardiopatía en el embarazo es un problema grave pues, aunque su incidencia oscila entre el 0,4-2%, para muchos es la primera causa de mortalidad materna de causa no obstétrica. La disminución de la frecuencia de fiebre reumática y, por tanto, de la posible cardiopatía residual, así como el mejor tratamiento médico-quirúrgico de las cardiopatías congénitas, hacen que el obstetra se enfrente a problemas que difieren en mucho a los de hace dos o tres decenios. La proporción 20:1 entre cardiopatías reumáticas y congénitas es actualmente en muchos hospitales de 2:1. El resto de las enfermedades asociadas al corazón constituyen un grupo de menor frecuencia e incluyen la hipertensión arterial, la cardiopatía isquémica y las arritmias.
Los cambios fisiológicos que ocurren durante el embarazo pueden aumentar el riesgo de complicaciones, tanto para la madre como para el feto en las mujeres con cardiopatías. En la mayoría de los casos, las pacientes en clase funcional I-II de la New York Heart Association (NYHA) con buena función ventricular y con cardiopatías no complejas, este aumento de riesgo es despreciable o fácilmente controlable, con un seguimiento cercano y con los medios de que disponemos en la actualidad. Afortunadamente, en los países occidentales son pocas las mujeres que llegan a la edad fértil desconociendo que padecen una enfermedad cardíaca, pero existen todavía grupos de población en los que se puede descubrir una cardiopatía, incluso severa, por primera vez durante un embarazo 1,2.
La actitud del cardiólogo ante la mujer cardiópata que desea tener descendencia o que ya está embarazada debe ser la de considerar adecuadamente los riesgos para la madre y el feto durante el embarazo, parto y puerperio, junto con el pronóstico a medio y largo plazo de la cardiopatía que podrían afectar al cuidado futuro de los hijos. En estas situaciones nos enfrentamos con la dificultad de que existen muy pocos estudios sobre el tema y la información de la bibliografía está constituida fundamentalmente por casos aislados.
La intervención médica a los posibles padres debe iniciarse precozmente antes de la concepción y debe incluir el conocimiento de aspectos que afectan a madre y feto.
Influencia de la gestación sobre la cardiopatía
La mortalidad materna durante la gestación es aún importante en ciertas enfermedades. Entre las cardiopatías adquiridas se consideran asociadas a mortalidad extremadamente alta la estenosis aórtica descompensada (17%), las valvulopatías en clase funcional III-IV o en fibrilación auricular (5%) y, en menor grado, aquellas en clase funcional I-II (1%), la cardiomiopatía dilatada perinatal (15-60%) y el infarto de miocardio (37%). En cuanto a las cardiopatías congénitas asociadas a riesgo más elevado, se incluyen la hipertensión pulmonar y el síndrome de Eisenmenger (25-53%), la coartación de aorta (9%) y el síndrome de Marfan (50%). Finalmente, las pacientes portadoras de prótesis valvulares presentan cifras de mortalidad relacionada con el embarazo del 1% en el caso de bioprótesis y del 2-4% cuando se trata de portadores de prótesis mecánicas o requieren anticoagulación.
Además, en general se puede considerar que la cardiopatía empeora un grado de la Clasificación Funcional de la New York Heart Association durante la gestación. Según la situación funcional, las cifras de mortalidad materna oscilan del 0,1% en las pacientes asintomáticas hasta el 6% en las pacientes en clase funcional IV de la NYHA (tabla 1).
Influencia de la cardiopatía sobre la gestación
Las gestaciones en madres cardiópatas se han asociado también a mayor incidencia de parto prematuro, retraso del crecimiento intrauterino, sufrimiento fetal y una mortalidad perinatal cercana al 18%, diez veces superior a la general. En las cardiopatías congénitas (CC) hay que valorar, asimismo, la asociación del riesgo hereditario.
En general, la enfermedad cardíaca tiende a empeorar con el tiempo, por lo que las mujeres con cualquier tipo de cardiopatía que deseen tener niños deberían hacerlo lo antes posible. La mayoría de las pacientes con cardiopatía no tienen problemas para llevar a término un embarazo, pero existen excepciones a esta regla y en los siguientes casos debe desaconsejarse el embarazo o, en caso de producirse, puede recomendarse su interrupción como aborto terapéutico, autorizado por la ley 2, siempre dentro de las primeras 12 semanas de gestación, asumiendo los problemas éticos que se generan a la embarazada y al médico 3:
1. Pacientes en grado funcional III y IV con severo compromiso de la función cardíaca, riesgo elevado de muerte materna y de problemas fetales, cuando ya no existen posibilidades de realizar tratamiento de las lesiones cardíacas incluido el tratamiento intervencionista o quirúrgico.
2. La hipertensión pulmonar (HTP) de cualquier origen, tanto en la HTP primaria como en el síndrome de Eisenmenger o secundaria a otras enfermedades, que conlleva una mortalidad materna y fetal superior al 50%.
3. Las lesiones obstructivas izquierdas severas, sintomáticas o asintomáticas, con datos de disfunción sistólica, como la estenosis aórtica severa y la coartación aórtica con hipertensión no tratable.
4. El síndrome de Marfan con dilatación de la raíz aórtica > 4-5 cm o inferior a esta cifra si existe historia familiar de rotura aórtica, por el importante riesgo de disección o rotura aórtica durante el embarazo.
5. Las cardiopatías congénitas con cianosis y grado funcional III y IV determinan una elevada incidencia de aborto espontáneo y debe valorarse el riesgo asociado de herencia de la cardiopatía congénita, del 2-25% y más elevado en la miocardiopatía hipertrófica y el síndrome de Marfan. En las cardiopatías complejas cianóticas, corregidas o no, debe realizarse riguroso consejo obstétrico y valorar la posibilidad del aborto terapéutico.
6. Portadoras de válvulas cardíacas artificiales que precisan anticoagulación y que precisarían cuidados especiales con elevado aumento del riesgo para la madre y el feto.
7. Pacientes con antecedentes de miocardiopatía asociada al embarazo que conllevan un elevado riesgo de recidiva con consecuencias impredecibles de la evolución de la función ventricular.
MANEJO DE LA ENFERMEDAD VALVULAR EN EL EMBARAZO
Consideraciones generales
La experiencia clínica demuestra que los cambios fisiológicos del embarazo pueden ser mal tolerados en pacientes con determinadas cardiopatías. Entre las portadoras de valvulopatías, se asocian con un alto riesgo de complicaciones maternofetales durante el embarazo las siguientes 4:
- Estenosis aórtica severa con o sin síntomas.
- Estenosis mitral en clase funcional III-IV.
- Regurgitación aórtica o mitral en clase funcional III-IV.
- Valvulopatía mitral o aórtica asociada a hipertensión pulmonar severa (> 75% de la presión sistémica).
- Valvulopatía mitral o aórtica asociadas a disfunción del VI (fracción de eyección [FE] < 40%).
- Prótesis valvulares mecánicas que requieren anticoagulación.
- Insuficiencia aórtica en el síndrome de Marfan.
Sin embargo, estas lesiones valvulares en distinta situación funcional permiten el desarrollo del embarazo y parto a término sin complicaciones, considerándose de bajo riesgo 4:
- Estenosis aórtica con gradientes inferiores a 50 mmHg con buena función ventricular izquierda (FE > 50%).
- Regurgitación mitral o aórtica en clase funcional I-II con buena función del VI.
- Prolapso valvular mitral con/sin insuficiencia mitral ligera-moderada con función sistólica del VI normal.
- Estenosis mitral con área valvular mitral (AVM) > 1,5 cm 2, gradiente medio < 5 mmHg sin HTP severa.
- Estenosis valvular pulmonar ligera o moderada.
Siempre que sea posible, las lesiones valvulares severas o sintomáticas deberían ser corregidas antes de la concepción. Por otra parte, el manejo de estas pacientes puede llevarse a cabo con éxito en la mayor parte de los casos con tratamiento conservador, orientado a optimizar el volumen intravascular y las condiciones de pre y poscarga 5. Se deben recomendar medidas sencillas, como el reposo en cama evitando la posición de decúbito supino, y restricción de la ingesta de sal; además, el tratamiento farmacológico debería ser evitado siempre que sea posible.
Valvulopatías específicas
Estenosis mitral
Aquellas pacientes con estenosis mitral severa sintomática deben ser consideradas candidatas a valvuloplastia mitral percutánea o comisurotomía mitral quirúrgica antes del embarazo. Sin embargo, el tratamiento médico cuidadoso, con énfasis en el control de la frecuencia cardíaca, permite completar el embarazo y parto sin necesidad de corrección valvular en la mayoría de los casos.
La estenosis ligera-moderada puede manejarse con diuréticos y β-bloqueantes. Los diuréticos se emplean exclusivamente para mejorar los síntomas de congestión pulmonar y venosa, evitando la depleción excesiva de volumen que puede conducir a hipoperfusión uteroplacentaria. Se han descrito, además, trombocitopenia, ictericia, bradicardia e hiponatremia en relación a su uso, considerándose potencialmente inseguros. Los β-bloqueantes tienen como objetivo prevenir o tratar las taquiarritmias, optimizando el llenado diastólico. Aunque se pueden emplear de forma segura, pueden provocar retraso del crecimiento intraútero, bradicardia e hipoglucemia y apnea al nacer. Los β-bloqueantes no selectivos, como el propanolol, tienen el riesgo de provocar contracciones uterinas, por lo que se recomiendan β-bloqueantes cardioselectivos, como metoprolol o atenolol. También la digoxina puede emplearse de forma segura para el control de la frecuencia ventricular en pacientes con taquiarritmias 1.
El parto vaginal puede desarrollarse con éxito en la mayoría de las pacientes con estenosis mitral. Cuando están sintomáticas, se recomienda realizar monitorización hemodinámica durante el mismo. Una vez producido el alumbramiento se produce un incremento súbito del retorno venoso al liberarse la compresión de la vena cava por el útero gravídico, por lo que la monitorización hemodinámica debería mantenerse hasta varias horas después del parto. La anestesia epidural es la forma adecuada de analgesia en estas pacientes: generalmente se asocia con disminución de la presión arterial pulmonar y de la presión auricular izquierda debido a vasodilatación sistémica. Además, evitando la ansiedad y el dolor mejora la taquicardia refleja, mal tolerada en pacientes con estenosis mitral 6.
La valvuloplastia mitral percutánea, la reparación quirúrgica o reemplazo valvular durante el embarazo sólo deben considerarse en los casos de estenosis mitral severa (área valvular mitral < 1 cm 2) refractaria a tratamiento médico adecuado, evitando realizar cualquiera de los procedimientos durante el primer trimestre de la gestación. La valvuloplastia mitral debería realizarse con precaución, en centros experimentados, guiada mediante ecocardiografía (transtorácica y transesofágica) o con exposición limitada a fluoroscopia (de 1 a 2 minutos de escopia con delantal plomado abdomino-pélvico), y presenta pocas complicaciones maternofetales en las series informadas 7. Aunque la cirugía de reparación o reemplazo valvular no se ha asociado a alto riesgo maternofetal, la comisurotomía mitral cerrada se considera la técnica de elección en los centros con experiencia 8.
Estenosis aórtica
La causa más común es la valvulopatía aórtica congénita. Además, esta valvulopatía se asocia con frecuencia a necrosis quística de la media, que aumenta el riesgo de disección aórtica en el tercer trimestre. Debería evitarse el embarazo antes de la corrección de la valvulopatía en pacientes con estenosis severa o sintomática 4. La estenosis aórtica, cuando es severa, incluso en mujeres que están libres de síntomas antes del embarazo, se asocia con un riesgo elevado de aparición de angina, insuficiencia cardíaca izquierda, edema de pulmón y muerte súbita, así como de pérdidas fetales. La valoración del estado adecuado para la gestación debería realizarse antes de intentar el embarazo mediante ecocardiografía y prueba de esfuerzo. Las pacientes sin datos de fallo ventricular y con buena capacidad de esfuerzo pueden tolerar la sobrecarga del embarazo. En caso de producirse el embarazo en las pacientes de alto riesgo debe recomendarse la interrupción del mismo.
Durante el embarazo, la presencia de síncope o insuficiencia cardíaca izquierda obliga a establecer la indicación de valvuloplastia aórtica percutánea o cirugía antes del parto, aunque ambos procedimientos conllevan considerable riesgo maternofetal 9.
Insuficiencia aórtica
Se trata de una valvulopatía bien tolerada, que puede manejarse adecuadamente durante la gestación. Las condiciones fisiológicas del embarazo (taquicardia y disminución de las resistencias vasculares sistémicas) mejoran la hemodinámica de esta lesión regurgitante. En pacientes sintomáticas, los diuréticos y la hidralazina (que ha demostrado evitar el incremento de la presión capilar pulmonar durante el ejercicio isométrico) se emplean como tratamiento de elección 1, intentando mantener el embarazo hasta que exista madurez fetal y pueda inducirse el parto.
Insuficiencia mitral
El prolapso mitral es la causa más frecuente de regurgitación en mujeres jóvenes durante la gestación, aunque la valvulopatía mitral reumática es también una causa común. La incidencia de auscultación típica y signos ecocardiográficos de prolapso mitral se reduce entre las gestantes en relación con la población general por las condiciones hemodinámicas de aumento de volumen plasmático y disminución de las resistencias sistémicas.
El manejo médico de las pacientes sintomáticas incluye diuréticos, en los pocos casos que desarrollan congestión pulmonar, y vasodilatadores cuando se acompaña de hipertensión sistémica (hidralazina) 1. No se debe olvidar que los inhibidores de la enzima conversora están contraindicados en el embarazo. Las sobrecargas de volumen son bien toleradas en estas dos cardiopatías, por lo que no suelen aparecer problemas durante el embarazo. Si ocurren complicaciones se utilizará tratamiento sintomático hasta que se alcance la madurez fetal y pueda inducirse el parto.
Valvulopatía tricúspide
Son causas adquiridas el prolapso valvular, la endocarditis o el síndrome carcinoide. No representa un problema significativo durante la gestación, precisando tan sólo precaución en la administración de diuréticos en las lesiones severas (evitar hipoperfusión por excesiva reducción de la precarga).
Prótesis valvulares
Las pacientes portadoras de prótesis valvulares plantean varios problemas durante el embarazo 1:
1. Problemas hemodinámicos secundarios a los cambios fisiológicos del embarazo: la tolerancia depende de la normofunción de la prótesis, la capacidad funcional de la paciente antes del embarazo y la presencia de disfunción ventricular e hipertensión pulmonar (como en las restantes valvulopatías).
2. Deterioro estructural intrínseco acelerado de las prótesis biológicas, que obliga a reintervenir durante el embarazo o poco después hasta en el 47% de las pacientes. Este riesgo debe ser muy valorado en contraposición con los riesgos del embarazo en las mujeres con prótesis mecánicas y anticoagulación.
3. Estado de hipercoagulabilidad que aumenta la probabilidad de complicaciones tromboembólicas pulmonares o sistémicas, incluso en pacientes con anticoagulación correcta, portadoras de prótesis mecánicas.
4. Riesgo fetal secundario a tratamiento anticoagulante: embriopatía, lesiones del sistema nervioso central y aborto espontáneo en los primeros meses del embarazo y prematuridad o hemorragia cerebral del feto durante el parto (véase tratamiento anticoagulante).
EMBARAZO Y CARDIOPATÍAS CONGNITAS
Riesgo de herencia de la cardiopatía congénita. La incidencia es 4-5 por 1.000 recién nacidos vivos, elevándose al 4% de los hijos de madres afectadas de cardiopatías congénitas 10. En el 18% de los casos el defecto se asocia a alteraciones cromosómicas y/o síndromes hereditarios que se consideran la «causa» de la malformación, y en otro reducido grupo cercano al 2% se involucran factores medioambientales que requieren una pequeña predisposición genética. No obstante, la mayoría se asume que son debidas a interacciones genéticas con factores ambientales, así como por la posible influencia hipóxica o medicamentosa sobre el feto sin exhibir patrones hereditarios que hagan posible su predicción 11.
Existen evidencias de que la presencia de CC en familiares de primer grado es un factor de riesgo para el feto, incluso en ausencia de alteraciones genéticas conocidas y en mayor grado cuando la afectación es materna. Así, en las cardiopatías congénitas en general, si la madre está afectada, la recurrencia en la descendencia es del 6,7% 2,5-18 y si es el padre del 2,1% 1,5-3. En un niño con un solo hermano previamente afectado el riesgo de recurrencia es del 2,3% 1,5-3 y con 2 previamente afectados es del 7,3% 5-10. En el conjunto de las CC es del 2-25%, siendo mayor en el síndrome de Marfan y en la miocardiopatía hipertrófica 12.
Riesgo materno. Es necesario considerar la morbilidad, la mortalidad y el pronóstico a largo plazo de la cardiopatía basadas en la valoración diagnóstica y funcional de la madre. Los determinantes más importantes son:
- Tipo de CC. El riesgo más elevado se encuentra en CC cianógenas, HTP severa, síndrome de Eisenmenger, lesiones obstructivas severas y síndrome de Marfan. Lógicamente, la influencia será diferente si ha sido corregida mediante cirugía de forma eficaz o con secuelas importantes. Las complicaciones más importantes son insuficiencia cardíaca (IC), HTP, HTA, arritmias, tromboembolismos, endocarditis y angina.
- Presencia de cianosis. Implica la existencia de cortocircuitos intracardíacos cuya direccionalidad puede alterarse debido a los cambios de precarga y/o postcarga que se producen en las diferentes fases del embarazo, parto y puerperio. Existen, además, asociadas a la poliglobulia alteraciones de la coagulación, con riesgos hemorrágicos y tromboembólicos 13.
- Clasificación funcional. Del mismo modo que en la cardiopatía valvular el riesgo se modifica en relación directa con el grado funcional según la clasificación de cardiopatías congénitas de la Universidad de California-Los Ángeles (UCLA), que presenta ligeras modificaciones respecto a la clasificación de la NYHA, con un riesgo bajo para los grados I-II y alto para los grados III-IV 14:
Clase I: asintomática para todos los niveles de actividad.
Clase II: síntomas presentes pero no limitan la actividad física diaria.
Clase III: los síntomas reducen de forma significativa, pero no totalmente, la actividad física diaria.
Clase IV: los síntomas reducen significativamente la actividad diaria e incluso existen en reposo.
Riesgo fetal. La enfermedad cardíaca materna expone al feto a los riesgos de interferir su viabilidad intraútero y de desarrollar malformaciones.
La viabilidad está influenciada por la clase funcional, cianosis y tratamiento anticoagulante maternos. La clasificación funcional materna es el mayor determinante de la mortalidad fetal, que alcanza el 30-50% en las gestantes en clase III-IV. La cianosis pone en peligro el desarrollo del feto, aumentando las pérdidas fetales, inmadurez y prematuridad. La incidencia de aborto espontáneo es alta y se incrementa paralelamente a la hipoxemia materna. Los riesgos remotos para el feto son la transmisión genética y el efecto teratogénico de ciertos fármacos.
En las cardiopatías más severas debe aconsejarse la prevención del embarazo, y en el resto, realizar seguimiento cardiológico y obstétrico muy estrecho. En caso de descompensación hemodinámica se deben seleccionar los métodos diagnósticos y terapéuticos disponibles en orden de menor afectación fetal; pero en caso de necesidad el más eficaz para la madre. La reparación quirúrgica de la CC durante el embarazo mejora el pronóstico materno, pero conlleva una mortalidad fetal elevada (16%) por los efectos deletéreos de la hipoperfusión placentaria y el riesgo de parto prematuro (un 20% mortalidad antes de la semana 26). La cirugía debe anticiparse al embarazo, consiguiendo así reducir los riesgos maternos y fetales 15.
Comentaremos a continuación las implicaciones para ambos de las principales CC antes y después de su corrección.
Cardiopatías congénitas más comunes en la mujer joven
Comunicación interauricular
Especialmente importante por su longevidad sin cirugía. Es bien tolerada incluso en los cortocircuitos grandes, pero después de la cuarta década aumenta el riesgo de arritmias supraventriculares que favorecen el riesgo ya existente de embolismo paradójico 15. Se deben considerar también el grado funcional y la presión pulmonar.
Recomendaciones. Reducir en lo posible los efectos de la estasis venosa en los miembros inferiores y los asociados a sangrado severo que pueden aumentar el cortocircuito derecha-izquierda.
Poscirugía. Se elimina el riesgo de embolismo paradójico con secuelas insignificantes, excepto las arritmias, en las reparaciones a edades avanzadas.
Comunicación interventricular (CIV)
Es bien tolerada en las restrictivas, pero si son grandes las complicaciones más frecuentes son IC y arritmias. Si la CIV no es restrictiva, con una HTP suprasistémica, el riesgo materno es muy elevado, del 30-70%, acumulándose durante el embarazo, el parto y el puerperio.
Su incidencia es elevada en los nacidos vivos descendientes, de hasta el 22% 16.
Recomendaciones. La hipotensión severa por sangrado posparto puede invertir el cortocircuito, por lo que debe estabilizarse con volumen y vasopresores.
Poscirugía. El cierre en la infancia previene las complicaciones, siendo el embarazo normal si también lo son la presión pulmonar y la función ventricular. Excepcionalmente la enfermedad vascular pulmonar puede progresar durante el embarazo después del cierre de una CIV restrictiva.
Ductus
Es raro en el embarazo por su corrección habitualmente precoz. Si el ductus es reducido sólo existe el riesgo de endocarditis, pero en los grandes puede aparecer IC, con una mortalidad materna de hasta el 5% 17.
Recomendaciones. Si hay signos de IC, se debe recomendar reposo, administrar diuréticos y valorar, solamente si no hay respuesta adecuada, la necesidad de cierre percutáneo o quirúrgico. Si hay HTP se debe evitar la inversión del cortocircuito asociada a hipotensión en el parto, aunque también en el embarazo puede invertirse por resistencias periféricas bajas.
Poscirugía. Se consideran cardiológicamente normales, pero pueden quedar secuelas de resistencias pulmonares elevadas o recuperación incompleta del volumen ventricular.
Coartación aórtica
Es igualmente rara durante el embarazo por su corrección temprana. La coartación no complicada puede ser bien tolerada por la madre, pero alterar el desarrollo del feto por disminución del riego uteroplacentario, con mayor incidencia cuando no ha sido corregida. Las complicaciones maternas, aunque infrecuentes, pueden ser graves e incluyen IC, HTA (con baja incidencia de preeclampsia), angina, disección, rotura aórtica y de aneurismas cerebrales y endocarditis infecciosa. Este último riesgo y el de disección son mayores si se asocian a una aorta bicúspide 18,19, pero en conjunto la mortalidad ha disminuido del 17 al 3% de todas las complicaciones referidas.
Recomendaciones. Debe corregirse antes del embarazo. El tratamiento debe limitar la actividad física e intentar el difícil control de la presión arterial (PA) sin disminuir el riego uteroplacentario. La corrección quirúrgica durante el embarazo sólo se plantea si la PA sistólica es muy elevada, no controlable o ante una IC rebelde. Las complicaciones graves de disección o rotura suelen ocurrir antes del parto, a pesar de lo cual algunos autores aconsejan la cesárea, aunque con elevado riesgo de sangrado por la abundancia de vasos colaterales.
Poscirugía. La corrección quirúrgica en la infancia temprana con anastomosis término-terminal favorece la normalización de la PA. Se encuentran anomalías del tejido conectivo -necrosis quística- en la zona pericoartación, e incluso en embarazos normales hay fragmentación de fibras elásticas que pueden favorecer la disección o la rotura. La aortoplastia con parche de Dacron y la angioplastia con catéter balón en coartación no operada o reestenosis del parche tienen el riesgo añadido de formación de aneurismas.
Se desconoce hasta qué punto la corrección de la coartación hace disminuir estos riesgos.
Valvulopatía aórtica
La más frecuente es la estenosis por válvula bicúspide que afecta hasta al 1-2% de la población, pero puede ser también por válvula tricúspide, unicúspide, subvalvular y supravalvular.
En pacientes con estenosis aórtica moderada-grave se ha comunicado un buen pronóstico con la atención adecuada. Si hay estenosis grave (gradiente > 50 mmHg) se recomienda evitar el embarazo o aborto precoz hasta corregir la lesión. Si hay deterioro clínico después de la semana 22 está indicada la cirugía 20,21; se ha realizado también angioplastia percutánea satisfactoria pero no está exenta de riesgo de mortalidad inmediata y tardía 9. Sólo debe recomendarse si se presentan síntomas graves que no responden a tratamiento médico y en embarazos avanzados.
La insuficiencia aórtica congénita es generalmente bien tolerada, incluso en grados moderado y severo, como se refiere en las valvulopatías adquiridas. Si se requiere cirugía antes del embarazo, la técnica idónea es el procedimiento de Ross (reemplazo de la válvula aórtica por la válvula pulmonar).
Existe, para ambas lesiones, riesgo de endocarditis, por lo que se recomienda profilaxis.
Tetralogía de Fallot
Es la CC cianótica más frecuente en adultos. Durante el embarazo los cambios hemodinámicos (aumento del volumen sanguíneo y descenso de las resistencias periféricas) pueden exacerbar el cortocircuito derecha-izquierda ocasionando cianosis y síncope. Indicadores de mal pronóstico y deterioro clínico materno son: hematócrito > 60%, saturación de O 2 < 80%, presión sistólica del ventrículo derecho (VD) > 50% de la sistémica y antecedentes de síncope 22.
Recomendaciones. Reparación completa antes del parto si la relación gasto pulmonar/gasto sistémico (Qp/Qs) > 1,5 y presión sistólica VD > 60 mmHg. Debe vigilarse la hipotensión arterial por bloqueo epidural, complementándolo con otros fármacos por vía sistémica. Existe riesgo de endocarditis.
Poscirugía. Es la CC cianótica con mayor experiencia en embarazos poscorrección con un riesgo similar al de la población general. Los embarazos pueden ser seguros, sobre todo en las pacientes con lesiones residuales (obstrucción al tracto de salida del VD e insuficiencia pulmonar) ligeras, que mantienen buena función ventricular y no presentan alteraciones del ritmo con el esfuerzo 17.
Cardiopatías congénitas complejas e infrecuentes
Son estadísticamente poco importantes, pero sí lo son sus problemas clínicos. Se han informado embarazos satisfactorios en pacientes con transposición de grandes arterias corregidas y no corregidas, ventrículo único, atresia tricúspide y tronco arterioso, pero tienen un índice elevado de deterioro hemodinámico y funcional materno, con una elevada morbilidad e incluso mortalidad. Asimismo, hay una elevada incidencia de pérdida fetal, prematuridad, bajo peso y malformaciones congénitas cardíacas y no cardíacas. En la serie más amplia, 96 embarazos en 44 pacientes con CC excluyendo la situación de Eisenmenger, las complicaciones maternas fueron elevadas (32%): IC, taquicardia supraventricular, trombosis cerebral y de arteria pulmonar y endocarditis, requiriéndose cesárea en el 14% de las pacientes por razones maternas y obstétricas. En el 43% de los embarazos resultaron nacidos vivos con bajo peso medio y en el 37% con prematuridad. La incidencia de CC en el feto fue del 4,9%. Las cifras de hemoglobina y saturación de O 2 maternas resultaron predictores independientes de riesgo 22.
Recomendaciones. Por todo ello, el embarazo debe desaconsejarse o interrumpirse precozmente; en caso de continuar debe restringirse la actividad física y vigilar la aparición de insuficiencia cardíaca o arritmias. En general se tolera el parto vaginal acortando en los casos necesarios el segundo estadio (fórceps). Debe monitorizarse la saturación de O 2 y la hemodinámica. Se debe evitar la anestesia regional que puede aumentar el cortocircuito derecha-izquierda utilizando anestesia inhalada e intravenosa.
Transposición de grandes arterias
Presentan discordancia ventrículo-arterial siendo infrecuente la supervivencia en adultos, pero no imposible.
Poscirugía. Los principales problemas se relacionan con la vulnerabilidad del VD a la sobrecarga de volumen, ya que está sometido a circulación sistémica y al riesgo elevado de bloqueo aurículo-ventricular en los pacientes intervenidos con neocanalización auricular (técnicas de Senning o Mustard). En una serie de 23 mujeres operadas con técnica de Mustard, nueve tuvieron 15 embarazos sin sintomatología antes ni después del parto. Hubo 12 nacidos vivos con peso adecuado y 3 pérdidas fetales, sin ninguna CC 23. De las pacientes intervenidas mediante la técnica de Jatene ( switch arterial) existe todavía poca información.
Ventrículo único
Se utiliza este término cuando las 2 aurículas están relacionadas casi o completamente con un ventrículo izquierdo, derecho o indeterminado. En la mayoría de los casos la morfología es izquierda y tiene en su base una cámara rudimentaria de salida que comunica con la aorta, saliendo la pulmonar desde el ventrículo principal. Los pacientes que alcanzan la vida adulta tienen estenosis pulmonar o enfermedad vascular asociada. Aunque se produce algún embarazo con éxito, existe muy escasa información.
Atresia tricúspide
La válvula aurículo-ventricular derecha no está perforada, por lo que el flujo venoso atraviesa el septo interauricular para llegar al VI. La forma más habitual tiene una concordancia arterial y una CIV restrictiva con estenosis subpulmonar. Hay supervivencias esporádicas a la segunda a quinta décadas e incluso embarazos con éxito.
Poscirugía. La operación de Fontán para ventrículo único y atresia tricúspide con estenosis pulmonar crea una circulación entre las cavas o la aurícula derecha y el tronco pulmonar, evitando el ventrículo derecho. El gasto cardíaco puede aumentar con el esfuerzo de una forma casi normal, lo cual implica que en ritmo sinusal estable y con buena función ventricular sistémica se puede asumir la sobrecarga del embarazo de manera adecuada. En una serie de 126 mujeres operadas con diversas técnicas de Fontán con varios tipos de ventrículo único y atresia tricúspide se registraron 38 embarazos, con un 45% nacidos vivos, todos ellos de bajo peso medio. El embarazo fue bien tolerado en la mayoría de las madres, con escasas complicaciones, que incluían flúter auricular e insuficiencia cardíaca pero sin mortalidad, por lo que en mujeres estables podría ser positivamente considerado 24.
Síndrome de Eisenmenger
La mortalidad materna descrita inicialmente era superior al 50%, siendo en la actualidad más favorable, pero el elevado riesgo de muerte súbita y la elevada incidencia de tromboembolismos hacen que el embarazo deba desaconsejarse y se deba proponer aborto. Se asocia también a mal pronóstico fetal, y apenas un 25% de los embarazos llegan a término, con elevada incidencia de prematuridad, retraso de crecimiento intrauterino y muerte perinatal 22,25.
Recomendaciones. La frecuencia elevada de parto prematuro hace recomendable la hospitalización precoz. También se aconseja tratamiento anticoagulante en las 8-10 semanas últimas y en las 4 semanas postparto. El parto puede ser espontáneo con monitorización gasométrica y hemodinámica y acortamiento del segundo estadio, aunque también hay cesáreas sin complicaciones bajo anestesia epidural.
Enfermedad de Ebstein
La supervivencia espontánea hasta la edad de la concepción es elevada. Su pronóstico a largo plazo depende de la severidad de la insuficiencia tricúspide, de la disfunción ventricular derecha y de la cianosis por cortocircuito derecha-izquierda interauricular. Hay casos de evolución satisfactoria, pero pueden presentarse complicaciones, más frecuentes en cianóticos, de insuficiencia cardíaca derecha, endocarditis, embolismo paradójico e hipoxemia fetal. La cianosis puede manifestarse también por primera vez debido al aumento de la presión de llenado ventricular derecha. Las arritmias supraventriculares paroxísticas ocurren en un tercio de las pacientes no embarazadas y su incidencia aumenta en el embarazo, lo cual las hace potencialmente peligrosas por la asociación de este síndrome a vías accesorias tipo Wolf-Parkinson-White. El riesgo fetal es significativo de pérdida fetal, bajo peso incluso sin cianosis materna y elevado riesgo de CC. Connolly informa de 111 embarazos en 44 mujeres, con un 76% de nacidos vivos, el 89% con parto vaginal y sin complicaciones maternas graves, pero con una elevada incidencia de prematuridad (27%) y menor bajo peso medio en las madres cianóticas. La incidencia de CC de los descendientes fue del 4%, siendo de tipo Ebstein en 0,6% (26%).
Poscirugía. En la situación más favorable se realiza reconstrucción valvular con resección de la parte atrializada e interrupción de las vías accesorias, reduciéndose significativamente el riesgo materno.
En resumen, los supervivientes de una cirugía paliativa por una enfermedad congénita compleja deben ser valorados en cuanto a su reserva cardíaca, función ventricular, hipertensión pulmonar, estenosis pulmonar o de conductos, defectos de conducción y arritmias. La mayoría de las mujeres con cardiopatías congénitas con shunts izquierda-derecha, estenosis pulmonar, transposición corregida o enfermedad de Ebstein sin cianosis toleran el embarazo sin problemas.
En las cardiopatías con cianosis los riesgos para la madre y para el feto son elevados: aumentan la cianosis, el riesgo tromboembólico y la mortalidad materna, conllevando un alto índice de abortos espontáneos, partos prematuros, retraso del crecimiento intrauterino y nacidos muertos. La hipertensión pulmonar acarrea el mayor número de muertes maternas y fetales, por lo que en estos casos debe aconsejarse la interrupción del embarazo.
Síndrome de Marfan
Es una enfermedad hereditaria del tejido conectivo, transmitida con carácter autosómico dominante, que se reconoce por alteraciones oculares, esqueléticas o cardiovasculares. Las complicaciones más graves asociadas al embarazo son la disección y rotura aórtica, que se originan frecuentemente en la aorta ascendente 27. La dilatación de la raíz aórtica > 4 cm identifica al subgrupo de pacientes de alto riesgo, asociado o no a regurgitación aórtica. También el PVM es una lesión común en este grupo de pacientes.
Recomendaciones. Durante la gestación se deben realizar ecocardiogramas seriados, ya que la presencia de raíz de aórtica de tamaño normal antes de la concepción no excluye totalmente el riesgo de disección. Cualquier mujer con síndrome de Marfan que se plantee la posibilidad del embarazo debería realizarse un ecocardiograma para cuantificar las dimensiones de la raíz aórtica: un diámetro > 4-5 cm o una dilatación progresiva en el seguimiento se asocian a elevado riesgo de complicaciones fatales, por lo que se recomienda la cirugía electiva (sustitución de aorta ascendente por prótesis valvulada y reimplantación coronaria) antes de la gestación, aunque debe recomendarse evitar el embarazo en estos casos o la interrupción terapéutica del mismo 4.
Con mayor probabilidad, las complicaciones mayores se presentan en el tercer trimestre o cerca del parto. Durante la gestación se restringe la actividad física y se recomienda tratamiento β-bloqueante, que enlentece la dilatación progresiva de la raíz aórtica y disminuye la incidencia acumulativa de complicaciones cardiovasculares 28. Se debe asegurar durante el parto una analgesia adecuada que evite incrementos súbitos de la presión arterial, así como las técnicas obstétricas que acorten el período expulsivo, aunque es más recomendable la anestesia general y cesárea.
MIOCARDIOPATÍA HIPERTRÎFICA
La mayoría de las pacientes tolera bien el embarazo, ya que el aumento del volumen circulante compensa el descenso de las resistencias periféricas. No se ha encontrado un valor pronóstico a la presencia de gradiente elevado en el tracto de salida del VI. El pronóstico es favorable, aunque es frecuente el desarrollo o empeoramiento de síntomas cardíacos. La insuficiencia cardíaca congestiva se diagnostica por vez primera durante un embarazo o empeora en el 20% de las pacientes, que de manera ocasional presentan síntomas cardíacos como dolor precordial, palpitaciones, lipotimias o síncope. Las arritmias ventriculares, aunque muy raras, pueden ser mortales. El pronóstico fetal no pareció verse afectado por la miocardiopatía hipertrófica materna; sin embargo, el riesgo de heredar trastornos alcanza hasta el 50% en casos familiares y algo menos en los casos esporádicos 29.
El diagnóstico de miocardiopatía hipertrófica puede ser pasado por alto durante el embarazo, ya que los soplos sistólicos asociados con miocardiopatía hipertrófica obstructiva pueden atribuirse a soplos cardíacos inocentes que a menudo se escuchan en el embarazo. La presencia de hipertrofia ventricular izquierda, de un cuarto ruido y un frémito sistólico en la parte inferior del borde izquierdo del esternón y en la punta, y un soplo más intenso en posición de pie o durante la fase de tensión de la maniobra de Valsalva, justifican un estudio adicional con ecocardiografía, que es la prueba diagnóstica definitiva clave para la miocardiopatía hipertrófica.
La modalidad terapéutica para la mujer gestante con miocardiopatía hipertrófica depende de los síntomas y de la obstrucción del tracto de salida del ventrículo izquierdo. No está indicado el tratamiento cuando la paciente está asintomática y no hay obstrucción en reposo ni provocable del ventrículo izquierdo. Las indicaciones para el tratamiento farmacológico incluyen síntomas y presencia de arritmias.
Los síntomas asociados con la elevación de las presiones de llenado del ventrículo izquierdo deben tratarse con fármacos bloqueadores betaadrenérgicos y, excepcionalmente, son necesarios los diuréticos.
Aunque los antagonistas del calcio parecen ser útiles en las mujeres no embarazadas, en la gestación no se ha establecido el efecto de estos fármacos sobre el feto.
Por sí mismo, el embarazo no parece incrementar el riesgo de muerte súbita en pacientes con miocardiopatía hipertrófica, pero ésta es más frecuente durante los años de la procreación. Las arritmias ventriculares, un signo pronóstico importante, deben ser buscadas con registro electrocardiográfico dinámico tipo Holter. Las arritmias ventriculares complejas deben ser tratadas con fármacos que no dañen al feto, como quinidina, procainamida y bloqueadores beta (si son eficaces). No se ha establecido la seguridad de la amiodarona durante el embarazo, que ha demostrado prevenir la muerte súbita en pacientes no embarazadas con miocardiopatía hipertrófica. Por tanto, se emplea amiodarona únicamente en pacientes con arritmias malignas que pongan en peligro la vida y no respondan a otros fármacos.
Las arritmias supraventriculares, especialmente la fibrilación auricular, deben tratarse con fármacos antiarrítmicos de clase IA durante el embarazo. Se aplica cardioversión eléctrica cuando las pacientes con fibrilación auricular sintomática no responden al tratamiento médico. Dado que la digoxina conlleva efectos hemodinámicos desfavorables en la miocardiopatía obstructiva y se desconoce la seguridad a largo plazo de los antagonistas del calcio, los bloqueadores beta son los mejores fármacos, al controlar la frecuencia cardíaca en pacientes con fibrilación auricular rebelde.
Se ha comprobado que el parto vaginal es seguro en mujeres con miocardiopatía hipertrófica. En las que tienen síntomas u obstrucción significativa, se debe acortar la duración del período expulsivo. El uso de prostaglandinas para aumentar las contracciones uterinas puede ser desfavorable debido a su efecto vasodilatador, mientras que la oxitocina parece ser bien tolerada. Dado que los fármacos tocolíticos simpaticomiméticos beta agravan la obstrucción del tracto de salida del ventrículo izquierdo, se prefiere el sulfato de magnesio. De manera semejante, se evitará la anestesia espinal y epidural en miocardiopatía obstructiva debido a su efecto vasodilatador, y se vigilará también la pérdida sanguínea excesiva, que debe reemplazarse de inmediato con líquidos por vía intravenosa o sangre 1,2.
Dado que en la miocardiopatía hipertrófica aumenta el riesgo de endocarditis infecciosa, especialmente la forma obstructiva, se debe pensar en profilaxis antimicrobiana para el trabajo de parto y el parto.
MIOCARDIOPATÍA PERIPARTO
En los EE.UU. su incidencia varía de 1 en 1.300 a 1 en 15.000 gestantes. La incidencia es más elevada (1%) en ciertas zonas de África 1.
Para establecer el diagnóstico de miocardiopatía periparto se debe excluir cualquier otra causa de dilatación y de disfunción sistólica del ventrículo izquierdo. Esta forma de miocardiopatía dilatada tiene los signos y síntomas de insuficiencia cardíaca debido a disfunción sistólica del ventrículo izquierdo, que se manifiesta por vez primera en el período periparto. Rara vez hay síntomas durante el último mes de la gestación o inmediatamente después del parto, aunque algunos casos aparecen en cualquier momento de los tres últimos meses del embarazo o en los primeros seis meses de puerperio 30,31.
La sintomatología es de insuficiencia cardíaca congestiva, con dolor precordial, palpitaciones y en ocasiones embolia periférica o pulmonar. La exploración física pone a menudo de manifiesto crecimiento del corazón y un tercer tono; así mismo, son frecuentes los soplos de insuficiencia mitral y tricuspídea.
En el electrocardiograma, la radiografía de tórax, la ecocardiografía-Doppler y los cambios hemodinámicos son indistinguibles de los asociados con otras formas de miocardiopatía dilatada.
La incidencia de la cardiopatía periparto es mayor en mujeres con embarazo gemelar, multíparas, mayores de 30 años de edad y en la raza negra. Aunque se desconoce la etiología de la miocardiopatía periparto, la naturaleza especial de este síndrome se sospecha por su presentación a una edad más o menos joven en comparación con otras formas de miocardiopatía dilatada, la recuperación del tamaño y la función cardíaca en un gran número de pacientes y su relación con el embarazo. Se ha postulado que la miocardiopatía periparto se debe a miocarditis, deficiencia nutricional, anomalías arteriales de vasos coronarios de calibre pequeño, efectos hormonales, toxemia o a una respuesta inmunológica materna al antígeno fetal 32.
El uso de la biopsia endomiocárdica en pacientes con miocardiopatía periparto puso de manifiesto recientemente una mayor incidencia de miocarditis, en comparación con otras formas de miocardiopatía dilatada. En algunas investigaciones los resultados de la biopsia fueron normales para miocarditis, alcanzando una incidencia en otras publicaciones del 29 al 100% 33-35.
La evolución clínica de la miocardiopatía periparto es variable. Aproximadamente el 50% de las enfermas tienen una recuperación completa o casi completa de la función cardíaca y del estado clínico en los seis meses que siguen al parto; en el otro 50% hay deterioro clínico continuo que conduce a muerte temprana o a disfunción ventricular izquierda persistente, con una insuficiencia cardíaca crónica y una morbimortalidad elevadas 31.
La insuficiencia cardíaca aguda se trata con oxígeno, diuréticos, apoyo inotrópico con digital y fármacos vasodilatadores. El uso de hidralacina como fármaco reductor de la poscarga es seguro durante el embarazo. La experiencia con los nitratos orgánicos es limitada, aunque la hipotensión secundaria a una dosis excesiva se asocia con bradicardia fetal. Se ha utilizado satisfactoriamente el nitroprusiato durante el embarazo, aunque los experimentos realizados en animales han demostrado riesgos de toxicidad fetal. Los inhibidores de la enzima conversiva de la angiotensina pueden tener efectos nocivos sobre el control de la presión arterial y la función renal en el feto y, por tanto, no se recomiendan como tratamiento antes del parto 36. En razón de la mayor incidencia de sucesos tromboembólicos en la miocardiopatía periparto se recomienda el tratamiento anticoagulante.
La inmunodepresión en pacientes con miocardiopatía periparto y evidencia de miocarditis en la biopsia se asocia a mejoría clínica importante y rápida de la función ventricular izquierda. Aunque no se puede recomendar este tratamiento de forma generalizada, parece razonable en pacientes con deterioro clínico agudo que no responden a la terapéutica convencional, incluido el balón de contrapulsación. Debido a la mortalidad y morbilidad elevadas en pacientes que no se recuperan pronto, estas pacientes deben ser consideradas para trasplante cardíaco 37.
Los embarazos subsecuentes en mujeres con miocardiopatía periparto se asocian a menudo con recaídas y riesgo elevado de mortalidad materna. Aunque la probabilidad de estas recaídas es mayor en pacientes con crecimiento persistente del corazón o función anormal, también se ha señalado en mujeres en las que la función ventricular izquierda se restableció después del primer episodio. Por estas razones se deben desalentar los embarazos subsecuentes en pacientes con miocardiopatía periparto que tienen disfunción cardíaca persistente; las mujeres que recuperaron la función cardíaca después de un episodio de miocardiopatía periparto deben ser informadas del mayor riesgo que representan los embarazos posteriores.
TRASPLANTE CARDÍACO
Hay algunos casos descritos de embarazos en mujeres trasplantadas. Se ha observado un aumento del riesgo de complicaciones maternas durante el embarazo, sin un aumento de la mortalidad. El índice de abortos espontáneos es alto, pero no se han observado malformaciones atribuibles a la inmunodepresión.
La mortalidad materna se eleva en los años siguientes al nacimiento, por lo que debe advertirse esta circunstancia por la posible repercusión sobre la crianza de los hijos 37.
ARTERIOPATÍA CORONARIA
La enfermedad coronaria es rara en las mujeres en edad fértil y la aparición de infarto de miocardio periparto se puede considerar casi anecdótica. Los factores de riesgo en las mujeres por debajo de los 50 años incluyen valores altos de colesterol total, bajas concentraciones de colesterol HDL, tabaco, diabetes mellitus, hipertensión, historia familiar de enfermedad coronaria, toxemia del embarazo y la utilización de anticonceptivos orales. La combinación de fumadora importante y el uso concomitante de anticonceptivos se ha observado que es un potente predictor de infarto de miocardio en mujeres jóvenes. El infarto de miocardio periparto a menudo se asocia con arterias coronarias normales y puede ser debido a una reducción local en la perfusión coronaria debido a espasmo o trombosis. El espasmo a veces se ha asociado con hipertensión inducida por el embarazo y a la utilización de derivados ergotamínicos, oxitocina y prostaglandinas, para evitar la lactancia o el sangrado uterino. La disección de las arterias coronarias durante el embarazo o inmediatamente después del parto es otra causa relativamente común de infarto de miocardio periparto. Otras causas potenciales son las enfermedades del colágeno, enfermedad de Kawasaki, anemia de células falciformes, feocromocitoma, embolismos y utilización de cocaína 1,15.
El diagnóstico de infarto de miocardio muchas veces se retrasa durante el embarazo o posparto debido al bajo índice de sospecha. La aproximación diagnóstica y terapéutica está influida a veces en exceso por las consideraciones sobre el daño que algunas técnicas pueden causar en el feto. Si la situación clínica no implica gravedad, el tratamiento médico será el habitual, incluyendo la utilización de fibrinolíticos si el diagnóstico se hace con la suficiente precocidad. Los fármacos más aconsejables en el infarto agudo de miocardio por su efecto beneficioso y por la seguridad de su utilización durante el embarazo son los betabloqueantes. La aspirina a dosis bajas es también segura y no ha demostrado efectos deletéreos sobre el feto. Sin embargo, no deben utilizarse los inhibidores de la enzima conversiva de la angiotensina hasta después del parto por el riesgo de muerte fetal.
La coronariografía deberá utilizarse como método diagnóstico sin demora si la situación lo aconseja para instaurar el tratamiento más adecuado: angioplastia, stent, fibrinólisis local y cirugía urgente si lo requiere la gravedad del cuadro 38. En los casos de disección coronaria, la implantación de un stent puede ser el tratamiento de elección, y cuando ésta sea muy extensa puede ser necesaria la cirugía urgente. En estos casos, la coronariografía ofrece mayor información sobre la etiología y posibilidades terapéuticas que las técnicas no invasivas y, por tanto, no hay que sobrevalorar en exceso el riesgo de la radiación sobre el feto en detrimento de la supervivencia de la madre y, por consiguiente, de ambos.
ARRITMIAS
El embarazo crea un estado «proarrítmico» incluso en pacientes sin historia previa de arritmias ni enfermedad cardíaca orgánica, a pesar de lo cual las arritmias graves son infrecuentes. Se debe intentar identificar factores potencialmente causantes o agravantes de arritmias y que sean corregibles, como alteraciones electrolíticas, hipertiroidismo, efecto arritmogénico de drogas, alcohol, cafeína, tabaco. En el caso de que las arritmias sean sintomáticas, con repercusión hemodinámica o supongan un riesgo para la vida, se valorará la utilización de los fármacos antiarrítmicos más seguros.
La digoxina, los betabloqueantes y el verapamilo son seguros y tienen las indicaciones habituales. La adenosina intravenosa para la reversión de la taquicardia por reentrada intranodal no afecta al feto. Es posible también la cardioversión eléctrica sin que se hayan descrito complicaciones. La amiodarona no tiene efectos teratógenos pero puede producir hipotiroidismo fetal. Se han utilizado otros fármacos antiarrítmicos sin consecuencias sobre el feto, pero los casos comunicados son muy escasos 39.
La valoración de las arritmias mediante estudio electrofisiológico y la ablación con catéter deberán posponerse hasta después del parto. En casos indiferibles deberá utilizarse la ayuda de la ecocardiografía para disminuir en lo posible la radiación.
Los trastornos de la conducción sintomáticos, generalmente debidos a bloqueo cardíaco congénito, aunque también por otras causas, se tratarán con implantación de marcapasos temporal o definitivo.
FIEBRE REUMÁTICA AGUDA
Aunque la incidencia de fiebre reumática aguda ha descendido claramente en los países occidentales, la enfermedad continúa teniendo gran prevalencia en muchas partes del mundo y se puede asociar con una morbilidad y mortalidad elevadas durante el embarazo, durante el cual puede recurrir y tener consecuencias fatales.
Los antibióticos están indicados como profilaxis contra la infección estreptocócica y prevención de las recurrencias de la fiebre reumática aguda durante el embarazo en pacientes con historia previa de la enfermedad. Las pautas antibióticas recomendadas son las mismas que para las mujeres no grávidas, con penicilina o eritromicina a dosis de prevención primaria o secundaria. La sulfadiacina no se recomienda durante el tercer trimestre debido a la posibilidad de causar ictericia neonatal 40.
HIPERTENSIÎN ARTERIAL EN EL EMBARAZO
La HTA durante el embarazo no es una complicación infrecuente. Suele afectar al 10% de las embarazadas y puede suponer una importante causa de mortalidad maternofetal.
De acuerdo con el Comité de Terminología del Colegio Americano de Obstetricia y Ginecología, hay cuatro formas de HTA que pueden estar presentes en el embarazo:
1. La HTA relacionada con el embarazo (preeclampsia), que podría entenderse como una HTA secundaria especial que se acompaña de proteinuria, edema o ambos, y en ocasiones por alteraciones de la coagulación y en las funciones hepática y renal. Puede progresar rápidamente a una fase convulsiva, la eclampsia. Su fisiopatología es compleja. La inadecuada vascularización de la placenta, unida a disfunción endotelial con desequilibrio de las sustancias vasoactivas a favor de los agentes vasoconstrictores, proagregantes plaquetarios y factores de crecimiento (tromboxano A 2, endotelinas, serotonina, factor de crecimiento derivado de las plaquetas, actividad de la trombina, etc.), en detrimento de los agentes vasorrelajadores y antiagregantes (prostaciclina y óxido nítrico), y todo ello agravado por una mayor susceptibilidad a los efectos de la angiotensina II exógena, conlleva una importante vasoconstricción local y sistémica, con disminución del flujo placentario. Es más frecuente en nulíparas o en las primeras gestaciones, y suele presentarse después de la semana 20 de la gestación con un cortejo sintomático muy expresivo (cefaleas, náuseas, vómitos, dolores epigástricos, etc.). Suele acompañarse de cifras plasmáticas elevadas de creatinina y ácido úrico como expresión de la afectación renal, del hematócrito por la hemoconcentración, mientras que la plaquetopenia es prácticamente constante. Las enzimas hepáticas también suelen estar elevadas por la citólisis hepática, así como la proteinuria. Por contra, la eliminación de calcio por la orina está disminuida. Así mismo, la gonadotrofina coriónica está anormalmente elevada ya a las 15-18 semanas de gestación. Una de las formas más graves es el denominado síndrome de Hellp que asocia HTA, hemólisis, hepatólisis y trombopenia grave; conlleva un elevado riesgo maternofetal y el parto tiene que inducirse antes de la semana 32.
2. HTA crónica previa al embarazo y, por tanto, no relacionada con el mismo. Es más frecuente en las multíparas, más estable hemodinámicamente y con menos expresión clínica. Las alteraciones bioquímicas y hematológicas, de existir, no son llamativas.
3. Preeclampsia que se añade a una HTA crónica previa.
4. HTA transitoria del último trimestre.
La HTA del embarazo y/o la preeclampsia pueden incrementar de modo significativo la mortalidad total de la madre, siendo la causa más habitual de fracaso renal, rotura hepática, ictus hemorrágico y, sobre todo, de abruptio placentae. También aumenta el riesgo fetal. El retraso de crecimiento intrauterino, la prematuridad, la mortalidad intraútero e incluso perinatal se incrementan de forma considerable.
El objetivo del tratamiento en las mujeres con HTA crónica gestantes es minimizar los riesgos maternos a corto plazo de la presión arterial elevada, evitando además que el tratamiento comprometa el bienestar del feto.
Los diuréticos, así como la mayoría de los agentes antihipertensivos, a excepción de los inhibidores de la enzima conversora y los antagonistas de los receptores de la angiotensina II, si se tomaban antes de la gestación, pueden seguir administrándose 41.
En las mujeres con diagnóstico de HTA crónica y con cifras de presión arterial diastólica (PAD) igual o superior a 100 mmHg (incluso con cifras inferiores en el caso de existir afectación de órganos diana o nefropatía subyacente) y en mujeres con HTA aguda cuando las cifras de PAD son iguales o superiores a 105 mmHg, se sugieren los siguientes fármacos:
1. Alfaagonistas centrales: la metildopa ha sido ampliamente probada y es el fármaco de elección recomendado por el Grupo de Trabajo sobre la Hipertensión Arterial en la Gestación del National High Blood Pressure Education Program (NHBPEP), sobre todo en las mujeres en las que se diagnostica HTA por primera vez durante la gestación 42.
2. Los betabloqueantes, atenolol y metoprolol se comparan favorablemente con la metildopa respecto a la eficacia, y se consideran seguros en el tramo final de la gestación, aunque su utilización en el período inicial de la misma puede asociarse a retraso del crecimiento del feto. Los agentes de acción dual, alfa y betabloqueantes, como carvedilol, parecen tener un perfil de mayor seguridad y eficacia 43.
3. La experiencia con calcioantagonistas es muy limitada. Los agentes bradicardizantes, como verapamilo o diltiazem, pueden inducir bradicardia fetal. El potencial sinergismo de los calcioantagonistas con el sulfato de magnesio (indicado en el tratamiento de la eclampsia) puede desencadenar hipotensión en estas pacientes, por lo que su utilización debe reservarse a indicaciones muy concretas.
4. Los diuréticos están recomendados en la HTA crónica si ya se tomaban antes de la gestación o bien en mujeres con evidente sensibilidad a la sal. No están recomendados en la preeclampsia.
5. La hidralazina es el vasodilatador directo de elección en caso de precisar vía parenteral, debido a su larga historia de seguridad y eficacia.
6. Los inhibidores de la enzima conversora y los antagonistas de los receptores de la angiotensina II deben evitarse debido a que se han descrito graves problemas neonatales que incluyen la insuficiencia renal y la muerte, cuando la madre tomaba estos fármacos durante los dos últimos trimestres de la gestación 44.
Estudios suficientemente amplios no han confirmado el potencial efecto beneficioso de la utilización profiláctica de la aspirina a bajas dosis o de calcio suplementario para prevenir la preeclampsia.
Si la situación de la paciente lo requiere, debe permanecer en reposo domiciliario o internada en una unidad maternoinfantil. Las crisis de eclampsia deben tratarse con reposo, sedación, sulfato de magnesio, hidralazina, diazóxido o nitroprusiato sódico y en algunos casos carvedilol si fuera preciso. Los corticoides pueden facilitar la maduración pulmonar del feto.
TRATAMIENTOS ANTICOAGULANTES EN EL EMBARAZO
Durante el embarazo se encuentra aumentada la incidencia de complicaciones tromboembólicas.
Los factores que influyen en este hecho son: a) aumento de fibrinógeno y factor VIII; b) aumento del PAI-2 (inhibidor de la fibrinólisis), y c) cambios hormonales.
La presencia de cardiopatía embolígena o de otras enfermedades susceptibles de trombosis durante el embarazo requiere importantes decisiones de las posibles pautas de terapia anticoagulante. Es indudable que las pacientes con prótesis valvulares mecánicas, bioprótesis en fibrilación auricular o historia de tromboembolismo requieren continuación del tratamiento anticoagulante durante el embarazo; sin embargo, debido a la falta de información relevante sobre su eficacia y seguridad sigue siendo un tema controvertido no existiendo recomendaciones definitivas en la elección de las 3 pautas posibles: heparina sola, dicumarínicos solos o combinación de heparina y dicumarínicos. Hay potenciales riesgos para la madre y el feto con ambos fármacos, por lo que el régimen definitivo debe definirse después de informar a la mujer y su familia de las implicaciones de cada una de ellas 45.
- Heparina s.c. Debido a su peso molecular elevado no atraviesa la placenta y no se asocia a elevación de la morbilidad fetal. En la madre puede ocasionar osteoporosis, trombocitopenia, hematomas o abscesos estériles, así como elevación del riesgo de trombosis protésica incluso en administración s.c. e i.v. a dosis adecuadas.
Las heparinas de bajo peso molecular son una alternativa a la heparina no fraccionada. Su excelente biodisponibilidad, sin atravesar tampoco la placenta, hace su uso muy atractivo, habiendo demostrado utilidad en la prevención de trombosis venosa, pero no se ha publicado su utilidad en la embarazada con valvulopatía. Con estas heparinas, la trombocitopenia por trombosis inducida por las heparinas no fraccionadas (1/2.000 pacientes) parece ser menos frecuente, pero el riesgo de osteoporosis es desconocido.
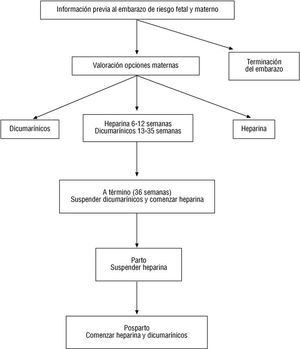
- Dicumarínicos. La warfarina atraviesa la placenta por su bajo peso molecular. La embriopatía dicumarínica (4-10% de recién nacidos) afecta fundamentalmente al desarrollo de los huesos (hipoplasia nasal y condrodisplasia punctata) entre la 6-9 semanas de gestación. Durante el segundo-tercer trimestres se relaciona con anomalías del sistema nervioso central (SNC) (atrofia del nervio óptico, microcefalia, retraso mental, espasticidad e hipotonía) y aborto espontáneo. El acenocumarol (Sintrom) parece ser menos teratogénico, pero también se han descrito estas alteraciones. La falta de datos suficientes hace difícil confirmar o refutar la hipótesis de que los dicumarínicos reducen el riesgo de tromboembolismo más que la heparina 46 (fig. 1).
Fig. 1. Tratamiento anticoagulante en pacientes embarazadas con enfermedad valvular cardíaca.
Semanas 1 a 35
Preconcepción y primeras 12 semanas
Si la mujer no está todavía embarazada, tiene la opción de continuar con tratamiento dicumarínico hasta confirmar el embarazo o cambiar a heparina subcutánea. Si realiza esta última elección evita la exposición del feto a los dicumarínicos, pero puede añadir meses de exposición materna a la heparina. Si no desea exponer el feto en ningún momento a los dicumarínicos, debe cambiar a heparina antes de la concepción y continuar el embarazo con heparina s.c. La paciente que elige la «combinación», puede concebir con dicumarínicos, monitorizando semanalmente la posibilidad de embarazo y cambiar a heparina cuando se confirme. Esta pauta minimiza los efectos de la heparina sobre la madre y evita al feto los dicumarínicos durante las primeras 6-12 semanas, cuando el riesgo teratogénico es más elevado.
La recomendación habitual de sustituir los dicumarínicos los tres primeros meses de embarazo por heparina para valores de tiempo parcial de tromboplastina activado (TTPA) 2-3 veces el tiempo control a las 6 h de la inyección subcutánea no tiene aún evidencia aleatorizada. La otra opción recomendada ya por algunos centros es mantener la heparina s.c. desde el diagnóstico del embarazo hasta el final del mismo, con las complicaciones potenciales de las inyecciones subcutáneas y del fármaco (riesgo de osteoporosis y trombocitopenia).
La terapia combinada o con heparina sólo en pacientes con anticoagulación antes del embarazo requiere un protocolo consensuado como el siguiente: si la paciente planea una gestación, pese a haber sido informada del riesgo que ello comporta en esta situación, deberá procurarse que el diagnóstico de la misma se lleve a cabo con la máxima precocidad. Una vez confirmado, se procederá a la suspensión de la anticoagulación por vía oral y a la administración de heparina a dosis totales, de acuerdo con la pauta siguiente: a) suspensión inmediata del dicumarínico por vía oral y determinación de la INR; b) administración de vitamina K por vía intravenosa (30 mg en 30 ml de suero fisiológico en 30 min); c) a las 8 h de administrar la vitamina K, iniciar la heparina sódica por vía intravenosa a dosis media (300-400 U/kg/día), administrada en perfusión continua o repartida en 6 dosis (1 cada 4 h); d) veinte horas después de administrar la vitamina K, comprobar si el valor de la INR es inferior a 1,6 y aumentar entonces la heparina a la dosis total (500-600 U/kg/día en perfusión continua o distribuida en seis tomas [1 cada 4 h]). La dosis total de heparina se ajustará con controles periódicos cada 2-3 días para mantener el TTPA entre 1,7 y 2,7, y el tratamiento se mantendrá como mínimo hasta la semana 16, y e) a partir de la semana 17 se deberá elegir entre continuar con heparina s.c. (heparina cálcica a dosis total [2.500 U/10 kg/12 h] o heparina de bajo peso molecular 1-2 veces al día según el preparado) o reiniciar los dicumarínicos hasta la semana 36.
Portadoras de prótesis mecánicas
Indicación clase I
Las pacientes de alto riesgo: prótesis mecánicas de antigua generación (Bjork-Shiley, Starr-Edwards, especialmente mitrales) o tromboembolismo previo que eligen no continuar con dicumarínicos durante el primer trimestre deben recibir tratamiento con heparina continua intravenosa con dosis que prolongue el TTPA 2-3 veces el control.
Indicación clase IIa
Las pacientes que continúan con dicumarínicos deben mantener el INR entre 2-3 con la dosis más reducida posible y añadiendo bajas dosis de aspirina 80-10 mg/día (el dipiridamol se evitará por efectos indeseables en el feto).
En estudios realizados en pacientes de elevado riesgo no embarazadas, la asociación de aspirina reducía significativamente la mortalidad y el embolismo sistémico, con un insignificante aumento de las hemorragias mayores. Estos datos no son comparables con embarazadas, pero es razonable añadirla a cualquiera de los 3 regímenes de anticoagulación referidos en las pacientes de alto riesgo. Estas bajas dosis no aumentan el riesgo de cierre del ductus fetal, aunque sí lo hacen dosis más elevadas 4.
Indicación clase IIb
Las mujeres de bajo riesgo, con prótesis de última generación y sin historia de tromboembolismo previo pueden mantenerse con dosis de heparina subcutánea de 17.500-20.000 U/12 h, ajustadas para prolongar el TTPA 2-3 veces el control.
Portadoras de prótesis biológicas
Las válvulas biológicas, sobre todo en posición mitral con factores de riesgo (fibrilación auricular, aurícula dilatada, coágulos intracavitarios, tromboembolias previas), precisan anticoagulación con dicumarínicos para valores de INR entre 2 y 3. La adición de aspirina en estas pacientes no ha sido estudiada como para aconsejar una terapéutica combinada.
En las pacientes con bioprótesis aórtica y en ritmo sinusal la anticoagulación será optativa.
Proceso intercurrente que requiere anticoagulación
Tromboembolismo pulmonar, tromboflebitis, etc. Si debe iniciarse el tratamiento anticoagulante durante la gestación se empleará heparina intravenosa a dosis totales. En los procesos trombofílicos, como el síndrome antifosfolípido, déficit de ATIII, etc., se empleará la misma pauta, aunque en el primero se ha empleado heparina de bajo peso molecular con buenos resultados.
Después de la semana 36
Indicación clase IIa
- Si se ha seleccionado la terapia combinada, se deben suspender los dicumarínicos antes del parto, la semana 35-36 de gestación (2-3 semanas antes del parto previsto), comenzando nuevamente con heparina. En el momento del parto se cambiará la heparina cálcica por heparina i.v. a dosis totales y en función de la evolución del parto se disminuirá la dosis a 200 U/kg/día 4 h antes de la expulsión. Si no se producen complicaciones, en las primeras 12-24 h del alumbramiento se aumentará a 300-400 U/kg/día y a las 48 h se pasará a 500-600 U/kg/día, siempre en perfusión continua y con estricto control hematológico.
- Si el parto se inicia mientras se continúa el tratamiento con dicumarínicos, existe alto riesgo de hemorragia para la madre y el feto, por lo que se debe practicar cesárea y evitar el parto vaginal. El efecto del acenocumarol puede persistir en el feto 7-10 días después de suspender el fármaco.
- Después del parto, en ausencia de sangrados, el cambio a anticoagulación oral deberá hacerse durante el ingreso hospitalario y lentamente hasta comprobar que el INR es el deseado.
- Ni heparina ni dicumarínicos interfieren con la lactancia en el período posparto.
PROFILAXIS DE LA ENDOCARDITIS BACTERIANA EN LAS EMBARAZADAS. PARTO Y PUERPERIO
Las pacientes con cardiopatía son susceptibles de padecer endocarditis infecciosa, por lo que deben ser protegidas. La discusión en cuanto a la eficacia de la profilaxis de la endocarditis en la población general sigue siendo incierta, pero parece haber consenso en cuanto a la cardiópata embarazada, en quien debe hacerse la profilaxis sobre todo en el momento del parto, dada la alta mortalidad por endocarditis bacteriana en las pacientes valvulópatas. Un grupo de riesgo especial lo constituyen las diabéticas, en quienes la colonización bacteriana es más frecuente. Las endocarditis se desarrollan por lo general en mujeres que presentan defectos cardíacos estructurales, que desarrollen bacteriemia con aquellos microorganismos capaces de causar endocarditis. sta puede surgir espontáneamente o puede complicar una infección focal, sobre todo en aquellas que presentan diseminación hematógena.
La realidad es que sólo ciertas bacterias son responsables de las endocarditis y no siempre es posible predecir qué pacientes desarrollarán esta infección o qué procedimiento en particular será responsable. Por tanto, los expertos han decidido qué procedimientos y afecciones cardíacas son susceptibles de profilaxis dado su elevado riesgo, en aquellos pacientes con una incidencia mayor que los de la población general. Las indicaciones potenciales de profilaxis de la endocarditis bacteriana en embarazadas con cardiopatía son las mismas que en las pacientes no embarazadas con cardiopatía que vayan a ser sometidas a procedimientos que sean susceptibles de provocar bacteriemia. Se consideran de elevado riesgo válvulas cardíacas protésicas, endocarditis previa, cardiopatías congénitas cianóticas, ductus arterioso permeable, comunicación interventricular, coartación aórtica, valvulopatía aórtica, valvulopatía mitral y lesiones intracardíacas corregidas quirúrgicamente, con defectos residuales. Son de riesgo moderado la miocardiopatía hipertrófica y el prolapso de válvula mitral con insuficiencia.
La bacteriemia causada por una variedad de organismos intestinales ocurre sólo en el 0,5-3% de los partos normales, y no hay casos probados de endocarditis en más de 2.000 partos normales en mujeres sin profilaxis con enfermedad cardíaca. No hay evidencia de que la profilaxis antibiótica sea necesaria o efectiva durante el parto 47.
La profilaxis antibiótica no está recomendada por la American Heart Association en los partos vaginales no complicados o por cesárea; sin embargo, debería darse a las pacientes susceptibles para cubrir los partos prolongados o quirúrgicos y en pacientes con válvulas protésicas o con historia de endocarditis bacteriana. Al ser la evolución del parto impredecible y debido sobre todo a los efectos potencialmente devastadores de la endocarditis bacteriana en las pacientes con lesiones valvulares 48, la actitud habitual, sobre todo en los EE.UU., es administrar profilaxis antibiótica a todas las pacientes con lesiones cardíacas susceptibles, independientemente del tipo de parto que se espere 4.
La pauta de profilaxis antibiótica es igual a la utilizada en pacientes sin embarazo. En el parto se administra ampicilina i.m. o i.v. 2 g, más gentamicina 1 mg/kg 1 hora antes del parto previsto y 8 h después del mismo.
Las condiciones de uso y efectos adversos en la madre, el feto y el recién nacido, de los antimicrobianos que se emplean más habitualmente en la embarazada se resumen en la tabla 2.
CIRUGÍA CARDÍACA DURANTE EL EMBARAZO
Se asocia a distrés fetal, retraso de crecimiento intrauterino o muerte (15%), ocasionados por la disminución del flujo uteroplacentario durante el bypass cardiopulmonar, aunque no se ha descrito aumento del riesgo materno. Se recomienda retrasar la cirugía hasta que se considere viable el feto, y realizar en el mismo acto quirúrgico cesárea electiva. Sólo se indica cirugía en pacientes refractarios a tratamiento médico, especialmente si presentan síndrome de bajo gasto. En estos casos debe mantenerse un flujo alto > 2,5 l/m/m 2 y una PA media > 70 mmHg. El feto debe monitorizarse y, si aparece bradicardia, aumentar el flujo sanguíneo. La hipotermia parece no afectar al feto, pero puede aumentar la actividad uterina con riesgo de parto pretérmino 21.
Para las lesiones susceptibles siempre se prefiere la reparación valvular al reemplazo. Cuando no es posible la reparación, la elección del tipo de prótesis es problemática: en posición aórtica pueden emplearse homoinjertos o autoinjertos pulmonares. Debe reconsiderarse la práctica de implantar prótesis biológicas a pacientes jóvenes que desean tener descendencia, ya que la anticoagulación puede hacerse necesaria por otras razones (fibrilación auricular, tromboflebitis, historia de tromboembolismo). Además, debe asumirse el riesgo de un segundo recambio valvular en el futuro y a corto plazo por el deterioro protésico acelerado relacionado con el embarazo.
FÁRMACOS CARDIOACTIVOS Y EMBARAZO
En el caso de muchos fármacos no disponemos de información suficiente sobre su uso durante el embarazo, siendo mal conocidas sus acciones indeseables sobre el feto. Esto dificulta sobremanera el establecimiento del necesario balance entre los beneficios potenciales para la madre y los riesgos que corre el feto.
Los cambios que se establecen en el sistema cardiovascular durante el embarazo pueden modificar la farmacocinética de los fármacos cuyo uso está plenamente aceptado. La hipomotilidad gástrica, con el consiguiente retraso en el vaciado, puede dificultar la absorción del fármaco en el tracto gastrointestinal.
El volumen de distribución de los fármacos hidrosolubles puede estar aumentado a consecuencia del incremento del agua corporal total y el de los liposolubles también, debido al del tejido graso que se instaura sobre todo en la décima y trigésima semanas. El aumento del flujo plasmático renal se acompaña de un incremento de la filtración glomerular, que puede comportar una más rápida eliminación de los fármacos excretados por vía renal; además, la actividad enzimática está probablemente reducida en el hígado, lo cual podría afectar a los fármacos que se eliminan por esta vía. Por estos motivos, es preciso estar muy atentos a la posibilidad de tener que modificar en las gestantes la dosificación habitual de los fármacos cuyo uso está aceptado, por haberse demostrado que carecen de los efectos indeseables sobre la madre y/o sobre el feto.
Otros fármacos están formalmente contraindicados en estas circunstancias, lo que puede dar lugar a una problemática diversa. En primer lugar, puede que sea muy difícil disponer de un fármaco alternativo para el tratamiento de un determinado problema cardiológico. Otro problema grave viene dado por el hecho de que muchos embarazos no habían sido planeados y algunas gestantes pueden estar bajo un tratamiento farmacológico que podrá ejercer su acción deletérea sobre el feto durante el tiempo que se haya tardado en conocer la existencia del embarazo; esta situación ha motivado incluso alguna interrupción no deseada de algún embarazo. En otros casos, el problema radica en que la gestante está bajo tratamiento a largo plazo por una afección diagnosticada ya antes del embarazo y el fármaco utilizado está contraindicado en la nueva situación (p. ej., el tratamiento anticoagulante con dicumarínicos por una prótesis valvular de tipo mecánico). Esto obliga a su sustitución por otro que ejerza una acción similar, siempre que dispongamos de él; en estos casos, la mejor conducta terapéutica es la preventiva, mediante la oportuna información a la paciente de los riesgos que comportaría un embarazo.
Finalmente, cabe recordar que, en la gestante, los problemas ligados al empleo de fármacos cardioactivos no concluyen con el parto, y es preciso tener en cuenta sus posibles acciones sobre el niño en el caso de lactancia materna si se eliminan por la leche 49.
Procederemos a continuación a una breve revisión de los fármacos cardioactivos más utilizados en la práctica, enfocada a su posible uso en el curso de una gestación.
Antiarrítmicos<+f"Helvetica">39<$f$>
- Adenosina. Se ha empleado en el tratamiento de la taquicardia supraventricular materna, sin que se hayan descrito efectos adversos sobre el feto o el recién nacido atribuibles a su uso.
- Fármacos de clase IA. No se han descrito efectos teratogénicos de la quinidina, la procainamida o el disopiramida.
La quinidina atraviesa la barrera placentaria y alcanza en el feto concentraciones plasmáticas similares a las de la madre. Se considera que es relativamente inocua para el feto, aun cuando se han descrito casos de trombocitopenia neonatal. A dosis muy altas puede ocasionar el aborto por sus propiedades oxitócicas. Se elimina por la leche materna, sin interferir en la lactancia.
La experiencia con el disopiramida es limitada y se recomienda precaución en su empleo.
El uso de la procainamida no se ha asociado a ningún efecto fetal adverso. Se elimina por la leche de la madre, pero la lactancia materna se considera compatible con su uso.
- Fármacos de clase IB. La lidocaína atraviesa rápidamente la placenta y a dosis altas puede ocasionar una depresión en el sistema nervioso central del recién nacido. A las dosis adecuadas es el tratamiento de elección para las arritmias ventriculares. Es compatible con la lactancia materna.
La mexiletina también atraviesa libremente la placenta. Los datos sobre sus efectos son limitados, aunque no parece tener una acción teratogénica ni efectos adversos.
- Fármacos de clase IC. La flecaidina y la propafenona atraviesan la barrera placentaria. Aunque no parece que tengan efectos teratogénicos ni efectos secundarios adversos sobre el feto, deben emplearse con mucha precaución, dado que carecemos de estudios extensos en la mujer gestante. También es limitada la información acerca de su seguridad durante la lactancia materna.
- Fármacos de clase II. Véase apartado de betabloqueantes.
- Fármacos de clase III. La amiodarona atraviesa con dificultad la barrera placentaria; sin embargo, se ha descrito su asociación con hipotiroidismo fetal (9%), bocio fetal, parto prematuro, hipotonía, bradicardia, prolongación del intervalo QT, aborto espontáneo y posible muerte fetal. Su uso debe evitarse, excepto en casos de absoluta necesidad. Alcanza altas concentraciones en la leche materna, por lo que se recomienda evitar la lactancia materna en las pacientes bajo este tratamiento, incluso si ya se ha suprimido en los últimos meses.
El sotalol atraviesa la placenta; aunque disponemos de escasa información, no parece que provoque efectos adversos sobre el feto. Se han descrito bradicardias neonatales transitorias.
- Fármacos de clase IV. Véase el apartado de calcioantagonistas.
Digoxina
Puede utilizarse, siempre que sea muy necesaria, adaptando su dosificación a los cambios de sus propiedades farmacodinámicas. Por ser un fármaco hidrosoluble que se elimina por vía renal existe la posibilidad de obtener menores concentraciones plasmáticas usando las dosis habituales, por el aumento del volumen de distribución y el incremento de la eliminación renal. Atraviesa la barrera placentaria y la relación plasmática fetal/maternal varía entre 0,5 y 1. En el embarazo pueden aparecer altas concentraciones plasmáticas de sustancias similares a la digoxina que pueden distorsionar las medidas de su tasa plasmática, efectuadas por radioinmunoanálisis. Se han descrito reducciones de peso en el recién nacido.
Se elimina por la leche materna, variando la relación leche/plasma entre 0,6 y 0,9; la American Academy of Pediatrics considera que la lactancia materna es compatible con su empleo, dado que en su mayor parte el fármaco está unido a las proteínas y es muy baja su fracción libre.
Calcioantagonistas
Su empleo en las gestantes no ha sido estudiado a fondo y también es limitada la información acerca de su seguridad durante la lactancia.
El verapamilo ha sido el más empleado como antiarrítmico (arritmias supraventriculares maternas y fetales, incluso por vía intravenosa), sin que se haya comunicado su asociación con anomalías congénitas, pero sí algún caso de bradicardia, bloqueo cardíaco o hipotensión. Su empleo por vía intravenosa puede acompañarse de una importante hipotensión materna, con la consiguiente hipoperfusión fetal.
No disponemos de estudios adecuados en humanos referentes al uso del diltiazem, pero se han observado algunos efectos tóxicos sobre el embrión y el feto en trabajos de experimentación animal, como anomalías esqueléticas. Por este motivo es preferible el uso del verapamilo cuando esté indicado un calcioantagonista como antiarrítmico.
Aunque disponemos de mucha información, el nifedipino es el calcioantagonista más utilizado como antihipertensivo en las gestantes porque no reduce la perfusión uteroplacentaria. Puede usarse incluso por vía sublingual como tratamiento antihipertensivo de emergencia. Inhibe las contracciones uterinas.
Inhibidores de la enzima de conversión de la angiotensina
Están contraindicados debido a que se ha demostrado su estrecha relación con hipotensión neonatal, fallo renal y muerte neonatal (sólo en madres que hayan desarrollado insuficiencia renal) 44.
El empleo de captopril únicamente durante el primer trimestre del embarazo no parece comportar un riesgo significativo para el feto. Sin embargo, como norma general es mejor evitar estos fármacos durante la gestación y también en mujeres en edad fértil que hayan planeado un embarazo. El captopril es compatible con la lactancia materna.
Diuréticos
Su empleo es discutido porque, al reducir su expansión fisiológica de la volemia, pueden reducir la perfusión placentaria.
La furosemida atraviesa la barrera placentaria causando concentraciones plasmáticas similares en la madre y el feto, incrementando la producción fetal de orina. Pasado el primer trimestre, se ha utilizado sin efectos nocivos para el feto o para el recién nacido. Asimismo, puede seguir usándose si su administración ya se había iniciado antes del embarazo. Se elimina por la leche materna, pero sin efectos adversos para el lactante.
Las tiazidas atraviesan la placenta, y se han comunicado casos de trombocitopenia, ictericia o bradicardia. No es recomendable su uso.
Vasodilatadores
La hidralazina ha sido ampliamente utilizada en las gestantes sin efectos adversos maternos o fetales, sobre todo por vía intravenosa, en las crisis hipertensivas. A pesar de que atraviesa la barrera placentaria, es relativamente inocua para el feto. Es compatible con la lactancia materna.
La metildopa ha sido utilizada desde hace muchos años en mujeres gestantes, sin efectos secundarios adversos.
Los nitratos orgánicos se han utilizado también ampliamente en las gestantes, tanto por vía oral como intravenosa, en indicaciones tan diversas como la hipertensión, la cardiopatía isquémica, la insuficiencia cardíaca o para conseguir la relajación uterina posparto en la retención de placenta.
Su empleo hace aconsejable una vigilancia estricta de la presión arterial, al igual que sucede con cualquier otro tipo de vasodilatador.
El nitroprusiato sódico puede utilizarse en situaciones de emergencia y durante breve tiempo para evitar la acumulación de los metabolitos tiocianato y cianuro en la sangre materna y fetal, demostrada en animales.
Betabloqueantes
La gran experiencia acumulada con el amplio uso de propranolol ha mostrado su carencia de efectos teratogénicos y la bajísima frecuencia de sus efectos secundarios (hipoglucemia neonatal, bradicardia fetal, hiperbilirrubinemia, policitemia, retraso en el crecimiento intrauterino o prolongación del parto). Se elimina por la leche materna, con una relación leche/plasma de 0,5-1, pero puede mantenerse la lactancia materna.
El bloqueo de los receptores beta-2-adrenérgicos en el miometrio puede estimular las contracciones uterinas. Este inconveniente se evita con el empleo de betabloqueantes beta-1 selectivos, como el metroprolol. Durante el embarazo, el metabolismo del metroprolol está aumentado, lo cual reduce sus concentraciones plasmáticas. No se han comunicado efectos secundarios adversos importantes. Se elimina en pequeñas cantidades por la leche materna, y si el recién nacido tiene una función hepática normal, puede mantenerse la lactancia materna.
La seguridad del atenolol en las gestantes es similar a la de otros betabloqueantes. Se elimina por la leche, pero no interfiere con la lactancia materna.
El sotalol ya ha sido comentado con los fármacos antiarrítmicos de clase III.
No disponemos de mucha información sobre el empleo del labetalol y del acebutolol durante la gestación, aunque sí sabemos que este último alcanza altas concentraciones en la leche de la madre y es incompatible con la lactancia materna.
En general, el uso de fármacos betabloqueantes durante la gestación se considera razonablemente seguro.
Fármacos trombolíticos
La estreptocinasa y la urocinasa se han empleado durante el embarazo, pero con una tasa significativa de hemorragias, partos prematuros y contracciones uterinas incoordinadas, por lo que se reservarán para situaciones extremas en las que el posible beneficio sea más importante que estos efectos secundarios.
CARDIOPATÍA Y GESTACIÎN: LA VISIÎN DEL OBSTETRA
Control en la gestación
1. Revaluación de la cardiopatía. Deberá valorarse la situación funcional cada 2-4 semanas, ya que las mayores sobrecargas acontecen entre las 28-32 semanas y la mortalidad materna aumenta en proporción directa a la clase funcional. Es aconsejable un enfoque multidisciplinario.
2. Actividad física. Es aconsejable la disminución de la sobrecarga física, pero manteniendo una actividad que evite la estasis venosa y la atrofia muscular.
3. Dieta. Deberá ser hiposódica, eliminando la sal de mesa, o asódica en caso de insuficiencia cardíaca congestiva, y se limitará la ganancia ponderal a 7-9 kg. Se deberá administrar un suplemento de hierro entre 30 y 60 mg de hierro elemental, así como de ácido fólico y calcio.
4. Medicación. Se aconseja profilaxis antibiótica (penicilina/gentamicina) en las situaciones de riesgo.
Parto
1. Sustituir los dicumarínicos por heparina sódica de más fácil control días antes de la inducción electiva del parto, que permite tener presente el equipo multidisciplinario.
2. La perfusión de occitocina mediante bomba de infusión da un control exacto de los líquidos administrados, evitando la aparición de un edema pulmonar.
3. Profilaxis antibiótica de la endocarditis y monitorización maternofetal.
4. Se recomienda analgoanestesia para disminuir el dolor y ansiedad. Conviene prestar atención a los cambios hemodinámicos de la misma, como la hipotensión de la epidural.
5. Hay que acortar el período expulsivo intentando evitar el menor esfuerzo materno mediante una instrumentación tocúrgica adecuada.
6. En los primeros minutos del posparto se produce un aumento brusco del retorno venoso, por lo que debe vigilarse la función cardíaca incluso con el uso de un catéter de Swan-Ganz.
7. Hay que valorar cuidadosamente la pérdida hemática en todas las cardiópatas, especialmente en las sometidas a anticoagulación, siendo cuidadosos en la sutura de desgarros, episiotomía o incisión uterina si se ha practicado una cesárea.
8. En el postoperatorio inmediato, las pacientes en clase funcional III y IV de la NYHA deben someterse a vigilancia intensiva.
9. Se debe insistir en una deambulación temprana y recomendar el uso de medias de compresión durante los primeros días.
10. No hay contraindicaciones para la lactancia materna, pero la mayoría de los autores la desaconsejan si la anticoagulación se realiza con cumarínicos.
11. Se debe citar a la 1-2 semanas posparto para realizar un control obstétrico, revaluar la cardiopatía y planear la anticoncepción.
Anticoncepción
1. Los métodos anticonceptivos basados en la abstención, de barrera y espermicidas no presentan efectos secundarios, excepto por su relativa inseguridad anticonceptiva.
2. Los anovulatorios orales modernos contienen una dosis muy baja de estrógenos y se pueden usar con una relativa cautela. Debe considerarse la anticoncepción con progestágenos de acción prolongada (Depoprogevera ¨ 150 mg) como alternativa a los anticonceptivos orales.
3. El dispositivo intrauterino (DIU) puede dar lugar a metrorragias en pacientes anticoaguladas y puede favorecer el desarrollo de endocarditis bacteriana.
4. La ligadura de trompas debe ofertarse sin restricciones, preferiblemente en situaciones de estabilidad hemodinámica.
5. La interrupción voluntaria del embarazo se debe ofertar cuando, con la continuación de la gestación, se estime un mayor riesgo para la madre o el feto que en la población general, especialmente en las pacientes con cardiopatías cianógenas, hipertensión pulmonar severa, síndrome de Marfan, anticoaguladas y con cardiomiopatía periparto. La interrupción del embarazo no está exenta de riesgo, por lo que debe ser precoz y con profilaxis antibiótica.
La mayoría de las cardiopatías permiten hoy día una evolución satisfactoria del embarazo. Es excepcional la indicación del aborto terapéutico, permitiéndose la evolución del parto vaginal con estrictos controles de la situación hemodinámica y considerándose solamente la indicación de cesárea por motivos obstétricos, no cardíacos.
Bibliografía
[1]
Pregnancy and cardiovascular disease. En: Braunwald E, editor. Heart disease. A textbook of cardiovascular medicine (5.
[2]
40/1986 de 21 de noviembre y Ley general de Sanidad 14/1986 de 25 de abril.
[3]
Pregnancy and heart disease. En: Yusuf S, Cairns JA, Camm AJ, Fallen EL, Gersh B, editores. Evidence based cardiology (1.
[4]
J Am Coll Cardiol 1998; 32: 1486-1588.
[5]
Cardiopatías y embarazo. En: Hurst JW, editor. The heart. Arteries and veins (7.
[6]
Analgesia and anesthesia during pregnancy. En: Elkayam E, Gleicher N, editores. Cardiac problems in pregnancy. Diagnosis and management of maternal and fetal disease (2.
[7]
Usefulness of percutaneous balloon commissurotomy for mitral stenosis during pregnancy. Am J Cardiol 1994; 73: 398-400.
[8]
Closed mitral valvotomy during pregnancy: a 20-year experience. Scand J Thorac Cardiovasc Surg 1988; 22: 11-15.
[9]
Percutaneous balloon aortic valvuloplasty during pregnancy: use of the Inoue balloon and the physiologic antegrade approach. Cathet Cardiovasc Diagn 1998; 45: 422-425.
[10]
Congenital heart disease: incidence in the first year of life. Am J Epidemiol 1988; 128: 381-388.
[11]
Congenital cardiovascular malformations associated with chromosome abnormalities: an epidemiologic study. J Pediatr 1989; 114: 79-86.
[12]
Maternal transmission of congenital heart diseases: new recurrence risk figures and the questions of citoplasmic inheritance and vulnerability to teratogens. Am J Cardiol 1987; 59: 459-463.
[13]
Congenital heart disease in adults. Pregnancy and congenital heart disease: the mother and the fetus (2.» ed.). Filadelfia: Saunders Company, 1998; 144-164.
[14]
Risks of pregnancy in women with cardiac disease. JAMA 1977; 238: 892-893.
[15]
Pregnancy complicated maternal heart disease: a review of 519 women. Br J Obstet Gynaecol 1988; 95: 861-867.
[16]
Hemodynamic monitoring of cardiac patients during pregnancy. Cardiac problems in pregnancy: diagnosis and management of maternal and fetal disease (2.
[17]
Outcome of pregnancy in women with congenital shunt lesions. Heart 1999; 81: 271-275.
[18]
Aortic dissections during pregnancy. Am J Cardiol 1984; 54: 699-701.
[19]
Aortic dissection in pregnancy: importance of pregnancy induced changes in the vessel wall and bicuspid aortic valve in pathogenesis. Br J Obstet Gynaecol 1994; 101: 1085-1088.
[20]
Aortic stenosis in pregnancy. Obstet Gynecol 1988; 72: 113-118.
[21]
Valvular heart surgery during pregnancy. Surg Clin North Am 1995; 75: 59-75.
[22]
Pregnancy in cyanotic congenital heart disease. Outcome of mother and fetus. Circulation 1994; 89: 2673-2676.
[23]
Outcome of pregnancy after the Mustard operation for transposition of the great arteries with intact ventricular septum. J Am Coll Cardiol 1994; 24: 190-193.
[24]
Pregnancy outcomes after the Fontan repair. J Am Coll Cardiol 1996; 28: 763-767.
[25]
Outcome of pulmonary vascular disease in pregnancy: A systematic overview from 1978 through 1996. J Am Coll Cardiol 1998; 31: 1650-1657.
[26]
Ebstein's anomaly: outcome of pregnancy. J Am Coll Cardiol 1994; 23: 1194-1198.
[27]
Cardiovascular problems in pregnant women with the Marfan syndrome. Ann Intern Med 1995; 123: 117-122.
[28]
Progression of aortic dilatation and the benefit of long-term beta-adrenergic blockade in Marfan's syndrome. N Engl J Med 1994; 330: 1335-1341.
[29]
Hypertrofic cardiomiopathy in pregnancy. En: Elkayan U, Gleicher, editores. Cardiac problems in pregnancy: diagnosis and management of maternal and fetal disease (2.
[30]
Natural course of peripartum cardiomyopathy. Circulation 1971; 44: 1053-1061.
[31]
Peripartum vs idiopathic dilated cardiomiopathy in young woman. A comparison of clinical, pathological and prognostic features. Int J Cardiol 1993; 40: 57-67.
[32]
Peripartum cardiomyopathy. Am Heart J 1995; 130: 860-870.
[33]
Peripartum cardiomyopathy due to myocarditis. N Engl J Med 1982; 307: 731-734.
[34]
Peripartum myocarditis and cardiomyopathy. Circulation 1990; 81: 992-927.
[35]
Peripartum heart disease: an endomyocardial biopsy study. Br Heart J 19886; 56: 285-291.
[36]
Risks of angiotensin-converting enzyme inhibition during pregnancy: experimental and clinical evidence, potential mechanisms, and recommendations for use. Am J Med 1994; 96: 451-456.
[37]
Long-term outcome after heart transplantation for peripartum cardiomyopathy. Am Heart J 1994; 127: 1318-1323.
[38]
Primary stent implantation for acute myocardial infarction during pregnancy: use of abciximab, ticlopidine, and aspirin. Cathet Cardiovasc Diagn 1998; 45: 275-279.
[39]
Safety of antiarrhythmics during pregnancy: case report and review of the literature. Can J Cardiol 1999; 15: 113-117.
[40]
Safe conduct of pregnancy with rheumatic heart disease. En: Qullican EJ, Zuspan FP, editores. Current therapy in obstetrics and gynecology 3. Filadelfia: WB Saunders Co., 1990; 270-273.
[41]
The pharmacological management of hypertension in pregnancy. J Hypertens 1992; 10: 201-207.
[42]
Management of hypertensives urgencies and emergencies. Clin Pharmacol 1995; 35: 747-762.
[43]
Atenolol in essential hypertension during pregnancy. Br Med J 1990; 301: 587-589.
[44]
Angiotensin converting enzyme inhibitors phetopathy. J Am Soc Nephrol 1993; 3: 1575-1582.
[45]
Guidelines for prevention of thromboembolic events in valvular heart disease: Study group of the Working Group on Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 1995; 16: 1320-1330.
[46]
Anticoagulation in pregnant women with prosthetic heart valves: a double jeopardy. J Am Coll Cardiol 1996; 27: 1704-1706.
[47]
Antibiotic prophylaxis against infective endocarditis after normal delivery - is it necessary? Br Heart J 1980; 44: 499-502.
[48]
Infective endocarditis complicated by mycotic cerebral aneurysm: two case reports of women in the peripartum period. Eur J Cardiothorac Surg 1998; 14: 533-535.
[49]
The transfer of drugs and other chemicals into human milk. Pediatrics 1994; 93: 137-150.