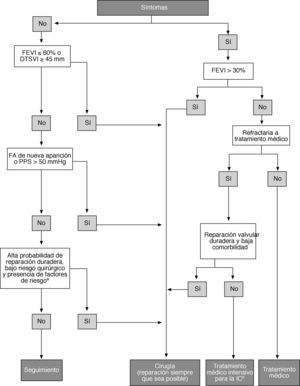
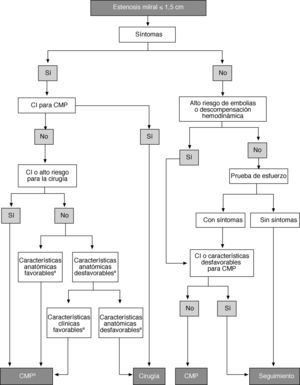
Las Guías de Práctica Clínica tienen como objetivo presentar y evaluar toda la evidencia disponible en el momento del proceso de redacción sobre un tema particular para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular, que sufre una enfermedad determinada, no sólo teniendo en cuenta el resultado final, sino también sopesando los riesgos y los beneficios de un procedimiento diagnóstico o terapéutico concreto. Las Guías de Práctica Clínica no sustituyen a los libros de texto, son un complemento de estos y cubren los temas curriculares de la ESC. Las Guías de Práctica Clínica y las recomendaciones deben asistir a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, el juicio último sobre el cuidado de un paciente concreto lo debe tomar el médico responsable de su cuidado.
En los últimos años, la Sociedad Europea de Cardiología (ESC) y otras sociedades y organizaciones han publicado un gran número de guías de práctica clínica. Debido al impacto de las guías en la práctica clínica, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente para el usuario. Las recomendaciones de la ESC para la elaboración y publicación de guías de práctica clínica se pueden encontrar en la sección de guías de la página web de la ESC (http://www.escardio.org/guidelines-surveys/esc-guidelines/about/Pages/ruleswriting. aspx). Las Guías de Práctica Clínica de la ESC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
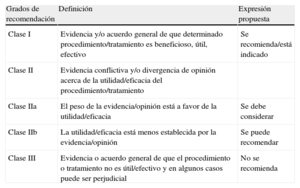
Los miembros de este Grupo de Trabajo fueron seleccionados por la ESC y la Asociación Europea de Cirugía Cardiotorácica (EACTS) en representación de los profesionales de la salud dedicados a los cuidados médicos de la patología tratada en el presente documento. Los expertos seleccionados realizaron una revisión exhaustiva de la evidencia publicada sobre diagnóstico, manejo y/o prevención de una entidad concreta según las normas establecidas por el comité de la ESC para la elaboración de guías de práctica clínica (GPC) y por la EACTS. Además llevaron a cabo la evaluación crítica de los procedimientos diagnósticos y terapéuticos, incluida la valoración de la razón riesgo/beneficio. Cuando se dispone de datos, se incluye también una estimación de los resultados sanitarios para grandes grupos de población. Se valoró el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
Grados de recomendación
| Grados de recomendación | Definición | Expresión propuesta |
| Clase I | Evidencia y/o acuerdo general de que determinado procedimiento/tratamiento es beneficioso, útil, efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del procedimiento/tratamiento | |
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general de que el procedimiento o tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo aleatorizado y controlado o de estudios no aleatorizados a gran escala |
| Nivel de evidencia C | Consenso de opinión de expertos y/o estudios a pequeña escala, estudios retrospectivos, registros |
Los miembros de los comités de redacción y revisión han declarado por escrito cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas han sido archivadas y están disponibles en la página web de la ESC (http://www.escardio.org/guidelines). Durante el periodo de redacción, las modificaciones en las relaciones que se pudieran considerar conflicto de intereses fueron notificadas a la ESC/EACTS y actualizadas.
El informe del Grupo de Trabajo fue financiado en su totalidad por la ESC y la EACTS y se desarrolló sin ninguna participación de la industria.
Los comités para las guías de práctica clínica de la ESC y la EACTS supervisan y coordinan la preparación de esta nueva guía de práctica clínica; además, son responsables del proceso de aprobación. Los comités para las guías de práctica clínica de ESC/EACTS y expertos externos revisan exhaustivamente el documento, tras lo cual es aprobado por todos los miembros del Grupo de Trabajo. Por último, el documento final es aprobado por el GPC para su publicación en European Heart Journal y European Journal of Cardio-Thoracic Surgery.
Tras la publicación, la difusión de las guías de práctica clínica y su mensaje es de suma importancia. Las ediciones de bolsillo y las ediciones digitales descargables (PDA) son especialmente útiles en los centros de atención médica. Encuestas realizadas muestran que algunos usuarios finales a los que van dirigidas las guías desconocen su existencia o, simplemente, no las aplican en la práctica clínica; por este motivo, los programas de implementación de las nuevas guías forman parte fundamental de la difusión del conocimiento. Para ello, la ESC/EACTS organiza reuniones con las sociedades nacionales y líderes de opinión en Europa; estas reuniones para la implementación de las guías también pueden celebrarse en cada país una vez que el documento se aprueba por las sociedades nacionales de la ESC/EACTS y se traduce a las diferentes lenguas. Los programas de implementación son necesarios porque se ha demostrado que los resultados clínicos se ven influidos favorablemente por la aplicación de las recomendaciones clínicas.
La tarea de elaboración de guías de práctica clínica incluye no sólo la integración de la investigación más reciente, sino también la creación de herramientas educativas y programas de implementación de las recomendaciones. Asimismo es necesario realizar encuestas y registros para verificar si la práctica clínica en la vida real se corresponde con las recomendaciones de las guías, y así completar el ciclo entre la investigación clínica, la elaboración de las guías y su implementación en la práctica clínica. Dichas encuestas y registros permiten además evaluar el impacto de la implementación de las guías en la evolución de los pacientes. No obstante, el juicio último sobre el cuidado de un paciente concreto, en consulta con dicho paciente y, si fuera necesario, con su representante legal, debe hacerlo el médico responsable de su cuidado. Además, es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
INTRODUCCIÓN¿Por qué necesitamos unas nuevas guías sobre el tratamiento de las valvulopatías?Aunque en los países industrializados las valvulopatías son menos comunes que la enfermedad coronaria (EC), la insuficiencia cardiaca (IC) o la hipertensión (HTA), es interesante disponer de una guía de práctica clínica sobre este tema debido a la incidencia de esta entidad frecuentemente asociada a la necesidad de una intervención1,2. Como las valvulopatías se presentan normalmente a una edad más avanzada y, por ello, la presencia de comorbilidades que conllevan aumento de riesgo es mayor, la toma de decisiones sobre una posible intervención suele ser compleja1,2. Actualmente, otro aspecto importante de las valvulopatías es la proporción creciente de pacientes previamente operados que se presentan con problemas adicionales1. Por el contrario, la valvulopatía reumática sigue siendo un importante problema de salud pública en países en desarrollo, donde afecta predominantemente a los adultos jóvenes3.
En comparación con otras enfermedades del corazón, hay pocos ensayos clínicos en el campo de las valvulopatías, y los ensayos aleatorizados son particularmente escasos.
Por último, los datos del estudio Euro Heart Survey sobre valvulopatías4,5, que otros ensayos clínicos han confirmado, indican que hay un auténtico desfase entre las guías disponibles y su aplicación efectiva6–9.
Creemos que existen dos razones principales para la actualización de las guías de la ESC publicadas en 20078:
- •
En primer lugar, disponemos nueva evidencia, especialmente en el campo de la estratificación del riesgo; además, se han producido cambios en los métodos diagnósticos —particularmente en la ecocardiografía— y en las opciones terapéuticas debido a los avances en cirugía de sustitución valvular y la introducción de técnicas percutáneas de intervencionismo, principalmente la implantación transcatéter de válvula aórtica (TAVI) y la reparación valvular por vía percutánea con el método borde con borde (edge-to-edge). Estos cambios afectan principalmente a los pacientes con estenosis aórtica (EA) e insuficiencia mitral (IM).
- •
En segundo lugar, la estrategia colaborativa entre cardiólogos y cirujanos cardiacos para el manejo de los pacientes con valvulopatía —especialmente los de mayor riesgo perioperatorio— ha llevado a la elaboración de un documento conjunto de la ESC y la EACTS. Se espera que este esfuerzo conjunto proporcione una visión más integral y facilite la implementación de esta guía en ambas comunidades.
La presente guía se centra en las valvulopatías adquiridas, está orientada al tratamiento y no hace referencia a la endocarditis ni a las enfermedades valvulares congénitas, incluida la valvulopatía pulmonar, ya que la ESC ha redactado recientemente unas guías sobre estos temas10,11. Esta guía no incluye información detallada sobre temas tratados en otras guías de la ESC, las recomendaciones de la ESC Association/Grupos de Trabajo, declaraciones de posicionamiento y documentos de consenso de expertos o los capítulos específicos del «Tratado de Medicina Cardiovascular» de la ESC12.
Cómo usar esta guíaEl GPC hace hincapié en el hecho de que son muchos los factores que determinan, en último término, el tratamiento más adecuado de cada paciente en una comunidad determinada. Estos factores incluyen la disponibilidad de equipos diagnósticos, la experiencia de los cardiólogos intervencionistas y de los cirujanos, sobre todo en el campo de la reparación valvular y en las intervenciones percutáneas, y especialmente lo que los pacientes bien informados desean. Además, debido a la escasez de datos basados en la evidencia en el área de las valvulopatías, la mayor parte de las recomendaciones se basan en la opinión consensuada de expertos. Por lo tanto, en algunas circunstancias clínicas puede ser adecuado desviarse de las recomendaciones de esta guía.
COMENTARIOS GENERALESLa toma de decisiones debe ser responsabilidad de un equipo cardiovascular (heart team) con experiencia en valvulopatías, que incluya a cardiólogos, cirujanos cardiacos, especialistas en imagen cardiaca, anestesistas y, si fuera necesario, médicos generales, geriatras o intensivistas. Esta estrategia interdisciplinaria es especialmente recomendable en el manejo de pacientes de alto riesgo, aunque también es importante en otros subgrupos, como los pacientes asintomáticos, en los que la evaluación de la posibilidad de reparación valvular es un elemento clave para la toma de decisiones.
El proceso de toma de decisiones puede resumirse según la estrategia descrita en la tabla 3.
Preguntas esenciales en la evaluación de un paciente para una intervención valvular
| • ¿La valvulopatía es grave? |
| • ¿El paciente tiene síntomas? |
| • ¿Los síntomas están relacionados con la valvulopatía? |
| • ¿Qué esperanza de vida* tiene el paciente y cuál es la calidad de vida esperada? |
| • ¿Los beneficios esperados de la intervención (comparados con la evolución espontánea) superan los riesgos? |
| • ¿Cuál es la voluntad del paciente? |
| • ¿Los recursos del centro son óptimos para la intervención planificada? |
Por último, las indicaciones para una intervención, así como para la elección del tipo de intervención, deben basarse en la evaluación
comparativa del pronóstico espontáneo y los resultados de la intervención de acuerdo con las características de la valvulopatía y las comorbilidades.
Evaluación del pacienteEvaluación clínicaEl objetivo de analizar la historia clínica de cada caso es evaluar los síntomas y buscar comorbilidades asociadas. Se interroga al paciente sobre su estilo de vida para detectar cambios progresivos en su actividad diaria y así poder limitar la subjetividad en el análisis de los síntomas, sobre todo en pacientes ancianos. En las enfermedades crónicas, debemos tener en cuenta la adaptación del paciente a los síntomas. La aparición de síntomas suele indicar la necesidad de intervención. Los pacientes que no refieren síntomas en el momento de la evaluación pero que han sido tratados anteriormente por IC deben ser considerados sintomáticos. La causa y el grado de limitación funcional deben quedar documentados en la historia clínica. En presencia de comorbilidades, es importante considerar la causa de los síntomas.
Interrogar al paciente es importante también para comprobar la calidad del seguimiento y la eficacia de la profilaxis de la endocarditis y, cuando corresponda, de la fiebre reumática. En pacientes que están recibiendo un tratamiento anticoagulante crónico, es necesario evaluar la adherencia al tratamiento y comprobar la presencia de tromboembolias o hemorragias.
La exploración clínica desempeña un papel muy importante en la detección de valvulopatías en pacientes asintomáticos. Es la primera etapa del diagnóstico definitivo de valvulopatía y la evaluación de su gravedad, en la que es preciso tener en cuenta que la presencia de un soplo de baja intensidad puede coexistir con una valvulopatía grave, especialmente en presencia de IC. En pacientes con prótesis valvular es necesario vigilar la aparición de cualquier cambio en el soplo o de ruidos protésicos.
Se suele realizar un electrocardiograma (ECG) y una radiografía de tórax junto con la exploración clínica. Además del aumento del tamaño cardiaco, para interpretar la disnea o los signos clínicos de IC, puede ser útil el análisis de la vascularización pulmonar al realizar la radiografía de tórax13.
EcocardiografíaLa ecocardiografía es la técnica clave para confirmar el diagnóstico de una valvulopatía, así como para evaluar su gravedad y su pronóstico. El examen ecocardiográfico debe ser realizado e interpretado por personal adecuadamente entrenado14. Está indicado en cualquier paciente que tenga un soplo, excepto cuando tras la evaluación clínica no haya sospecha de valvulopatía.
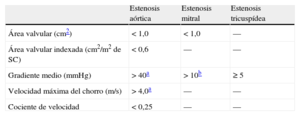
La evaluación de la gravedad (o “severidad”) estenótica debe combinar la determinación del área valvular y los índices dependientes del flujo, como el gradiente medio y la velocidad máxima de flujo (tabla 4)15. Los índices dependientes del flujo aportan información adicional y tienen valor pronóstico.
Criterios ecocardiográficos para la definición de la estenosis valvular grave: un enfoque integral
| Estenosis aórtica | Estenosis mitral | Estenosis tricuspídea | |
| Área valvular (cm2) | < 1,0 | < 1,0 | — |
| Área valvular indexada (cm2/m2 de SC) | < 0,6 | — | — |
| Gradiente medio (mmHg) | > 40a | > 10b | ≥ 5 |
| Velocidad máxima del chorro (m/s) | > 4,0a | — | — |
| Cociente de velocidad | < 0,25 | — | — |
SC: superficie corporal.
Adaptado de Baumgartner el al15.
En la evaluación de la insuficiencia valvular se debe combinar diferentes índices que incluyan mediciones cuantitativas, como la anchura de la vena contracta y el área del orificio regurgitante efectivo (ORE), que son menos dependientes de las condiciones de flujo que el tamaño del chorro en Doppler color (tabla 5)16,17. No obstante, todas las evaluaciones cuantitativas tienen limitaciones, particularmente porque combinan diversas mediciones y son muy sensibles a errores de medición; además, son muy dependientes del operador, por lo que su uso requiere experiencia y la integración de varias mediciones en lugar de un parámetro único.
Criterios ecocardiográficos para la definición de la insuficiencia valvular grave: un enfoque integral
| Insuficiencia aórtica | Insuficiencia mitral | Insuficiencia tricuspídea | ||
| Criterios cualitativos | ||||
| Morfología valvular | Defecto de coaptación grande, anormal, flail | Defecto de coaptación grande, flail de valvas, rotura de músculo papilar | Defecto de coaptación grande, anormal, flail | |
| Chorro regurgitante con Doppler color | Grande en chorros centrales, variable en los excéntricosa | Chorro central o excéntrico muy grande que se adhiere, se arremolina y alcanza la pared posterior de la AI | Chorro central o excéntrico muy grande que afecta a la pareda | |
| Señal de DC de chorro regurgitante | Densa | Densa/triangular | Densa/triangular con pico prematuro (pico < 2 m/s en IT masiva) | |
| Otros | Inversión holodiastólica del flujo en la aorta descendente (VTD > 20 cm) | Zona de convergencia de flujo de gran tamañoa | — | |
| Criterios semicuantitativos | ||||
| Anchura de la vena contracta (mm) | > 6 | ≥ 7 (> 8 para biplano)b | ≥ 7a | |
| Flujo venoso reversoc | — | Inversión sistólica en venas pulmonares | Inversión sistólica en venas hepáticas | |
| Flujo de entrada | — | Onda E dominante ≥ 1,5 m/sd | Onda E dominante ≥ 1 m/se | |
| Otros | Tiempo de hemipresión < 200 msf | ITV mitral/ITV aórtica > 1,4 | Radio PISA > 9 mmg | |
| Criterios cuantitativos | Primarios | Secundariosh | ||
| ORE (mm2) | ≥ 30 | ≥ 40 | ≥ 20 | ≥ 40 |
| Vol R (ml/latido) | ≥ 60 | ≥60 | ≥ 30 | ≥ 45 |
| + agrandamiento de cámaras/vasos cardiacos | VI | VI, AI | VD, AD, vena cava inferior | |
AD: aurícula derecha; AI: aurícula izquierda; IT: insuficiencia tricuspídea; ITV: integral tiempo – velocidad; DC: Doppler continuoua; ORE: área del orificio regurgitante efectivo;
VD: ventrículo derecho; VI: ventrículo izquierdo; Vol R: volumen de regurgitación; VTD: velocidad telediastólica.
Adaptado de Lancellotti el al16,17.
Para la media entre la proyección apical de cuatro cámaras y la de dos.
cExcepto cuando haya otras razones para el blunting sistólico (fibrilación auricular, presión auricular elevada).
Así pues, cuando se evalúa la gravedad de una valvulopatía, es necesario comprobar la concordancia entre los distintos parámetros ecocardiográficos, además de la anatomía y los mecanismos de la enfermedad. También es necesario comprobar la concordancia con la evaluación clínica.
La ecocardiografía debe incluir una evaluación exhaustiva de todas las válvulas en búsqueda de cualquier enfermedad valvular asociada o de la aorta.
Los índices de dilatación y función del ventrículo izquierdo (VI) son factores pronósticos importantes. Aunque la medición de diámetros ofrece una evaluación menos completa del tamaño del VI que los volúmenes, su valor pronóstico se ha estudiado más extensamente. Las dimensiones del VI deben ser indexadas respecto a la superficie corporal (SC). El uso de valores indexados es particularmente interesante en pacientes con una SC pequeña, pero debe evitarse en pacientes con obesidad mórbida (índice de masa corporal [IMC] > 40). Los índices derivados del Doppler tisular y del cálculo del strain pueden ser interesantes para la detección precoz de alteraciones de la función del VI, pero su valor pronóstico para las variables clínicas no se ha validado.
Por último, se debe evaluar también las presiones pulmonares, así como la función del ventrículo derecho (VD)18.
La ecocardiografía tridimensional (E3D) es una técnica útil para la evaluación de la anatomía valvular, la cual puede influir en la selección del tipo de intervención, especialmente cuando se trata de la válvula mitral19.
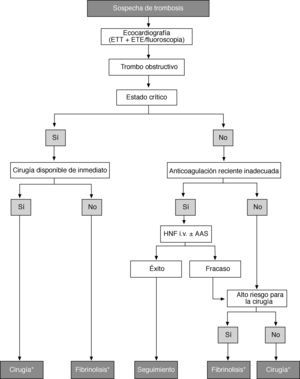
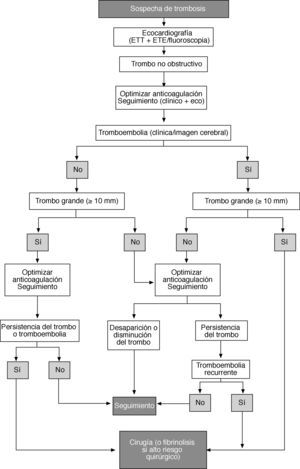
Debe considerarse la ecocardiografía transesofágica (ETE) cuando la ecocardiografía transtorácica (ETT) sea de calidad subóptima o cuando se sospeche de trombosis, disfunción protésica o endocarditis. La ETE intraoperatoria permite monitorizar los resultados de la reparación valvular o los procedimientos percutáneos.
Durante las intervenciones de reparación valvular, es imprescindible el uso de ETE intraoperatoria y de alta calidad. Comparada con laCriterios ecocardiográficos para la definición de la insuficiencia valvular grave: un enfoque integral
ecocardiografía bidimensional, la ETE tridimensional permite un examen más exhaustivo de la anatomía valvular y es una herramienta útil para evaluar problemas valvulares complejos y monitorizar intervenciones quirúrgicas o percutáneas.
Otras pruebas no invasivasPruebas de esfuerzoLas pruebas de esfuerzo se tratan aquí en relación con las valvulopatías y/o sus consecuencias, pero no para el diagnóstico de la EC asociada. Los valores predictivos de las pruebas de capacidad funcional utilizadas para el diagnóstico de la EC pueden no ser aplicables en presencia de valvulopatía, y por lo general no se utilizan en este contexto20.
Electrocardiograma de esfuerzoEl objetivo principal de las pruebas de esfuerzo es desenmascarar la aparición de síntomas objetivos en pacientes que se consideran asintomáticos o que tienen síntomas dudosos. Las pruebas de esfuerzo tienen un valor adicional para la estratificación del riesgo en la estenosis aórtica (EA)21. Las pruebas de esfuerzo sirven también para determinar el grado de actividad física autorizado, incluida la participación en deportes.
Ecocardiografía de esfuerzoLa ecocardiografía de esfuerzo puede aportar información adicional para una mejor identificación del origen cardiaco de la disnea, la cual es un síntoma poco específico, mostrando, por ejemplo, un aumento en los gradientes de insuficiencia mitral/aórtica y en las presiones sistólicas pulmonares. Tiene un valor diagnóstico en la IM isquémica transitoria, que puede no ser detectada en las pruebas en reposo. El impacto pronóstico de la ecocardiografía de esfuerzo se ha observado principalmente en la EA y en la IM. No obstante, esta técnica no está disponible de manera generalizada, puede presentar dificultades técnicas y requiere experiencia.
Otras pruebas de estrésLa determinación de la reserva de flujo (también llamada reserva contráctil) mediante ecocardiografía de estrés con dosis bajas de dobutamina es útil para la evaluación de la gravedad y la estratificación del riesgo operatorio en la EA con función del VI alterada y gradiente bajo22.
Resonancia magnética cardiacaEn pacientes con una ventana ecocardiográfica inadecuada o con resultados discrepantes, debe utilizarse la resonancia magnética cardiaca (RMC) para evaluar la gravedad de las lesiones valvulares, espe-cialmente en el caso de lesiones regurgitantes, y para determinar los volúmenes y la función sistólica ventriculares, ya que la RMC permite evaluar estos parámetros con mayor reproducibilidad que la ecocardiografía23.
La RMC es el método de referencia para la evaluación de los volúmenes y la función del VD, por lo que es útil para evaluar las consecuencias de la insuficiencia triscupídea (IT). En la práctica clínica, el uso sistemático de la RMC está limitado por su escasa disponibilidad, comparada con la de la ecocardiografía.
Tomografía computarizadaLa tomografía computarizada multicorte (TCMC) puede contribuir a la evaluación de la gravedad de la valvulopatía, particularmente en la EA, ya sea de forma indirecta mediante la cuantificación de la calcificación valvular o directamente por las mediciones de la planimetría valvular24,25. Esta técnica se utiliza ampliamente para valorar la gravedad y la localización de aneurismas en la aorta ascendente. Debido a su alto valor predictivo negativo, la TCMC puede ayudar a descartar la EC en pacientes con bajo riesgo de aterosclerosis25. La TCMC tiene un papel importante en la preparación de los pacientes de alto riesgo con EA considerados para la implantación transcatéter de válvula aórtica (TAVI)26,27. No obstante, debe tenerse en cuenta el riesgo de exposición a la radiación y de insuficiencia renal producida por el uso de contraste.
Ambas técnicas, RMC y TCMC, requieren la participación de radiólogos y cardiólogos con experiencia específica en valvulopatías y técnicas de imagen cardiaca28.
FluoroscopiaLa fluoroscopia es una técnica más específica que la ecocardiografía para la evaluación de la calcificación valvular o anular. También es útil para evaluar la cinética de los dispositivos oclusores de las prótesis mecánicas.
Angiografía con radionúclidosLa angiografía con radionúclidos proporciona una evaluación fiable y reproducible de la fracción de eyección del VI (FEVI) de pacientes que se encuentran en ritmo sinusal. Se puede realizar si la FEVI tiene un papel importante en la toma de decisiones médicas, especialmente en pacientes asintomáticos con insuficiencia valvular.
BiomarcadoresSe ha demostrado que la concentración sérica de péptido natriurético tipo B está relacionada con la clase funcional y el pronóstico, especialmente en la estenosis aórtica y la IM29. Sin embargo, los datos que demuestran su valor incremental en la estratificación del riesgo siguen siendo escasos.
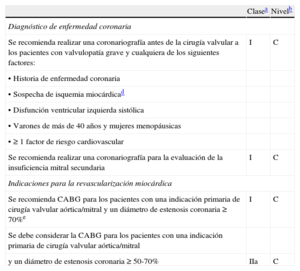
Pruebas invasivasCoronariografíaLa coronariografía está ampliamente indicada para detectar enfermedad arterial coronaria concomitante cuando se programa una intervención quirúrgica (tabla 6)20. El conocimiento de la anatomía coronaria mejora la estratificación del riesgo y determina si está indicada la revascularización coronaria con cirugía valvular.
Tratamiento de la enfermedad coronaria en pacientes con valvulopatías
| Clasea | Nivelb | |
| Diagnóstico de enfermedad coronaria | ||
| Se recomienda realizar una coronariografía antes de la cirugía valvular a los pacientes con valvulopatía grave y cualquiera de los siguientes factores: | I | C |
| • Historia de enfermedad coronaria | ||
| • Sospecha de isquemia miocárdicad | ||
| • Disfunción ventricular izquierda sistólica | ||
| • Varones de más de 40 años y mujeres menopáusicas | ||
| • ≥ 1 factor de riesgo cardiovascular | ||
| Se recomienda realizar una coronariografía para la evaluación de la insuficiencia mitral secundaria | I | C |
| Indicaciones para la revascularización miocárdica | ||
| Se recomienda CABG para los pacientes con una indicación primaria de cirugía valvular aórtica/mitral y un diámetro de estenosis coronaria ≥ 70%e | I | C |
| Se debe considerar la CABG para los pacientes con una indicación primaria de cirugía valvular aórtica/mitral | ||
| y un diámetro de estenosis coronaria ≥ 50-70% | IIa | C |
CABG: cirugía de revascularización coronaria.
La coronariografía puede omitirse en pacientes jóvenes que no tengan factores de riesgo (varones de edad < 40 años y mujeres premenopáusicas) y en circunstancias particulares cuando su riesgo sea mayor que el beneficio, por ejemplo en la disección aórtica aguda, cuando hay una vegetación aórtica grande delante del ostium coronario o cuando hay trombosis protésica oclusiva que produce inestabilidad hemodinámica.
Cateterización cardiacaLa determinación de las presiones y el gasto cardiaco o la realización de una ventriculografía o una aortografía deben restringirse a situaciones en que la evaluación no invasiva no es concluyente o es discordante con los hallazgos clínicos. Debido a sus riesgos potenciales, el cateterismo cardiaco no debe asociarse sistemáticamente a la coronariografía para la evaluación del estado hemodinámico.
Evaluación de comorbilidadesLa elección de pruebas específicas para evaluar las comorbilidades se decide mediante la evaluación clínica. Las comorbilidades que se encuentran con más frecuencia son la aterosclerosis periférica, la insuficiencia renal y hepática y la enfermedad pulmonar obstructiva crónica. La utilización de sistemas de clasificación (scores) específicos y validados permite evaluar las capacidades cognitivas y funcionales, que tienen importantes implicaciones pronósticas en los ancianos. En este contexto, la experiencia de especialistas en geriatría es muy útil.
Profilaxis de la endocarditisLa indicación de profilaxis antibiótica se ha reducido de forma importante en las guías recientes de la ESC10. La profilaxis con antibióticos debe considerarse para procedimientos de alto riesgo en pacientes de alto riesgo, como pacientes con válvulas protésicas o material protésico utilizado en la reparación valvular, o pacientes con historia de endocarditis o enfermedad cardiaca congénita, de acuerdo con lo establecido en las actuales guías de práctica clínica de la ESC. No obstante, las medidas de prevención de la endocarditis, como buena higiene oral y medidas asépticas durante la manipulación de catéteres o en cualquier procedimiento intervencionista, siguen siendo importantes para todos los pacientes con valvulopatía para reducir la incidencia de la endocarditis infecciosa asociada a procedimientos médicos.
Profilaxis de la fiebre reumáticaPara pacientes con cardiopatía reumática, se recomienda profilaxis de fiebre reumática a largo plazo, prescribiendo penicilina durante al menos 10 años desde el último episodio agudo de fiebre reumática o hasta los 40 años de edad, dependiendo de cuál sea el periodo más largo. La profilaxis durante toda la vida debe considerarse para pacientes de alto riesgo de acuerdo con la gravedad de la valvulopatía y la exposición a Streptococcus del grupo A30.
Estratificación del riesgoEn varios registros realizados en distintas partes del mundo, se ha demostrado de forma consistente que en la práctica clínica habitual las intervenciones terapéuticas para la valvulopatía están infrautilizadas en pacientes sintomáticos de alto riesgo, por razones que generalmente no están justificadas. Este hecho subraya la importancia de realizar en general una cuidadosa estratificación del riesgo31.
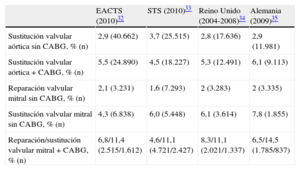
En ausencia de pruebas científicas obtenidas a partir ensayos clínicos aleatorizados, la decisión de intervenir a un paciente con una valvulopatía se basa en un análisis individual del riesgo-beneficio que indique que la mejoría del pronóstico, comparada con la historia natural de la enfermedad, compensa los riesgos de la intervención (tabla 7) y sus potenciales consecuencias a largo plazo, en particular las complicaciones relacionadas con las prótesis32–35.
Mortalidad operatoria tras la cirugía valvular
| EACTS (2010)32 | STS (2010)33 | Reino Unido (2004-2008)34 | Alemania (2009)35 | |
| Sustitución valvular aórtica sin CABG, % (n) | 2,9 (40.662) | 3,7 (25.515) | 2,8 (17.636) | 2,9 (11.981) |
| Sustitución valvular aórtica + CABG, % (n) | 5,5 (24.890) | 4,5 (18.227) | 5,3 (12.491) | 6,1 (9.113) |
| Reparación valvular mitral sin CABG, % (n) | 2,1 (3.231) | 1,6 (7.293) | 2 (3.283) | 2 (3.335) |
| Sustitución valvular mitral sin CABG, % (n) | 4,3 (6.838) | 6,0 (5.448) | 6,1 (3.614) | 7,8 (1.855) |
| Reparación/sustitución valvular mitral + CABG, % (n) | 6,8/11,4 (2.515/1.612) | 4,6/11,1 (4.721/2.427) | 8,3/11,1 (2.021/1.337) | 6,5/14,5 (1.785/837) |
CABG: cirugía de revascularización coronaria; EACTS: Asociación Europea de Cirugía Cardiotorácica; STS: Sociedad de Cirujanos Torácicos (Estados Unidos).
La mortalidad en STS incluye primera intervención y reintervención.
La mortalidad operatoria puede estimarse mediante varios sistemas de escalas multivariables en los que se combinan distintos factores de riesgo36. Los sistemas más utilizados son el EuroSCORE (European System for Cardiac Operative Risk Evaluation: www.euroscore.org/calc.html) y el sistema STS (Society of Thoracic Surgeons: http://209.220.160.181/STSWebRiskCalc261/), que tiene la ventaja de estar diseñado específicamente para valvulopatías, aunque para el usuario es menos sencillo de utilizar que el EuroSCORE. Se han desarrollado otros sistemas de escalas de riesgo específicas para las valvulopatías37,38; algunas proporcionan una discriminación relativamente buena (para diferenciar entre pacientes de alto y bajo riesgo), pero carecen de precisión para la estimación de la mortalidad operatoria de cada paciente, debido a una calibración inadecuada (diferencia entre el riesgo esperado y el observado)39. La calibración es deficiente en los pacientes de alto riesgo, en particular con el sistema Logistic EuroSCORE, por una sobrestimación del riesgo operatorio40,41. Esto subraya la importancia de no basarse en un solo número para establecer el riesgo de un paciente o determinar incondicionalmente la indicación y el tipo de intervención. La capacidad predictiva de las escalas de riesgo puede mejorarse de la siguiente forma: recalibrando las escalas según pasa el tiempo, como es el caso del STS y el EuroSCORE con el EuroSCORE II —en el que se han incorporado nuevas variables, en particular índices para valorar la capacidad funcional y cognitiva del paciente anciano y su fragilidad—, y diseñando escalas de riesgo diferenciadas para subgrupos específicos, como los pacientes ancianos o que van a someterse a cirugía valvular y coronaria combinadas42.
De igual modo, se debe desarrollar sistemas de riesgo específicos para predecir la evolución de los pacientes tras las intervenciones valvulares transcatéter.
Idealmente, la historia natural de las valvulopatías debe derivarse de series actuales, pero, en el contexto de esta enfermedad, no disponemos de sistemas de riesgo. Algunas escalas de riesgo validadas permiten estimar la expectativa de vida de un paciente según edad, comorbilidades e índices de capacidad funcional y cognitiva43. La calidad de vida esperada es otro aspecto que tener en consideración.
También hay que tener en cuenta los recursos locales, en particular la disponibilidad de reparación valvular y los resultados de la cirugía cardiaca y las intervenciones percutáneas de cada centro específico44. Dependiendo de la experiencia del centro, debe considerarse la transferencia del paciente a un centro más especializado en caso de procedimientos como una reparación valvular compleja45.
Por último, las decisiones clínicas deben tomarse en un proceso compartido. Primero el equipo multidisciplinario (heart team) discute el caso, después se informa en profundidad al paciente y, por último, se decide con el paciente y su familia cuál es la opción de tratamiento más adecuada46.
Manejo de entidades asociadasEnfermedad coronariaSe desaconseja la realización de pruebas de estrés para la detección de EC asociada a valvulopatía grave debido a su pobre valor diagnóstico y sus riesgos potenciales.
El manejo de la EC asociada aparece resumido en la tabla 6 y se trata en profundidad en las guías de práctica clínica específicas20.
ArritmiasSe recomienda el tratamiento con anticoagulantes orales para una razón internacional normalizada (INR) de 2-3 en pacientes con enfermedad en válvula nativa y cualquier tipo de fibrilación auricular (FA), siempre teniendo en cuenta el riesgo de hemorragias47. En algunos pacientes con válvulas protésicas, puede ser necesario un nivel más alto de anticoagulación (véase la sección 11). No se recomienda la sustitución de los antagonistas de la vitamina K (AVK) por nuevos agentes farmacológicos debido a la ausencia de ensayos clínicos específicos sobre pacientes con valvulopatías. A excepción de los casos en que la FA cause deterioro hemodinámico, la cardioversión no está indicada antes de la operación para pacientes con valvulopatía grave debido a que la cardioversión no restaura el ritmo sinusal de modo duradero. La cardioversión debe intentarse poco después de una intervención exitosa, excepto en los casos de FA crónica de larga evolución.
En pacientes programados para cirugía valvular, debe considerarse la ablación quirúrgica en pacientes con FA sintomática y se puede considerar también en los asintomáticos siempre que sea posible realizarla con un riesgo mínimo47. La decisión debe tomarse de individualizadamente según variables clínicas como edad, duración de la FA y tamaño de la aurícula izquierda (AI).
La evidencia científica disponible no respalda el tratamiento quirúrgico sistemático para el cierre de la orejuela izquierda, excepto cuando forme parte de una intervención quirúrgica de ablación de la FA.
INSUFICIENCIA AÓRTICALa insuficiencia aórtica (IA) puede estar causada por enfermedad de las valvas aórticas y/o anomalías en la geometría de la raíz aórtica, cuya incidencia en pacientes operados por IA pura está aumentando en los países occidentales. Las anomalías congénitas, especialmente relacionadas con la morfología de la válvula bicúspide, ocupan el segundo lugar1,12,48. El análisis del mecanismo de la IA es importante para el manejo del paciente, particularmente cuando se considere la cirugía de reparación valvular.
EvaluaciónLa exploración inicial debe incluir una evaluación clínica detallada. La IA se diagnostica por la presencia de un soplo diastólico con unas características determinadas. La amplitud exagerada del pulso arterial y la baja presión diastólica representan los primeros y más importantes signos clínicos para cuantificarla. Los signos periféricos están atenuados en la IA aguda, lo que contrasta con la escasa tolerancia funcional12.
Los principios generales para el uso de evaluaciones invasivas y no invasivas se basan en las recomendaciones expuestas en la sección 3.
A continuación se exponen los aspectos específicos de la IA:
- •
La ecocardiografía es la técnica clave para el diagnóstico y la cuantificación de la gravedad de la IA, utilizando Doppler color (fundamentalmente en vena contracta) y Doppler de onda continua (reversibilidad del flujo diastólico en la aorta descendente)16,49. La ecocardiografía Doppler cuantitativa, mediante el análisis del área de isovelocidad proximal, es menos sensible a las condiciones de carga, y su uso está menos establecido que en la IM, por lo que no se utiliza habitualmente en este contexto50. Los criterios para definir la IA grave se describen en la tabla 5. La ecocardiografía también es importante para evaluar los mecanismos de la insuficiencia, describir la anatomía valvular y determinar la factibilidad de la reparación valvular16,49. Se debe realizar mediciones de la aorta en cuatro zonas diferentes: anillo, senos de Valsalva, unión sinotubular y aorta ascendente51. Se debe indexar los diámetros aórticos según la SC de los sujetos con pequeño tamaño corporal. Un aneurisma/dilatación en la aorta ascendente, particularmente a nivel sinotubular, puede causar IA secundaria52. Si se considera la realización de cirugía de reparación valvular o preservación valvular, puede realizarse ETE en el preoperatorio para definir la anatomía de las cúspides y de la aorta ascendente. En la cirugía de reparación valvular aórtica, la ETE es imprescindible para evaluar los resultados funcionales e identificar a los pacientes con riesgo de recurrencia temprana de la IA53. Es esencial determinar la función y las dimensiones del VI. Se recomienda la indexación de estos valores según la SC, especialmente en pacientes de pequeño tamaño corporal (SC ≤ 1,68 m2)54. Los nuevos parámetros obtenidos mediante E3D, Doppler tisular y cálculo del strain pueden ser útiles en el futuro55.
- •
Se recomienda obtener imágenes por RM o TCMC para la evaluación de la aorta en pacientes con síndrome de Marfan o cuando se detecte un aumento de la aorta en la ecocardiografía, especialmente en pacientes con válvulas aórticas bicúspides56.
Los pacientes con IA aguda grave, cuya causa más frecuente es la endocarditis infecciosa y disección aórtica, tienen mal pronóstico sin intervención, debido a su inestabilidad hemodinámica. Los pacientes con IA crónica grave y síntomas también tienen mal pronóstico a largo plazo. Una vez se presentan los síntomas, la mortalidad entre los pacientes no intervenidos puede alcanzar un 10-20% anual57. En pacientes asintomáticos con IA grave crónica y función del VI normal, la posibilidad de complicaciones graves es baja. Sin embargo, cuando el diámetro telesistólico del ventrículo izquierdo (DTSVI) es > 50mm, la probabilidad de muerte, síntomas o disfunción del VI es del 19% anual57–59.
La historia natural del aneurisma de aorta ascendente y de raíz aórtica se ha estudiado sobre todo en pacientes con síndrome de Marfan60. Los más potentes predictores de muerte o complicaciones aórticas son el diámetro de la raíz aórtica y la historia familiar de complicaciones cardiovasculares agudas (disección aórtica, muerte súbita cardiaca)61. En el caso de pacientes con otros síndromes sistémicos asociados a la dilatación de la aorta ascendente, no se ha establecido con claridad su tratamiento, aunque parece razonable presumir un pronóstico similar al de los pacientes con síndrome de Marfan y tratarlos en consecuencia. Por lo general, se creía que los pacientes con válvulas aórticas bicúspides tenían mayor riesgo de disección. La evidencia científica más reciente indica que este riesgo puede estar relacionado con la alta prevalencia de dilatación de la aorta ascendente62. Sin embargo, y a pesar de la mayor tasa de crecimiento del diámetro aórtico, actualmente no está claro que haya un aumento de riesgo de complicaciones aórticas respecto a los pacientes con válvula aórtica tricúspide de tamaño aórtico similar63,64.
Resultados de la cirugíaEl tratamiento de la IA aislada ha sido tradicionalmente el reemplazo de la válvula. En los últimos veinte años se han desarrollado técnicas de reparación de válvula aórtica regurgitante para válvulas aórticas tricúspides y anomalías congénitas65–67. Cuando concurre un aneurisma de la raíz aórtica, el tratamiento quirúrgico convencional consiste en el reemplazo de la aorta y la válvula con reimplantación de las arterias coronarias. Las intervenciones de preservación de válvula aórtica se utilizan cada vez más en centros especializados, particularmente en pacientes jóvenes, para tratar al mismo tiempo la dilatación de la raíz aórtica y la regurgitación valvular65–67.
El recambio supracoronario de la aorta ascendente puede realizarse con/sin reparación valvular cuando el tamaño de la raíz está preservado67. El reemplazo valvular aórtico con autoinjerto pulmonar es menos frecuente y se utiliza mayormente en pacientes jóvenes (< 30 años)68.
En la práctica diaria, el reemplazo valvular sigue siendo la técnica más utilizada, pero el porcentaje de intervenciones de reparación valvular está aumentando en los centros con experiencia. La calcificación y la retracción de los bordes de las cúspides parecen ser los principales factores adversos para los procedimientos de reparación. En la cirugía valvular aórtica, la mortalidad operatoria es baja (1-4%), tanto con procedimientos de reemplazo como con los de reparación32–35,66. La mortalidad se incrementa con la edad avanzada, la función del VI alterada y la necesidad de cirugía de revascularización coronaria (CABG) concomitante, en que alcanza un 3-7%32–35. Los más potentes predictores de mortalidad operatoria son la edad avanzada, una clase funcional preoperatoria alta, una FEVI < 50% y un DTSVI > 50mm. En términos generales, la cirugía de raíz aórtica con reimplantación de arterias coronarias se asocia con una mortalidad ligeramente más elevada que la cirugía valvular aislada. En individuos jóvenes, el tratamiento combinado de aneurisma de aorta ascendente con reemplazo o preservación valvular puede realizarse en centros especializados con muy bajas tasas de mortalidad66,67. La mortalidad aumenta en los
procedimientos urgentes por disección aguda. Tanto las prótesis biológicas como las mecánicas se asocian con riesgo de complicaciones a largo plazo relacionadas con la válvula (véase la sección 11).
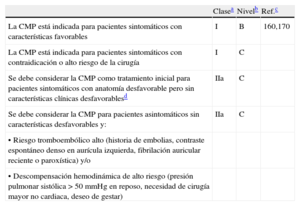
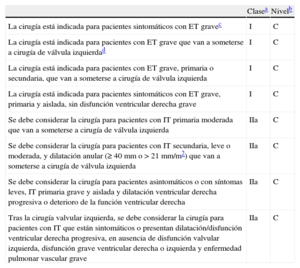
Indicaciones para cirugíaEn pacientes con IA aguda, sintomática y grave, está indicado el tratamiento quirúrgico urgente/emergente.
En los casos de IA crónica grave, los objetivos del tratamiento son prevenir la muerte, disminuir los síntomas, prevenir el desarrollo de IC y evitar complicaciones aórticas en pacientes con aneurisma aórtico69.
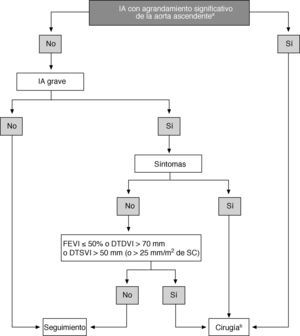
A continuación se exponen las indicaciones quirúrgicas recomendadas con base en evidencia científica robusta derivada de datos observacionales (tablas 8A y B; fig. 1):
- •
La aparición de síntomas es una indicación de cirugía en pacientes con IA grave. También debe realizarse cirugía en pacientes con disfunción del VI o una marcada dilatación del VI, una vez descartadas otras causas posibles. Aunque en estos pacientes la evolución postoperatoria es peor que en los pacientes operados en estadios más tempranos, se puede obtener una mortalidad operatoria aceptable, una mejoría de los síntomas y una supervivencia a largo plazo aceptable48,70,71.
- •
La cirugía también está indicada para pacientes asintomáticos con IA grave y función del VI alterada (FE < 50%), y debe considerarse si el diámetro telediastólico del VI (DTDVI) es > 70mm o el DTSVI es > 50mm (o > 25mm/m2 de SC en pacientes de talla pequeña), ya que la probabilidad de desarrollar una disfunción miocárdica irreversible es alta si se retrasa la intervención y los resultados clínicos postoperatorios son excelentes cuando la cirugía se realiza sin demora. Para pacientes asintomáticos, se recomienda realizar técnicas de imagen de calidad y confirmar los datos mediante la repetición de determinaciones antes de la cirugía. Un empeoramiento rápido de los parámetros ventriculares determinados en pruebas seriadas es otra razón para considerar la cirugía.
- •
Las razones para indicar cirugía para pacientes con dilatación en raíz y aorta ascendente están mejor definidas en los pacientes con síndrome de Marfan. En los casos dudosos, debe tenerse en cuenta la historia individual y familiar, la edad del paciente y los riesgos de la intervención previstos. En pacientes con síndrome de Marfan, la cirugía debe realizarse con menor grado de dilatación (≥ 50mm). En guías anteriores se consideraba la cirugía cuando el diámetro aórtico era > 45mm. Los fundamentos de esta estrategia agresiva no están justificados por la evidencia clínica en todos los pacientes. Sin embargo, en presencia de factores de riesgo (historia familiar de disección, aumento del tamaño > 2mm/año determinado en series de pruebas realizadas con la misma técnica y confirmadas por otra, IA grave, intención de gestar), debe considerarse la cirugía con un diámetro de raíz ≥ 45 mm61. En caso de diámetro aórtico de 40-45mm, el crecimiento aórtico previo y una historia familiar de disección son factores importantes que indican que es recomendable desaconsejar el embarazo72. Los pacientes con manifestaciones marfanoides debidas a enfermedad del tejido conectivo pero que no presentan todos los criterios del síndrome deben ser tratados como pacientes con síndrome de Marfan. En sujetos con válvula aórtica bicúspide, la decisión de considerar la cirugía ante diámetros aórticos ≥ 50mm debe basarse en edad, tamaño corporal, comorbilidades, tipo de cirugía y presencia de otros factores de riesgo (historia familiar, HTA sistémica, coartación de la aorta o aumento del diámetro aórtico > 2mm/año determinado en series de pruebas realizadas con la misma técnica y confirmadas por otra). En otras circunstancias, una dilatación de la raíz aórtica ≥ 55mm es indicación de cirugía independientemente del grado de IA73.
- •
Para pacientes que tienen indicación de cirugía de válvula aórtica se puede usar umbrales más bajos (> 45mm) en caso de cirugía combinada de reemplazo aórtico, según edad, superficie corporal, etiología de la valvulopatía, presencia de válvula aórtica bicúspide, además de la forma y el grosor de la aorta ascendente evaluados intraoperatoriamente74.
- •
También se puede considerar umbrales más bajos de los diámetros aórticos en pacientes de bajo riesgo si la reparación valvular es probable y se realiza en centros con experiencia y con altas tasas de reparación.
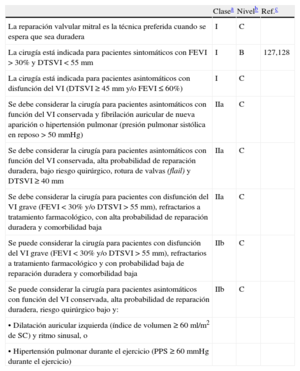
Indicaciones para cirugía en la insuficiencia aórtica grave y la enfermedad de la raíz aórtica (independientemente de la gravedad de la insuficiencia aórtica)
| Clasea | Nivelb | Ref.c | |
| A. Indicaciones para cirugía en la insuficiencia aórtica grave | |||
| La cirugía está indicada para pacientes sintomáticos | I | B | 59 |
| La cirugía está indicada para pacientes asintomáticos con FEVI en reposo ≤ 50% | I | B | 71 |
| La cirugía está indicada para pacientes que van someterse a CABG o cirugía de la aorta ascendente o de otra válvula | I | C | |
| Se debe considerar la cirugía para pacientes asintomáticos con FE > 50% y gran dilatación del VI: DTDVI > 70 mm o DTSVI > 50 mm | |||
| o DTSVI > 25 mm/m2 de SCd | IIa | C | |
| B. Indicaciones para cirugía en la enfermedad de la raíz aórtica (independientemente de la gravedad de la insuficiencia aórtica) | |||
| La cirugía está indicada para pacientes con enfermedad de la raíz aórtica con diámetro máximoe de la aorta ascendente ≥ 50 mm y síndrome de Marfan | I | C | |
| Se debe considerar la cirugía para pacientes con enfermedad de la raíz aórtica y un diámetro máximo de la aorta ascendente: | IIa | C | |
| • ≥ 45 mm en pacientes con síndrome de Marfan y factores de riesgof | |||
| • ≥ 50 mm en pacientes con válvula bicúspide y factores de riesgog | |||
| • ≥ 55 mm en otros pacientes | |||
CABG: cirugía de revascularización coronaria; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; SC: superficie corporal; VI: ventrículo izquierdo.
En la decisión hay que tener en cuenta también la forma de las distintas partes de la aorta. Se puede utilizar umbrales más bajos para la cirugía combinada de la aorta ascendente en pacientes que tienen una indicación de cirugía valvular aórtica.
Tratamiento de la insuficiencia aórtica. DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; IA: insuficiencia aórtica; SC: superficie corporal.
aConsulte la definición en la tabla 8.
bTambién se debe considerar la cirugía si durante el seguimiento aparecen cambios significativos en el tamaño ventricular izquierdo o aórtico.
La elección del procedimiento quirúrgico debe adaptarse a la experiencia del equipo médico, la presencia de aneurisma en la raíz, las características de las valvas, la esperanza de vida y el estado de anticoagulación deseado.
Tratamiento médicoAntes de la cirugía valvular aórtica se puede usar vasodilatadores y agentes inotrópicos como tratamiento de corta duración para mejorar el estado de los pacientes con IC grave. En pacientes con IA crónica grave e IC, los vasodilatadores (inhibidores de la enzima de conversión de la angiotensina [IECA] o antagonistas de los receptores de la angiotensina II [ARA-II]) son útiles en presencia de HTA, cuando la cirugía esté contraindicada o en caso de persistente disfunción postoperatoria del VI. No está probado el efecto positivo de estos fármacos o los antagonistas de los canales de calcio dihidropiridínicos en pacientes asintomáticos sin HTA para retrasar la cirugía75.
En pacientes con síndrome de Marfan, los bloqueadores beta retrasan el proceso de dilatación de la raíz aórtica y reducen el riesgo de complicaciones aórticas, y se debe considerar su administración antes y después de la cirugía61. Algunos hallazgos preliminares indican que
los ARA-II selectivos tienen un efecto intrínseco en la pared aórtica al preservar las fibras de elastina. El beneficio clínico de este tratamiento se está estudiando en ensayos clínicos actualmente en curso.
Se debe desaconsejar la práctica de ejercicio físico extenuante o deportes de contacto físico, competitivos e isométricos a los pacientes con síndrome de Marfan o con diámetros de la raíz aórtica cercanos al límite del umbral de intervención.
Dado el riesgo familiar de los aneurismas en aorta torácica, el cribado de los familiares de primer grado del caso índice mediante pruebas adecuadas de imagen está indicado en pacientes con síndrome de Marfan y se debe considerar para pacientes con válvulas bicúspides y enfermedad de raíz aórtica.
SeguimientoA los pacientes con IA de leve a moderada, se los puede evaluar anualmente y realizarles una ecocardiografía cada 2 años. Todos los pacientes con IA grave y la función del VI normal deben tener una consulta de seguimiento a los 6 meses del examen inicial. Si el diámetro del VI y/o la FE muestran cambios significativos o se acercan a los valores umbral para intervención, el seguimiento debe continuar a intervalos de 6 meses. En pacientes con parámetros estables, el seguimiento puede realizarse anualmente. A los pacientes con dilatación aórtica y en especial los pacientes con síndrome de Marfan o válvulas bicúspides, se les debe realizar anualmente un estudio ecocardiográfico. Se recomienda la realización de TCMC o preferiblemente RMC cuando no se visualice adecuadamente la zona distal de la aorta ascendente y/o cuando la indicación de cirugía esté basada en la dilatación de la aorta, más que en el tamaño o la función del VI.
Poblaciones especiales de pacientesSi la IA que requiere cirugía concurre con IM grave, se debe operar ambas.
Para pacientes con IA moderada a los que se va a realizar CABG o cirugía de la válvula mitral, la decisión de tratar la válvula aórtica debe basarse en la etiología de la IA, la edad, el empeoramiento de la función del VI y la posibilidad de reparación valvular.
Hay información más detallada sobre los pacientes con síndrome de Marfan en las guías de la ESC sobre enfermedades cardiacas congénitas en el adulto11.
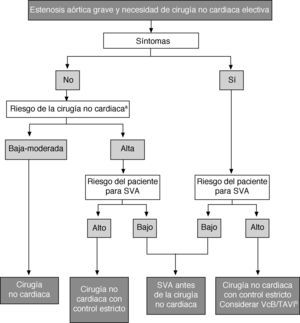
ESTENOSIS AÓRTICALa EA se ha convertido en el tipo más frecuente de valvulopatía en Europa y Norteamérica. Se presenta principalmente como EA calcificada en adultos de edad avanzada (un 2-7% de la población mayor de 65 años)1,2. La segunda etiología más frecuente, que predomina en grupos de menos edad, es la congénita, mientras que la EA reumática hoy es rara. El tratamiento de los pacientes con riesgo quirúrgico alto se ha modificado con la introducción de la TAVI.
EvaluaciónEs esencial interrogar cuidadosamente al paciente para evaluar la presencia de síntomas (disnea de esfuerzo, angina, mareo o síncope) y tomar decisiones sobre el manejo más adecuado teniendo en cuenta que algunos pacientes pueden negar que tengan síntomas, pues reducen significativamente sus actividades sin darse cuenta.
La existencia del característico soplo sistólico llama la atención y sirve de guía para el proceso diagnóstico posterior. Sin embargo, en ocasiones el soplo puede ser tenue y la presentación principal puede ser IC de causa desconocida. La desaparición del segundo ruido aórtico es una característica específica de la EA grave, aunque es un signo poco sensible12.
Los principios generales para el uso de estudios invasivos y no invasivos siguen las recomendaciones que se presentan en la sección 3.
Aspectos específicos de la EA
- •
La ecocardiografía es la herramienta diagnóstica clave. Sirve para confirmar la EA, evaluar el grado de calcificación valvular, la función del VI y el grosor de la pared, detectar otras afecciones en válvulas y aorta asociadas y proporcionar información pronóstica.
La ecocardiografía Doppler es la técnica preferida para evaluar la gravedad de la EA (tabla 4)15.
Los gradientes de presión transvalvular son dependientes de flujo y las mediciones del área valvular representan, desde un punto de vista teórico, la forma ideal de cuantificar la EA. Sin embargo, las mediciones del área valvular dependen del operador y son menos robustas que las estimaciones de gradiente de la práctica clínica. Por lo tanto, la determinación del área valvular con puntos de corte absolutos no debe bastar por sí sola para tomar decisiones clínicas y debe realizarse en combinación con la tasa de flujo, los gradientes de presión, la función y el tamaño del VI y el grosor de la pared, el grado de calcificación de la válvula y la presión sanguínea, así como el estado funcional. Aunque la EA con un área valvular < 1,0cm2 se considera grave, la EA crítica76 es más probable con un área valvular < 0,8cm2. La indexación por superficie corporal, con un valor de corte de 0,6cm2/m2 de SC, puede ser de ayuda, en especial en pacientes con una SC extremadamente pequeña.
La EA grave es poco probable cuando el gasto cardiaco (más concretamente el flujo transvalvular) es normal y hay un gradiente de presión medio < 40mmHg. Sin embargo, en presencia de bajo flujo se puede encontrar gradientes de presión bajos en pacientes con EA grave (EA de bajo flujo/bajo gradiente), aunque la mayoría de los casos presentan gradientes elevados. Hasta ahora, estos hallazgos se han detectado fundamentalmente en pacientes con mala función sistólica del VI. No obstante, cuanto el gradiente medio de presión es
< 40mmHg, un área valvular pequeña no sirve para confirmar definitivamente una EA grave, ya que las válvulas con afección leve-moderada pueden no abrirse por completo, lo que da lugar a un «área valvular funcionalmente pequeña» (EA seudograve)77. En este contexto, la ecocardiografía de estrés con dosis bajas de dobutamina puede servir de ayuda para distinguir una EA verdaderamente grave de la EA seudograve. La EA verdaderamente grave presenta sólo discretos cambios en el área valvular (aumento < 0,2cm2 manteniéndose en < 1cm2) con un aumento de la tasa de flujo, pero con incrementos significativos en los gradientes (gradiente medio > 40mmHg), mientras que la EA seudograve muestra aumentos marcados en el área valvular, pero sólo cambios pequeños en los gradientes22. Además, esta prueba puede detectar la presencia de reserva de flujo, también llamada reserva contráctil (aumento > 20% del volumen latido), la cual tiene implicaciones pronósticas22,78.
Recientemente se ha señalado la posibilidad de que haya EA grave en pacientes con un área valvular < 1,0cm2 y un gradiente medio < 40mmHg a pesar de que la FEVI esté conservada, con lo que se introduce una nueva entidad denominada «EA paradójica de flujo y gradiente bajos (volumen de eyección indexado < 35ml/m2 y gradiente medio < 40mmHg respectivamente) con FEVI preservada»76. Este cuadro se encuentra típicamente en ancianos y se asocia con tamaño ventricular pequeño, marcada hipertrofia del VI e historia de hipertensión. Este subgrupo de pacientes con EA sigue siendo un reto. Se ha demostrado también que los pacientes con un área valvular pequeña pero gradientes bajos pese a conservar una FEVI normal frecuentemente presentan EA moderada79. Hay que reconocer que en muchas ocasiones hay razones distintas de la EA grave para que se produzca esta combinación de medidas: en primer lugar, las determinaciones con Doppler suelen subestimar el flujo, lo cual resulta en subestimación del área valvular y el supuesto erróneo de «condiciones de flujo bajo»15; en segundo, puede tratarse de un paciente con tamaño corporal pequeño15, y por último, los puntos de corte para los gradientes no concuerdan completamente. Se ha demostrado76 que la generación de un gradiente medio de 40mmHg requiere un área valvular más cercana a 0,8 que a 1,0cm2. Por lo tanto, en este contexto el diagnóstico de EA grave requiere excluir previamente otras posibilidades que expliquen los hallazgos ecocardiográficos antes de intervenir. Además de determinaciones ecocardiográficas más precisas, puede ser necesario realizar RMC y cateterismo. Debido a que normalmente estos pacientes son personas de edad avanzada con HTA y otras comorbilidades, su evaluación sigue siendo compleja, incluso después de confirmarse los datos hemodinámicos. La presencia de hipertrofia y fibrosis del VI, así como síntomas o elevación de neurohormonas, puede deberse en parte a la cardiopatía hipertensiva subyacente y no ayuda a confirmar el diagnóstico de EA grave. Por otra parte, no está claro cómo descartar la EA seudograve en estos pacientes. La evaluación del grado de calcificación mediante TCMC puede ser útil24.
En presencia de HTA, se debe reevaluar la gravedad de la enfermedad cuando el paciente alcance valores normotensos15.
La ecocardiografía de estrés puede proporcionar información pronóstica en la EA asintomática mediante el incremento del gradiente medio de presión y los cambios en la función del VI durante el ejercicio21,80,81.
La ETE rara vez sirve de ayuda en la cuantificación de la EA, ya que la planimetría del área valvular resulta muy difícil en válvulas calcificadas15. Sin embargo, esta prueba puede proporcionar información adicional para la evaluación de las anomalías de la válvula mitral y ha cobrado mayor importancia para la evaluación del diámetro anular antes de la TAVI y como guía durante estos procedimientos26,27,82.
- •
La prueba de esfuerzo está contraindicada para pacientes con EA sintomáticos. Sin embargo, está recomendada para pacientes físicamente activos para desenmascarar síntomas y estratificar el riesgo de pacientes asintomáticos con EA grave21,83. Es preciso recordar que la aparición de disnea durante la prueba de esfuerzo es difícil de interpretar y que es un signo no específico en pacientes con un nivel de actividad física bajo, especialmente los ancianos. La prueba de esfuerzo es una prueba segura para pacientes asintomáticos siempre que se realice bajo la supervisión de un médico con experiencia y se monitorice la presencia de síntomas, cambios en la presión sanguínea y/o cambios electrocardiográficos21,83.
- •
La TCMC y la RMC aportan información adicional para la evaluación de la aorta ascendente cuando está dilatada. La TCMC puede ser útil para cuantificar el área valvular y la calcificación coronaria, datos que pueden ser útiles a la hora de valorar el pronóstico. Esta técnica se ha convertido en una importante herramienta diagnóstica para la evaluación de la raíz aórtica, la distribución del calcio, el número de valvas y la aorta ascendente, además permite evaluar la presencia de enfermedad y las dimensiones de las arterias periféricas, lo cual es útil antes de la TAVI26,27. Las mediciones del anillo aórtico obtenidas mediante distintas técnicas de imagen pueden variar dependiendo de la técnica utilizada, por lo que se debe interpretarlas con cautela26. Por esta razón se recomienda seguir una estrategia integradora. La RMC puede ser útil para la detección y cuantificación de fibrosis miocárdica, y proporciona información pronóstica adicional sobre pacientes sintomáticos que no tienen enfermedad coronaria84.
- •
Se ha demostrado que los péptidos natriuréticos pueden predecir la supervivencia libre de síntomas y la evolución de los pacientes con EA con flujo de normal a bajo, y pueden ser útiles en pacientes asintomáticos85–87.
- •
Raramente se requiere una cateterización del VI retrógrada para evaluar la gravedad de la EA, y debe utilizarse únicamente cuando la evaluación no invasiva no sea concluyente.
Por último, en esta población de pacientes es esencial investigar la presencia de comorbilidades.
Historia naturalLa EA calcificada es una enfermedad crónica progresiva. Durante un largo periodo de latencia, los pacientes permanecen asintomáticos88–91. La duración de la fase sintomática varía ampliamente de un sujeto a otro. La muerte súbita cardiaca es una frecuente causa de muerte entre los pacientes sintomáticos, pero sucede rara vez a los pacientes verdaderamente asintomáticos (< 1% anual), incluso en caso de EA grave88–91. En pacientes asintomáticos con EA grave, se han comunicado tasas de supervivencia libre de eventos a 2 años que varían del 20% a más del 50%88–91. Sin embargo, hay que considerar con precaución las estimaciones de supervivencia libre de eventos más bajas, ya que algunos pacientes de esos estudios fueron intervenidos quirúrgicamente sin síntomas.
Se ha identificado y documentado una serie de factores de riesgo asociados a la EA grave. Sin embargo, hay que señalar que estos factores son, en general, predictores de la supervivencia libre de eventos, que está condicionada en gran parte por la aparición de síntomas que hacen necesaria una intervención en la mayoría de los casos. Por ello, no queda claro que en presencia de estos factores de riesgo los pacientes se beneficien de una intervención temprana, antes de la aparición de síntomas. Los predictores de aparición de síntomas y evolución adversa en pacientes asintomáticos son los siguientes:
- •
Clínicos: edad avanzada, presencia de factores de riesgo de aterosclerosis.
- •
Ecocardiográficos: calcificación valvular, pico de velocidad de chorro aórtico88–91, FEVI90, tasa de progresión hemodinámica89, aumento del gradiente con el ejercicio80,81, excesiva hipertrofia del VI92 y parámetros anormales de la función sistólica y diastólica del VI en Doppler tisular87.
- •
Pruebas de esfuerzo: la aparición de síntomas durante las pruebas de esfuerzo en pacientes físicamente activos, particularmente entre los mayores de 70 años, predice una probabilidad muy alta de síntomas en un plazo de 12 meses. Una respuesta de presión arterial anormal y en mayor grado la depresión del segmento ST tienen un valor predictivo positivo menor que los síntomas a la hora de establecer un mal pronóstico clínico93.
- •
Biomarcadores: títulos plasmáticos elevados de péptidos natriuréticos, aunque no se han establecido con precisión los valores85–87. Tan pronto como aparecen los síntomas, el pronóstico de la EA grave es pésimo, con tasas de supervivencia de sólo un 15-50% a los 5 años. Los datos sobre la evolución espontánea de pacientes con gradientes bajos y FE normal siguen siendo controvertidos79.
La sustitución valvular aórtica (SVA) es el tratamiento definitivo de la EA grave. En las series actuales, la mortalidad operatoria de la SVA por EA es de un 1-3% en pacientes menores de 70 años y del 4-8% en pacientes seleccionados de edad más avanzada (tabla 7)1,12,32–35,40,41,94–97. Los siguientes factores aumentan el riesgo de mortalidad operatoria: edad avanzada, comorbilidades, sexo femenino, clase funcional más alta, cirugía de emergencia, disfunción del VI, hipertensión pulmonar, EC concomitante y CABG o cirugía valvular previas. Por lo general, después de una SVA realizada con éxito, los síntomas y la calidad de vida mejoran sensiblemente. La supervivencia a largo plazo de los pacientes de edad avanzada puede acercarse a la de la población general del mismo grupo de edad. Para pacientes más jóvenes, el tratamiento quirúrgico ofrece mejores resultados que el tratamiento conservador, aunque cabe esperar una supervivencia más baja que en grupos control ajustados por edad. Los factores de riesgo de muerte tardía incluyen edad, comorbilidades, síntomas graves, disfunción del VI, arritmias ventriculares y EC concomitante no tratada. Además, la evolución posoperatoria puede ser mala debido a complicaciones relacionadas con la prótesis y a un estado hemodinámico subóptimo derivado del comportamiento de la válvula protésica.
Se ha demostrado que la cirugía prolonga la vida y mejora su calidad, incluso en pacientes seleccionados de más de 80 años94–97. Por lo tanto, la edad por sí sola no se debe considerar contraindicación para cirugía. Sin embargo, un elevado porcentaje de pacientes aptos para tratamiento quirúrgico no son referidos a cirugía4,6.
La valvuloplastia con balón desempeña un papel importante en la población pediátrica, pero su papel es muy limitado en adultos utilizada sola, debido a que su eficacia es baja, la tasa de complicaciones es alta (> 10%) y la reestenosis y el deterioro clínico ocurren durante los primeros 6-12 meses en la mayoría de los pacientes, lo que da lugar a un resultado clínico a medio y largo plazo similar al de la historia natural98.
En pacientes con alto riesgo quirúrgico, se ha demostrado que la implantación transcatéter (TAVI) es factible (tasas de éxito del procedimiento > 90%) usando diferentes vías de abordaje como la transfemoral o la transapical y, menos frecuentemente, la subclavia o la transaórtica directa97,99–107. Si no hay contraindicaciones anatómicas, la vía transfemoral es la preferida en la mayoría de los centros, aunque no disponemos de comparaciones directas entre los distintos abordajes (transfemoral, transapical u otros). Igualmente, tampoco disponemos de comparaciones entre distintos sistemas o dispositivos. Las tasas de mortalidad a los 30 días varían del 5 al 15%99–101,103–106. Entre las complicaciones más importantes relacionadas con el procedimiento, se incluyen accidente cerebrovascular (ACV) (∼1-5%), necesidad de un nuevo marcapasos (hasta el 7% para los sistemas expandidos con balón y hasta el 40% para los sistemas autoexpandibles)99,103y las complicaciones vasculares (hasta el 20%)97,99. La regurgitación paravalvular es frecuente, aunque en la mayoría de los pacientes suele ser mínima o leve y en raras ocasiones tiene relevancia clínica; sin embargo, la regurgitación aórtica de mayor grado puede tener impacto en la supervivencia a largo plazo103,105. Este sigue siendo un motivo de preocupación que requiere un buen seguimiento y evaluación crítica. Aproximadamente un 1-2% de los pacientes sometidos a TAVI requieren cirugía cardiaca inmediata por complicaciones que ponen en riesgo la vida100.
En términos de gradiente y área valvular, la TAVI ofrece resultados hemodinámicos ligeramente superiores a la implantación de válvulas bioprotésicas convencionales97.
Según lo publicado, la supervivencia a 1 año tras una TAVI se sitúa en un 60-80%, dependiendo en gran medida de la gravedad de las comorbilidades97,99,102,103,105,107,108. La mayoría de los pacientes supervivientes experimentan una mejoría significativa de su estado de salud y calidad de vida. Sin embargo, queda por estudiar la durabilidad a largo plazo de estas válvulas, si bien los resultados a 3-5 años son prometedores108.
La reciente declaración del Valve Academic Research Consortium incluye una definición estandarizada para las variables de valoración (endpoints) tras la TAVI que permitirá una comparación más precisa y adecuada entre distintos dispositivos y abordajes109.
Los pacientes considerados no aptos para SVA quirúrgica tras consulta con los cirujanos se benefician claramente del tratamiento con TAVI, comparado con el tratamiento conservador, incluida la valvuloplastia con balón, según los datos de un ensayo aleatorizado (tasa de mortalidad a 1 año del 31 frente al 51% y superioridad significativa en la mejoría de los síntomas, con menos rehospitalizaciones)99. El primer ensayo aleatorizado en el que se comparó la TAVI con la SVA en pacientes de alto riesgo pero operables mostró que la TAVI no es inferior en cuanto a la mortalidad por todas las causas a 1 año (el 24,2 frente al 26,8%), con marcada mejoría funcional en ambos grupos del estudio97. El análisis de las variables de valoración secundarias mostró que la TAVI comporta mayor riesgo de eventos cerebrovasculares y complicaciones vasculares y tiene mayor incidencia de fugas paravalvulares, aunque estas suelen ser mínimas o leves. Por el contrario, las complicaciones hemorrágicas y la FA postoperatoria son más frecuentes tras las intervenciones quirúrgicas. Para la interpretación de los resultados de la serie de estudios PARTNER, hay que tener en cuenta las indicaciones y contraindicaciones específicas de la TAVI y la experiencia quirúrgica e intervencionista de los centros implicados97,99.
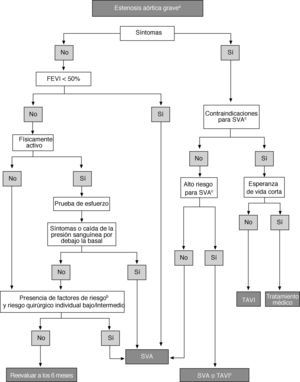
Indicaciones para la intervenciónIndicaciones para la sustitución valvular aórticaLas indicaciones para la SVA aparecen en la tabla 9 y lafigura 2. El recambio valvular precoz está muy recomendado en todos los pacientes sintomáticos con EA grave que cumplan los requisitos para la cirugía. Mientras el gradiente medio se mantenga en cifras > 40mmHg, no hay un límite inferior de FE para la cirugía.
Indicaciones para la sustitución valvular aórtica en la estenosis aórtica
| Clasea | Nivelb | Ref.c | |
| La SVA está indicada para pacientes con IA grave y cualquier síntoma relacionado con ella | I | B | 12,89,94 |
| La SVA está indicada para pacientes con IA grave que van a someterse a CABG o cirugía de la aorta ascendente o en otra válvula | I | C | |
| La SVA está indicada para pacientes asintomáticos con IA grave y disfunción del VI sistólica (FEVI < 50%) no debida a otra causa | I | C | |
| La SVA está indicada para pacientes asintomáticos con IA grave y prueba de esfuerzo anormal que muestran síntomas durante el ejercicio relacionados con la EA | I | C | |
| Se debe considerar la SVA para pacientes de alto riesgo con EA sintomática grave candidatos a TAVI, pero en los que el equipo cardiológico recomienda la cirugía según el perfil individual de riesgo y las características anatómicas | IIa | B | 97 |
| Se debe considerar la SVA para pacientes asintomáticos con EA grave y prueba de esfuerzo anormal que muestra una caída de la presión sanguínea por debajo de los valores basales | IIa | C | |
| Se debe considerar la SVA para pacientes con EAd moderada que van a someterse a CABG o cirugía de aorta ascendente u otra válvula | IIa | C | |
| En pacientes sintomáticos con EA con flujo y gradiente bajos (< 40 mmHg) y FE normal, sólo se debe considerar la SVA tras evaluación meticulosa y confirmación de la gravedad de la EAe | IIa | C | |
| Se debe considerar la SVA para pacientes sintomáticos con EA grave, flujo y gradiente bajo, FE reducida y evidencia de reserva de flujof | IIa | C | |
| Se debe considerar la SVA para pacientes asintomáticos con FE normal y ninguna de las alteraciones en la prueba de esfuerzo mencionadas antes, siempre que el riesgo quirúrgico sea bajo y haya uno o más de los siguientes hallazgos: | IIa | C | |
| • EA muy grave definida por un pico de velocidad transvalvular > 5,5 m/s, o | |||
| • Calcificación valvular intensa y una tasa de progresión del pico de velocidad transvalvular ≥ 0,3 m/s por año | |||
| Se puede considerar la SVA para pacientes sintomáticos con EA grave, flujo y gradiente bajo y disfunción del VI sin reserva de flujof | IIb | C | |
| Se puede considerar la SVA para pacientes asintomáticos con EA grave, FE normal y ninguna de las alteraciones en la prueba de esfuerzo mencionadas antes, siempre que el riesgo quirúrgico sea bajo y haya uno o más de los siguientes hallazgos: | IIb | C | |
| • Títulos marcadamente elevados de péptidos natriuréticos confirmados en el seguimiento, sin otra posible explicación | |||
| • Un aumento > 20 mmHg del gradiente medio de presión | |||
| • Hipertrofia del VI excesiva en ausencia de hipertensión |
CABG: cirugía de revascularización coronaria; EA: estenosis aórtica; FE: fracción de eyección; FEVI: fracción de eyección del ventrículo izquierdo; IA: insuficiencia aórtica;
TAVI: implantación transcatéter de válvula aórtica; SC: superficie corporal; SVA: sustitución valvular aórtica; VI: ventrículo izquierdo.
La EA moderada se define como un área valvular de 1,0-1,5 cm (0,6-0,9 cm2/m2 de SC) o un gradiente aórtico medio de 25-40 mmHg en presencia de condiciones normales de flujo. Sin embargo, es necesario el juicio clínico.
Tratamiento de la estenosis aórtica grave. El tratamiento de los pacientes con gradiente y fracción de eyección bajos se detalla en el texto. EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; SC: superficie corporal; SVA: sustitución valvular aórtica; TAVI: implantación transcatéter de válvula aórtica.
aConsulte la definición de EA grave en la tabla 4.
bSe debe considerar la cirugía (IIa C) en presencia de uno de los siguientes factores: pico de velocidad > 5,5 m/s; calcificación valvular importante + progresión del pico de velocidad ≥ 0,3 m/s/año. Se puede considerar la cirugía (IIb C) en presencia de uno de los siguientes factores: títulos marcadamente elevados de péptidos natriuréticos, un aumento del gradiente medio > 20 mmHg con el ejercicio o hipertrofia del ventrículo izquierdo excesiva.
cEl equipo cardiológico tomará la decisión de acuerdo con las características clínicas y anatomía del paciente.
En cambio, el tratamiento de los pacientes con EA de gradiente y flujo bajos (área valvular < 1cm2, FE < 40%, gradiente medio < 40mmHg) es más complejo. Si la depresión de la FE está causada principalmente por una poscarga excesiva (desequilibrio de la poscarga), en general la función del VI mejora después de la cirugía22,79,110. Por el contrario, no es seguro que se produzca una mejoría de la función del VI si la causa principal de la disfunción es la presencia de cicatrices producidas por un infarto de miocardio extenso o miocardiopatía. En pacientes con gradiente bajo y con evidencia de reserva de flujo, la cirugía está recomendada porque implica un riesgo aceptable y mejora el resultado clínico a largo plazo en la mayoría de los casos22. Aunque en los pacientes sin reserva de flujo el resultado clínico está comprometido por una mortalidad operatoria más alta, se ha demostrado que la SVA mejora la FE y el estado clínico22,78,110. La decisión clínica final debe tener en cuenta el estado clínico del paciente (en particular la presencia de comorbilidades y su gravedad), el grado de calcificación valvular, la extensión de la EC y la factibilidad de la revascularización. La nueva entidad reconocida como EA paradójica, con flujo y gradiente bajos y FE normal, requiere especial atención debido a la escasa información disponible sobre la historia natural y los resultados tras la cirugía76,79. En estos casos, sólo debe realizarse una intervención quirúrgica si hay síntomas y si la evaluación clínica indica que hay obstrucción valvular significativa.
El manejo de la EA asintomática grave sigue siendo una cuestión controvertida. Los resultados de estudios recientes no proporcionan datos convincentes para respaldar la recomendación general de SVA precoz, incluso en pacientes con EA asintomática muy grave88–91,111,112. En la decisión de operar a los pacientes asintomáticos es preciso sopesar cuidadosamente los beneficios y los riesgos.
La cirugía electiva precoz está indicada en los casos excepcionales de pacientes con función del VI deprimida no debida a otra causa o con prueba de esfuerzo anormal, sobre todo si produce la aparición de síntomas. También debe tenerse en consideración en pacientes con un descenso de la presión sanguínea por debajo de la basal21,83,90,93.
Debe considerarse la cirugía en pacientes con riesgo quirúrgico bajo, prueba de esfuerzo normal y una de los siguientes:
- •
EA muy grave, definida por un pico de velocidad > 5,5 m/s91,112.
- •
La combinación de calcificación valvular importante con rápido incremento del pico de velocidad transvalvular ≥ 0,3 m/s por año89.
Además puede considerarse la cirugía en pacientes con riesgo quirúrgico bajo y prueba de esfuerzo normal, pero con uno de los siguientes factores:
- •
Títulos muy altos de péptidos natriuréticos, confirmados en mediciones repetidas, sin otra explicación85–87.
- •
Un incremento > 20mmHg del gradiente medio de presión con el ejercicio80,81.
- •
Hipertrofia del VI excesiva sin historia de HTA92.
En pacientes que no tienen los factores predictivos expuestos anteriormente, la espera en observación parece la opción más segura, ya que es poco probable que la cirugía precoz sea beneficiosa.
Indicaciones para la valvuloplastia con balónLa valvuloplastia con balón puede considerarse un puente hacia la cirugía o TAVI para pacientes hemodinámicamente inestables con alto riesgo quirúrgico o con EA grave sintomática que precisan cirugía no cardiaca mayor y urgente (recomendación de clase IIb, nivel de evidencia C). La valvuloplastia con balón se puede considerar también como medida paliativa en casos individuales cuando la cirugía esté contraindicada debido la gravedad de las comorbilidades y la TAVI no sea una opción.
Indicaciones para la implantación transcatéter de válvula aórticaLas intervenciones de TAVI sólo deben realizarse en hospitales con servicio de cirugía cardiaca. El equipo cardiológico (heart team) que evalúe los riesgos individuales del paciente, la factibilidad técnica de la TAVI y el tipo de abordaje es el indicado para tomar decisiones clínicas en este grupo de pacientes113.
Se debe identificar las contraindicaciones clínicas y anatómicas (tabla 10). Los pacientes candidatos deben tener una expectativa de vida ≥ 1 año y probabilidades de mejorar su calidad de vida teniendo en cuenta sus comorbilidades.
Contraindicaciones para la implantación transcatéter de válvula aórtica
| Contraindicaciones absolutas |
| Carencia de equipo cardiológico (heart team) y cirugía cardiaca en el centro |
| Indicación de TAVI, como alternativa a la SVA, no confirmada por el equipo cardiológico |
| Clínicas |
| Esperanza de vida estimada < 1 año |
| Pocas probabilidades de mejoría de la calidad de vida mediante TAVI debido a las comorbilidades |
| Otra valvulopatía primaria grave asociada que es causa principal de los síntomas y sólo se puede tratar con cirugía |
| Anatómicas |
| Tamaño del anillo inadecuado (< 18 mm, > 29 mm*) |
| Trombo en ventrículo izquierdo |
| Endocarditis activa |
| Riesgo elevado de obstrucción de un ostium coronario (calcificación valvular asimétrica, corta distancia entre el anillo y el seno coronario, senos aórticos pequeños) |
| Placas con trombos móviles en la aorta ascendente o en el arco aórtico |
| Para el abordaje transfemoral/subclavio: acceso vascular inadecuado (tamaño, calcificación, tortuosidad del vaso) |
| Contraindicaciones relativas |
| Válvulas bicúspides o no calcificadas |
| Enfermedad coronaria no tratada que requiere revascularización |
| Inestabilidad hemodinámica |
| FEVI < 20% |
| Para el abordaje transapical: enfermedad pulmonar grave, ápex del VI inaccesible |
FEVI: fracción de eyección del ventrículo izquierdo; SVA: sustitución valvular aórtica; TAVI: implantación transcatéter de válvula aórtica.
Con los datos científicos actualmente disponibles, se recomienda la TAVI para pacientes con EA grave que, según el equipo cardiológico, no sean candidatos a cirugía convencional debido a comorbilidades graves (tabla 11, fig. 2.
Recomendaciones para implantación transcatéter de válvula aórtica
| Recomendaciones | Clasea | Nivelb | Ref.c |
| Sólo se debe realizar la TAVI con un equipo cardiológico multidisciplinario que incluya cardiólogos, cirujanos cardiacos y otros especialistas si fuera necesario | I | C | |
| La TAVI sólo se debe realizar en hospitales con cirugía cardiaca en el centro | I | C | |
| La TAVI está indicada para pacientes con EA sintomática grave que, en opinión del equipo cardiológico, no son candidatos a SVA y tienen probabilidades de mejorar su calidad de vida y una esperanza de vida > 1 año tras la evaluación de las comorbilidades | I | B | 99 |
| Se debe considerar la indicación de TAVI para pacientes de alto riesgo con EA sintomática que aún pueden ser candidatos para cirugía pero para quienes el equipo cardiológico prefiere la TAVI por el perfil de riesgo individual del paciente y sus características anatómicas | IIa | B | 97 |
EA: estenosis aórtica; SVA: sustitución valvular aórtica; TAVI: implantación transcatéter de válvula aórtica.
Para los pacientes de alto riesgo que siguen siendo candidatos para cirugía, la decisión debe ser individualizada. Se considerará la TAVI como alternativa a la cirugía para pacientes en que la TAVI sea más favorable en opinión del equipo cardiológico, teniendo en cuenta las respectivas ventajas y desventajas de cada técnica. Se ha propuesto un EuroSCORE logístico ≥ 20% para la indicación de TAVI, aunque es sabido que el EuroSCORE sobrestima en mucho la mortalidad operatoria113. El uso del sistema STS, con valores > 10%, puede ofrecer una valoración clínica más realista del riesgo operatorio40. Por otra parte, la fragilidad del paciente y la presencia de entidades como aorta de porcelana, historia de radiación torácica o injertos coronarios permeables pueden indicar que el paciente es menos apto para SVA pese a tener un EuroSCORE < 20% o un STS < 10%. Ante la carencia de un sistema cuantitativo perfecto, la valoración del riesgo debe basarse en el juicio clínico del equipo cardiológico, además del uso combinado de escalas de riesgo113.
Actualmente no se debe realizar una intervención de TAVI en pacientes con riesgo quirúrgico intermedio, pues son necesarios más ensayos clínicos en esta población.
Tratamiento farmacológicoLa progresión de la EA degenerativa es un proceso activo que comparte varias similitudes con la aterosclerosis. Aunque algunos estudios retrospectivos han mostrado los efectos beneficiosos de las estatinas y los IECA, en ensayos aleatorizados se ha demostrado de manera consistente que las estatinas no producen ningún efecto en la progresión de la EA114,115. Por lo tanto, no se debe administrar estatinas a pacientes con EA, ya que su único propósito es retrasar la progresión de la enfermedad. Por otra parte, se debe recomendar encarecidamente la modificación de los factores de riesgo de aterosclerosis, de acuerdo con las guías sobre prevención secundaria de la aterosclerosis116.
Los pacientes sintomáticos requieren una intervención precoz porque no hay tratamiento farmacológico capaz de mejorar los resultados respecto a la historia natural. Sin embargo, los pacientes que no son candidatos a cirugía o TAVI y los que se encuentran en espera de cirugía o TAVI pueden ser tratados con digoxina, diuréticos, IECA o ARA-II si tienen síntomas de IC. Se debe tratar la HTA concomitante; sin embargo, se debe titular con precisión el tratamiento para evitar la hipotensión y se debe examinar a los pacientes con más frecuencia. Es particularmente importante mantener el ritmo sinusal.
SeguimientoEn el paciente asintomático, la gran variabilidad de la tasa de progresión de la EA subraya la necesidad de que los pacientes reciban una educación adecuada sobre la importancia del seguimiento y la necesidad de informar de los síntomas en cuanto aparezcan. Las pruebas de estrés deben determinar el grado de recomendación para la actividad física. Las consultas de seguimiento deben incluir una evaluación ecocardiográfica que preste especial atención a la progresión hemodinámica, la función del VI y la hipertrofia, además de la aorta ascendente. El tipo y el intervalo del seguimiento deben determinarse de acuerdo con el examen inicial.
En los casos de EA grave, se tiene que reevaluar a los pacientes cada 6 meses para comprobar la aparición de síntomas, cambios en la tolerancia al ejercicio (de ser posible, con una prueba de esfuerzo en caso de que los síntomas sean dudosos) y en los parámetros ecocardiográficos. Puede considerarse la determinación de péptidos natriuréticos.
Los pacientes con EA de leve a moderada y calcificación significativa deben ser reevaluados una vez al año. En pacientes jóvenes con EA leve y sin calcificación importante, el seguimiento puede realizarse cada 2 o 3 años.
Poblaciones especiales de pacientesLa combinación de SVA y CABG comporta mayor riesgo que la SVA sola32–35. Sin embargo, la realización de SVA mucho tiempo después de la CABG también se asocia con un aumento significativo del riesgo. Aunque no disponemos de estudios prospectivos y aleatorizados, los datos de análisis retrospectivos indican que los pacientes para los que está indicada la CABG y que tienen EA moderada (gradiente medio 25-40mmHg y flujo normal, área valvular 1,0-1,5cm2) en general se benefician de la SVA concomitante. Se ha señalado que si la edad es < 70 años y, lo que es más importante, la tasa media de progresión de EA documentada es de 5mmHg/año, estos pacientes pueden beneficiarse de la sustitución de válvula en el momento de la CABG cuando el pico de gradiente basal exceda de 30 mmHg117. Se recomienda una evaluación individualizada que tenga en cuenta la SC del paciente, los datos hemodinámicos, el grado de calcificación de las valvas, la tasa de progresión de la EA, la esperanza de vida y las comorbilidades, así como el riesgo individual de la sustitución valvular concomitante o una intervención tardía.
No se debe denegar la posibilidad de una SVA a los pacientes con EA grave sintomática y EC difusa a los que no se pueda revascularizar, aunque se trate de un grupo de alto riesgo.
Algunos estudios recomiendan el uso potencial de la revascularización coronaria percutánea en lugar de la CABG para pacientes con EA. No obstante, aún no hay datos suficientes para recomendar esta opción, excepto para pacientes seleccionados de alto riesgo con síndrome coronario agudo o con EA no grave.
Se ha demostrado que la ICP combinada con TAVI es factible, pero son necesarios más datos para poder recomendar en firme esta estrategia. Se debe discutir individualizadamente la decisión de intervenir y la cronología de las intervenciones según el estado clínico del paciente, la anatomía coronaria y el miocardio en riesgo.
Cuando la IM se asocia con EA, la gravedad puede estar sobrestimada si hay presiones ventriculares elevadas, por lo que es necesaria una cuantificación meticulosa (véase la sección 3 «Comentarios generales»). Mientras no haya anomalías morfológicas de las valvas (rotura o prolapso, cambios posreumáticos o signos de endocarditis infecciosa), dilatación anular mitral o anomalías marcadas de la geometría del VI, la intervención quirúrgica de la válvula mitral generalmente no es necesaria y la IM secundaria no grave a menudo mejora después del tratamiento de la válvula aórtica.
El aneurisma y la dilatación concomitantes de la aorta ascendente requieren el mismo tratamiento que la EA (véase la sección 4).
Para la EA congénita, consulte la guía de la ESC sobre enfermedades cardiacas congénitas en el adulto11.
INSUFICIENCIA MITRALEn Europa, la IM es la segunda causa más frecuente de enfermedad valvular que requiere cirugía1. Se ha redefinido el tratamiento como consecuencia de los buenos resultados obtenidos con la reparación valvular. Esta sección trata separadamente la IM primaria y la secundaria, de acuerdo con el mecanismo causal118. En los raros casos en que ambos mecanismos están presentes, generalmente uno de ellos predomina y determina la indicación de tratamiento.
Insuficiencia mitral primariaLa IM primaria incluye todas las etiologías en que las lesiones intrínsecas afectan a uno o varios componentes del aparato de la válvula mitral. La reducción de la prevalencia de la fiebre reumática y el aumento de la esperanza de vida en los países industrializados han cambiado progresivamente la distribución etiológica, y hoy la IM degenerativa es la más común1,2,12. La endocarditis se trata en una guía específica de la ESC10.
EvaluaciónInsuficiencia mitral agudaTras el infarto agudo de miocardio, hay que considerar la posibilidad de que la rotura del músculo papilar sea la causa de la IM aguda en los pacientes que presentan edema pulmonar agudo o shock. La exploración física puede inducir a error, en particular cuando hay un soplo de baja intensidad o inaudible, y el estudio ecocardiográfico con Doppler color puede subestimar la gravedad de la lesión. La demostración de función hiperdinámica en presencia de IC aguda indica el diagnóstico y subraya la importancia de realizar una ecocardiografía urgente en este contexto12,119.
La IM aguda también puede estar causada por endocarditis infecciosa o traumatismo.
Insuficiencia mitral crónicaLa exploración clínica normalmente proporciona las primeras pistas de la presencia de IM y de que puede ser significativa, según indican la intensidad y la duración del soplo sistólico y la presencia de tercer ruido12.
Los principios generales para usar pruebas invasivas y no invasivas siguen las recomendaciones de la sección 3. A continuación se exponen los aspectos específicos de la IM:
- •
La ecocardiografía es el examen principal y debe incluir una evaluación de la gravedad, los mecanismos, las posibilidades de reparación y las consecuencias17. Los criterios para definir la IM primaria grave se describen en la tabla 5. Se puede usar varios métodos para determinar la gravedad de la IM. Hay que descartar la planimetría del chorro regurgitante, ya que esta determinación se reproduce mal y depende de numerosos factores. La medición del ancho de la vena contracta, la parte más estrecha del chorro, ofrece más precisión. Cuando sea posible, y teniendo en cuenta sus limitaciones, se recomienda el análisis del área de superficie proximal de isovelocidad (método PISA) para valorar el volumen regurgitante y el área del orificio regurgitante efectivo (ORE). La evaluación final de la gravedad requiere integrar la información obtenida con Doppler y los datos sobre la morfología, además de una comprobación cuidadosa de la validez de estos datos en relación con las consecuencias en las presiones pulmonares y del ventrículo y la aurícula derechos (tabla 5)17. La ETT proporciona una definición anatómica precisa de las diferentes lesiones, que debe estar relacionada con la anatomía segmentaria y funcional de acuerdo con la clasificación de Carpentier para poder evaluar la factibilidad de la reparación. La ETT también permite valorar las dimensiones del anillo mitral17. La ETE se realiza con frecuencia antes de la cirugía con este propósito, pero si personas experimentadas practican la ETT y las imágenes son de buena calidad, puede ser suficiente120. Hay que señalar que, en términos generales, la evaluación preoperatoria de la factibilidad de la reparación valvular requiere experiencia17. Se debe evaluar intraoperatoriamente los resultados de la reparación de la válvula mitral por ETE, para permitir la corrección quirúrgica si fuera necesario. La E3D puede ofrecer más información121. Las consecuencias de la IM para el corazón se evalúan mediante ecocardiografía con la medición del volumen de la AI, el tamaño del VI y la FEVI, la presión pulmonar arterial sistólica y la función del VD.
- •
La determinación de la capacidad funcional mediante prueba de esfuerzo cardiopulmonar puede ayudar en la valoración clínica122. En manos expertas, la ecocardiografía de esfuerzo es útil para cuantificar los cambios inducidos por el ejercicio en la IM, la presión arterial pulmonar sistólica y la función del VI21,123,124. Nuevas técnicas como la prueba de esfuerzo cardiopulmonar, el strain longitudinal general (medido por el método de speckle tracking) y los cambios inducidos por el esfuerzo en los volúmenes del VI, la FE y el strain general pueden ayudar a predecir una disfunción del VI postoperatoria124.
- •
Se ha evaluado la activación neurohormonal en la IM, y varios estudios apuntan que los títulos elevados y los cambios en el péptido natriurético tipo B (BNP) pueden tener valor predictivo. Un valor de corte de BNP ≥ 105 pg/ml determinado en una cohorte de derivación se validó prospectivamente en una cohorte separada y ayudó a identificar a los pacientes asintomáticos con mayor riesgo de IC, disfunción del VI o muerte en el seguimiento a medio plazo125. Los títulos plasmáticos de BNP bajos tienen alto valor predictivo negativo y pueden ser útiles para el seguimiento de pacientes asintomáticos126.
La IM aguda se tolera muy mal y comporta mal pronóstico si no se interviene. En pacientes con rotura de cuerdas, la clínica puede estabilizarse después de un periodo sintomático inicial. No obstante, si no se interviene, conlleva mala evolución espontánea debido al desarrollo ulterior de hipertensión pulmonar.
En la IM crónica asintomática, las tasas estimadas de muerte por cualquier causa, muerte por causas cardiacas y eventos cardiacos (muerte por causas cardiacas, IC o aparición de FA con tratamiento médico) a los 5 años fueron del 22 ± 3%, el 14 ± 3% y el 33 ± 3% respectivamente118. Además de los síntomas, edad, FA, grado de IM (en especial el ORE), hipertensión pulmonar, dilatación de la AI, aumento del DTSVI y FEVI baja son predictores de mal pronóstico118,127–133.
Resultados de la cirugíaA pesar de que no hay comparaciones aleatorizadas entre los resultados de la sustitución valvular y la reparación, se acepta ampliamente que la reparación valvular, cuando es factible, es el tratamiento quirúrgico óptimo en pacientes con IM grave. Cuando se compara con la sustitución valvular, la reparación tiene menos mortalidad perioperatoria, mejor supervivencia, mejor preservación de la función del VI postoperatoria y menor morbilidad a largo plazo (tabla 7).
Además de los síntomas, los predictores más importantes del resultado postoperatorio de la IM son la edad, la fibrilación auricular, la función del VI preoperatoria, la hipertensión pulmonar y la factibilidad de la reparación valvular. Los mejores resultados de la cirugía se observan en pacientes con una FE preoperatoria > 60%. Aunque en el pasado se aceptaba generalmente un valor de corte de 45mm, se ha demostrado que un DTSVI ≥ 40mm (≥ 22mm/m2 de SC) se asocia de manera independiente con un aumento de la mortalidad con tratamiento médico comparado con la cirugía mitral131. Además de las determinaciones iniciales, también se debe tener en cuenta los cambios temporales de las dimensiones del VI y la función sistólica a la hora de tomar decisiones sobre el momento idóneo para la cirugía, aunque estos parámetros requieren validación133.
La probabilidad de realizar una reparación valvular duradera es de vital importancia. La IM degenerativa debida a prolapso valvular segmentario normalmente puede repararse con un riesgo de reintervención bajo. La posibilidad de reparar las lesiones reumáticas, el prolapso extenso y, aún más, la IM con calcificación de las valvas o calcificación anular extensa no es tan regular, aunque la realicen cirujanos experimentados134. En la práctica diaria, la experiencia quirúrgica en la reparación de la válvula mitral está aumentando y se está generalizando135.
Los pacientes en los que se prevé una reparación compleja deben ser intervenidos en centros con experiencia en este tipo de intervenciones, con altas tasas de reparación y baja mortalidad operatoria32–35,44,135.
Cuando la reparación no es factible, se prefiere un recambio valvular mitral con preservación del aparato subvalvular.
Intervención percutáneaSe han desarrollado intervenciones percutáneas para corregir la IM mediante catéteres. La única intervención que se ha evaluado en la IM orgánica es la técnica «edge-to-edge». Los datos de la serie de estudios EVEREST (Endovascular Valve Edge-to-Edge REpair STudy)136y los resultados de registros realizados en Europa137 y Estados Unidos indican que el procedimiento con MitraClip tiene una tasa de éxito del procedimiento (IM posprocedimiento ≤ 2+) de alrededor del 75%, es relativamente seguro y generalmente se tolera bien, incluso pacientes en malas condiciones clínicas. La supervivencia libre de muerte, cirugía de válvula mitral o IM superior a moderada es del 55% a 1 año. Este procedimiento es menos efectivo que la cirugía de válvula mitral para la reducción de la IM. El seguimiento está limitado a un máximo de 2 años y es probable que la recurrencia o el empeoramiento de la IM ocurra durante el seguimiento, según los datos del estudio EVEREST II, en el que un 20% de los pacientes requirieron reintervención durante el primer año. La utilidad del procedimiento es escasa porque requiere que se cumplan criterios ecocardiográficos muy precisos para que un paciente sea candidato136. En procedimientos fallidos de colocación de clip mitral, se ha descrito la realización de cirugía de reparación valvular, aunque puede ser necesaria la sustitución valvular hasta en el 50% de los casos.
Indicaciones para la intervenciónLa cirugía urgente está indicada en pacientes con IM aguda grave. La rotura de un músculo papilar requiere tratamiento quirúrgico de urgencia, tras estabilizar el estado hemodinámico, mediante balón de contrapulsación intraaórtico (BCIA), fármacos inotrópicos positivos y, cuando sea posible, vasodilatadores. En la mayoría de los casos el tratamiento quirúrgico consiste en la sustitución valvular119.
Las indicaciones para la cirugía en la IM primaria crónica grave se muestran en la tabla 12 y lafigura 3.
Indicaciones para la cirugía en la insuficiencia mitral primaria grave
| Clasea | Nivelb | Ref.c | |
| La reparación valvular mitral es la técnica preferida cuando se espera que sea duradera | I | C | |
| La cirugía está indicada para pacientes sintomáticos con FEVI > 30% y DTSVI < 55 mm | I | B | 127,128 |
| La cirugía está indicada para pacientes asintomáticos con disfunción del VI (DTSVI ≥ 45 mm y/o FEVI ≤ 60%) | I | C | |
| Se debe considerar la cirugía para pacientes asintomáticos con función del VI conservada y fibrilación auricular de nueva aparición o hipertensión pulmonar (presión pulmonar sistólica en reposo > 50 mmHg) | IIa | C | |
| Se debe considerar la cirugía para pacientes asintomáticos con función del VI conservada, alta probabilidad de reparación duradera, bajo riesgo quirúrgico, rotura de valvas (flail) y DTSVI ≥ 40 mm | IIa | C | |
| Se debe considerar la cirugía para pacientes con disfunción del VI grave (FEVI < 30% y/o DTSVI > 55 mm), refractarios a tratamiento farmacológico, con alta probabilidad de reparación duradera y comorbilidad baja | IIa | C | |
| Se puede considerar la cirugía para pacientes con disfunción del VI grave (FEVI < 30% y/o DTSVI > 55 mm), refractarios a tratamiento farmacológico y con probabilidad baja de reparación duradera y comorbilidad baja | IIb | C | |
| Se puede considerar la cirugía para pacientes asintomáticos con función del VI conservada, alta probabilidad de reparación duradera, riesgo quirúrgico bajo y: | IIb | C | |
| • Dilatación auricular izquierda (índice de volumen ≥ 60 ml/m2 de SC) y ritmo sinusal, o | |||
| • Hipertensión pulmonar durante el ejercicio (PPS ≥ 60 mmHg durante el ejercicio) |
DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; PPS: presión pulmonar sistólica; SC: superficie corporal; VI: ventrículo izquierdo.
Tratamiento de la insuficiencia mitral primaria crónica grave. AI: aurícula izquierda; DTSVI: diámetro telesistólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; PPS: presión pulmonar sistólica; SC: superficie corporal; VI: ventrículo izquierdo.
aCuando haya alta probabilidad de reparación valvular duradera con bajo riesgo, se debe considerar la reparación valvular (IIa C) en pacientes con rotura o flail de valvas y DTSVI ≥ 40 mm; se debe considerar la reparación valvular (IIb C) en presencia de uno de los siguientes: volumen de la AI ≥ 60 ml/m2 de SC y ritmo sinusal o hipertensión pulmonar durante el ejercicio (PPS ≥ 60 mmHg).
bEl tratamiento extendido de la IC incluye: terapia de resincronización cardiaca, dispositivos de asistencia ventricular, dispositivos de restricción cardiaca y trasplante cardiaco.
La decisión de sustituir o reparar la válvula depende fundamentalmente de la anatomía valvular, la experiencia quirúrgica del centro y el estado del paciente.
La cirugía está indicada para pacientes con síntomas debidos a IM crónica pero sin contraindicaciones para la cirugía.
Cuando la FEVI es < 30%, una reparación quirúrgica perdurable puede mejorar los síntomas, aunque se desconoce su efecto en la supervivencia. En este caso, la decisión sobre la conveniencia de operar deberá tener en cuenta la respuesta al tratamiento médico, las comorbilidades y las probabilidades de reparar la válvula.
Puede considerarse la indicación de un procedimiento con la técnica edge-to-edge para pacientes con IM primaria grave y sintomática que cumplan los criterios ecocardiográficos, los que el equipo cardiológico considere inoperables o con riesgo quirúrgico alto y que tengan una esperanza de vida > 1 año (recomendación de clase IIb, nivel de evidencia C).
El tratamiento de los pacientes asintomáticos es un tema controvertido, ya que no hay estudios clínicos aleatorizados que justifiquen un tipo particular de intervención. Sin embargo, se puede recomendar la cirugía para pacientes asintomáticos seleccionados con IM grave, especialmente cuando la reparación es probable138,139.
La cirugía está indicada para pacientes con signos de disfunción del VI (FEVI ≤ 60% y/o DTSVI ≥ 45mm), incluso aquellos con elevada probabilidad de sustitución valvular. Para pacientes de baja estatura, se puede considerar valores de DTSVI inferiores.
Si la función del VI está conservada, se puede considerar la cirugía para pacientes asintomáticos con FA de nueva aparición o hipertensión pulmonar (presión arterial pulmonar sistólica > 50mmHg en reposo)47.
En recientes ensayos clínicos prospectivos y aleatorizados, se han propuesto las siguientes indicaciones de cirugía para pacientes con riesgo quirúrgico bajo en los que haya alta probabilidad de que la reparación sea perdurable a tenor de las lesiones valvulares y la experiencia del cirujano:
- •
Se debe considerar la cirugía si hay rotura de valvas y DTSVI ≥ 40mm (≥ 22mm/m2 de SC en pacientes de baja estatura)131.
- •
Se puede considerar la cirugía en presencia de una o más de las siguientes condiciones: presión pulmonar sistólica > 60mmHg en ejercicio21,123, pacientes en ritmo sinusal con gran dilatación de la AI (índice de volumen ≥ 60ml/m2 de SC)132.
En otros pacientes asintomáticos se ha demostrado que se puede seguir de modo seguro la IM grave hasta que aparezcan síntomas o se alcancen los valores de corte recomendados previamente. Esta estrategia requiere un seguimiento riguroso y regular138.
Cuando haya dudas sobre la factibilidad de la reparación valvular, se recomienda un seguimiento clínico estrecho. En estos casos, el riesgo operatorio y/o las complicaciones derivadas de la válvula protésica probablemente sobrepasen las ventajas de corregir la IM en una fase temprana. Estos pacientes deben ser examinados cuidadosa mente y se les debe indicar cirugía cuando aparezcan síntomas o signos objetivos de disfunción del VI.
Cuando se alcanzan las indicaciones de cirugía recomendadas en las guías de práctica clínica, la cirugía temprana (en un plazo de 2 meses) se asocia a mejores resultados, ya que la aparición de síntomas, aunque sean leves, en el momento de la cirugía se asocia a cambios perjudiciales en la función cardiaca tras la intervención139,140.
Por último, conviene mencionar que no se disponemos de datos firmes sobre el valor de la cirugía para los pacientes con prolapso valvular mitral y función del VI conservada con arritmias ventriculares recurrentes a pesar del tratamiento médico.
Tratamiento farmacológicoEn la IM aguda se puede obtener una reducción de las presiones de llenado con nitratos y diuréticos. El nitroprusiato de sodio reduce la poscarga y la fracción regurgitante, al igual que el BCIA. Los agentes inotrópicos y el BCIA deben utilizarse en casos de hipotensión.
No hay evidencia científica que respalde el uso de vasodilatadores, incluidos los IECA, en la IM crónica sin IC, de modo que no están recomendados para este grupo de pacientes. Sin embargo, en caso de IC, los IECA son beneficiosos y se puede utilizarlos en pacientes con IM avanzada y síntomas graves no candidatos para cirugía o cuando todavía hay síntomas residuales después de la cirugía. Los bloqueadores beta y la espironolactona también pueden ser apropiados.
SeguimientoA los pacientes asintomáticos con IM moderada y función del VI preservada, se les puede hacer un seguimiento clínico anual y ecocardiográfico cada 2 años. Los pacientes asintomáticos con IM grave y función del VI preservada deben ser examinados cada 6 meses y se les debe realizar una ecocardiografía cada año. El seguimiento debe ser aún más estrecho cuando no se disponga de ninguna evaluación previa, los valores sean próximos al límite o se hayan producido cambios significativos desde la última consulta. Estos pacientes deben recibir instrucciones para que informen inmediatamente sobre cualquier cambio que se produzca en el estado funcional.
Insuficiencia mitral secundariaEn la IM secundaria, también llamada «IM funcional», las valvas y cuerdas de la válvula están estructuralmente normales y la IM resulta de la distorsión geométrica del aparato subvalvular secundaria al aumento y el remodelado del VI, producida por miocardiopatía idiopática o EC. En esta, la IM secundaria también se define como «IM isquémica», aunque esto no implica que haya isquemia coronaria en curso. Por lo tanto, la IM secundaria no es una valvulopatía primaria, sino el resultado de la tensión cordal o tethering (desplazamiento apical y lateral de los músculos papilares) y una pérdida de la fuerza de cierre secundaria a disfunción del VI (contractilidad reducida y/o disincronía del VI)12,17.
EvaluaciónEn la IM secundaria crónica, frecuentemente el soplo es tenue y su intensidad no está relacionada con la gravedad de la IM. La IM isquémica es una entidad dinámica y su gravedad puede variar con los cambios en las condiciones de carga: HTA, tratamiento médico o ejercicio. El componente dinámico se puede valorar y cuantificar mediante ecocardiografía de esfuerzo. Los cambios dinámicos en la IM isquémica pueden resultar en edema pulmonar agudo, con el consecuente aumento de las presiones pulmonares vasculares141.
El examen ecocardiográfico es útil para establecer el diagnóstico y diferenciar la IM secundaria de la primaria en pacientes con EC o IC. Después de un infarto de miocardio y en pacientes con IC, se debe buscar sistemáticamente la presencia de IM secundaria y evaluar su gravedad mediante Doppler. Al igual que en la IM primaria, la planimetría del chorro regurgitante sobrestima la gravedad de la IM isquémica y se reproduce mal, mientras que la determinación de la anchura de la vena contracta es más precisa. Por su valor predictivo, se han propuesto valores umbral de gravedad más bajos en la IM secundaria al utilizar métodos cuantitativos (20 mm2 para el ORE y 30ml para el volumen regurgitante) (tabla 5)17,118,142. La valoración de la función sistólica del VI es más complicada en presencia de IM.
La IM isquémica es una enfermedad dinámica, por lo que las pruebas de estrés pueden desempeñar un papel importante en su evaluación. La cuantificación de la IM durante el ejercicio es factible, proporciona una buena apreciación de las características dinámicas y tiene importancia pronóstica. Se ha demostrado que un incremento del ORE ≥ 13 mm2 se asocia a un aumento importante del riesgo relativo de muerte y hospitalización por descompensación cardiaca143. Sin embargo, es necesario evaluar cuál es el valor pronóstico de las pruebas de esfuerzo para predecir los resultados de la cirugía. La importancia pronóstica de la IM dinámica no se aplica necesariamente a la IM secundaria a miocardiopatía idiopática.
El estudio del estado coronario es necesario para completar el diagnóstico y evaluar las opciones de revascularización.
En pacientes con FEVI baja, es imprescindible valorar si hay viabilidad miocárdica y en qué grado mediante una de las técnicas de imagen disponibles actualmente (ecocardiografía con dobutamina, TC por emisión monofotónica [SPECT] o RMC).
En pacientes con EC programados para revascularización, la decisión de tratar la IM isquémica debe tomarse antes de la cirugía, pues la anestesia general reduce significativamente la intensidad de la regurgitación. Cuando fuera necesario, se puede realizar una prueba de precarga y/o poscarga en el quirófano para una estimación adicional de la gravedad de la IM144.
Historia naturalLos pacientes con IM isquémica crónica tienen mal pronóstico118,142. La EC grave y la disfunción del VI tienen importancia pronóstica. La relación causal entre IM y mal pronóstico no está clara. Sin embargo, a mayor gravedad se asocia peor resultado142.
En la IM secundaria de etiología no isquémica, los datos relativos a la historia natural son más escasos que en la IM isquémica145. Es difícil realizar un análisis preciso, ya que el número de series es escaso y estas incluyen a pocos pacientes con muchos factores de confusión. En algunos estudios se ha observado una relación independiente entre IM significativa y mal pronóstico.
Resultados de la cirugíaLa cirugía para la IM secundaria sigue siendo un reto. La mortalidad operatoria es más alta que en IM primaria, y el pronóstico a largo plazo es peor, en parte por la presencia de comorbilidades más graves (tabla 7). Para los pacientes con IM isquémica, las indicaciones de cirugía y el procedimiento quirúrgico preferido siguen siendo un tema controvertido, fundamentalmente por las altas tasas de persistencia y recurrencia de la IM tras la reparación valvular y la ausencia de evidencia científica que confirme que la cirugía prolonga la vida146. La mayoría de los estudios muestran que la IM isquémica grave normalmente no mejora sólo con la revascularización y que la persistencia de IM residual comporta un aumento del riesgo de muerte. El impacto de la cirugía valvular en la supervivencia sigue estando poco claro porque no hay ensayos clínicos aleatorizados, y los escasos estudios observacionales realizados sobre este tema tienen demasiadas limitaciones para poder establecer conclusiones claras147. En cuanto al pronóstico, la mayoría de los estudios no han podido demostrar que la corrección quirúrgica de la IM secundaria mejore los resultados clínicos a largo plazo148,149. El único estudio aleatorizado en el que se comparó CABG frente a CABG más reparación valvular en pacientes con IM moderada no estaba diseñado para analizar el efecto de la combinación de CABG más reparación valvular en la supervivencia. Este estudio mostró que la reparación valvular mejoraba la clase funcional, la FE y el diámetro del VI a corto plazo150.
Cuando está indicada la cirugía, se suele preferir la reparación valvular mediante anuloplastia con anillo rígido de menor calibre, que comporta menos riesgo operatorio pero mayor riesgo de recurrencia de la IM151,152. Esta técnica quirúrgica también es aplicable a la IM secundaria a cardiomiopatía153.
Se han identificado numerosos predictores preoperatorios de IM secundaria recurrente tras la anuloplastia con anillo de poco calibre, los cuales indican la presencia de una tensión cordal (tethering) importante y se asocian con peor pronóstico (DTDVI > 65mm, ángulo de la valva mitral posterior > 45°, ángulo distal de la valva mitral anterior > 25°, área de angulación sistólica > 2,5cm2, distancia de coaptación —distancia entre el plano anular y el punto de coaptación—> 10mm, distancia interpapilar telesistólica > 20mm, índice de esfericidad sistólica > 0,7)152. Sin embargo, el valor pronóstico de estos parámetros requiere de más validación. Tras la cirugía, las alteraciones geométricas y funcionales localizadas en zonas adyacentes a los músculos papilares se asocian a la IM recurrente.
A la hora de decidir sobre la intervención, hay que tener en cuenta si hay viabilidad miocárdica significativa, ya que es un predictor de buen resultado después de la reparación valvular combinada con cirugía de bypass154.
No está claro si la anuloplastia restrictiva puede crear una estenosis mitral (EM) clínicamente significativa.
No se ha realizado ningún estudio aleatorizado para comparar la reparación y la sustitución valvular. En contextos complejos de alto riesgo, las supervivencias son similares con una u otra técnica. En un reciente metaanálisis de estudios retrospectivos se observó mejor supervivencia a corto y largo plazo tras la reparación valvular que con la sustitución155. Para los pacientes con los predictores preoperatorios de aumento de recurrencias de la IM, se han propuesto varias técnicas que se pueden considerar además de la anuloplastia para resolver la tensión subvalvular156. En un reciente estudio aleatorizado, se observó mayor supervivencia y reducción significativa de los eventos adversos mayores en pacientes revascularizados en los que se realizó un remodelado ventricular157. En la IM secundaria no isquémica, distintas modalidades quirúrgicas para el remodelado inverso del VI, como las técnicas de reconstrucción del VI, han dado resultados decepcionantes y no se puede recomendarlas.
Intervención percutáneaLa experiencia con el pequeño número de pacientes de los estudios EVEREST y la recogida en estudios observacionales indican que la reparación percutánea de la válvula mitral con la técnica edge-to-edge es factible, con bajo riesgo operatorio, en pacientes con IM secundaria si no hay una tensión cordal excesiva y que este tratamiento proporciona a corto plazo mejoría del estado funcional y de la función del VI136,137. Se debe confirmar estos hallazgos en estudios aleatorizados con series más grandes y seguimiento más largo. Los datos sobre la anuloplastia mitral a través del seno coronario son escasos, y la mayoría de los dispositivos utilizados inicialmente han sido retirados158.
Indicaciones para la intervenciónLa heterogeneidad de los datos relativos a la IM secundaria hacen que su tratamiento esté menos basado en la evidencia científica que en la IM primaria (tabla 13).
Indicaciones para la cirugía valvular mitral en la insuficiencia mitral secundaria crónica
| Clasea | Nivelb | |
| La cirugía está indicada para pacientes con IM gravec que van a someterse a CABG y con FEVI > 30% | I | C |
| Se debe considerar la cirugía para pacientes con IM moderada que van a someterse a CABGd | IIa | C |
| Se debe considerar la cirugía para pacientes asintomáticos con IM grave y FEVI < 30% que son candidatos a revascularización y con evidencia de viabilidad | IIa | C |
| Se puede considerar la cirugía para pacientes con IM grave y FEVI > 30% que siguen sintomáticos a pesar del tratamiento médico (incluido TRC si está indicado) y tienen comorbilidad baja siiempre que la revascularización no esté indicada | IIb | C |
CABG: cirugía de revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; TRC: terapia de resincronización cardiaca.
La IM grave debe corregirse en el momento de la cirugía de bypass. Las indicaciones de sólo cirugía de válvula mitral para pacientes sintomáticos con IM secundaria grave y función sistólica del VI muy deprimida a los que no se puede revascularizar o sufren miocardiopatía son cuestionables. Puede considerarse la reparación en pacientes seleccionados si la comorbilidad es baja, al objeto de evitar o posponer el trasplante. Para los demás pacientes, el tratamiento médico óptimo actualmente es la mejor opción, seguida, en caso de que fracase, de tratamiento completo de la IC (terapia de resincronización cardiaca [TRC], dispositivos de asistencia ventricular, dispositivos de contención cardiaca, trasplante cardiaco).
Se puede considerar un procedimiento percutáneo con clip mitral para pacientes con IM secundaria sintomática y grave pese a tratamiento médico óptimo (incluida la TRC si está indicada) que cumplan los criterios ecocardiográficos de elección, que el equipo cardiológico y los cirujanos consideren inoperables o con riesgo quirúrgico alto y que además tengan una esperanza de vida > 1 año (recomendación de clase IIb, nivel de evidencia C).
Hay un debate continuo sobre el tratamiento de la IM isquémica moderada para pacientes que van a someterse a CABG. En estos casos, es preferible la reparación valvular. En pacientes con una FE baja, es más probable que se considere la cirugía de válvula mitral si hay viabilidad miocárdica y la comorbilidad es baja. Para los pacientes con capacidad de ejercicio, se debe considerar una ecocardiografía de esfuerzo siempre que sea posible. La disnea inducida por el ejercicio y un incremento importante en el grado de IM y de la presión arterial pulmonar sistólica favorecen la elección de cirugía combinada.
No hay datos que respalden la corrección quirúrgica de la IM leve.
Tratamiento médicoEl tratamiento médico óptimo es imprescindible, es la primera medida para el manejo de todos los pacientes con IM secundaria y se debe administrar de acuerdo con las guías de práctica clínica sobre el manejo de la IC13. El tratamiento incluye IECA y bloqueadores beta, con la adición de antagonistas de la aldosterona en presencia de IC. En caso de sobrecarga de fluidos, es necesario un diurético. Los nitratos son útiles para tratar la disnea aguda secundaria a un componente dinámico importante. Las indicaciones de TRC deben seguir las recomendaciones de las guías específicas13. En pacientes respondedores,
la TRC puede reducir inmediatamente la intensidad de la IM por el aumento de las fuerzas de cierre y resincronización de los músculos papilares159. Se puede lograr una reducción adicional de la IM y su componente dinámico reduciendo la tensión cordal (tethering) asociada al remodelado inverso del VI.
ESTENOSIS MITRALAunque la prevalencia de la fiebre reumática, que es la etiología predominante de la EM, ha disminuido de manera importante en los países industrializados, la EM sigue teniendo una morbimortalidad significativa en todo el mundo1,3. Desde su introducción, la comisurotomía mitral percutánea (CMP) ha tenido un impacto importante en el tratamiento de la EM reumática.
EvaluaciónEl paciente con EM puede sentirse asintomático durante años y luego presentarse con disminución gradual de la actividad. El diagnóstico se establece normalmente mediante la exploración física, radiografía de tórax, ECG y ecocardiografía.
Los principios generales para el uso de pruebas invasivas y no invasivas siguen las recomendaciones establecidas en la sección 3
«Comentarios generales»12.
A continuación se exponen los aspectos específicos de la EM:
- •
La ecocardiografía es el método principal para evaluar la gravedad y las consecuencias de la EM, así como la extensión de las lesiones anatómicas. El área valvular debe medirse mediante planimetría y el método de hemipresión, que son complementarios. La planimetría, cuando es factible, es el método de elección, sobre todo inmediatamente después de la CMP. Puede utilizarse la ecuación de continuidad y la isovelocidad proximal cuando es necesaria una evaluación adicional. Las determinaciones del gradiente transvalvular medio calculado mediante las velocidades Doppler son muy dependientes de la frecuencia cardiaca y el flujo, pero pueden ser útiles para probar la concordancia en la evaluación de la gravedad, particularmente en pacientes en ritmo sinusal. Normalmente, la EM no tiene consecuencias clínicas en reposo cuando el área valvular es > 1,5cm2 (tabla 4)15. La evaluación de la morfología valvular es importante para la elección de la estrategia de tratamiento. Para evaluar la idoneidad de la estrategia, se han desarrollado sistemas de puntuación en los que se tiene en cuenta el grosor valvular, la movilidad, la calcificación, la deformación del aparato subvalvular y las zonas de comisura15,160,161.
La ecocardiografía también evalúa las presiones arteriales pulmonares, la presencia de IM asociada y enfermedad valvular concomitante y el tamaño de la AI. Debido a la frecuente asociación de la EM con otras valvulopatías, es fundamental evaluar en profundidad las válvulas tricúspide y aórtica. La ETT normalmente proporciona suficiente información para el manejo habitual. También se debe realizar ETE para excluir trombosis de la AI antes de la CMP o después de un evento embólico, si la ETT proporciona una información subóptima sobre la anatomía o, en casos seleccionados, para guiar el procedimiento. La E3D permite una evaluación más precisa de la morfología valvular (particularmente la visualización de las comisuras)162, optimiza la precisión y la reproducibilidad de la planimetría y puede ser útil para guiar (ETE) y monitorizar (ETT) los procedimientos de CMP de los casos más complejos. La ecocardiografía también desempeña un papel importante para la monitorización de los resultados de la CMP durante el procedimiento.
- •
Las pruebas de estrés están indicadas para pacientes sin síntomas o con síntomas dudosos o discordantes con la gravedad de la EM. La ecocardiografía con dobutamina o, preferiblemente, con ejercicio proporciona información adicional evaluando los cambios en el gradiente mitral y las presiones pulmonares21.
Para los pacientes asintomáticos, la supervivencia es normalmente buena hasta los 10 años, con progresión muy variable y deterioro súbito, precipitado generalmente por embarazo o complicaciones como la FA o las embolias163. Los pacientes sintomáticos tienen mal pronóstico sin intervención12.
Resultados de la intervenciónComisurotomía mitral percutáneaEl éxito técnico y las complicaciones están relacionados con la selección del paciente y la experiencia del operador164. Los buenos resultados iniciales, definidos por un área valvular > 1,5cm2 sin IM > 2/4, se alcanzan en más del 80% de los casos. Las principales complicaciones son mortalidad operatoria (0,5-4%), hemopericardio (0,5-10%), embolias (0,5-5%) y regurgitación grave (2-10%). Raramente se requiere cirugía de urgencia (< 1%)165.
Los datos de seguimiento clínico confirman la eficacia a largo plazo de la CMP con una supervivencia libre de eventos de un 30-70% trascurridos 10-20 años, dependiendo de las características del paciente160,166–168. Cuando los resultados inmediatos no son satisfactorios, normalmente se requiere cirugía en un plazo corto160,167,168. En cambio, después de una CMP con éxito, los resultados a largo plazo son buenos en la mayoría de los casos y se pueden predecir por las características anatómicas y clínicas preoperatorias y por la calidad de los resultados inmediatos160,167,169. Cuando se produce deterioro funcional, suele ser tardío y relacionado fundamentalmente con reestenosis170. La CMP exitosa también reduce el riesgo embólico163.
CirugíaLa comisurotomía cerrada de válvula mitral se sigue realizando en países en vías de desarrollo, mientras que en otros se ha sustituido por la comisurotomía abierta mediante bypass cardiopulmonar, aunque esta técnica se usa rara vez. En series realizadas en centros con experiencia, que en su mayoría incluyen a pacientes jóvenes, los resultados a largo plazo son buenos, con tasas de reintervención para sustitución valvular de un 0-7% a los 36-50 meses y tasas de supervivencia de un 81-90% a los 10 años171,172.
En la práctica clínica actual, la cirugía para la EM es mayormente la sustitución valvular (∼95%) como resultado de que la enfermedad se presenta a edades más avanzadas y las características de las válvulas para la reparación valvular son desfavorables1,34. La mortalidad operatoria para la sustitución valvular se sitúa en un 3-10% y se correlaciona con la edad, la clase funcional, la hipertensión pulmonar y la EC. La supervivencia a largo plazo está relacionada con la edad, la clase funcional, la FA, la hipertensión pulmonar, la función de VI/VD preoperatoria y las complicaciones de la válvula protésica12.
Indicaciones para la intervenciónSe debe decidir el tipo de tratamiento y el momento en que iniciarlo en función de las características clínicas (como estado funcional y predictores del riesgo operatorio y de los resultados de la CMP), la anatomía valvular y la experiencia del centro.
A continuación se exponen las indicaciones para la intervención (tabla 14, fig. 4):
- •
La intervención sólo debe realizarse en pacientes con EM clínicamente significativa (área valvular ≤ 1,5cm2).
- •
La intervención debe realizarse en pacientes sintomáticos. La mayoría de los pacientes con una anatomía valvular favorable son sometidos a CMP; sin embargo, los cirujanos experimentados pueden preferir la comisurotomía abierta en pacientes jóvenes con IM levemoderada. Cómo decidir el tipo de intervención para pacientes con anatomía desfavorable sigue siendo motivo de debate, y se debe tener en cuenta la naturaleza multifactorial de los predictores del resultado de la CMP160,170. Se debe considerar la CMP en el tratamiento inicial de pacientes seleccionados con calcificación leve-moderada o aparato subvalvular desfavorable que por lo demás tienen características clínicas favorables, en particular pacientes jóvenes en los que es más atractivo posponer una intervención de sustitución valvular173.
Indicaciones para la comisurotomía mitral percutánea en la estenosis mitral con un área valvular ≤ 1,5 cm2
| Clasea | Nivelb | Ref.c | |
| La CMP está indicada para pacientes sintomáticos con características favorables | I | B | 160,170 |
| La CMP está indicada para pacientes sintomáticos con contraidicación o alto riesgo de la cirugía | I | C | |
| Se debe considerar la CMP como tratamiento inicial para pacientes sintomáticos con anatomía desfavorable pero sin características clínicas desfavorablesd | IIa | C | |
| Se debe considerar la CMP para pacientes asintomáticos sin características desfavorables y: | IIa | C | |
| • Riesgo tromboembólico alto (historia de embolias, contraste espontáneo denso en aurícula izquierda, fibrilación auricular reciente o paroxística) y/o | |||
| • Descompensación hemodinámica de alto riesgo (presión pulmonar sistólica > 50 mmHg en reposo, necesidad de cirugía mayor no cardiaca, deseo de gestar) |
CMP: comisurotomía mitral percutánea.
Se puede definir como características desfavorables para la CMP varias de las
siguientes:
– Clínicas: edad avanzada, historia de comisurotomía, clase IV de la New York Heart Association, fibrilación auricular permanente y hipertensión pulmonar grave.
– Anatómicas: score ecográfico > 8, score de Cormier 3 (cualquier grado de calcificación valvular mitral determinada por fluoroscopia), área valvular mitral muy pequeña e insuficiencia tricuspídea grave.
Tratamiento de la estenosis mitral clínicamente significativa. CI: contraindicaciones; CMP: comisurotomía mitral percutánea; EM: estenosis mitral.
aConsulte la tabla 14.
bSe puede considerar la comisurotomía quirúrgica por equipo quirúrgico experimentado o para pacientes con contraindicaciones para la CMP.
La CMP es el procedimiento de elección cuando la cirugía está contraindicada o como puente a la cirugía en pacientes de alto riesgo que están en estado crítico.
La cirugía es preferible en pacientes que no son adecuados para la CMP.
Debido al riesgo —pequeño pero claro— inherente a la CMP, los pacientes verdaderamente asintomáticos no suelen ser candidatos para este procedimiento, excepto en caso de que haya alto riesgo de tromboembolias o descompensación hemodinámica. En estos pacientes, la CMP sólo debe realizarse si las características son favorables y por operadores experimentados.
En pacientes asintomáticos con EM, la cirugía se limita a los escasos pacientes que tienen alto riesgo de complicaciones y contraindicaciones para la CMP.
La cirugía es la única alternativa cuando la CMP está contraindicada (tabla 15). La contraindicación más importante es la trombosis de la AI. Sin embargo, cuando el trombo está localizado en la orejuela izquierda, puede considerarse la CMP en pacientes con contraindicaciones para la cirugía o sin necesidad urgente de intervención en quienes la anticoagulación oral puede seguirse con seguridad de 2 a 6 meses, siempre que el examen por ecocardiografía transesofágica muestre la desaparición del trombo. Si el trombo persiste, está indicada la cirugía.
Contraindicaciones para la comisurotomía mitral percutánea
| • Área valvular mitral > 1,5 cm2 |
| • Trombo en aurícula izquierda |
| • Insuficiencia mitral de grado superior a leve |
| • Calcificación importante o bicomisural |
| • Ausencia de fusión comisural |
| • Valvulopatía aórtica grave concomitante o estenosis e insuficiencia tricuspídea |
| combinadas |
| • Enfermedad coronaria concomitante que requiere cirugía de revascularización |
| coronaria |
Los diuréticos o los nitratos de acción prolongada mejoran transitoriamente la disnea. Los bloqueadores beta o los bloqueadores de los canales de calcio que regulan la frecuencia cardiaca pueden mejorar la tolerancia al ejercicio. El tratamiento anticoagulante con un INR en la mitad superior del intervalo 2-3 está indicado en pacientes con FA persitente o paroxística47. Para los pacientes en ritmo sinusal está indicado anticoagular si ya han tenido embolias o hay un trombo en la AI (recomendación de clase I, nivel de evidencia C) y se puede considerar cuando la ETE muestre contraste denso espontáneo o crecimiento de la AI (diámetro en modo M > 50mm o volumen de la AI > 60ml/m2) (recomendación de clase IIa, nivel de evidencia C)174. El ácido acetilsalicílico u otros agentes antiagregantes no son alternativas válidas.
SeguimientoLos pacientes asintomáticos con EM clínicamente significativa que no han sido intervenidos quirúrgicamente deben ser seguidos cada año mediante exámenes clínicos y ecocardiográficos, y con intervalos más largos (de 2 a 3 años) cuando la estenosis sea de menor grado.
El tratamiento de los pacientes después de una CMP exitosa es similar al de los pacientes asintomáticos. El tratamiento debe ser más estricto en caso de reestenosis asintomática. Cuando la CMP no se ha realizado con éxito y los síntomas persisten, se debe considerar la cirugía inmediata, a menos que haya claras contraindicaciones.
Poblaciones especiales de pacientesCuando aparece reestenosis con síntomas después de una comisurotomía quirúrgica o percutánea, en la mayoría de los casos la reintervención requiere una sustitución valvular. La repetición de la CMP puede proponerse a pacientes seleccionados con características favorables si el mecanismo predominante es la fusión de las comisuras, y en algunos casos en que la CMP ha tenido buenos resultados iniciales si al cabo de unos años se produce reestenosis. La CMP puede tener fines paliativos para pacientes cuya anatomía valvular no presenta las características ideales para esta intervención pero que no son candidatos para la cirugía175,176.
Para información sobre la EM durante la gestación, véase la sección 13.
En los ancianos, cuando la cirugía presenta alto riesgo o está contraindicada pero la esperanza de vida es aceptable, la CMP puede ser una opción útil, aunque sólo sea paliativa. En pacientes con características anatómicas favorables, se puede intentar la CMP como primera opción y recurrir a la cirugía si los resultados son insatisfactorios. Para otros pacientes, se prefiere la cirugía.
Para pacientes con EM combinada con valvulopatía aórtica grave, se prefiere la cirugía. En casos en que concomiten EM y valvulopatía aórtica moderada, la CMP se puede realizar con el objetivo de posponer el tratamiento quirúrgico de las dos válvulas.
Para los pacientes con insuficiencia tricuspídea (IT) grave, la CMP se puede intentar en aquellos en ritmo sinusal, con un aumento auricular moderado e IT funcional secundaria a hipertensión pulmonar. En otros casos se prefiere la cirugía de las dos válvulas177.
El paciente anciano puede presentar calcificación anular mitral degenerativa, particularmente en presencia de insuficiencia renal, pero rara vez causa una EM grave que requiera cirugía.
La sustitución valvular es la única opción para el tratamiento de los raros casos de EM grave de origen no reumático sin fusión comisural.
INSUFICIENCIA TRICUSPÍDEAEn la ecocardiografía de sujetos normales se detecta frecuentemente IT sin importancia. La IT patológica es secundaria más a menudo que causada por lesión valvular primaria. La IT secundaria está causada por la dilatación anular y el aumento del tethering de las valvas tricuspídeas, que se relacionan con la presión y/o la sobrecarga de volumen del VD. La sobrecarga de presión se debe normalmente a la hipertensión pulmonar secundaria a cardiopatía izquierda o, raramente, a cor pulmonale o hipertensión pulmonar idiopática. La sobrecarga de volumen del VD posiblemente se relacione con la existencia de comunicación interauricular o enfermedad intrínseca del VD12.
1.1EvaluaciónLos síntomas predominantes son los correspondientes a las valvulopatías asociadas, e incluso la IT grave puede ser bien tolerada durante largo tiempo. Aunque son dependientes de la carga, los signos clínicos de IC derecha son muy útiles a la hora de evaluar la gravedad de la IT12.
Los principios generales para el uso de estudios invasivos y no invasivos se basan en las recomendaciones expuestas en «Comentarios generales» (sección 3).
Los aspectos específicos de la IT son los siguientes:
- •
La ecocardiografía es la técnica ideal para evaluar la IT porque proporciona la siguiente información:
- -
Al igual que en la IM, permite distinguir entre primaria y secundaria en presencia de anomalías estructurales de la válvula. En la IT primaria, se puede identificar la etiología por la presencia de anomalías específicas como vegetaciones en la endocarditis10, engrosamiento y retracción de valvas en la enfermedad reumática y carcinoide, prolapso/rotura de valvas en la enfermedad mixomatosa o postraumática, y válvula tricúspide displásica en enfermedades congénitas como la malformación de Ebstein11. También se debe medir la dilatación del anillo17. Una dilatación significativa del anillo tricuspídeo se define por un diámetro diastólico ≥ 40mm o > 21mm/m2 en la proyección transtorácica de cuatro cámaras17,178–180. En la IT secundaria, una distancia de coaptación > 8mm caracteriza a los pacientes con tethering significativo (distancia entre el plano anular tricuspídeo y el punto de coaptación mesosistólica en proyección apical de cuatro cámaras)181.
- -
Se debe evaluar la gravedad de la IT y la presión pulmonar sistólica, de acuerdo con las recomendaciones actuales (tabla 5)17.
- -
Se debe evaluar las dimensiones y la función del VD, a pesar de las limitaciones de los actuales índices funcionales. Para identificar a los pacientes con disfunción del VD, se puede utilizar el desplazamiento sistólico del plano anular tricuspídeo (TAPSE < 15mm), la velocidad sistólica anular tricuspídea (< 11cm/s) y el área telesistólica del VD (> 20cm2)182.
- -
Se debe determinar la presencia de lesiones asociadas (examen cuidadoso de las lesiones valvulares asociadas, particularmente del lado izquierdo) y la función del VI.
- -
- •
Cuando sea posible, la RMC es el método preferido para determinar el tamaño y la función del VD.
Los pocos datos disponibles sobre la historia natural de la IT primaria indican que la IT grave tiene mal pronóstico, aunque pueda ser bien tolerada funcionalmente durante años12,183,184. Al igual que en la insuficiencia valvular izquierda, la sobrecarga de volumen persistente puede producir disfunción ventricular y daño miocárdico irreversible. La rotura o flail de los velos de la válvula tricúspide (típicamente asociadas a la IT grave) se relaciona con una disminución de la supervivencia y un aumento del riesgo de IC184. La IT secundaria puede disminuir o desaparecer a medida que la insuficiencia ventricular derecha mejora como respuesta a un tratamiento específico. No obstante, la IT puede persistir incluso después de una corrección exitosa de las lesiones izquierdas. Sigue siendo muy difícil predecir la evolución de la IT funcional después del tratamiento quirúrgico de la válvula mitral. La hipertensión pulmonar, el aumento de la presión y el tamaño del VD, la FA, los electrodos del marcapasos y el grado de deformación de la válvula tricúspide (diámetro anular tricuspídeo, altura de coaptación) son importantes factores de riesgo de persistencia o empeoramiento tardío de la IT178,180,181.
1.2Resultados de la cirugíaLa anuloplastia es clave en la cirugía para la IT. Se observan mejores resultados a largo plazo con anillos protésicos que con la técnica de suturas; las incidencias de IT residual a los 5 años son del 10 y el 20-35% respectivamente179,180,185,186. La experiencia actual favorece el uso de la anuloplastia para la IT grave relacionada con la dilatación anular tricuspídea aislada187. Cuando la deformación de la válvula tricúspide es significativa, puede ser útil realizar procedimientos complementarios con el objetivo de reducir la IT postoperatoria residual (p. ej., el alargamiento de la valva anterior)188. En presencia de formas más avanzadas de tethering o dilatación del VD, se debe considerar la sustitución de la válvula. Actualmente se prefiere la implantación de grandes bioprótesis en lugar de válvulas mecánicas189. La reparación adicional de la válvula tricúspide, si está indicada durante la cirugía izquierda, no aumenta el riesgo operatorio. La supervivencia a los 10 años varía entre un 30 y un 50%, y los predictores son la clase funcional preoperatoria, las funciones ventriculares izquierda y derecha y las complicaciones protésicas185–189. En presencia de electrodos del marcapasos a través de la válvula tricúspide e IT, la técnica quirúrgica debe adaptarse al estado del paciente y la experiencia del cirujano. La reintervención de la válvula tricúspide en casos de IT persistente después de la cirugía de válvula mitral conlleva un alto riesgo, principalmente por el estado clínico del paciente (como la edad y el número de intervenciones cardiacas previas), y es probable que tenga malos resultados a largo plazo relacionados con la presencia de disfunción ventricular derecha irreversible previa a la reoperación o disfunción del VI, miocárdica o valvular.
Indicaciones para la cirugíaSigue siendo un tema controvertido decidir el mejor momento para la intervención quirúrgica debido a los pocos datos disponibles y su naturaleza heterogénea (tabla 16). Como principio general, sepuede afirmar que la reparación valvular, cuando sea técnicamente posible, es preferible a la sustitución valvular y que la cirugía debe realizarse con la suficiente prontitud para evitar una disfunción ventricular derecha irreversible.
Indicaciones para la cirugía valvular tricupídeaS
| Clasea | Nivelb | |
| La cirugía está indicada para pacientes sintomáticos con ET gravec | I | C |
| La cirugía está indicada para pacientes con ET grave que van a someterse a cirugía de válvula izquierdad | I | C |
| La cirugía está indicada para pacientes con ET grave, primaria o secundaria, que van a someterse a cirugía de válvula izquierda | I | C |
| La cirugía está indicada para pacientes sintomáticos con ET grave, primaria y aislada, sin disfunción ventricular derecha grave | I | C |
| Se debe considerar la cirugía para pacientes con IT primaria moderada que van a someterse a cirugía de válvula izquierda | IIa | C |
| Se debe considerar la cirugía para pacientes con IT secundaria, leve o moderada, y dilatación anular (≥ 40 mm o > 21 mm/m2) que van a someterse a cirugía de válvula izquierda | IIa | C |
| Se debe considerar la cirugía para pacientes asintomáticos o con síntomas leves, IT primaria grave y aislada y dilatación ventricular derecha progresiva o deterioro de la función ventricular derecha | IIa | C |
| Tras la cirugía valvular izquierda, se debe considerar la cirugía para pacientes con IT que están sintomáticos o presentan dilatación/disfunción ventricular derecha progresiva, en ausencia de disfunción valvular izquierda, disfunción grave ventricular derecha o izquierda y enfermedad pulmonar vascular grave | IIa | C |
CMP: comisurotomía mitral percutánea; ET: estenosis tricuspídea; IT: insuficiencia tricuspídea.
La necesidad de corrección de la IT se suele considerar en el momento de la corrección quirúrgica de las lesiones valvulares izquierdas. La cirugía de válvula tricúspide está indicada en pacientes con IT grave. Se puede considerar la cirugía de válvula tricúspide para pacientes con IT primaria moderada y aquellos con IT secundaria leve-moderada y una dilatación anular significativa (≥ 40mm)178–180.
Se recomienda la cirugía aislada de la válvula tricúspide en pacientes sintomáticos con IT primaria grave. Aunque estos pacientes responden bien al tratamiento con diuréticos, el retraso de la cirugía probablemente resulte en daño irreversible del VD, afección orgánica y malos resultados de la intervención quirúrgica tardía. Aunque los valores de corte no están bien definidos (al igual que en la IM), se debe controlar estrechamente a los pacientes asintomáticos con IT primaria grave para detectar el aumento progresivo del VD y la aparición de disfunción del VD, que requieren una intervención quirúrgica temprana.
En caso de IT grave recurrente o persistente después de la cirugía izquierda, se puede considerar la posibilidad de operar de forma aislada la válvula tricúspide de pacientes sintomáticos o con disfunción o dilatación progresiva del VD, en ausencia de disfunción valvular izquierda, disfunción grave del VD o el VI o vasculopatía pulmonar grave.
Para el tratamiento de la malformación de Ebstein, consulte la publicación de Baumgartner et al11.
Tratamiento médicoLos diuréticos reducen la congestión. Se precisa un tratamiento específico de la enfermedad subyacente.
ESTENOSIS TRICUSPÍDEALa ET, que suele ser de origen reumático, se observa raramente en países industrializados, aunque prevalece en países en desarrollo3,12. La detección de la ET requiere una meticulosa evaluación debido a que, en la mayoría de los casos, se asocia a lesiones valvulares izquierdas cuyos síntomas predominan en la presentación de la enfermedad.
EvaluaciónNormalmente, los signos clínicos están enmascarados por los de otras lesiones valvulares asociadas, en particular la EM12,190. La ecocardiografía proporciona la información más útil. Con frecuencia la ET pasa inadvertida, por lo que requiere una evaluación cuidadosa. El método de hemipresión para evaluar la gravedad de la ET es menos válido que para la EM, y la ecuación de continuidad raramente se puede aplicar debido a la frecuente presencia de regurgitación asociada. La planimetría del área valvular casi siempre es imposible porque requiere el uso de E3D. No existe una gradación generalmente aceptada de la gravedad de la ET. Se considera que un gradiente medio ≥ 5mmHg con frecuencia cardiaca normal indica la presencia de ET clínicamente significativa15. Mediante la ecocardiografía también se debe evaluar la presencia de fusión comisural, la anatomía de la válvula y el aparato subvalvular, los cuales determinan la factibilidad de la reparación y el grado de IT concomitante.
CirugíaLa ausencia de tejido flexible en las valvas es la mayor limitación para la reparación valvular. Aunque sigue siendo un tema de debate, normalmente se prefiere la utilización de prótesis biológicas para la sustitución valvular, por su mayor durabilidad en la posición tricuspídea, mientras que las prótesis mecánicas tienen más riesgo de trombosis189–191.
Intervención percutáneaLa valvuloplastia tricuspídea con balón, sola o combinada con CMP, se ha realizado en un pequeño número de casos, pero frecuentemente induce regurgitación significativa. No hay datos suficientes sobre la evaluación de los resultados a largo plazo192.
Indicaciones para la intervenciónLa intervención de la válvula tricúspide se suele realizar al mismo tiempo que las intervenciones de otras válvulas en pacientes que siguen sintomáticos pese al tratamiento médico. Dependiendo de la anatomía y la experiencia quirúrgica del equipo en la reparación valvular, se prefiere la cirugía conservadora o la sustitución valvular a la comisurotomía con balón, que sólo se puede considerar como estrategia inicial en los pocos casos de ET aislada (tabla 16).
Tratamiento médicoLos diuréticos son útiles en presencia de IC, aunque su eficacia es limitada.
VALVULOPATÍAS MÚLTIPLES Y COMBINADASSe puede encontrar estenosis e insuficiencia en la misma válvula. La valvulopatía múltiple puede encontrarse en varias entidades, especialmente en las cardiopatías reumáticas y, menos frecuentemente, en la valvulopatía degenerativa. No hay datos suficientes sobre valvulopatías múltiples y combinadas, por lo que no es posible hacer recomendaciones basadas en la evidencia190.
Los principios generales para el tratamiento de las valvulopatías múltiples y combinadas son los siguientes:
Cuando la estenosis o la insuficiencia son predominantes, el tratamiento debe seguir las recomendaciones para la valvulopatía predominante. Cuando las gravedades de la estenosis y la insuficiencia están equilibradas, las indicaciones para una intervención deben basarse en los síntomas y las consecuencias objetivas, más que en los índices de gravedad de la estenosis o la insuficiencia.
- •
Además de evaluar por separado cada una de las lesiones valvulares, es necesario tener en cuenta también la interacción entre las distintas lesiones valvulares. Como ilustración, la IM asociada puede llevar a subestimar la gravedad de la EA, ya que la disminución del volumen latido secundaria a IM reduce también el flujo a través de la válvula aórtica y, por lo tanto, el gradiente aórtico. Este mecanismo subraya la necesidad de combinar diferentes determinaciones, como la de las áreas valvulares, utilizando si es posible métodos menos dependientes de las condiciones de carga, como la planimetría.
- •
Las indicaciones para la intervención se basan en la evaluación integral de los efectos de las diferentes lesiones valvulares, como los síntomas o la presencia de dilatación o disfunción del VI. Puede considerarse la intervención de valvulopatías múltiples no graves si se asocian con síntomas o llevan a afección del VI.
- •
La decisión de intervenir sobre múltiples válvulas debe tener en cuenta el riesgo quirúrgico adicional de los procedimientos combinados.
- •
En la elección de la técnica quirúrgica, se debe tener en cuenta la presencia de las otras valvulopatías. Aunque la reparación valvular sigue siendo la opción ideal, el deseo de reparar una válvula puede disminuir si se requiere la sustitución valvular protésica de otra válvula.
- •
El tratamiento de otras asociaciones específicas de las valvulopatías se detalla en las secciones individuales.
Los pacientes a quienes se ha realizado previamente una cirugía valvular son el 28% de todos los pacientes con valvulopatía del Euro Heart Survey1. Es esencial optimizar la elección del tipo de prótesis valvular, además del posterior tratamiento de los pacientes con prótesis valvulares, para reducir las complicaciones relacionadas con la válvula protésica.
Elección de la prótesis valvularNo hay un sustituto valvular perfecto. Todos implican algún compromiso y todos introducen nuevos procesos patológicos, ya sean de tipo mecánico (válvulas monodisco y bivalvas) o biológico. Entre las válvulas biológicas están los xenoinjertos, los autoinjertos pulmonares y las bioprótesis porcinas y de pericardio bovino o equino. Los xenoinjertos se dividen a su vez en válvulas con y sin soporte (stent). Estas pueden ofrecer mejor rendimiento hemodinámico, pero hasta ahora no se ha demostrado mayor durabilidad a largo plazo193. La nueva tecnología de bioprótesis que no requieren puntos de sutura permite una implantación rápida sin manguito de cosido y ofrece ORE mayores.
Las dos prótesis con implantación transcatéter más utilizadas están hechas de tejido pericárdico insertado en un stent sin recubrir expasible mediante balón o en un stent de nitinol autoexpansible. Todas las válvulas mecánicas requieren anticoagulación durante toda la vida. Las válvulas biológicas no requieren anticoagulación a largo plazo a menos que haya FA u otra indicación, pero son susceptibles de deterioro estructural valvular (DEV) con el tiempo.
Los homoinjertos y los autoinjertos pulmonares se utilizan principalmente en la posición aórtica en adultos, aunque representan menos del 1% de los recambios valvulares aórticos en la mayoría de las grandes bases de datos. Los homoinjertos están sujetos a DEV. En un análisis ajustado por tendencia, no se observó mayor durabilidad de los homoinjertos que de las bioprótesis pericárdicas, y un estudio aleatorizado mostró mayor durabilidad de las bioprótesis sin stent que de los homoinjertos194,195. El tiempo medio hasta la reoperación del homoinjerto por DEV depende de la edad y varía de una media de 11 años en un paciente de 20 años de edad a 25 años en un paciente de 65194,195. Los aspectos técnicos, la poca disponibilidad y la gran complejidad de la reoperación contribuyen a restringir el uso de homoinjertos196.
Aunque es cuestión en debate, la indicación principal de los homoinjertos es la endocarditis infecciosa aguda con lesiones perivalvulares10,197. El autoinjerto pulmonar en la posición aórtica (operación de Ross) proporciona un estado hemodinámico excelente, pero requiere gran pericia y tiene varias desventajas: riesgo de estenosis temprana del homoinjerto pulmonar, riesgo de recurrencia de la insuficiencia aórtica debido a la ulterior dilatación de la raíz aórtica nativa o del propio autoinjerto pulmonar cuando se usa en una reparación de raíz mínimamente invasiva, y el riesgo de afección reumática198. Aunque en algunas ocasiones esta operación se realiza en adultos (atletas profesionales y mujeres que se plantean un embarazo), la principal ventaja del autoinjerto es para los niños, ya que la válvula y el nuevo anillo aórtico parecen crecer con ellos, algo que no sucede con los homoinjertos. Los candidatos potenciales para una operación de Ross deben ser referidos a centros con experiencia y buenos resultados en este tipo de intervención11.
En la práctica, para la mayoría de los pacientes, la elección debe hacerse entre una prótesis mecánica y una prótesis biológica con stent.
La heterogeneidad de las valvulopatías y la variabilidad de los resultados de las intervenciones hacen que el diseño y la ejecución de estudios prospectivos aleatorizados sea difícil. En dos estudios aleatorizados de comparación de dos modelos más antiguos de válvula biológica y mecánica, no se encontraron diferencias significativas en las tasas de trombosis valvular y tromboembolias, al igual que sucede en numerosas series individuales. La supervivencia a largo plazo fue muy similar199,200. En un estudio más reciente, se asignó aleatoriamente a tratamiento con prótesis mecánica o biológica a 310 pacientes de 55-70 años de edad201. No se encontraron diferencias en las tasas de supervivencia, tromboembolias o sangrado, pero se observó una tasa más elevada de fracaso de la válvula y reoperación tras la implantación de bioprótesis. En los metaanálisis de series observacionales, no se encontraron diferencias en supervivencia teniendo en cuenta las características de los pacientes. Los modelos de microsimulación pueden ayudar a elegir el tratamiento para cada paciente estimando la supervivencia libre de eventos relacionados con la válvula, de acuerdo con la edad del paciente y el tipo de prótesis202.
Aparte de las consideraciones hemodinámicas, la elección entre una válvula mecánica y una biológica en adultos depende sobre todo de la estimación del riesgo de hemorragias asociadas al tratamiento anticoagulante y tromboembolias con las válvulas mecánicas comparado con el riesgo de DEV con las bioprótesis, teniendo en cuenta también los objetivos, los valores, el estilo de vida y las preferencias médicas del paciente46,203–205. El riesgo de hemorragias está determinado principalmente por el INR elegido, la calidad del control de la anticoagulación, el uso concomitante de ácido acetilsalicílico y los factores de riesgo de hemorragia propios del paciente. La estimación del riesgo de DEV debe tener en cuenta la tasa de deterioro (que disminuye con la edad y es más elevada en la posición mitral que en la aórtica) y el riesgo de la reoperación, que es ligeramente más alto que para la primera operación203.
Más que establecer límites de edad arbitrarios, la elección de la prótesis debe ser individualizada y después de una discusión en profundidad entre el paciente informado, los cardiólogos y los cirujanos, teniendo en cuenta los factores que se detallan en las tablas 17 y 18.
Elección de la prótesis aórtica/mitral. A favor de una prótesis mecánica
| Clasea | Nivelb | |
| Se recomienda el uso de prótesis mecánica teniendo en cuenta la voluntad del paciente informado y si hay contraindicaciones para la anticoagulación a largo plazoc | I | C |
| Se recomienda el uso prótesis mecánica en pacientes con riesgo de deterioro estructural valvular aceleradod | I | C |
| Se recomienda el uso de prótesis mecánica en pacientes que reciben tratamiento anticoagulante como resultado de tener una prótesis mecánica en otra válvula | I | C |
| Se debe considerar el uso de prótesis mecánica en pacientes < 60 años con prótesis en posición aórtica y < 65 años con prótesis en posición mitrale | IIa | C |
| Se debe considerar el uso de prótesis mecánica en pacientes con esperanza de vida razonablef y para los que una futura reoperación valvular comportaría un riesgo alto | IIa | C |
| Se puede considerar el uso de prótesis mecánica en pacientes que reciben tratamiento anticoagulante a largo plazo debido al riesgo de tromboemboliasg | IIb | C |
La decisión se basa en la integración de varios factores.
Incremento del riesgo de hemorragia debido a comorbilidades, problemas de adherencia al tratamiento y condiciones geográficas, ocupacionales y estilo de vida.
Para pacientes de 60-65 años que deben recibir una prótesis aórtica y los de 65-70 años en caso de prótesis mitral, son aceptables ambos tipos de prótesis y su elección requiere un cuidadoso análisis de otros factores distintos de la edad.
Elección de la prótesis aórtica/mitral. A favor de una bioprótesis
| Clasea | Nivelb | |
| Se recomienda el uso de bioprótesis teniendo en cuenta la voluntad del paciente informado | I | C |
| Se recomienda el uso bioprótesis cuando el tratamiento anticoagulante óptimo sea poco probable (problemas de adherencia, dificultades de disponibilidad) o cuando esté contraindicado debido al alto riesgo de sangrado (sangrado mayor previo, comorbilidades, falta de interés, problemas de adherencia al tratamiento, ocupación) | I | C |
| Se recomienda el uso de bioprótesis en caso de necesidad de reintervenir por trombosis de válvula mecánica a pesar de un buen control del tratamiento anticoagulante a largo plazo | I | C |
| Se debe considerar el uso de bioprótesis en pacientes para los que una futura reintervención valvular presenta un riesgo bajo | IIa | C |
| Se debe considerar el uso de bioprótesis en mujeres jóvenes que desean quedarse embarazadas | IIa | C |
| Se debe considerar el uso de bioprótesis en pacientes> 65 años para prótesis en posición aórtica y > 70 años para prótesis en posición mitral, o para los que tengan una esperanza de vidac inferior a la durabilidad estimada de la bioprótesisd | IIa | C |
La decisión se basa en la integración de varios factores.
Para pacientes de 60-65 años de edad a los que se va a implantar una prótesis aórtica y los de 65-70 años a los se va a implantar una prótesis mitral, los dos tipos de prótesis valvulares son aceptables y su elección requiere un cuidadoso análisis de factores adicionales. Se debe tener en cuenta las siguientes consideraciones:
- •
Se debe considerar el uso de bioprótesis para pacientes cuya esperanza de vida sea menor que la durabilidad estimada de la bioprótesis, particularmente en caso de comorbilidades que puedan requerir otros procedimientos quirúrgicos y en pacientes con mayor riesgo de hemorragias. Aunque el DEV se acelera con la insuficiencia renal crónica, la mala supervivencia a largo plazo con ambos tipos de prótesis y el mayor riesgo de hemorragia asociado a las prótesis mecánicas pueden favorecer la elección de una bioprótesis en estos casos206.
- •
En mujeres que desean quedarse embarazadas, el alto riesgo de complicaciones tromboembólicas durante el embarazo asociado al uso de prótesis mecánicas, que es independiente del régimen anticoagulante administrado, y el bajo riesgo de reoperación electiva son incentivos para la elección de una bioprótesis, a pesar del rápido desarrollo de DEV en este grupo de edad207.
- •
También se debe tener en cuenta aspectos relacionados con la calidad de vida y las preferencias del paciente informado. Los inconvenientes de la anticoagulación oral pueden minimizarse mediante el autocontrol del tratamiento. Aunque los receptores de una bioprótesis pueden evitar la anticoagulación a largo plazo, se exponen a la posibilidad de un deterioro del estado funcional debido al DEV y a la perspectiva de una reintervención si viven los años suficientes.
- •
Durante el seguimiento a medio plazo, algunos pacientes receptores de una bioprótesis pueden contraer otra enfermedad que requiera anticoagulación oral (FA, ACV, enfermedad arterial periférica y otras).
El impacto del desajuste entre paciente y prótesis en la posición aórtica aconseja usar una prótesis con la mayor área posible de orificio efectivo, aunque al uso de datos de experiencias in vitro y del área geométrica del orificio le falte fiabilidad208. Si se estima que el cociente prótesis/paciente es < 0,65cm2/m2 de SC, se puede considerar un aumento del anillo que permita la implantación de una prótesis de mayor tamaño209.
Tratamiento tras el reemplazo valvularLas tromboembolias y las hemorragias debidas a la anticoagulación constituyen la mayoría de las complicaciones que sufren los receptores de válvulas protésicas12. La profilaxis de la endocarditis y el tratamiento de la endocarditis valvular protésica se detallan en las guías específicas de la ESC10.
Evaluación basal y modalidades de seguimientoLo ideal es realizar 6-12 semanas después de la cirugía una evaluación basal completa, que incluya valoración clínica, radiografía de tórax, ECG, ETT y hemograma. Esta evaluación de referencia es de la máxima importancia para poder interpretar los cambios en el soplo y los ruidos protésicos, así como la función ventricular, los gradientes transprotésicos y la regurgitación paravalvular. Esta consulta postoperatoria también es útil para mejorar la educación del paciente sobre la profilaxis de la endocarditis y, cuando sea necesario, sobre el tratamiento anticoagulante y también para enfatizar la importancia que tiene informar sobre la aparición de síntomas nuevos en cuanto se produzcan. Todos los pacientes que se hayan sometido a cirugía valvular necesitan un seguimiento cardiológico de por vida para poder detectar el deterioro precoz de la función protésica o ventricular o la progresión de la enfermedad en otra válvula cardiaca. La evaluación clínica debe realizarse anualmente o lo antes posible si aparecen nuevos síntomas cardiacos. Se debe realizar una ETT si aparecen nuevos síntomas tras el reemplazo valvular o si se sospecha de complicaciones. En pacientes con bioprótesis se recomienda realizar un examen ecocardiográfico anual después del quinto año, o antes si se trata de pacientes jóvenes. Los gradientes transprotésicos se interpretan mejor si se comparan con los valores basales en el mismo paciente, más que si se comparan con los valores teóricos de una determinada prótesis, que carecen de fiabilidad. Se debe considerar la ETE cuando la ETT sea de baja calidad y en todos los casos en que se sospeche una disfunción protésica o endocarditis210. La cinefluoroscopia y la TC multicorte pueden proporcionar información adicional útil si se sospecha la presencia de trombo o panículo valvulares211.
Tratamiento antitrombóticoManejo generalEl tratamiento antitrombótico debe englobar el control efectivo de los factores de riesgo de tromboembolia modificables y la prescripción de fármacos antitrombóticos203,212,213.
Las indicaciones para el tratamiento antitrombótico tras la reparación o la sustitución valvular se resumen en la tabla 19.
Indicaciones para el tratamiento antitrombótico tras la cirugía valvular
| Clasea | Nivelb | Ref.c | |
| Se recomienda la anticoagulación oral de por vida para todos los pacientes con prótesis mecánicas | I | B | 213 |
| Se recomienda la anticoagulación oral de por vida para los pacientes con bioprótesis que tienen otras indicaciones para la anticoagulaciónd | I | C | |
| Se debe considerar agregar al tratamiento ácido acetilsalicílico a dosis bajas para pacientes con prótesis mecánicas y enfermedad aterosclerótica concomitante | IIa | C | |
| Se debe considerar agregar al tratamiento ácido acetilsalicílico a dosis bajas para pacientes con prótesis mecánicas tras un evento tromboembólico pese a tener un INR adecuado | IIa | C | |
| Se debe considerar la anticoagulación oral durante los primeros 3 meses tras la implantación de una bioprótesis mitral o tricuspídea | IIa | C | |
| Se debe considerar la anticoagulación oral durante los primeros 3 meses tras la reparación valvular mitral | IIa | C | |
| Se debe considerar la administración de ácido acetilsalicílico a dosis bajas durante los primeros 3 meses tras la implantación de una bioprótesis aórtica | IIa | C | |
| Se debe considerar la anticoagulación oral durante los primeros 3 meses tras la implantación de una bioprótesis aórtica | IIb | C |
INR: razón internacional normalizada.
Se ha cuestionado la necesidad de tratamiento anticoagulante postoperatorio durante un periodo de 3 meses con ácido acetilsalicílico a bajas dosis, que ahora se considera una alternativa214,215. La sustitución de AVK por inhibidores orales directos del factor IIa o Xa no está recomendada para pacientes con prótesis mecánicas porque, por el momento, no se han realizado ensayos clínicos específicos en este grupo de pacientes.
Cuando esté indicado el tratamiento anticoagulante postoperatorio, debe iniciarse la anticoagulación oral durante los primeros días tras la intervención. La heparina no fraccionada (HNF) intravenosa, monitorizada para obtener un tiempo de tromboplastina parcial activada (TTPa) de 1,5-2,0 veces el valor control, permite una rápida anticoagulación antes de que aumente el INR. Parece que la heparina de bajo peso molecular (HBPM) ofrece una anticoagulación efectiva y estable, y se ha utilizado en pequeñas series observacionales216. Este uso está fuera de indicación (off-label). El uso de HBPM está limitado por la falta de estudios aleatorizados, los posibles efectos farmacocinéticos en pacientes obesos y la actividad anti-Xa deseada, por su contraindicación en presencia de disfunción renal grave y la incapacidad para neutralizar su efecto. En caso de utilizar HBPM, se recomienda el control de la actividad anti-Xa.
El primer mes postoperatorio es un periodo con especial riesgo de aparición de tromboembolias, y se debe evitar que durante ese tiempo la anticoagulación sea menor que la deseada, particularmente en pacientes receptores de prótesis mitral mecánica217,218. Además, durante ese periodo la anticoagulación está sujeta a mayor variabilidad y se debe controlarla con más frecuencia.
Pese a la falta de pruebas, inmediatamente después de la TAVI o de una reparación percutánea de tipo edge-to edge, se utiliza el tratamiento combinado de ácido acetilsalicílico a dosis bajas y una tienopiridina, seguido de uno de estos dos fármacos solos. En pacientes con FA, se suele utilizar la combinación de un AVK y ácido acetilsalicílico o tienopiridina, aunque es preciso sopesar el aumento de riesgo de hemorragia.
INR objetivoEn la elección del INR óptimo, se debe tener en cuenta los factores de riesgo del paciente y la trombogenicidad de la prótesis, tal como determinan las tasas de trombosis valvular publicadas para dicha prótesis en relación con los valores específicos de INR (tabla 20)203,219. Nose puede utilizar los estudios aleatorizados disponibles en los que se comparan distintos valores óptimos de INR para determinar el INR óptimo en todos los casos; además, la variedad de métodos utilizados no permite la realización de metaanálisis220–222.
Objetivo de INR con las prótesis mecánicas
| Trombogenicidad de la prótesisa | Factores de riesgo relacionados con el pacienteb | |
| Sin factores de riesgo | Al menos 1 factor de riesgo | |
| Baja | 2,5 | 3,0 |
| Media | 3,0 | 3,5 |
| Alta | 3,5 | 4,0 |
Se debe tener en cuenta las siguientes advertencias a la hora de seleccionar el INR óptimo:
- •
Las prótesis no pueden clasificarse adecuadamente por su diseño básico (como ser bivalvas, tener un disco oscilante, etc.) o por la fecha de su introducción para determinar su trombogenicidad.
- •
Para muchas de las prótesis actualmente disponibles, sobre todo las que se han introducido recientemente, no hay datos suficientes sobre las tasas de trombosis valvular para los diferentes valores de INR que permitan su clasificación. Hasta que dispongamos de más resultados, deben incluirse en la categoría de «trombogenicidad media».
- •
Las recomendaciones de INR para los pacientes individuales pueden requerir una revisión a la baja si aparecen hemorragias recurrentes o al alza en caso de tromboembolia pese a un INR aceptable.
Recomendamos un valor de INR mediano, más que una gama de valores, para no considerar válidos valores extremos de INR, ya que los extremos de un intervalo no son tan seguros y efectivos como los valores medianos.
La alta variabilidad del INR es el más potente predictor independiente de reducción de la supervivencia después de un recambio valvular. Se ha demostrado que el control del tratamiento anticoagulante por el propio paciente reduce la variabilidad del INR y los eventos clínicos, pero requiere entrenarlo adecuadamente. No obstante, para los pacientes con un INR inestable o complicaciones relacionadas con la anticoagulación, hay que considerar el control del tratamiento anticoagulante en un centro especializado.
Manejo de la sobredosis de antagonistas de la vitamina K y sangradoEl riesgo de hemorragias mayores aumenta considerablemente cuando el INR excede de 4,5 y se incrementa de manera exponencial cuando el INR es > 6,0. Por lo tanto, un INR ≥ 6,0 requiere una rápida reversión de la anticoagulación por el riesgo de sangrado. En ausencia de hemorragia, el tratamiento depende del INR objetivo, el INR del paciente y la vida media del AVK utilizado. Se puede interrumpir la anticoagulación oral y permitir que el INR disminuya gradualmente o administrar vitamina K oral en incrementos de 1 o 2 mg223. Si el INR es > 10, se puede considerar dosis más altas de vitamina K oral (5mg). Es preferible la administración por vía oral a la intravenosa, ya que esta comporta mayor riesgo de anafilaxia223. La reversión inmediata de la anticoagulación sólo es necesaria en caso de sangrado intenso, definido como el que no se puede corregir con control local, pone en riesgo la vida o la función de un órgano importante (como el sangrado intracraneal), causa inestabilidad hemodinámica o requiere un procedimiento quirúrgico urgente o transfusión. El concentrado intravenoso de complejo protrombínico tiene una vida media corta y, si se utiliza, debe combinarse con vitamina K oral, independientemente del valor del INR223. Cuando sea posible, este concentrado es preferible al plasma fresco congelado. No se puede recomendar el uso del factor VII activado recombinante debido a la falta de datos. Tampoco hay datos que indiquen que el riesgo de tromboembolias debido a una reversión transitoria de la anticoagulación supere a las consecuencias de una hemorragia grave en pacientes con prótesis mecánicas. Se debe discutir el momento ideal para reiniciar el tratamiento anticoagulante, teniendo en cuenta la localización del evento hemorrágico, su evolución y las intervenciones realizadas para detener la hemorragia y/o tratar la causa subyacente. Cuando el INR está en intervalo terapéutico, las hemorragias a menudo están relacionadas con una causa patológica subyacente, por lo que es importante identificarla y tratarla.
Tratamiento combinado con anticoagulantes orales y agentes antiagregantesEs importante distinguir entre los posibles beneficios en la enfermedad vascular y los que son específicos de las válvulas protésicas a la hora de determinar si se añade un antiagregante plaquetario a la anticoagulación de pacientes con válvulas protésicas. Los estudios clínicos que muestran beneficio clínico de los antiagregantes plaquetarios en la enfermedad vascular y en pacientes con válvulas protésicas y enfermedad vascular no hay que tomarlos como evidencia de que los pacientes con válvulas protésicas y sin enfermedad vascular también pueden beneficiarse224. Cuando se añaden al tratamiento anticoagulante, los agentes antiagregantes aumentan el riesgo de hemorragias mayores225,226. Por lo tanto, no se debe prescribirlos a todos los pacientes con válvulas protésicas, sino que hay que reservarlos para indicaciones específicas de acuerdo con el análisis de los beneficios y el mayor riesgo de hemorragias mayores. Si se usan, se debe prescribir la dosis más baja recomendada (p. ej., ácido acetilsalicílico ≤ 100mg/día). Las indicaciones para la adición de un antiagregante plaquetario se muestran en la tabla 19. La adición de un antiagregante plaquetario debe decidirse tras una completa exploración y haber tratado los factores de riesgo identificados, además de optimizar el tratamiento anticoagulante. Es necesario añadir ácido acetilsalicílico y un bloqueador del receptor P2Y12 después de la implantación de un stent intracoronario, pero aumenta el riesgo de hemorragia. Los stents sin recubrir son preferibles a los stents liberadores de fármacos para reducir a 1 mes la administración de tratamiento antitrombótico triple20. Se debe considerar un régimen de tratamiento antitrombótico triple más largo (3-6 meses) para pacientes seleccionados con síndrome coronario agudo47. Durante este periodo se recomienda un control estrecho del INR para evitar en todo momento una anticoagulación excesiva20.
Por último, conviene señalar que no hay pruebas que respalden el uso de antiagregantes plaquetarios durante más de 3 meses en pacientes con bioprótesis sin más indicación que la presencia de la propia prótesis.
Suspensión del tratamiento anticoagulanteEl tratamiento anticoagulante durante la cirugía no cardiaca requiere una atención muy cuidadosa basada en la evaluación del riesgo203,227. Además de los factores protrombóticos relacionados con las prótesis o con los pacientes (tabla 20), la cirugía por una enfermedad maligna o un proceso infeccioso conlleva especial riesgo debido a la hipercoagulabilidad asociada a estas entidades.
Para la mayoría de los procedimientos quirúrgicos menores (como extracciones dentales y la cirugía de cataratas) y aquellos en que la hemorragia se puede controlar fácilmente, no se recomienda interrumpir la anticoagulación oral (recomendación de clase I, nivel de evidencia C). Se debe utilizar técnicas apropiadas de hemostasis y determinar el INR el mismo día de la intervención228,229.
Los procedimientos de cirugía mayor requieren un INR < 1,5. En pacientes con prótesis mecánicas, es necesario suspender el tratamiento anticoagulante antes de la cirugía, y se recomienda un tratamiento puente con heparina (recomendación de clase I, nivel de evidencia C)227–229. La HNF es el único tratamiento con heparina aprobado para pacientes con prótesis mecánicas; es preferible la administración intravenosa a la subcutánea (recomendación de clase IIa, nivel de evidencia C). Como alternativa a la HNF, se puede administrar HBPM por vía subcutánea como tratamiento puente (recomendación de clase IIa, nivel de evidencia C). Sin embargo, a pesar de su uso generalizado y los resultados positivos de estudios observacionales230,231, el uso de HBPM no está aprobado para pacientes con prótesis mecánicas debido a la falta de estudios controlados que la comparen con la HNF. Cuando se usa HBPM, se debe administrar dos veces al día en dosis terapéuticas adaptadas al peso corporal y, si es posible, con control de la actividad anti-Xa con un objetivo de 0,5-1,0 U/ml227. Las HBPM están contraindicadas en los casos de insuficiencia renal grave. La última dosis de HBPM se debe administrar > 12h antes del procedimiento, mientras que la HNF debe suspenderse 4h antes del procedimiento. La anticoagulación efectiva debe restablecerse lo antes posible después de un procedimiento quirúrgico, dependiendo del riesgo de sangrado, y mantenerse hasta que el INR se encuentre otra vez en el intervalo terapéutico227.
Cuando sea necesario, y después de una evaluación cuidadosa de la relación riesgo-beneficio, se debe interrumpir el tratamiento combinado con ácido acetilsalicílico 1 semana antes de un procedimiento no cardiaco.
La anticoagulación oral puede continuar en dosis modificadas para la mayoría de los pacientes sometidos a cateterización cardiaca, particularmente en caso de abordaje radial. En los casos raros de pacientes que precisan cateterización transeptal, punción directa del VI o pericardiocentesis, hay que interrumpir la anticoagulación oral e instaurar un tratamiento anticoagulante que sirva de puente, como ya se ha descrito203.
Para los pacientes que tengan un INR en valores subterapéuticos durante el control habitual, está indicado el tratamiento puente ya descrito con una HNF (o preferiblemente una HBPM) en régimen ambulatorio hasta que se alcance un nivel terapéutico del INR.
Tratamiento de la trombosis valvularSe debe sospechar inmediatamente una trombosis valvular obstructiva ante cualquier paciente con cualquier tipo de válvula protésica que se presenta con disnea reciente o evento embólico. La sospecha debe ser mayor si recientemente ha habido anticoagulación inadecuada o una causa de aumento de la coagulabilidad (como deshidratación, infección, etc.). El diagnóstico debe confirmarse por ETT y/o ETE o cinefluoroscopia210,232.
El tratamiento de la trombosis protésica es siempre de alto riesgo, sea cual sea la opción que se tome. La cirugía es de alto riesgo porque a menudo se realiza de urgencia y es una reintervención. Por otra parte, la fibrinolisis conlleva riesgos de hemorragia, embolia sistémica y trombosis recurrente233.
El análisis de los riesgos y beneficios de la fibrinolisis se debe adaptar a las características del paciente y a los recursos locales.
La sustitución valvular de urgencia es el tratamiento recomendado de la trombosis obstructiva de pacientes críticos sin comorbilidades graves (recomendación de clase I, nivel de evidencia C) (fig. 5). Si la trombogenicidad de la prótesis es un factor importante, se debe reemplazar por una prótesis menos trombogénica.
Tratamiento de la trombosis protésica obstructiva de lado izquierdo. AAS: ácido acetilsalicílico; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; HNF i.v.: heparina no fraccionada intravenosa.
*Hay que valorar individualizadamente los riesgos y beneficios de ambos tratamientos. La presencia de una prótesis de primera generación es un incentivo para la cirugía.
Se debe considerar la fibrinolisis en los siguientes casos:
- •
Pacientes críticos con pocas probabilidades de sobrevivir a la cirugía debido a las comorbilidades o una función cardiaca muy afectada antes de que apareciera la trombosis valvular.
- •
Situaciones en que la cirugía no esté disponible inmediatamente y el paciente no pueda ser trasladado.
- •
Trombosis de los recambios de las válvulas tricúspide o pulmonar, debido a una tasa de éxito más alta y al bajo riesgo de embolia sistémica.
En caso de inestabilidad hemodinámica, se recomienda la administración de un activador tisular de plasminógeno recombinante en bolo de 10mg seguido de infusión de 90mg durante 90min y HNF o estreptoquinasa en infusión de 1,5 × 106 U durante 60min sin HNF. En pacientes estables, se puede utilizar tiempos de infusión más largos234.
La fibrinolisis tiene menos probabilidades de éxito en la prótesis mitral, la trombosis crónica o en presencia de panículos, que pueden ser difíciles de distinguir de un trombo210,233.
La trombosis protésica no obstructiva se diagnostica con ETE realizada después del evento embólico o sistemáticamente después de la sustitución valvular mitral con una prótesis mecánica. El tratamiento depende principalmente de la aparición de un evento tromboembólico y del tamaño del trombo (fig. 6). Es imprescindible realizar un control estricto con ETE. El pronóstico es favorable con tratamiento médico en la mayoría de los casos en que el trombo es pequeño (< 10mm). Una buena respuesta con resolución gradual del trombo haces innecesarias la cirugía o la fibrinolisis. En cambio, se debe considerar la cirugía para trombos protésicos no obstructivos grandes (≥ 10mm) complicados con embolias (recomendación de clase IIa, nivel de evidencia C) o que persistan después de una anticoagulación óptima217. La fibrinolisis se puede considerar como alternativa si la cirugía tiene un riesgo elevado. Sin embargo, sólo se debe utilizar fibrinolisis en casos absolutamente necesarios, dado el riesgo de hemorragia y tromboembolias.
Tratamiento de las tromboemboliasLas tromboembolias después de la cirugía valvular son de origen multifactorial203. Aunque muchos eventos tromboembólicos se originan en la prótesis, muchos otros proceden de otras fuentes y forman parte de la incidencia habitual de ACV y accidentes isquémicos transitorios (AIT) en la población general. Por lo tanto, es esencial investigar en profundidad cada episodio tromboembólico (con técnicas de imagen cardiaca y no cardiaca) (fig. 6), sin limitarse únicamente a aumentar el INR deseado o añadir un fármaco antiplaquetario. La prevención de nuevos eventos tromboembólicos implica:
- •
El tratamiento o la reversión de factores de riesgo como FA, HTA, hipercolesterolemia, diabetes mellitus, tabaquismo, infección crónica y anomalías sanguíneas protrombóticas.
- •
Optimizar el control de la anticoagulación, por el propio paciente cuando sea posible, sobre la base de que un mejor control es más efectivo que simplemente aumentar el INR. Hay que discutir este aspecto con el neurólogo en caso de ACV reciente.
- •
Si no se había prescrito antes, se debe añadir ácido acetilsalicílico en dosis bajas (≤ 100mg/día), después de un análisis detallado del balance riesgo-beneficio. Se debe evitar la anticoagulación excesiva.
Los análisis sanguíneos en busca de hemolisis deben formar parte del seguimiento sistemático tras la sustitución valvular. La determinación de haptoglobina es demasiado sensible, mientras que la de lactato deshidrogenasa, aunque no es específica, se relaciona mejor con la intensidad de la hemolisis. El diagnóstico de anemia hemolítica precisa una ETE para detectar la fuga paravalvular (FPV) si la ETT no aporta información. Se recomienda la reoperación si la FPV se debe a endocarditis, causa una hemolisis que requiera transfusiones sanguíneas repetidas o produce síntomas graves (recomendación de clase I, nivel de evidencia C). Para los pacientes con anemia hemolítica grave y FPV no relacionada con endocarditis y contraindicación para la cirugía o que rechacen una reintervención, el tratamiento médico incluye suplementos de hierro, bloqueadores beta y eritropoyetina235. Aunque el cierre percutáneo de la FPV es factible, la experiencia es escasa y, por el momento, no hay evidencia concluyente sobre su eficacia236. Se puede considerar para pacientes seleccionados para quienes la reintervención suponga alto riesgo o esté contraindicada.
Tratamiento de la insuficiencia bioprotésicaDespués de los primeros 5 años tras el implante, o antes si se trata de pacientes jóvenes, es necesario realizar una ecocardiografía anual para detectar signos precoces de deterioro valvular estructural: endurecimiento de las valvas, calcificación, reducción en el área del orificio efectivo y/o regurgitación. Hay que comparar cuidadosamente los hallazgos ecocardiográficos y auscultatorios con los exámenes previos en el mismo paciente. Se debe aconsejar la reoperación a los pacientes sintomáticos que tengan un aumento significativo del gradiente transprotésico o regurgitación grave (recomendación de clase I, nivel de evidencia C), y se debe considerar para los pacientes asintomáticos con cualquier tipo de disfunción protésica significativa si tienen bajo riesgo con una reintervención (recomendación de clase IIa, nivel de evidencia C). Se puede considerar la posibilidad de realizar un recambio profiláctico de una bioprótesis implantada más de 10 años antes pero sin deterioro estructural durante una intervención sobre otra válvula o arteria coronaria (recomendación de clase IIb, nivel de evidencia C).
En la decisión de reoperar se debe tener en cuenta el riesgo de la reoperación y la situación de urgencia. Esto subraya la importancia de hacer un seguimiento cuidadoso que permita realizar la reintervención en el momento adecuado237.
Hay que evitar las intervenciones percutáneas con balón para el tratamiento de las bioprótesis estenóticas izquierdas. Se ha demostrado que es factible tratar el fallo de la bioprótesis implantando una válvula dentro de la válvula238,239, aunque la evidencia es escasa y, por lo tanto, no se lo puede considerar alternativa válida a la cirugía, excepto en pacientes inoperables o de alto riesgo, según el criterio del equipo cardiológico.
Insuficiencia cardiacaLa IC después de una cirugía valvular debe conducir a la búsqueda de complicaciones relacionadas con las prótesis, deterioro de la reparación, disfunción del VI o progresión de otra valvulopatía. También hay que considerar las causas no relacionadas con las válvulas, como EC, HTA o arritmias persistentes. El tratamiento de los pacientes con IC debe seguir las recomendaciones de las guías específicas13.
MANEJO DURANTE LA CIRUGÍA NO CARDIACALos pacientes con valvulopatías (especialmente si son graves) sometidos a cirugía no cardiaca tienen un riesgo significativo de morbimortalidad cardiovascular. El manejo perioperatorio de los pacientes con valvulopatías se basa en pruebas de menor nivel que las utilizadas para la cardiopatía isquémica, como se detalla en las guías específicas de la ESC227.
Evaluación preoperatoriaSe debe valorar la presencia de síntomas, arritmias o soplo, que justificaría la realización de un examen ecocardiográfico, particularmente en los ancianos. El riesgo cardiovascular se estratifica según el tipo de cirugía no cardiaca y se clasifica según el riesgo de complicaciones cardiacas227.
Cada caso se debe tratar individualizadamente y se debe discutir con los cardiólogos, anestesistas (idealmente con experiencia en cardiología), cirujanos (tanto cirujanos cardiacos como los que van a realizar la cirugía no cardiaca), el paciente y su familia.
Lesiones valvulares específicasEstenosis aórticaEn los pacientes con estenosis aórtica grave que precisan cirugía urgente no cardiaca, los procedimientos quirúrgicos deben realizarse con control hemodinámico estricto.
En los pacientes con estenosis aórtica grave que precisan cirugía no cardiaca electiva, el manejo depende sobre todo de si hay síntomas y el tipo de procedimiento quirúrgico (fig. 7)227,240,241.
Tratamiento de la estenosis aórtica grave y cirugía no cardiaca electiva según las características del paciente y el tipo de cirugía. EA: estenosis aórtica; SVA: sustitución valvular aórtica; VcB: valvuloplastia con balón; TAVI: implantación transcatéter de válvula aórtica.
aClasificación en tres grupos según el riesgo de complicaciones cardiacas (muerte a los 30 días e infarto de miocardio) con la cirugía no cardiaca227 (alto riesgo, > 5%; riesgo intermedio, 1-5%; bajo riesgo, < 1%).
bLa cirugía no cardiaca sólo debe realizarse en casos estrictamente necesarios. En la elección entre valvuloplastia con balón y TAVI, se debe tener en cuenta la esperanza de vida del paciente.
Para los pacientes sintomáticos, se debe considerar la sustitución valvular antes de la cirugía no cardiaca. Si la cirugía valvular comporta alto riesgo, hay que reevaluar la necesidad de la cirugía no cardiaca antes de considerar la posibilidad de una valvuloplastia aórtica con balón o TAVI.
En los pacientes asintomáticos con estenosis aórtica grave, se puede realizar de manera segura un procedimiento no cardiaco de riesgo bajo o moderado240. Si la cirugía no cardiaca es de alto riesgo, una estenosis aórtica muy grave, una calcificación valvular grave o los resultados anormales en la prueba de esfuerzo son incentivos para considerar primero la SVA. En pacientes asintomáticos cuya cirugía valvular comporta un riesgo alto, la cirugía no cardiaca, si realmente es necesaria, se debe llevar a cabo con estricto control hemodinámico. Cuando es necesaria la cirugía valvular antes de la cirugía no cardiaca, la bioprótesis es el sustituto valvular preferido para evitar problemas de anticoagulación durante la cirugía no cardiaca posterior.
Estenosis mitralEn pacientes asintomáticos con EM significativa y presión arterial pulmonar sistólica < 50mmHg, la cirugía no cardiaca puede realizarse de forma segura.
En pacientes sintomáticos o con una presión arterial pulmonar sistólica > 50mmHg, se debe intentar la corrección de la EM, por CMP siempre que sea posible, antes de la cirugía no cardiaca si esta es de alto riesgo. Cuando se precisa cirugía de recambio valvular, la decisión de actuar antes de la cirugía no cardiaca se debe tomar con precaución e individualizadamente.
Insuficiencia aórtica e insuficiencia mitralEn pacientes asintomáticos con IM o insuficiencia aórtica graves y función del VI preservada, la cirugía no cardiaca puede realizarse de forma segura. En presencia de síntomas o disfunción del VI, se recomienda considerar la cirugía valvular, aunque raramente es necesaria antes de la cirugía no cardiaca. En caso de función del VI deprimida (FE < 30%), la cirugía no cardiaca debe realizarse sólo cuando sea estrictamente necesario y tras optimizar el tratamiento médico de la IC.
Válvulas protésicasEl mayor problema es adaptar la anticoagulación para pacientes con prótesis mecánicas, que se trata en «Suspensión del tratamiento anticoagulante» (sección 11.2.2.5).
Control perioperatorioEn el manejo perioperatorio debe controlarse la frecuencia cardiaca (especialmente en la IM) para evitar la sobrecarga de fluidos, la depleción de volumen y la hipotensión (especialmente en la estenosis aórtica), y se debe optimizar la anticoagulación si fuera necesaria240.
En los pacientes con insuficiencia aórtica o IM moderadas o graves, se puede utilizar bloqueadores beta o amiodarona de forma profiláctica para mantener el ritmo sinusal241. El uso de bloqueadores beta y estatinas debe adaptarse al riesgo de cardiopatía isquémica de acuerdo con las guías de práctica clínica.
Tras la cirugía, es prudente el ingreso electivo en la unidad de cuidados intensivos de los pacientes con valvulopatías graves.
TRATAMIENTO DURANTE LA GESTACIÓNEl tratamiento de las valvulopatías durante la gestación se detalla en una guía específica de la ESC207. De manera resumida, deben discutir el manejo antes y después del embarazo y la planificación del parto entre el obstetra, el cardiólogo, la paciente y su familia, de acuerdo con las guías específicas sobre este tema. Idealmente, la valvulopatía debe evaluarse antes de la gestación y tratarla cuando sea necesario. En algunas afecciones puede desaconsejarse el embarazo.
Valvulopatía nativaLa EM a menudo se tolera mal cuando el área valvular es < 1,5cm2, incluso en pacientes previamente asintomáticas. La EM sintomática debe ser tratada con reposo absoluto y bloqueadores beta, posiblemente combinados con diuréticos. En caso de disnea persistente o hipertensión pulmonar a pesar del tratamiento farmacológico, se debe considerar la CMP en un centro con experiencia después de la semana 20 de gestación. En algunos casos seleccionados, está indicado el tratamiento anticoagulante207.
Las complicaciones de la estenosis aórtica grave ocurren principalmente en pacientes que estaban sintomáticas antes de la gestación. El riesgo de IC es bajo cuando el gradiente aórtico medio es < 50mmHg.
La insuficiencia aórtica y la IM crónicas se toleran bien durante el embarazo, incluso cuando son graves, siempre que la función sistólica del VI esté preservada. La cirugía con bypass cardiopulmonar se asocia a una tasa de mortalidad fetal de un 20-30% y se debe restringir a los casos poco frecuentes en que la vida de la madre corre peligro.
Válvulas protésicasLa mortalidad materna estimada varía entre el 1 y el 4% de las mujeres con válvulas mecánicas. Estas pacientes deben ser informadas de los riesgos y restricciones asociados al tratamiento anticoagulante en caso de embarazo. Durante el primer trimestre de la gestación, hay que sopesar cuidadosamente los respectivos riesgos materno y fetal a la hora de elegir entre un AVK, HNF o HBPM. Se favorece el uso de AVK durante el segundo y tercer trimestre hasta la semana 36, cuando se debe sustituirlos por heparina207.