Una red para la atención del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) activada por no cardiólogos reduce los retrasos en la atención, pero pueden aumentar los falsos positivos. El objetivo es evaluar la prevalencia, los predictores y el impacto de los diagnósticos falsos positivos dentro de la red catalana para la atención del IAMCEST (Codi Infart).
MétodosSe incluyó a los pacientes atendidos por el Codi Infart entre enero de 2010 y diciembre de 2011. Se consideró activación apropiada si se cumplían los criterios clínicos y electrocardiográficos de IAMCEST. Las activaciones apropiadas se clasificaron como falso positivo según 2 definiciones no excluyentes: a) «angiográfica» si no se identificó una arteria causal, y b) «clínica» si el diagnóstico al alta no era IAMCEST.
ResultadosSe incluyó un total de 5.701 activaciones. La activación resultó apropiada en el 87,8% de las veces. Los falsos positivos angiográficos fueron el 14,6% y los clínicos, el 11,6%. El sexo femenino, el bloqueo de rama izquierda y el antecedente de infarto de miocardio se asociaron con el falso positivo. Utilizando la definición clínica, se observó una tasa de falsos positivos mayor en los hospitales sin sala de hemodinámica y los pacientes con complicaciones durante el primer contacto. La mortalidad hospitalaria y a los 30 días fue similar entre los falsos y los verdaderos positivos.
ConclusionesLa evolución clínica es similar entre los pacientes con falsos positivos y aquellos con verdaderos positivos. La identificación de predictores de falsos positivos justifica una evaluación cuidadosa para optimizar el uso de las redes de IAMCEST.
Palabras clave
Vídeo del artículo

La intervención coronaria percutánea (ICP) es el tratamiento de elección para pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) si la realizan expeditivamente profesionales bien capacitados1,2. Una reducción del tiempo total de isquemia mejora los resultados clínicos en los pacientes con IAMCEST3,4, y la decisión sobre el tratamiento de reperfusión debe tomarse de inmediato tras el primer contacto médico (PCM). Una estrategia clave para reducir el tiempo PCM-balón es permitir que los profesionales de la salud que atienden al paciente hagan el diagnóstico, elijan las estrategias de reperfusión y lo trasladen a un laboratorio de cateterismo cardiaco o le administren tratamiento trombolítico en función de la información clínica y del electrocardiograma (ECG)5–7.
La elección de la estrategia de reperfusión por profesionales de la salud no cardiólogos podría reducir el tiempo de isquemia total, pero es posible que aumentara las activaciones inapropiadas de la red de IAMCEST o los diagnósticos de IAMCEST falsos positivos. Además, según cuál sea el estado clínico del paciente, el cateterismo cardiaco en pacientes sin IAMCEST podría conllevar consecuencias nocivas relacionadas con la intervención y debería evitarse. La identificación de los factores predictivos de diagnósticos de IAMCEST falsos positivos deberá ayudar a los profesionales de la salud a mejorar la exactitud diagnóstica.
El objetivo de este estudio es determinar la prevalencia de las activaciones inapropiadas de la red de IAMCEST y los diagnósticos de IAMCEST falsos positivos, así como su influencia en los resultados clínicos.
MÉTODOSSe realizó un estudio multicéntrico observacional y basado en los datos obtenidos prospectivamente de pacientes consecutivos tratados en la red de IAMCEST de Cataluña (Codi Infart) entre enero de 2010 y diciembre de 2011.
Cataluña es una comunidad autónoma del noreste de España, con una población de aproximadamente 7.500.000 habitantes. En junio de 2009, se creó en Cataluña una red regional de IAMCEST8,9. Con objeto de proporcionar el tratamiento de reperfusión más apropiado a cada paciente, la red se dividió en áreas de referencia con hospitales que disponían de ICP. La red de Codi Infart tiene 4 componentes: a) ambulancias de servicios de emergencias médicas (SEM) con médicos o enfermeras capaces de diagnosticar los síntomas, interpretar un ECG, elegir una estrategia de reperfusión y administrar un tratamiento fibrinolítico; b) un centro de distribución del SEM que coordina la logística entre las ambulancias o los hospitales locales y los hospitales con capacidad para ICP primaria; c) 10 hospitales con capacidad para ICP primaria, que en 5 era de disponibilidad ininterrumpida (en el periodo que abarca este estudio), y d) un registro del Codi Infart, con la inclusión prospectiva de todos los pacientes tratados en la red; se registran los datos demográficos, clínicos y de la intervención, los tiempos de retraso y las complicaciones hospitalarias. Se evaluó la mortalidad por cualquier causa mediante una llamada telefónica 30 días después del episodio. Las complicaciones durante el PCM definidas fueron las siguientes: parada cardiaca, taquicardia ventricular, bloqueo auriculoventricular, shock cardiogénico, ventilación mecánica y hemorragia grave.
La red Codi Infart se activa después de que un profesional de la salud haya diagnosticado a un paciente un IAMCEST basándose en criterios de ECG y clínicos. Una vez activada la red, se elige la estrategia de reperfusión aplicando las guías habituales. Si se opta por una ICP primaria, el paciente es trasladado al centro con ICP primaria más cercano; tras la ICP primaria y cuando el paciente está clínicamente estable, se lo traslada al centro de referencia para evitar una sobresaturación de los centros con ICP. A todos los pacientes tratados con fibrinolisis se los traslada a un centro con ICP inmediatamente si la fibrinolisis no da resultado o para una coronariografía electiva. El tratamiento de prevención secundaria se prescribe según la práctica médica habitual.
Los criterios de activación del código por IAMCEST se definieron según la definición universal del infarto de miocardio10: a) criterios de ECG con elevación del segmento ST de nueva aparición o bloqueo de rama izquierda del haz de His (BRI) presuntamente de nueva aparición, y b) criterios clínicos de posibles síntomas isquémicos, como diversas combinaciones de molestias en tórax, extremidades superiores, mandíbula o epigastrio, o un equivalente isquémico como disnea o fatiga. Los cardiólogos que han atendido al paciente tras su llegada al centro de ICP primaria (centro de referencia) son los responsables de determinar si se han cumplido los criterios para la activación del código de IAMCEST y registrar esta decisión en la base de datos del registro Codi Infart.
La activación inapropiada del código de IAMCEST se definió como cualquier activación de la red por pacientes en los que no se diera 1 o ninguno de los criterios de activación por IAMCEST antes descritos.
Se han propuesto varias definiciones de los diagnósticos de IAMCEST «falsos positivos»11-14. Para los fines de este estudio, se tuvo en cuenta 2 definiciones: a) definición angiográfica, que incluye a los pacientes sin una arteria coronaria culpable (oclusión aguda total o subtotal de una arteria coronaria o una lesión coronaria con un trombo visible), y b) definición clínica, que incluye a los pacientes con un diagnóstico al alta distinto del IAMCEST, como angina inestable, infarto de miocardio sin elevación del segmento ST (IAMSEST) y síndrome coronario no agudo, con independencia del tratamiento.
La cohorte de estudio se dividió en 2 grupos, en función de que la activación hubiera sido apropiada o no (grupo 1: activación inapropiada; grupo 2: activación apropiada). El grupo 2 se clasificó según las 2 definiciones preespecificadas del diagnóstico de IAMCEST falso positivo, que no eran mutuamente excluyentes. Para el objetivo de este estudio, cuando el PCM se producía en un centro sin capacidad permanente de ICP en horario sin disponibilidad, el lugar del PCM se registraba como centro de ICP.
Análisis estadísticoSe exploró si las variables continuas tenían una distribución normal con la prueba de Kolmogorov-Smirnov. Las variables con distribución normal se expresan como media ± desviación estándar y las variables de distribución no normal, como mediana [intervalo intercuartílico]; se compararon con pruebas de la t de Student y U de Mann-Whitney, según fuera apropiado. Las variables discretas se expresan en forma de número (porcentaje) y se compararon con la prueba de la χ2. Se realizó un análisis de regresión logística mediante el método de exclusión retrógrada basado en el cociente de verosimilitudes, con objeto de evaluar el efecto de las variables explicativas en la presencia de activación inapropiada o el diagnóstico de IAMCEST falso positivo. Las variables incluidas en el modelo de regresión ajustado final se seleccionaron en función de una combinación de la significación estadística (p< 0,10) y el juicio clínico. Los resultados se presentan en forma de odds ratio (OR) junto con sus intervalos de confianza del 95% (IC95%). Para evaluar la asociación entre el tipo de activación y la mortalidad por cualquier causa hospitalaria y a los 30 días, se realizaron análisis de regresión de Cox de riesgos proporcionales. Se llevó a cabo un análisis univariable exploratorio, y las covariables que tenían una justificación clínica o p< 0,10 se incluyeron en los modelos de Cox. Los resultados se presentan en forma de hazard ratio (HR) con su IC95%. Todos los valores de p fueron bilaterales, con un nivel de significación estadística de p< 0,05. Los análisis estadísticos se llevaron a cabo con el programa informático SPSS versión 20.0 (SPSS, Inc.; Chicago, Illinois, Estados Unidos).
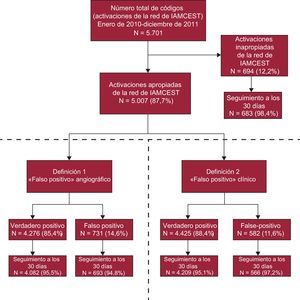
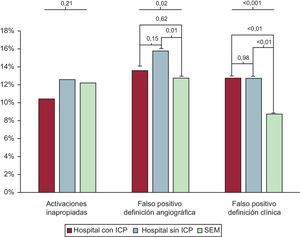
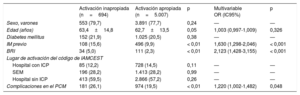
RESULTADOSActivaciones apropiadas e inapropiadasDurante el periodo de estudio de 2 años, se activaron 5.701 códigos de IAMCEST en la red Codi Infart. De ellos, 5.007 (87,8%) cumplían los criterios clínicos y de ECG de activación apropiada; 694 (12,2%) se clasificaron como activaciones inapropiadas (figura 1). Las características principales según las activaciones fueran apropiadas o inapropiadas se muestran en la tabla 1. En 216 activaciones inapropiadas (31,1%), la ausencia de BRI o elevación del segmento ST hacía que no se cumplieran los criterios de ECG. Los 478 episodios restantes (68,9%) mostraron discrepancia en los criterios clínicos de IAMCEST según el cardiólogo del hospital con ICP. No se observaron diferencias estadísticamente significativas en estos resultados entre los distintos puntos de activación de la red de IAMCEST (figura 2). Los pacientes con una activación inapropiada eran de más edad y tenían mayor prevalencia de infartos de miocardio previos (tabla 1). El BRI fue más frecuente entre los pacientes con una activación inapropiada que en los que cumplían los criterios clínicos y de ECG (el 5,0 frente al 2,3%; p< 0,01). Se llevó a cabo ICP en 240 pacientes (34,6%) del grupo de activación inapropiada. La angina inestable y el IAMSEST fueron los diagnósticos al alta de 51 (7,3%) y 55 pacientes (7,9%) respectivamente. En el análisis multivariable, el infarto de miocardio previo, el BRI y las complicaciones durante el PCM mostraron una asociación independiente con un mayor riesgo de activación inapropiada (tabla 1). La mortalidad hospitalaria fue similar entre activaciones inapropiadas y apropiadas (el 3,9 frente al 2,8%; p=0,12). En el seguimiento a los 30 días, la mortalidad también era similar (el 7,8 frente al 6,1%; p=0,10).
Factores univariables y multivariables predictivos de las activaciones inapropiadas de la red de IAMCEST
| Activación inapropiada (n=694) | Activación apropiada (n=5.007) | p | Multivariable OR (IC95%) | p | |
|---|---|---|---|---|---|
| Sexo, varones | 553 (79,7) | 3.891 (77,7) | 0,24 | — | — |
| Edad (años) | 63,4±14,8 | 62,7±13,5 | 0,05 | 1,003 (0,997-1,009) | 0,326 |
| Diabetes mellitus | 152 (21,9) | 1.025 (20,5) | 0,38 | — | — |
| IM previo | 108 (15,6) | 496 (9,9) | < 0,01 | 1,630 (1,298-2,046) | < 0,001 |
| BRI | 34 (5,0) | 111 (2,3) | < 0,01 | 2,123 (1,428-3,155) | < 0,001 |
| Lugar de activación del código de IAMCEST | |||||
| Hospital con ICP | 85 (12,2) | 728 (14,5) | 0,11 | — | — |
| SEM | 196 (28,2) | 1.413 (28,2) | 0,99 | — | — |
| Hospital sin ICP | 413 (59,5) | 2.866 (57,2) | 0,26 | — | — |
| Complicaciones en el PCM | 181 (26,1) | 974 (19,5) | < 0,01 | 1,220 (1,002-1,482) | 0,048 |
BRI: bloqueo de rama izquierda; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; OR: odds ratio; PCM: primer contacto médico; SEM: servicio de emergencias médicas.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
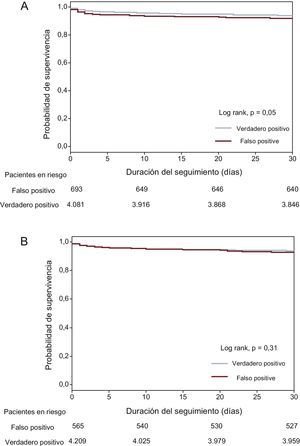
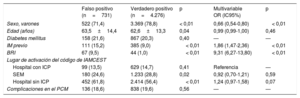
De un total de 5.007 activaciones apropiadas del código de IAMCEST, 731 (14,6%) se clasificaron como diagnósticos de IAMCEST falsos positivos según la definición angiográfica (figura 1). Cuando el PCM se produjo en un hospital sin ICP, el porcentaje de falsos positivos fue superior a la media; en cambio, hubo mayor porcentaje de diagnósticos de IAMCEST verdaderos positivos cuando el PCM se produjo a través del SEM. El porcentaje de falsos positivos fue mayor en los hospitales sin ICP que en aquellos con ICP y en el SEM (figura 2). Los diagnósticos de IAMCEST clasificados como «falsos positivos» según la definición angiográfica fueron más frecuentes en los pacientes de edad avanzada, las mujeres y los pacientes con una prevalencia superior de infarto de miocardio previo (tabla 2). Además, la proporción de pacientes con BRI fue mayor en el grupo de resultados angiográficos falsos positivos que en el de verdaderos positivos. En el análisis multivariable, el sexo femenino, el infarto de miocardio previo y el BRI mostraron una asociación independiente con un mayor riesgo de diagnósticos falsos positivos. Los factores predictivos univariables y multivariables de los diagnósticos angiográficos falsos positivos se muestran en la tabla 2. Por definición, no se trató con ICP a ningún paciente del grupo de falsos positivos angiográficos; sin embargo, se trató con fibrinolisis a un porcentaje de pacientes de este grupo mayor que en el de verdaderos positivos (el 9,2 frente al 6,7%; p=0,02). Entre los pacientes con diagnósticos falsos positivos hubo menor prevalencia de bloqueo auriculoventricular en el PCM y durante la hospitalización (el 2,5 frente al 4,4%; p=0,01, y el 1,1 frente al 3,9%; p< 0,01) y también una menor prevalencia de fibrilación ventricular o taquicardia ventricular durante la hospitalización (el 2,5 frente al 5,3%; p=0,02). La prevalencia de shock cardiogénico durante el PCM fue numéricamente superior en el grupo de falsos positivos, aunque sin alcanzar la significación estadística (el 5,7 frente al 4,4%; p=0,10). El diagnóstico final fue de angina inestable en el 16,3% de los pacientes clasificados como IAMCEST falso positivo según la definición clínica y de IAMSEST en el 0,52%; a los demás pacientes se los clasificó como síndromes coronarios no agudos. Por lo que respecta a los pacientes clasificados como IAMCEST falso positivo según la definición angiográfica, el 9,3% tuvo un diagnóstico de angina inestable y el 9,4%, de IAMSEST, mientras que en los restantes el diagnóstico no fue de síndrome coronario agudo. Las tasas brutas de mortalidad hospitalaria y a los 30 días entre los pacientes con diagnóstico angiográfico falso positivo fueron mayores que entre aquellos con diagnóstico verdadero positivo (el 4,5 frente al 2,6%; p=0,01, y el 7,8 frente al 5,8%; p=0,05) (figura 3A). Sin embargo, después del ajuste por posibles factores de confusión, los riesgos de mortalidad hospitalaria y a los 30 días fueron similares en los 2 grupos (HR=0,94 [IC95%, 0,61-1,47] y HR=1,04 [IC95%, 0,76-1,42]).
Factores univariables y multivariables predictivos de las activaciones de la red IAMCEST por falso positivo (definición angiográfica)
| Falso positivo (n=731) | Verdadero positivo (n=4.276) | p | Multivariable OR (IC95%) | p | |
|---|---|---|---|---|---|
| Sexo, varones | 522 (71,4) | 3.369 (78,8) | < 0,01 | 0,66 (0,54-0,80) | < 0,01 |
| Edad (años) | 63,5±14,4 | 62,6±13,3 | 0,04 | 0,99 (0,99-1,00) | 0,46 |
| Diabetes mellitus | 158 (21,6) | 867 (20,3) | 0,40 | — | — |
| IM previo | 111 (15,2) | 385 (9,0) | < 0,01 | 1,86 (1,47-2,36) | < 0,01 |
| BRI | 67 (9,5) | 44 (1,0) | < 0,01 | 9,31 (6,27-13,80) | < 0,01 |
| Lugar de activación del código de IAMCEST | |||||
| Hospital con ICP | 99 (13,5) | 629 (14,7) | 0,41 | Referencia | — |
| SEM | 180 (24,6) | 1.233 (28,8) | 0,02 | 0,92 (0,70-1,21) | 0,59 |
| Hospital sin ICP | 452 (61,8) | 2.414 (56,4) | < 0,01 | 1,24 (0,97-1,58) | 0,07 |
| Complicaciones en el PCM | 136 (18,6) | 838 (19,6) | 0,56 | — | — |
BRI: bloqueo de rama izquierda; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; OR: odds ratio; PCM: primer contacto médico; SEM: servicio de emergencias médicas.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Curvas de supervivencia de Kaplan-Meier un seguimiento a los 30 días. A: definición angiográfica; verdadero positivo (azul) frente a falso positivo (rojo). B: definición clínica; verdadero positivo (azul) frente a falso positivo (rojo). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
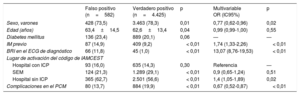
De un total de 5.007 activaciones apropiadas del código de IAMCEST, 582 (11,6%) se clasificaron como falsos positivos clínicos (figura 1). De manera similar a lo observado con la definición angiográfica, cuando los pacientes acudieron inicialmente a un hospital sin ICP, la prevalencia de falsos positivos fue superior a la media, pero cuando el PCM se produjo a través del SEM hubo un número significativamente inferior de episodios clasificados como falsos positivos (figura 2). La proporción de pacientes con BRI fue mayor en el grupo de resultados clínicos falsos positivos que en el de verdaderos positivos. Los diagnósticos de IAMCEST falsos positivos según la definición del diagnóstico al alta se dieron en pacientes que con mayor frecuencia eran ancianos o mujeres y tenían una prevalencia superior de infartos de miocardio previos (tabla 3). En el análisis multivariable, el sexo femenino, el infarto de miocardio previo, el BRI y las complicaciones durante el PCM mostraron asociación independiente con un mayor riesgo de diagnósticos falsos positivos según la definición clínica. Además, la activación de la red de IAMCEST por el SEM presentó una asociación independiente con un menor riesgo de diagnósticos falsos positivos, en comparación con la activación de la red en un hospital local sin ICP. Los factores predictivos univariables y multivariables de los diagnósticos clínicos falsos positivos se muestran en la tabla 3. Los pacientes clasificados como falsos positivos con la definición clínica mostraron menor probabilidad de que se los tratara con fibrinolisis, ICP primaria o ICP de rescate; no obstante, se trató con ICP primaria o de rescate a 132 pacientes (22,6%) del grupo de falsos positivos. Entre los pacientes con diagnósticos «falsos positivos», hubo menor prevalencia de bloqueo auriculoventricular en el PCM (el 2,6 frente al 4,3%; p=0,04) y durante la hospitalización (el 0,5 frente al 3,9%; p< 0,01) y también menor prevalencia de fibrilación ventricular o taquicardia ventricular durante el PCM (el 5,2 frente al 7,5%; p=0,03) y durante la hospitalización (el 1,7 frente al 5,3%; p< 0,01). Las prevalencias de shock cardiogénico fueron similares entre los 2 grupos durante el PCM (el 4,8 frente al 4,5%; p< 0,77) y la hospitalización (el 5,0 frente al 6,1%; p=0,27). Las tasas brutas de mortalidad durante la hospitalización y a los 30 días fueron similares entre los pacientes con una activación por falso positivo según lo indicado por el diagnóstico al alta (el 3,3 frente al 2,8%; p=0,51) y aquellos con una activación verdadera positiva (el 7,1 frente al 6,0%; p=0,31) (figura 3B).
Factores univariables y multivariables predictivos de las activaciones de la red IAMCEST por falso positivo (definición clínica)
| Falso positivo (n=582) | Verdadero positivo (n=4.425) | p | Multivariable OR (IC95%) | p | |
|---|---|---|---|---|---|
| Sexo, varones | 428 (73,5) | 3.463 (78,3) | 0,01 | 0,77 (0,62-0,96) | 0,02 |
| Edad (años) | 63,4±14,5 | 62,6±13,4 | 0,04 | 0,99 (0,99-1,00) | 0,55 |
| Diabetes mellitus | 136 (23,4) | 889 (20,1) | 0,06 | — | — |
| IM previo | 87 (14,9) | 409 (9,2) | < 0,01 | 1,74 (1,33-2,26) | < 0,01 |
| BRI en el ECG de diagnóstico | 66 (11,8) | 45 (1,0) | < 0,01 | 13,07 (8,76-19,53) | < 0,01 |
| Lugar de activación del código de IAMCEST | |||||
| Hospital con ICP | 93 (16,0) | 635 (14,3) | 0,30 | Referencia | — |
| SEM | 124 (21,3) | 1.289 (29,1) | < 0,01 | 0,9 (0,65-1,24) | 0,51 |
| Hospital sin ICP | 365 (62,7) | 2.501 (56,6) | < 0,01 | 1,4 (1,05-1,89) | 0,02 |
| Complicaciones en el PCM | 80 (13,7) | 884 (19,9) | < 0,01 | 0,67 (0,52-0,87) | < 0,01 |
BRI: bloqueo de rama izquierda; ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; OR: odds ratio; PCM: primer contacto médico; SEM: servicio de emergencias médicas.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
El presente estudio describe las características demográficas y los resultados clínicos de los diagnósticos de IAMCEST falsos positivos de una red regional en una cohorte de pacientes amplia. Los resultados principales pueden resumirse de la siguiente forma: a) se observó una alta prevalencia de diagnósticos de IAMCEST falsos positivos; b) el sexo femenino, los antecedentes de infarto de miocardio previos y el BRI fueron factores independientes predictivos de diagnóstico «falso positivo», ya fuera por definición clínica o angiográfica; c) la presencia de complicaciones clínicas durante el PCM se asoció también de manera independiente con mayor porcentaje de diagnósticos falsos positivos; d) las activaciones de la red de SEM se asociaron con un porcentaje de «falsos positivos» inferior cuando se utilizó la definición clínica, y e) no se observaron diferencias en la mortalidad a los 30 días entre los grupos de falsos positivos y verdaderos positivos.
Al utilizar las definiciones no mutuamente excluyentes angiográfica y clínica, se identificaron diagnósticos de IAMCEST falsos positivos en, respectivamente, el 14,6 y el 11,6% de las activaciones de IAMCEST apropiadas. El porcentaje de diagnósticos falsos positivos es similar al descrito en otras series, y oscila entre el 14 y el 36%12,14.
El sexo femenino, el antecedente de infarto de miocardio y el BRI en el ECG diagnóstico fueron factores independientes predictivos de la activación por falso positivo. Anteriormente se ha descrito que el sexo femenino es un factor independiente predictivo del retraso en solicitar atención médica y de la activación falsa positiva de la red de IAMCEST. Se sabe que las mujeres tienen síntomas diferentes que los varones en el infarto de miocardio15. La diferencia en la forma de presentación clínica podría explicar el mayor porcentaje de falsos positivos observado con las definiciones clínicas. Las mujeres presentan también un porcentaje superior de infarto agudo de miocardio sin ateroesclerosis coronaria obstructiva, lo que podría explicar también el mayor porcentaje de falsos positivos con la definición angiográfica. En el análisis multivariable, la presencia de un patrón de BRI se asoció al riesgo más alto de diagnóstico falso positivo. Incluso empleando los criterios de ECG específicos para el diagnóstico de infarto agudo de miocardio en presencia de un BRI16, este se ha asociado de manera uniforme a un porcentaje superior de diagnósticos falsos positivos. A pesar del mayor porcentaje de diagnósticos falsos positivos en los pacientes con BRI y síntomas de un posible infarto de miocardio, los pacientes con BRI e infarto de miocardio verdadero positivo tienen mala evolución clínica17 y se debe tener precaución antes de descartar un infarto agudo de miocardio y los tratamientos de reperfusión para estos pacientes18,19.
En el presente estudio, 694 activaciones (12,2%) se clasificaron como inapropiadas al aplicar las guías actuales1. Este porcentaje es similar al observado en otros registros, en los que osciló entre el 5 y el 31%20. Se recomienda precaución al comparar el porcentaje de activaciones inapropiadas, debido al empleo de definiciones diferentes y el uso incorrectamente indistinto de los términos «inapropiado» y «falso positivo». Garvey et al.20 examinaron el porcentaje y los resultados de la activación inapropiada del código de IAMCEST en una red estatal de Estados Unidos, con 14 centros regionales de ICP. Para clasificarlas como inapropiadas, las activaciones debían haber sido canceladas a causa de una reinterpretación del ECG o porque el paciente no fuera apto para un cateterismo cardiaco según la iniciativa Reperfusion of Acute Myocardial Infarction in the North Carolina Emergency Departments (RACE). De las 5.073 alertas, se incluyó en el análisis a 3.973 pacientes, y se observó un 15% de activaciones inapropiadas. A diferencia de ese estudio, nuestro grupo no observó diferencias en el porcentaje de activaciones inapropiadas en función de cuál fuera el punto de activación. El porcentaje de activaciones inapropiadas por el SEM similar al de los hospitales sin ICP o con ICP primaria en Cataluña podría explicarse por el personal de que disponen las ambulancias del SEM con apoyo vital avanzado, que cuentan con enfermeras o médicos que podrían tener más experiencia en el diagnóstico de los pacientes con IAMCEST que el personal de un hospital local. La activación del IAMCEST fuera del hospital por personal no médico se ha asociado con un porcentaje superior de activaciones inapropiadas21, aunque la seguridad y la efectividad de la activación de la red de IAMCEST fuera del hospital por personal no médico se han estudiado ampliamente y están validadas17,22–26.
Se observó mayor mortalidad en el grupo de falsos positivos angiográficos que en el de IAMCEST verdaderos positivos; sin embargo, después de un ajuste por posibles factores de confusión, esta diferencia dejó de ser significativa. Los resultados son similares a los observados en estudios previos14 y resaltan las similares tasas de mortalidad de los pacientes con independencia de su clasificación como IAMCEST falso positivo o verdadero positivo. Una vez activada la red de IAMCEST, el acceso a un hospital terciario con asistencia cardiológica aguda e intensiva especializada es inmediato en nuestra red. Para evitar retrasos innecesarios, el protocolo de la red de IAMCEST evita la necesidad de que un cardiólogo diagnostique el IAMCEST. En este contexto, se podía trasladar a un centro con asistencia cardiológica especializada a los pacientes en situación crítica que no cumplían ambos criterios (clínicos y de ECG), como aquellos en alto riesgo para los que podía ser útil un diagnóstico temprano, lo que explica la mayor mortalidad observada en los grupos de activación inapropiada y de diagnóstico de IAMCEST falso positivo.
LimitacionesEl presente estudio tiene varias limitaciones que es preciso resaltar. Las observaciones son el resultado de un análisis retrospectivo. El diagnóstico al alta se clasificó como IAMCEST u otro, y no se estableció el diagnóstico alternativo. No se obtuvo información sobre la mortalidad a los 30 días de todos los pacientes, si bien los datos no disponibles fueron menos del 5% en ambos grupos. Otra limitación es el tiempo transcurrido entre la última fecha de seguimiento y la presentación de los resultados. Sin embargo, los resultados del presente estudio parecen válidos, puesto que las características de la población del estudio son similares a las de registros de IAMCEST contemporáneos27. Además, aunque los hospitales de la red Codi Infart con disponibilidad ininterrumpida han aumentado de 5 a 10 desde el inicio del periodo de estudio, los principales componentes de la red y su organización se han mantenido inalterados. Otra limitación de este estudio es el seguimiento relativamente breve. Las conclusiones deben interpretarse como generadoras de hipótesis y deberán confirmarse en futuros estudios con seguimiento más largo.
CONCLUSIONESLos diagnósticos de IAMCEST falsos positivos dentro de una red regional fueron frecuentes. Los pacientes tratados dentro de una red de IAMCEST pese a no cumplir los criterios de IAMCEST mostraron una mortalidad a corto plazo similar a la de los pacientes con un IAMCEST verdadero. La presencia de todo factor modificable predictivo de diagnóstico de IAMCEST falso positivo justifica una evaluación cuidadosa para optimizar el uso de las redes de IAMCEST.
FINANCIACIÓNSe dispuso de ayuda para la realización del análisis estadístico del estudio, financiada por el programa Codi Infart del Pla director de malalties de l’aparell circulatori.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La reducción del tiempo total de isquemia mejora los resultados clínicos de los pacientes con IAMCEST.
- –
La reducción del tiempo PCM-balón en los pacientes con IAMCEST puede conseguirse permitiendo que los profesionales de la salud que los atienden establezcan el diagnóstico, elijan las estrategias de reperfusión y los trasladen a los laboratorios de cateterismo cardiaco.
- –
Los resultados a corto plazo de los pacientes con diagnósticos de elevación del segmento ST verdaderos positivos o falsos positivos tratados en una red de IAMCEST son similares.
- –
Con independencia de la definición de IAMCEST falso positivo utilizada, los factores asociados con mayor riesgo de diagnóstico de IAMCEST falso positivo fueron el sexo femenino, el antecedente de infarto de miocardio y el BRI.
- –
La presencia de complicaciones clínicas durante el PCM se asocia con un porcentaje superior de diagnósticos de IAMCEST falsos positivos según la definición clínica.
Los autores quisieran dar las gracias a todos los profesionales participantes en el programa Codi Infart. Se agradece a Ignacio Ferreira-González y Josep Ramón Marsal su inestimable ayuda en el análisis estadístico.