La hipotermia leve terapéutica (HLT) se ha relacionado con un aumento del riesgo de eventos trombóticos y hemorrágicos en los pacientes comatosos que han sobrevivido a una parada cardiaca extrahospitalaria (PCEH) y los pacientes con síndrome coronario agudo (SCA) tras PCEH sometidos a intervención coronaria percutánea (ICP)1,2. Hay controversia respecto a la asociación de la HLT con un aumento del riesgo de trombosis del stent (TS)3. El solo estado posterior a una parada cardiaca (PC) podría aumentar el riesgo trombótico/hemorrágico, con independencia de la HLT, lo cual ha generado un debate respecto a los efectos clínicos de la HLT en sí3,4. El objetivo de este estudio es determinar la incidencia de eventos trombóticos/hemorrágicos en los pacientes con SCA tras PCFH según se les aplique o HLT o no.
Se trata de un estudio observacional unicéntrico. Se examinó para su posible inclusión a pacientes consecutivos ingresados en nuestro hospital entre el año 2005 y enero de 2016 con SCA tras PCEH y tratados con ICP. Desde 2010, en nuestro centro se ha utilizado el protocolo de HLT para los pacientes en coma tras una PCEH de presunta causa cardiaca, independientemente del ritmo cardiaco inicial. Se compararon los resultados obtenidos en estos pacientes con los de otros no sometidos a HLT entre 2005 y 2009.
Los criterios de exclusión fueron pacientes con PCEH y contraindicaciones para la HLT (embarazo, temperatura al ingreso < 30°C, uso de cumarínicos, uso previo de un fibrinolítico, hemorragia aguda intracraneal sospechada o conocida, ictus) y pacientes que fallecieron antes de la intervención de cualificación para el estudio. El estudio fue aprobado por el comité de ética de investigación de nuestro centro (recogida de datos retrospectiva).
Se remitió al laboratorio de cateterismo cardiaco a todos los supervivientes a PCEH con alto grado de sospecha de SCA (cambios electrocardiográficos, ritmo cardiaco desfibrilable inicial o dolor torácico previo). Se administró tratamiento con ácido acetilsalicílico y heparina. Se realizó una ICP si había una lesión aterotrombótica coronaria aguda. Inmediatamente después de la ICP, se administró por sonda nasogástrica una dosis de carga mediante comprimidos de inhibidores del P2Y12 triturados. Tras ella, se administró una dosis de mantenimiento. Desde 2010, se aplicó a los pacientes HLT hasta 33°C según el protocolo local de la unidad de cuidados intensivos.
El objetivo principal fue la aparición de eventos trombóticos, incluida la TS definitiva o probable, así como la incidencia de eventos hemorrágicos evaluados según los criterios de Bleeding Academic Research Consortium durante la hospitalización.
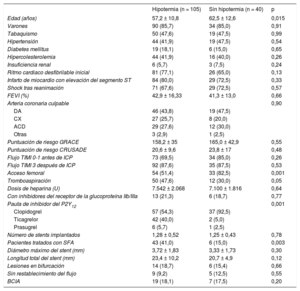
De 2005 a 2016, se trató a 204 pacientes en la unidad de cuidados intensivos cardiacos después de una PCEH. De ellos, 145 sufrieron un SCA. De 2005 a 2009, se trató a 40 pacientes (38%) sin HLT, mientras que de 2010 a 2016 se trató con HLT a 105 (62%). Las características clínicas basales y las características de la intervención se presentan en la tabla 1. Durante la hospitalización, no hubo diferencias entre los grupos por lo que respecta a los eventos trombóticos, las hemorragias totales o las hemorragias mayores y la mortalidad (tabla 2). Todas las TS se produjeron en pacientes tratados con clopidogrel. Entre los pacientes que recibieron clopidogrel, no hubo diferencias significativas entre las incidencias de TS con HLT (14%) y sin HLT (8,8%; p = 0,52). En un modelo de regresión logística multivariable que incluía covariables como la HLT, la tromboaspiración, el tipo de stent y el uso de clopidogrel, la HLT no fue un factor predictivo de la TS significativo (odds ratio ajustada = 1,1; intervalo de confianza del 95%, 0,24-4,95; p = 0,89).
Características clínicas basales y de la intervención
| Hipotermia (n = 105) | Sin hipotermia (n = 40) | p | |
|---|---|---|---|
| Edad (años) | 57,2 ± 10,8 | 62,5 ± 12,6 | 0,015 |
| Varones | 90 (85,7) | 34 (85,0) | 0,91 |
| Tabaquismo | 50 (47,6) | 19 (47,5) | 0,99 |
| Hipertensión | 44 (41,9) | 19 (47,5) | 0,54 |
| Diabetes mellitus | 19 (18,1) | 6 (15,0) | 0,65 |
| Hipercolesterolemia | 44 (41,9) | 16 (40,0) | 0,26 |
| Insuficiencia renal | 6 (5,7) | 3 (7,5) | 0,24 |
| Ritmo cardiaco desfibrilable inicial | 81 (77,1) | 26 (65,0) | 0,13 |
| Infarto de miocardio con elevación del segmento ST | 84 (80,0) | 29 (72,5) | 0,33 |
| Shock tras reanimación | 71 (67,6) | 29 (72,5) | 0,57 |
| FEVI (%) | 42,9 ± 16,33 | 41,3 ± 13,0 | 0,66 |
| Arteria coronaria culpable | 0,90 | ||
| DA | 46 (43,8) | 19 (47,5) | |
| CX | 27 (25,7) | 8 (20,0) | |
| ACD | 29 (27,6) | 12 (30,0) | |
| Otras | 3 (2,9) | 1 (2,5) | |
| Puntuación de riesgo GRACE | 158,2 ± 35 | 165,0 ± 42,9 | 0,55 |
| Puntuación de riesgo CRUSADE | 20,6 ± 9,6 | 23,8 ± 17 | 0,48 |
| Flujo TIMI 0-1 antes de ICP | 73 (69,5) | 34 (85,0) | 0,26 |
| Flujo TIMI 3 después de ICP | 92 (87,6) | 35 (87,5) | 0,53 |
| Acceso femoral | 54 (51,4) | 33 (82,5) | 0,001 |
| Tromboaspiración | 50 (47,6) | 12 (30,0) | 0,05 |
| Dosis de heparina (U) | 7.542 ± 2.068 | 7.100 ± 1.816 | 0,64 |
| Con inhibidores del receptor de la glucoproteína IIb/IIIa | 13 (21,3) | 6 (18,7) | 0,77 |
| Pauta de inhibidor del P2Y12 | 0,001 | ||
| Clopidogrel | 57 (54,3) | 37 (92,5) | |
| Ticagrelor | 42 (40,0) | 2 (5,0) | |
| Prasugrel | 6 (5,7) | 1 (2,5) | |
| Número de stents implantados | 1,28 ± 0,52 | 1,25 ± 0,43 | 0,78 |
| Pacientes tratados con SFA | 43 (41,0) | 6 (15,0) | 0,003 |
| Diámetro máximo del stent (mm) | 3,72 ± 1,83 | 3,33 ± 1,73 | 0,30 |
| Longitud total del stent (mm) | 23,4 ± 10,2 | 20,7 ± 4,9 | 0,12 |
| Lesiones en bifurcación | 14 (18,7) | 6 (15,4) | 0,66 |
| Sin restablecimiento del flujo | 9 (9,2) | 5 (12,5) | 0,55 |
| BCIA | 19 (18,1) | 7 (17,5) | 0,20 |
ACD: arteria coronaria derecha; BCIA: balón de contrapulsación intraaórtico; CX: arteria circunfleja izquierda; DA: arteria descendente anterior izquierda; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; SFA: stent farmacoactivo; TIMI: Thrombolysis In Myocardial Infarction.
Los valores expresan n (%) o media ± desviación estándar.
Resultados
| Hipotermia (n = 105) | Sin hipotermia (n = 40) | p | |
|---|---|---|---|
| Eventos trombóticos | |||
| Trombosis del stent | 7 (6,7) | 3 (7,5) | 0,86 |
| Trombosis venosa profunda/embolia pulmonar | 4 (3,8) | 1 (2,5) | 0,69 |
| Eventos trombóticos totales | 11 (10,4) | 4 (10,0) | 0,93 |
| Hemorragias | |||
| Cualquiera | 24 (22,9) | 8 (20,0) | 0,71 |
| Tipo BARC 3 o 5 | 12 (11,4) | 4 (10,0) | 0,80 |
| Gastrointestinal | 9 | 2 | |
| Cerebral | 2 | 1 | |
| Alveolar | 1 | 0 | |
| Vía de acceso vascular | 0 | 1 | |
| Mortalidad | 29 (27,6) | 16 (40,0) | 0,15 |
BARC: Bleeding Academic Research Consortium.
Los valores expresan n (%).
La incidencia de TS en los pacientes con PCEH se ha estudiado poco y los resultados han sido diversos, con tasas entre el 1,4 y el 45,5% en series pequeñas3. Este estudio muestra una alta incidencia de TS en los pacientes con PCEH después de una ICP (en total, el 6,8%). En la mayor parte de los estudios, la relación entre la HLT y la TS se estudia sin un grupo de control de pacientes con PCEH a los que no se haya aplicado la HLT.
Nuestro estudio no mostró una mayor incidencia de eventos trombóticos en los pacientes tratados con HLT en comparación con el grupo de control, de manera similar a lo indicado por un estudio previo3, y ello indica que el estado posterior a una PC podría ser por sí solo el desencadenante de la TS. En el presente estudio se hizo mayor uso de los inhibidores del P2Y12 en los últimos años. Anteriormente, nuestro grupo había descrito una reducción de la incidencia de TS en los pacientes con SCA tras una PCEH en HLT con ticagrelor en comparación con clopidogrel5. Este estudio muestra altas tasas de eventos hemorrágicos totales y de hemorragias mayores (11%) en los pacientes con SCA tras PCEH sometidos a ICP. No hubo diferencias en función del uso de HLT. La tasa de hemorragias de los pacientes concuerda con la observada en estudios previos en pacientes con PCEH2. Así pues, los efectos clínicos de la HLT añadidos a los del estado tras la PC continúan en controversia. El estado comatoso de los pacientes dificulta la administración oral de los inhibidores del P2Y12, y el fallo multiorgánico puede causar un retraso de la absorción y la metabolización de los antiagregantes plaquetarios y el consiguiente aumento del riesgo de TS. Los pacientes con PCEH a menudo tienen acidosis, daño tisular y altas concentraciones de catecolaminas intrínsecas o administradas terapéuticamente, lo cual podría facilitar la aparición de complicaciones hemorrágicas.
El presente estudio tiene varias limitaciones. Se trata de un estudio no aleatorizado y de un solo centro que incluyó a pacientes tratados en un largo periodo y de grupos heterogéneos, con cambios en los protocolos de tratamiento (HLT, tromboaspiración, acceso radial, nuevos inhibidores del P2Y12, stents farmacoactivos). Hubo una reducción de la mortalidad en el grupo de HLT. Estos pacientes son los incluidos en los últimos años del estudio, y es probable que obtuvieran un beneficio derivado de los avances terapéuticos. Aunque esta reducción no fue estadísticamente significativa, es probable que ello se debiera al pequeño tamaño muestral del estudio.
En conclusión, la incidencia de eventos trombóticos/hemorrágicos en este estudio fue alta en los pacientes con SCA sometidos a ICP tras PCEH. El uso de HLT no se asoció con un aumento del riesgo de eventos trombóticos/hemorrágicos. Los resultados deben interpretarse como generadores de hipótesis y será necesario obtener nuevos datos de estudios aleatorizados.